糖肽高分子材料及生物医学应用
2021-10-22张婧楷刘潇璇李莉莉
张婧楷, 刘潇璇, 李莉莉
(1. 中国药科大学,天然药物活性组分与药效国家重点实验室,药物科学研究院高端药物制剂与材料研究中心,南京 210009;2. 国家纳米科学中心,中国科学院纳米生物效应与安全性重点实验室,中国科学院纳米科学卓越创新中心,北京 100190)
多肽是由各种氨基酸通过肽键按照一定顺序共价连接而成的,其分子量介于氨基酸与蛋白质之间。由于多肽源自于生物体内,因此多肽材料具有良好的生物相容性和可降解性[1,2]。通过调控多肽分子中氨基酸的种类、数量和顺序,或在氨基酸上修饰各种不同的官能团,可以实现多肽的自组装。多肽自组装材料比多肽本身具有更高的稳定性和更好的治疗、靶向等性能,广泛应用于各种生物医学领域[3-5]。本课题组发展了一系列具有自组装性能的多肽材料,在癌症诊断及治疗、细菌感染诊断及治疗等方面具有广泛的应用[6-8]。
糖类是存在于自然界的一类主要生物分子,结构极为多样和复杂,具有从能源到生物结构多方面的功能[9,10]。糖对蛋白质的修饰是蛋白质翻译后的主要修饰之一,对多种关键生物过程(包括蛋白质折叠、运输、细胞黏附、细胞生长和细胞分化等)至关重要[11-13]。蛋白质的异常糖基化会扰乱细胞内识别,与包括癌症和自身免疫性疾病在内的许多严重疾病有关。免疫系统主要依靠细胞免疫来消除病毒和肿瘤细胞的细胞内感染,但是此类细胞可能利用异常糖基化结构逃避免疫系统的监视和识别[14,15]。病毒也利用宿主的糖基化机制组装其自身的包膜糖蛋白,从而有助于避免免疫检测[16]。在自身免疫性疾病类风湿关节炎和系统性红斑狼疮中,免疫球蛋白G(IgG)糖型发生显著变化。在类风湿关节炎中,IgG聚集的半乳糖基糖型被甘露糖结合凝集素特异性识别,从而可能不适当激活先天免疫系统[17]。此外,在肿瘤的发展过程中,细胞表面糖类的分布有显著变化,似乎与转移的状态有关。糖类丰富的生物学特性在其应用于生物医学研究和治疗发展方面引起了越来越多的关注[18-21]。然而,天然糖类的复杂性和异质性给其生产和表征带来了巨大困难,对进一步的结构修饰、机理研究和药物应用造成了极大限制。为了充分利用糖类的优势,同时规避天然材料的缺点,人们在制备均质低聚糖和多糖方面进行了诸多努力[22-24]。
糖肽高分子材料是糖基基团通过共价键与多肽相连所形成的一类分子。糖肽树形分子是一种典型的支状糖肽高分子材料,一般为纳米尺度,通常由3个部分组成:树形分子的核、分支单元和末端基团。糖肽树形分子的核心位于分子最里层;有着精确设计的氨基酸序列和结构的分支单元在核和分子表面之间;一般由氨基酸组成的末端基团位于分子表面,可以修饰不同糖基基团而产生不同生物学应用。末端具有的大量基团可以进行多位点糖基化修饰,在糖基与受体相互作用中发挥多价效应。肽类骨架因具有易获得性、高化学多样性和良好的生物相容性等优势而受到了广泛的关注。更重要的是,通过自组装的方式将糖类以聚集方式呈现给相关受体,可实现多价相互作用[25-28]。因此,自组装糖肽高分子材料也是一个重要的研究方向。多肽分子间可以通过氢键、静电相互作用、π-π 堆积、疏水作用等分子间作用力自组装形成不同的超分子结构[29-31]。糖对多肽的修饰不仅赋予了多肽许多生物功能,也会改变多肽的结构。自组装糖肽高分子材料中各种糖基基团的加入拓宽了糖肽分子在自组装时的氢键作用,增加了自组装糖肽高分子材料的结构稳定性,拓宽了多肽自组装的生物医学应用。
本文综述了糖肽材料的化学合成、设计策略及其在生物医学领域的应用(图1),重点介绍了糖肽纳米材料的构建策略,并对糖肽领域的发展前景和面临的挑战进行了讨论。
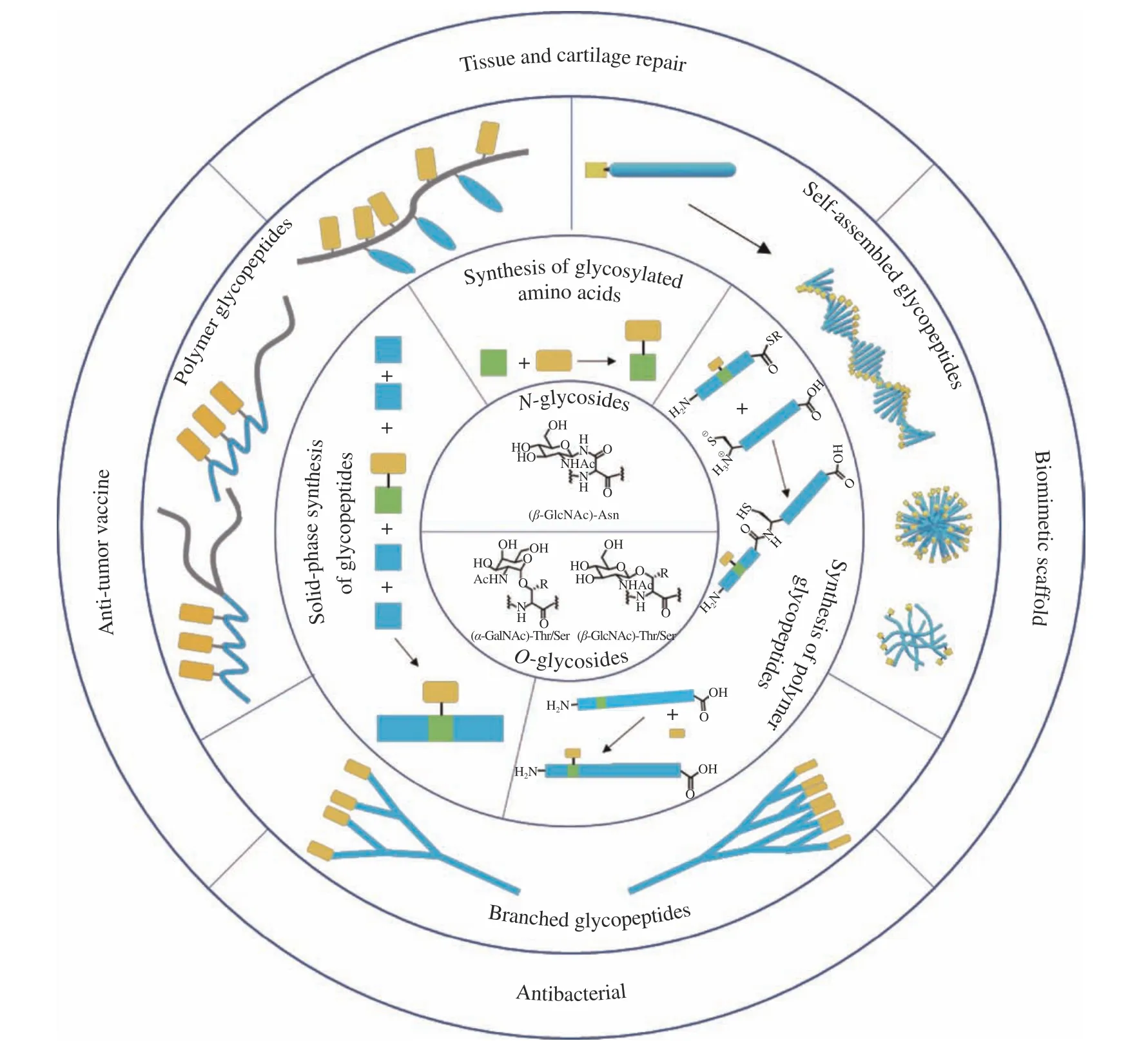
图1 糖肽高分子材料及其生物医学应用Fig. 1 Schematic illustration of development of glycopeptide-based polymers and its applications
1 糖肽材料的化学合成
1.1 糖基化氨基酸的合成
几乎所有天然形成的糖苷键都可分为2大类:N-糖苷类(与天冬酰胺侧链相连)与O-糖苷类(与丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)的侧链相连,也有少见的与羟赖氨酸(Hyl)和羟脯氨的酸侧链相连)。目前,最常观察到的多肽/蛋白糖基化位点是天冬酰胺(Asn)侧链的酰胺氮。这是在特定的序列Asn-X-Thr/Ser上完成的,其中X是除脯氨酸以外的任何氨基酸。下一个位置的Ser或Thr残基对糖基化是绝对必要的。在自然产生的O-糖蛋白中,最丰富的碳水化合物是N-乙酰-D-半乳糖胺(N-Acetyl-D-galactosamine,GalNAc)残基与丝氨酸或苏氨酸结合的α-O-糖苷,因此,大量的工作致力于建立适当保护的α-GalNAc-Thr/Ser构建块。由于人们普遍认为β-O-N-乙酰氨基葡萄糖(N-Acetyl-D-Glucosamine,GlcNAc)-Ser/Thr部分在蛋白质的瞬时修饰中具有调控作用,因此人们也对β-O-GlcNAc-Ser/Thr部分的合成给予了很多关注。此外,α-甘露糖(Mannose,Man)-Thr/Ser、α-半乳糖(galactose,Gal)-Hyl以及其他O-糖苷化氨基酸也逐渐引起人们的关注。
1.2 糖肽的合成
糖肽化学合成的一个关键步骤是将糖基与多肽共价偶联。为了达到这一目的,可以考虑两种方法:一个是对适当保护的全长多肽进行直接糖基化;另一个是使用预先形成的糖基化氨基酸构建块逐步合成多肽主链。直接糖基化的优点是可以快速获得不同糖肽结构。然而,在化学糖基化常用的条件下,侧链羟基的反应活性低且肽的溶解度低,直接O-糖基化常常受到产率低的困扰。用糖胺和含有天冬氨酸的肽直接缩合获得N-糖基化肽的方法又有严重的副反应[32]。
目前,最常用的糖肽类合成方法是采用预先形成的糖基化氨基酸模块进行逐步多肽固相合成(Solid Phase Peptide Synthesis,SPPS)。然而,糖基给固相糖肽合成带来了复杂性和不确定性,许多在SPPS中常用的反应方法和条件并不适用于糖肽的制备[33,34]。因此,在选择保护基团时必须特别小心。如O-糖苷键是酸不稳定的,但在强碱条件下又会发生β-消除,强碱也会使肽外消旋。目前,使用乙酰酯作为寡糖羟基的保护,9-芴基甲氧基羰基(Fmoc)作为氨基酸α-氨基的保护,N,N'-二异丙基碳二亚胺(DIC)/ 1-羟基苯并三唑(HOBt)、1H-苯并三唑-1-基氧三吡咯烷基六氟磷酸盐(PyBOP)/HOBt、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)/HOBt、O-(7-氮杂苯并三唑-1-基)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)/N-羟基-7-氮杂苯并三氮(HOAt)下等作为偶联剂已成为固相糖肽合成的标准技术[35-38]。在Fmoc合成方法中,在温和的碱性条件(如哌啶和吗啉)下可以脱去α-氨基的保护基,而不影响糖肽中的O-糖苷键[39,40]。然而,在叔丁氧羰基(Boc)/苄基(benzyl)方案中,α-氨基保护基的脱去是在强酸三氟乙酸(TFA)条件下完成的,这种强酸性条件容易导致糖苷键的不稳定。O-乙酰基和O-苯甲酰基是吸电子基团,在TFA裂解多肽的过程中可以稳定糖苷键。甲醇钠的甲醇或水合肼溶液可以去除乙酰基[41]。邻苯甲酸盐法所需要的苛刻条件使得它们不太适合用于糖肽的合成[42]。
1.3 高分子糖肽的合成
常规的SPPS合成仅限于50个氨基酸以内,因此天然化学连接(Native Chemical Ligation,NCL)是合成更长肽链的有效方法[43]。NCL是一种化学选择性反应,在生理pH下,1个N端半胱氨酸残基和1个C端硫酯可以选择性反应(图2)。该方法是Kent课题组[44]在20世纪90年代发展起来的,此后不断改进以提高其实用性。在NCL的第一步,C端硫酯与N端半胱氨酸残基的巯基之间发生可逆反式硫代酯化反应。结合后的单肽硫酯会自发地发生快速且不可逆的分子内S→N移动,从而在连接处产生热力学稳定的天然酰胺键。NCL特定地发生在N端半胱氨酸残基上,而与其他的内部半胱氨酸残基无关。由于这种连接方法与糖和多肽兼容,因此可以连接糖蛋白结构。由于硫酯固有的碱敏感性,多肽硫酯的制备最初依赖于Boc策略[45,46]。Fmoc策略在肽合成中的广泛应用以及糖肽的酸敏感性促进了多肽硫酯制备新方法的发展[47]。

图2 NCL机理的示意图Fig. 2 Mechanism diagram of NCL
2 糖肽高分子材料
2.1 糖肽树形分子
单个糖和蛋白质之间的相互作用通常很弱,多个糖配体与受体结合能够增强这种相互作用,这种现象称为“簇效应”或“多价效应”。包括肽类树形分子在内的支状多肽通过偶联糖形成的支状糖肽可以利用多价态簇效应增强糖与蛋白的相互作用。树形分子是一种高分支聚合物,具有明确且多分散性的核-壳纳米结构,分支单元围绕核心单元逐代合成,广泛应用于多种生物医学应用[48-52]。由于树形分子的高度分支、多价性质和分子结构,糖肽类树形分子是用作针对传染病和癌症的免疫反应调节剂疫苗以及基于树形分子的抗感染和抗炎药的理想材料。
糖肽树形分子可以根据具体要求进行多种设计,其结构分类示于图3。糖肽树形分子的核心部分可以是氨基酸序列,也可以连接常见的疏水烷基链,形成两亲性树形分子。此外,核心支架也可以使用其他树形分子,如经典的聚酰胺-胺型(Polyamindoamine,PAMAM)树形分子。重复的分支单元通常是一些优化的氨基酸序列,一般用赖氨酸进行分支,随着分支的增加,代数不断增加。末端基团的数目随着代数的增加而指数增加,并且树形分子的总密度也增加,但是树形分子的柔性和所有官能团的可及性降低。丰富的末端基团可以修饰大量的糖基团,这些糖基团可以是相同的糖,也可以是不同的糖。在一定程度上,代数的增加使糖基团的数目增加,增强了糖簇与蛋白的相互作用,但是由于官能团可及性随代数的增加而降低,树形分子的代数不能无限增加。根据糖肽树形分子具体的结构,又可以分为两亲性、哑铃形和球形等。

图3 糖肽树形分子的结构分类Fig. 3 Structural classification of glycopeptide dendrimers
Reymond课题组[53-55]设计了具有4个末端的G2糖肽树形分子,末端连接半乳糖或岩藻糖,分别用于靶向铜绿假单胞菌的LecA和LecB凝集素。具有4个末端的糖肽树形分子FD2、D-FD2、GalAG2和GalBG2能有效阻断铜绿假单胞菌生物膜的形成并诱导生物膜在体外的分散,2个末端的糖肽树形分子或单个末端的糖肽分子对凝集素的结合力要弱得多,而8个末端的糖肽树形分子与凝集素的结合力增加,但再增加至16个末端时,平均到每个半乳糖基的结合效力反而降低。可能是由于凝集素LecA或LecB为四聚体结构,每个单体有1个结合位点,1个LecA或LecB有4个结合位点,大致排列在1个矩形的4个顶点,当设计的糖肽树形分子糖基之间的间距与四聚体内结合位点的距离一致或能够桥接不同的四聚体时,理论上可以最大限度地发挥多价作用对识别和结合过程的影响,并确保与宿主聚糖结合的最佳竞争,提高化合物的治疗效率。当进一步增加糖肽树形分子端基数目时,可能出现由于空间位阻等因素无法与凝集素结合位点相互作用的糖基,使糖肽树形分子与凝集素的结合力不随代数线性增加。当将分支处的赖氨酸用更紧凑的2,3-二氨基丙酸替代时,结合力明显减弱,可能是由于2,3-二氨基丙酸的2个氨基之间比赖氨酸少了3个碳原子的距离。一般认为,较长的碳链会使分子柔性增加且更加灵活;较短的碳链会使分子柔性降低。当将末端换成同时含有半乳糖和岩藻糖的杂糖簇时,结合力比同样的单糖簇稍弱。Bouvier课题组[56]进一步应用MARTINI粗粒度模型和长时间的分子动力学模拟系统探索氨基酸序列对半乳糖官能化八价肽树形大分子动力学以及它们与半乳糖特异性凝集素的结合能力的影响,图4为多价糖肽树形分子的二维示意图。
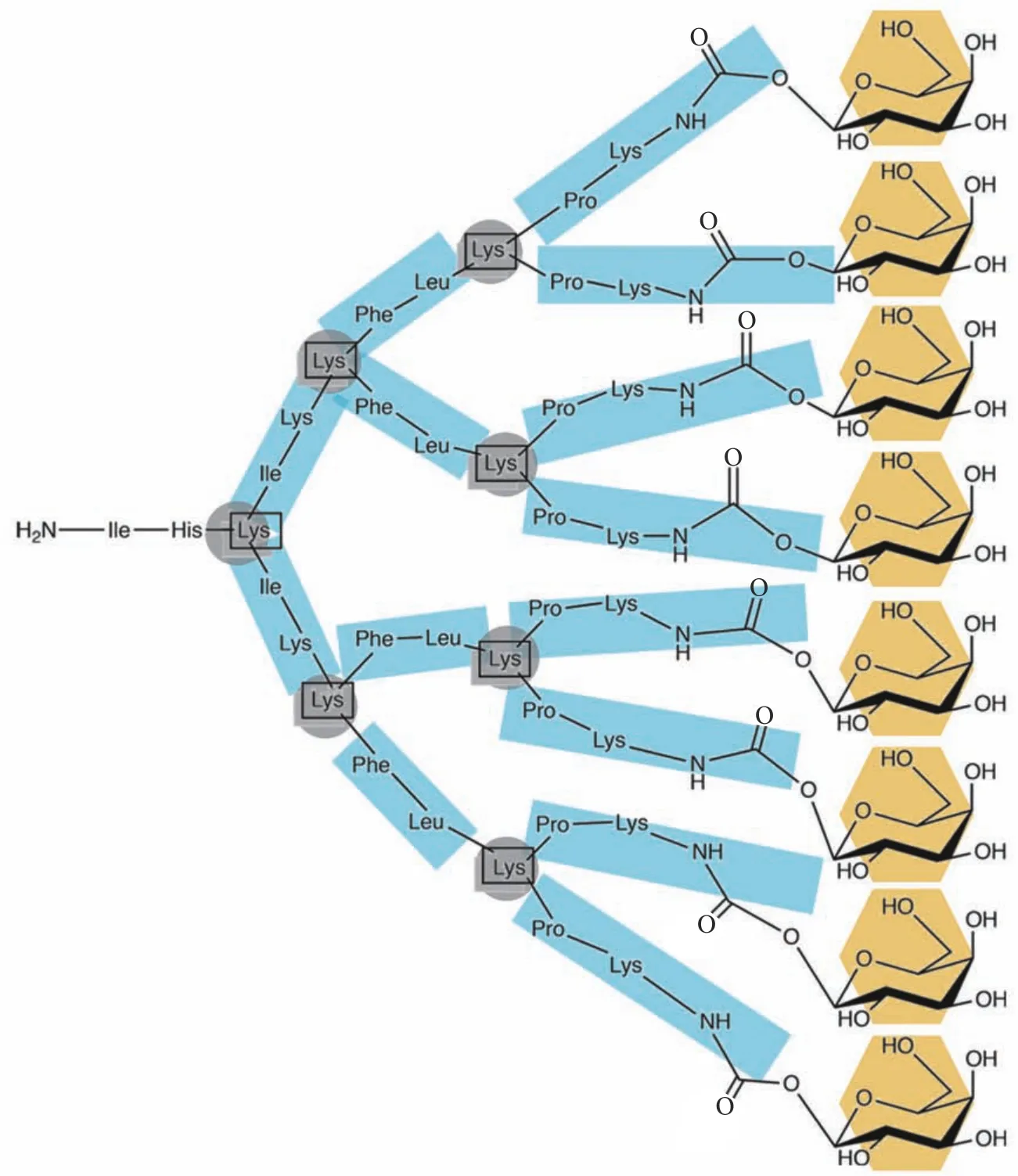
图4 多价糖肽树形分子的二维示意图[56]Fig. 4 Two-dimensional sketch of the multivalent glycoconjugated peptide dendrimers[56]
除了使用肽作为糖基树形分子的骨架,也可以使用其他树形分子作为支架,形成扇形、哑铃形、球形以及其他形态的糖肽树形分子,如PAMAM树形分子、具有环状核心区域选择性可寻址功能化模板(Regioselectively Addressable Functionalized Templates,RAFTs)以及类似环状结构的树形分子[57-59]。
2.2 自组装糖肽材料
由于多价亲合力效应,固定在多价骨架中的糖基通常表现出比可溶性单价糖基高得多的蛋白质结合亲和力。当多价糖基化合物在单个蛋白质上占据多个结合位点时,会出现螯合效应。受簇状糖苷效应的启发,已开发出不同的支架来设计具有多价糖基配体的结构,然而,由于较为复杂的多价结构和合成程序,仍需要设计一种简便的方法来制备多价糖基簇。近年来,随着超分子化学和自组装多肽的发展,自组装糖肽为多价糖基配体设计提供了一种简便且可替代的方法。自组装糖肽不仅具有容易合成、分子结构明确以及固有的生物相容性和生物降解性等诸多优势,还可以模拟自然界中的自组装过程,以形成具有纳米级精度的复杂结构或功能材料。在多肽分子的氨基酸上修饰糖基基团,能够构建具有不同性能的糖肽类超分子自组装材料(图5)。
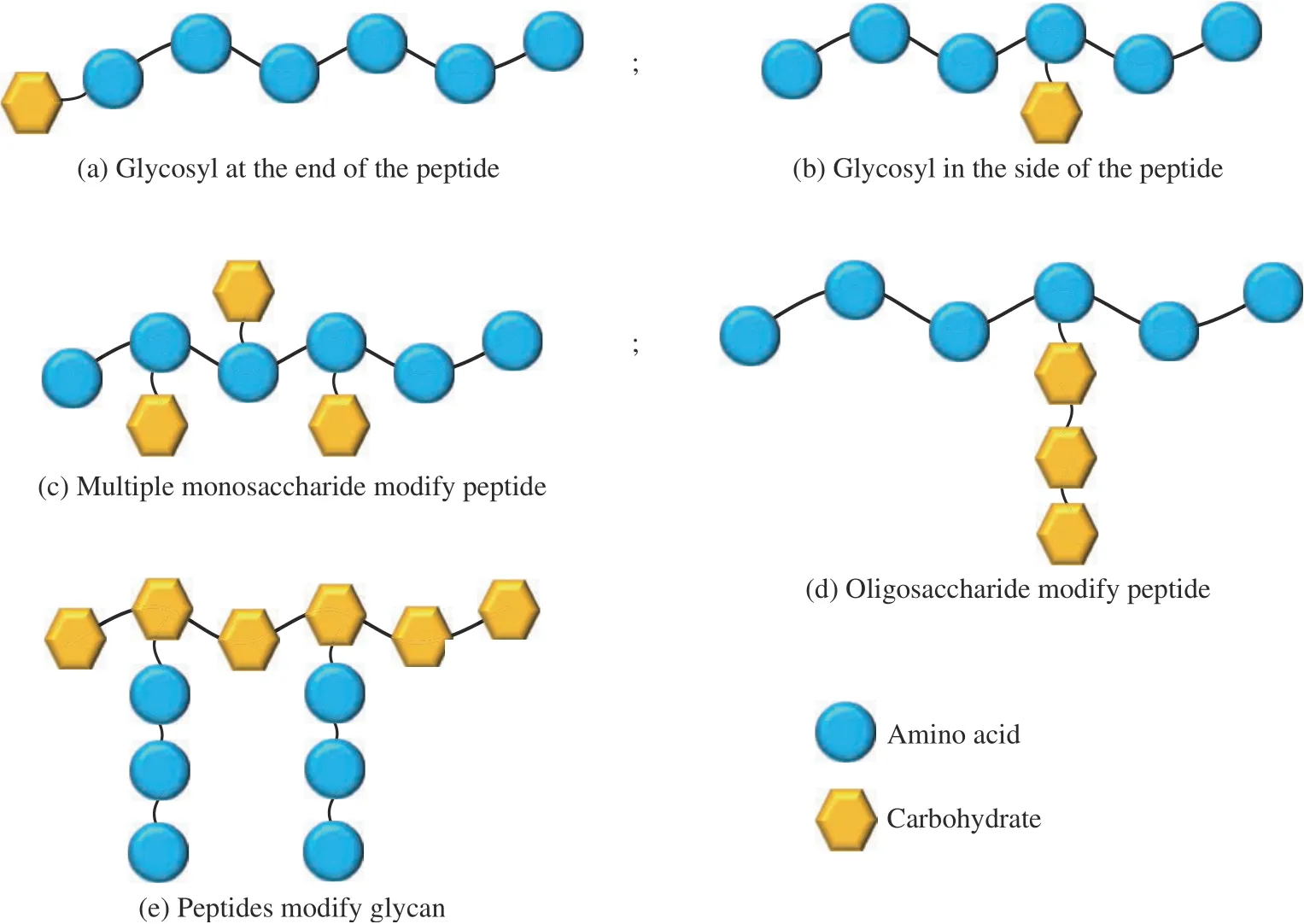
图5 自组装糖肽材料的设计Fig. 5 Design of self-assembled glycopeptide materials
对于自组装糖肽,一种简单有效的方法是在自组装多肽序列的末端共价修饰糖基团,该修饰一般不会影响多肽原有的自组装功能,修饰方法主要为点击反应。本课题组[8]设计了甘露糖通过点击反应共价修饰五肽序列酪氨酸(Tyr)-缬氨酸(Val)-组氨酸(His)-天冬氨酸(Asp)-半胱氨酸(Cys)的糖肽,甘露糖基共价修饰在五肽的N末端。Stupp课题组[26]设计了单糖基通过点击反应与肽两亲体末端进行共价修饰的糖肽材料,可以自组装形成超分子硫酸化糖肽纳米结构,糖基与相应蛋白的结合不会破坏纳米结构或其内部βsheet骨架。这种在末端或侧链修饰糖基的方法一般不会影响多肽原有的自组装功能。Hudalla课题组[60,61]通过在Q11(QQKFQFQFEQQ)的N端修饰N-乙酰氨基葡萄糖(N-Acetyl-D-Glucosamine,GlcNAc)得到糖肽GQ11,通过将Q11和GQ11以不同物质的量之比自组装形成β-sheet纳米纤维,成功改变了自组装体表面的糖基密度。糖基在自组装体表面暴露,不仅使糖基密度的调节变得简单,而且很容易受到外部环境中各种因素的调节而改变糖基结构,实现动态调控糖肽自组装体结构的目的。陈国颂课题组[62]设计的糖肽分子在水中自组装形成纳米纤维后,糖基暴露在表面,在糖基转移酶KfoC或PmHS2的作用下,可以原位高效地形成糖苷键,生成新的糖肽类两亲分子GalNAcGlcA-YF和GlcNAcGlcA-YF,组装形态从纳米纤维转变为纳米颗粒(图6)。

图6 糖基转移酶诱导含蛋白多糖残基的糖肽自组装形态转变[62]Fig. 6 Glycosyltransferase-induced morphology transition of glycopeptide self-assemblies with proteoglycan residues[62]
此外,在多肽序列中引入含有侧链官能团的氨基酸作为糖基修饰位点,将糖基通过侧链与多肽共价连接。李新明课题组[63,64]设计了在萘基-苯丙氨酸(Phe)-Phe-Asp-Tyr序列和萘基-Phe-Phe-Ser-Tyr序列侧链修饰单糖基的自组装糖肽分子(图7)。董甦伟课题组[65]设计合成了通过丝氨酸侧链偶联甘露糖的自组装糖肽分子,可以自组装形成纳米颗粒模拟复杂多糖的功能。在多肽侧链上可以修饰单个糖基,也可以引入多个含侧链的氨基酸,从而在一条肽链上同时修饰多个糖基。李艳梅课题组[66]设计的肿瘤相关抗原黏蛋白1(Tumorassociated Antigen Mucin 1,MUC1)糖肽分子通过引入2个含有侧链的氨基酸在一条多肽上,同时连有2个Tn抗原,与其他T辅助细胞表位肽和γ-聚谷氨酸(γ-Polyglutamic acid,γ-PGA)在水中发生多层自组装,形成纳米偶联物抗肿瘤疫苗。在多肽上不仅可以修饰单糖,还可以修饰较长的寡糖链。如Huang课题组[67]在硫酸软骨素糖肽Syndecan-1的丝氨酸侧链共价连有1个八糖链。
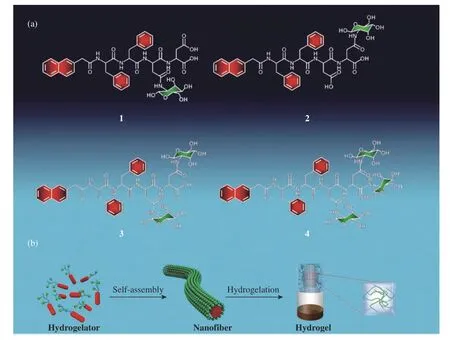
图7 (a)糖肽类凝胶的分子结构;(b)超分子水凝胶的自组装过程[64]Fig. 7 (a) Molecular structures of glycopeptide gelators; (b) Illustration of the self-assembling process of glycopeptides for the generation of supramolecular hydrogel[64]
除了以自组装肽为主体在其上修饰寡糖外,还可以将聚糖长链作为主体,在长链上修饰较短的自组装肽。但是其组装驱动力仍主要来源于自组装短肽。王伟伟课题组[68]设计了以葡甘露聚糖长链为母体,在其上修饰多条Q11自组装肽序列的糖肽分子。多条Q11肽作为组装驱动力,形成高度有序的β-折叠纳米纤维。
自组装多肽与糖偶联形成的自组装糖肽在基本保留多肽自组装行为的基础上,又具有易合成的化学结构。这样形成的糖肽自组装体在易于合成的同时具有自组装形成的多价效应。糖肽形成的超分子组装系统在构建具有新型分子结构、动态可调自组装行为和应用的材料方面具有巨大潜力。
2.3 糖肽聚合物材料
糖基化除了赋予肽基超分子生物材料功能外,还可以影响其结构。为了更好地理解糖基化对自组装肽的影响以及天然糖肽缀合物的自组装机制,更好地开发基于糖肽共聚物在药物传递功能生物材料、生物成像、组织工程等方面的应用,更多新型的聚合物糖肽被开发出来。图8示出了2种糖肽聚合物。
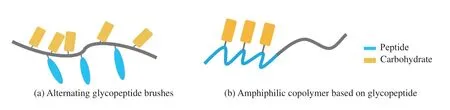
图8 糖肽聚合物示例Fig. 8 Examples of glycopeptide polymer
糖基化通过建立分子间作用力来改变蛋白质的形态和功能,这种作用力可以介导特异性的相互作用,同时防止非特异性的聚集。Hudalla等[69]研究表明致密的糖表层可以促进肽纳米纤维分层组装成各向异性网络。低浓度的糖肽纳米纤维在水中仍然分散,而非糖基化的纳米纤维倾向于聚集。在拥挤的条件下,一些糖基化的纳米纤维横向结合并排列。这种行为取决于糖基的化学性质,尤其是羟基,表明存在短程引力。
随着聚合物表面糖基密度的增加,糖基与糖基之间的相互作用显露出来,对分子之间的相互作用以及聚合物的自组装行为产生影响。江明课题组[70]设计的交替两亲糖多肽刷(Alternating Amphiphilic Glycopolypeptide Brushes,AAGB)带有高密度的糖基侧链(图9)。分子初始形成纳米颗粒,但分子之间高密度的糖基侧链具有的糖基-糖基相互作用会使初始形成的纳米颗粒逐渐吸引、融合、生长,最后形成纳米线,实现分级自组装。
此外,糖基部分也可以作为亲水部分参与共聚物的组装。Gupta课题组[71,72]设计的基于糖肽的两亲性共聚物,以连有糖基的聚甘氨酸链作为亲水段,聚(ε-己内酯)链或聚环氧丙烷(Polypropylene Oxide,PPO)作为疏水段,形成纳米纤维、囊泡、胶束等不同组装体(图10)。许多使用糖多肽片段作为调节共聚物结构以及亲水性工具的共聚物或聚合物也被开发出来[73-76]。
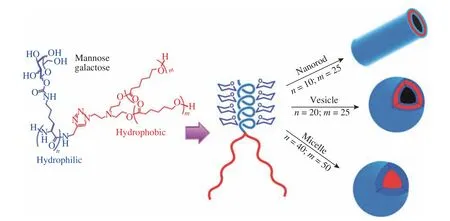
图10 nGP-(PCLm)2共聚物的化学结构和调节亲水和疏水嵌段长度获得的纳米结构[71]Fig. 10 General chemical structures of nGP-(PCLm)2 copolymers and nanostructures obtained by tuning the hydrophilic and hydrophobic block length[71]
3 糖肽高分子材料的生物医学应用
3.1 抗菌
一些细菌(如金黄色葡萄球菌)能够侵入哺乳动物细胞尤其是巨噬细胞,并在其中生存,从而阻止抗菌剂对它们的清除。巨噬细胞表面含有甘露糖受体,在抵抗病原体感染中起着重要作用,因此设计一些连有甘露糖的糖肽用于靶向巨噬细胞内的细菌感染。糖肽进入巨噬细胞后,可以在细胞内特有的生理条件调控下实现自组装,在被感染巨噬细胞内长期滞留,从而达到长效杀菌的目的。糖肽自组装后,分子性能也可以得到放大。本课题组[77]设计了连有甘露糖糖肽的光声造影剂,命名为MPC,MPC同时含有caspase-1酶切位点,主动靶向巨噬细胞后,酶切形成J型聚集体并积聚在巨噬细胞内使光声信号增强,检测到巨噬细胞内金黄色葡萄球菌感染[8]。我们也开发出具有“三明治”二聚体结构的甘露糖糖肽-叶绿素光动力治疗(Photodynamic Therapy,PDT)药物,可以增强PDT的效应和活性靶向性,消除巨噬细胞的细胞内感染(图11)。
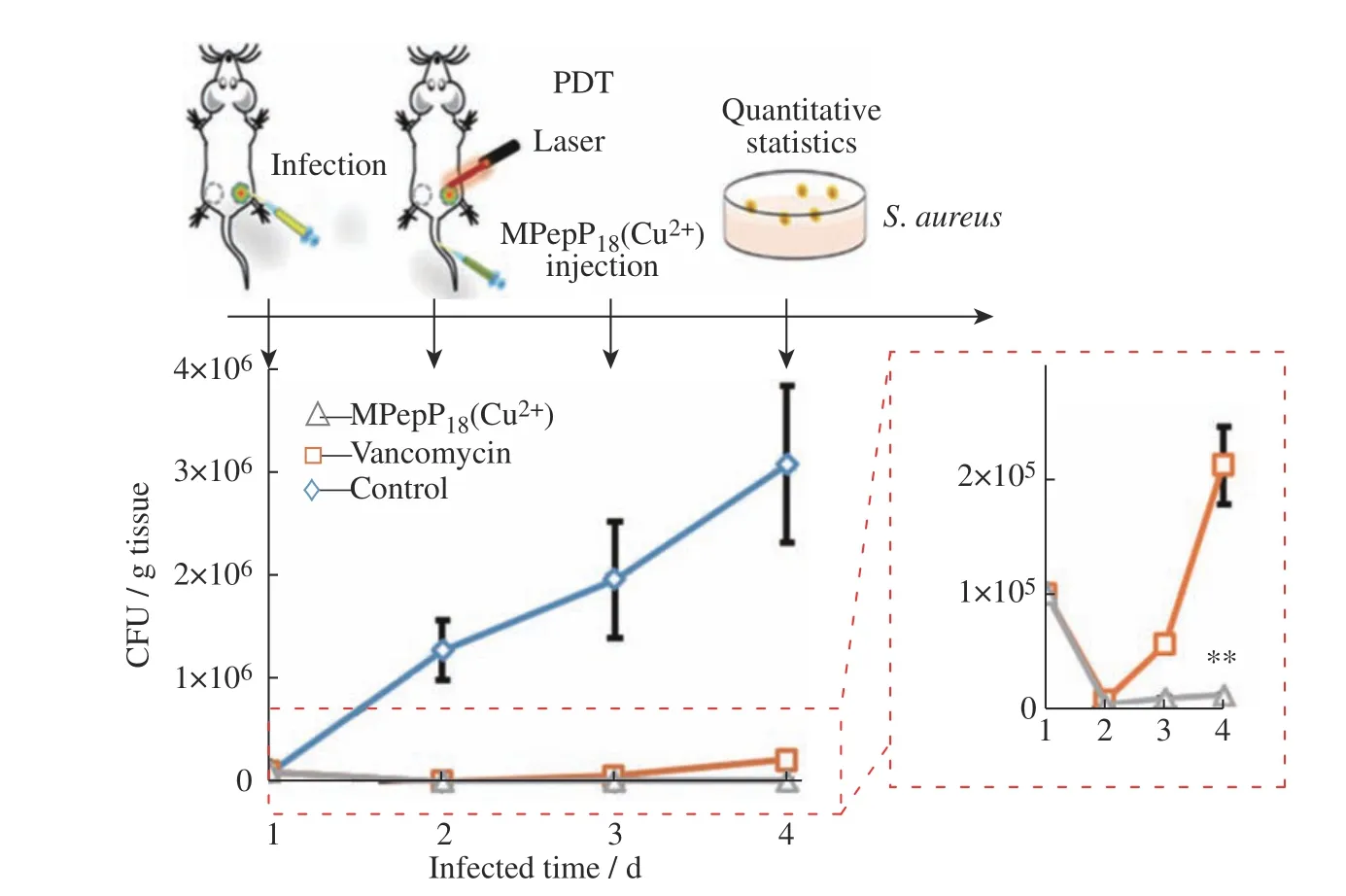
图11 MPepP18(Cu2+)与万古霉素在金黄色葡萄球菌感染小鼠模型中的体内抗菌活性比较[77]Fig. 11 In vivo antibacterial activity of MPepP18(Cu2+) compared to vancomycin in a S. aureus infected mice model[77]
细菌感染可以用抗生素进行治疗,然而耐药性的产生促使科研工作者尝试更多抗菌方法,其中针对细菌凝集素的治疗方法被认为在降低细菌感染致病能力的同时不会直接影响细菌的生存能力,从而降低耐药性出现的可能,因此受到了广泛关注。凝集素是一种蛋白质,可以与糖基特异性识别并结合,在细菌感染宿主的过程中发挥重要作用。然而这种凝集素-糖相互作用具有多价性,因此自组装糖肽被广泛用于靶向凝集素的抗菌治疗。糖肽的糖基部分选用靶向特定细菌凝集素的糖,多肽部分提供自组装驱动力。阿尔兹海默症患者脑内淀粉样纤维的形成是蛋白质自组装的结果。糖肽分子中的多肽部分可以模拟自组装过程形成纳米尺度的自组装体。在有些糖肽设计中,糖基位于多肽末端,自组装形成聚集体后,糖基暴露在聚集体表面。聚集体由多个糖肽组装而成,因此聚集体表面有多个糖基基团,可以提供多价相互作用,增强了与细菌凝集素的结合能力,极大抑制了细菌的感染致病能力。李新明课题组[78]设计并合成的甘露糖修饰的糖肽(萘基-Phe-Phe-Ser-Tyr,NMY),其多价甘露糖配体靶向甘露糖结合蛋白Fim H黏附素,多肽部分能够在催化酶的帮助下驱动超分子自组装,以高特异性结合大肠杆菌,并导致细菌黏附、膜被破坏和随后的细胞死亡。
除了多肽自组装提供多价性外,糖肽树形分子具有的大量末端基团同样可以提供多价性,增强糖基与凝集素的相互作用。Reymond课题组[55]设计了带有大量半乳糖和/或岩藻糖末端的糖肽树形分子,靶向铜绿假单胞菌的凝集素LecA和LecB,可以有效抑制铜绿假单胞菌的生物膜。随着树形分子末端基团数量的增加,末端糖基的柔性和可及性逐渐减小,有效性不会明显提升,反而增加了合成难度,因此大部分应用的糖肽树形分子末端数量一般在2~16个。在糖肽聚合物方面,Chan-Park课题组[79]设计了含有聚甘露糖和抗菌多肽的四臂星型聚合物,抗菌多肽臂对细菌具有杀伤作用,而聚甘露糖臂对大肠杆菌FimH凝集素表达出高亲和力,增强了聚合物对细菌表面的亲和力,并且在游离甘露糖苷存在的情况下,聚合物也能抵抗竞争。
3.2 肿瘤疫苗
正常细胞上的糖蛋白(特别是黏蛋白)带有长糖链,而上皮肿瘤细胞上的黏蛋白由于关键糖基转移酶的变化导致黏蛋白糖链被严重截短,称为肿瘤相关碳水化合物抗原(tumor-associated carbohydrate antigens,TACA),包括T抗原、Tn抗原及其唾液酸化衍生物等[80]。已经发现几种黏蛋白在肿瘤细胞中过表达,被用于肿瘤疫苗的研究,其中肿瘤相关抗原黏蛋白1(MUC1)是一个非常有前景的研究靶点。MUC1是一种膜蛋白,许多免疫治疗研究表明,在大约80%的上皮癌细胞表面MUC1过表达。由于糖蛋白中糖的生物微观异质性,从肿瘤细胞中分离出来的MUC1通常在1个蛋白链上携带肿瘤细胞和正常细胞2种抗原,不仅免疫原性弱,还能诱导针对健康组织的免疫反应。因此,通过化学方法人工合成MUC1类似物是一种有效生产肿瘤疫苗的方法。目前主要有3种设计MUC1抗肿瘤疫苗的策略,分别是将MUC1糖肽与T细胞表位偶联、将MUC1糖肽与载体蛋白偶联、设计含有佐剂的MUC1糖肽。最近,已经制备了许多以MUC1肿瘤相关糖肽表位为靶标的合成糖肽疫苗,使用多肽单一载体共价偶联多种抗原,然后利用自组装肽驱动糖肽自组装或利用树形分子大量末端基团形成糖苷簇效应激活免疫。Dumy课题组[59]利用区域选择的功能化模板(RAFTs)作为多价支架设计抗癌疫苗,这些偶联物显示成簇的Tn抗原类似物如肿瘤相关碳水化合物抗原(Tumorassociated Carbohydrate Antigens,TACA),并对候选疫苗的B和T抗原和免疫原性进行了体外和体内研究。Kunz课题组[81]设计合成了MUC1串联重复序列偶联Tn和唾液酸Tn抗原以及破伤风类毒素(TTox),在野生型和人MUC1转基因小鼠中诱导了强烈地免疫应答。李艳梅课题组[82]将恒定自然杀伤T细胞(invariant natural killer T cell,iNKT细胞)的强效激动剂α-半乳糖神经酰胺(α-Galactosylceramide,α-GalCer)与MUC1糖肽抗原缀合在一起,产生的组装体作为新型的自佐剂癌症疫苗,在没有外部佐剂的疫苗结合物引起了高水平的肿瘤特异性IgG抗体。Bay课题组[83]设计合成了一种糖肽树形分子,可在表达HLA-DR1的转基因小鼠中诱导Tn特异性抗体介导的人Tn阳性肿瘤细胞的杀伤(图12)。
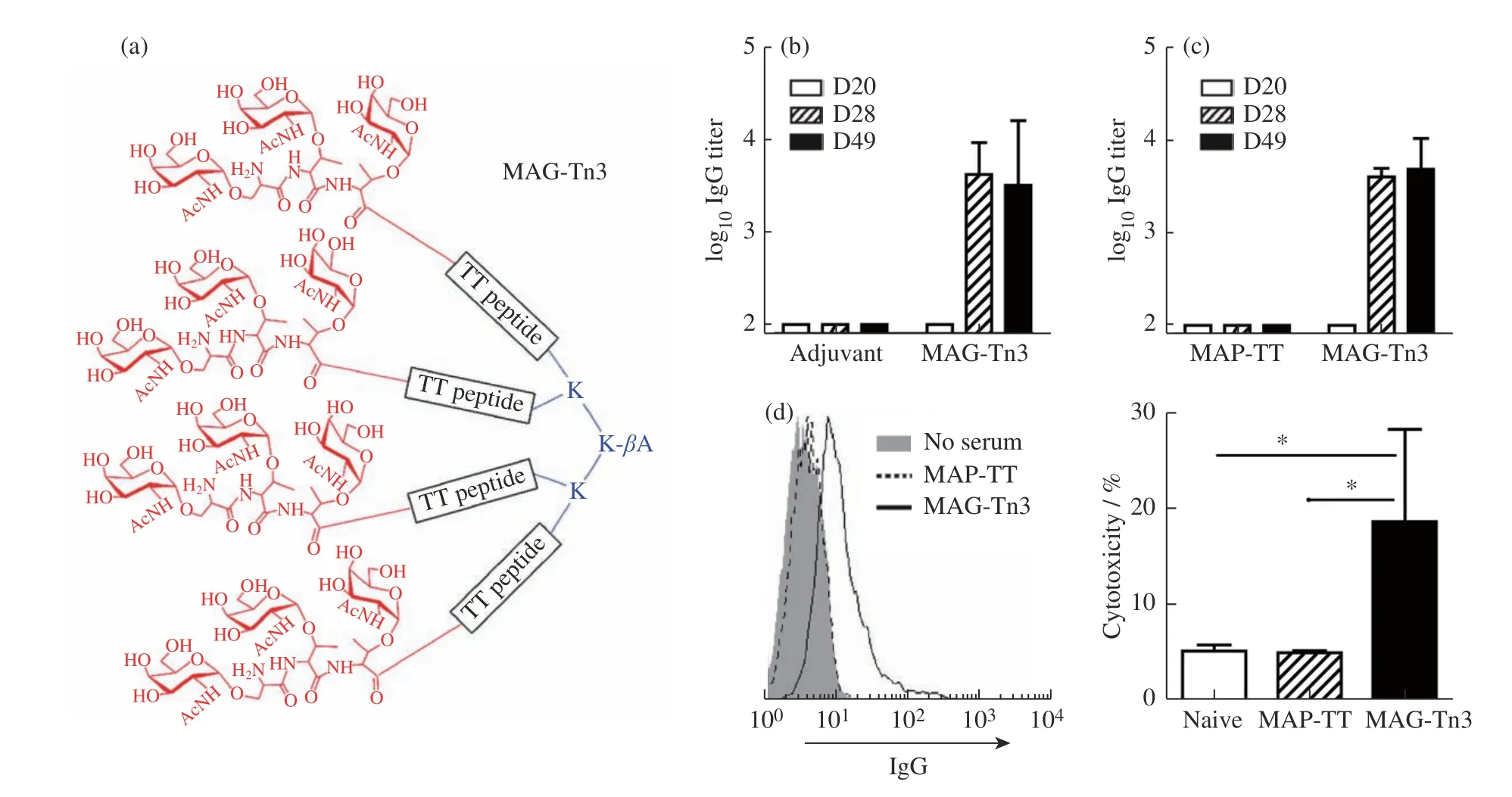
图12 (a)MAG-Tn3的结构;MAG-Tn3在HLA转基因小鼠(b)DR1 * A2和(c)DR1中诱导抗Tn抗体;(d)收集这些小鼠的血清,通过ELISA(b和c)和FACS对Tn阳性Jurkat细胞的Tn识别进行了分析;(e)用图(c)中的血清对Jurkat细胞的抗体介导的细胞毒性进行了评估[83]Fig. 12 (a) Structure of MAG-Tn3; MAG-Tn3 induced anti-Tn antibodies in HLA-transgenic mice (b) DR1 * A2 and (c) DR1; (d) Sera from these mice were collected and they were analyzed for Tn recognition by ELISA (b and c) and by FACS on Tn-positive Jurkat cells; (e) Antibody-mediated cytotoxicity was assessed on Jurkat cells with sera from Figure (c)[83]
3.3 仿生支架
糖肽由来源于生物体的糖和肽组成,具有生物相容性和易降解性。当选用特定的糖基和可以自组装形成凝胶的多肽后,糖肽自组装形成的组装体还可以模拟细胞外基质(ECM)糖基化微环境,因此作为优秀的仿生材料逐渐引起人们的注意。李新明课题组[63]设计的基于糖肽的自组装水凝胶表面部分葡萄糖通过糖-受体相互作用改善细胞附着和人脐静脉内皮细胞的生长(图13)。王伟伟课题组[68]设计的β-sheet Q11肽接枝的葡甘露聚糖自组装水凝胶(GPgel)无需任何其他治疗剂即可自我加速伤口愈合,也可以促进修复的皮肤组织中生成血管。

图13 (a)在Gp凝胶表面培养后的HUVECs活/死检测荧光图像;(b)荧光素(FITC)-鬼笔环肽对培养于Gp凝胶表面的HUVECs细胞骨架F-肌动蛋白染色;(c)图(b)所示方框区域的高倍图像;(d)在Gp凝胶上培养5 d,用血细胞计测定HUVECs细胞密度[63]Fig. 13 (a) Fluorescence images of the live/dead assays of HUVECs cultured on the surface of Gp gel over the course; (b) Cytoskeletal F-actin staining of HUVECs cultured on the surface of Gp gel by fluorescein (FITC)-phalloidin; (c) A high-magnification image of the boxed area shown in image(b); (d) Cell densities of HUVECs determined by cell counting with a hemocytometer over the course of 5 d culture on Gp gel[63]
3.4 组织及软骨修复
糖胺聚糖(glycosaminoglycans,GAG,包括硫酸乙酰肝素(Heparan Sulfate,HS)、硫酸软骨素(Chondroitin Sulfate,CSs)、透明质酸(Hyaluronic Acid,HA)等)是在哺乳动物组织中普遍存在的异质多糖,在生物体中有广泛应用。天然糖胺聚糖具有复杂性和异质性,大大限制了其在生物医学领域的研究与应用。自组装糖肽单体合成较为简单且结构明确可控,自组装后形成的纳米纤维可以模拟天然糖胺聚糖形态,因此许多基于自组装糖肽的均质低聚糖骨架被开发出来。Stupp课题组设计的硫酸化纳米结构超分子糖肽自组装形成纳米结构丝状糖肽比天然硫酸化多糖肝素显著增强了骨形态发生蛋白2的信号传导,并以极低剂量促进了脊柱中骨骼的再生(图14)。Guler课题组[84]设计的模仿天然透明质酸分子的糖肽纳米纤维与间充质干细胞相互作用,并以类似于天然血凝素的方式诱导软骨分化。
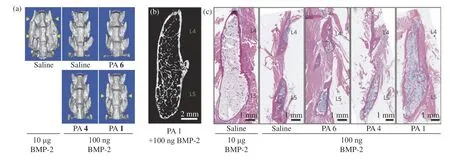
图14 (a)微计算机断层扫描(μCT)的代表性体积渲染(黄色箭头表示融合); (b)融合块的数字矢状切面,该融合物来自用 100 ng BMP-2和PA 1纳米结构处理过的动物(体积渲染是从高分辨率同步加速器X射线μCT获得的); (c)L4-L5后外侧脊柱标 本矢状横断面的H&E染色Fig. 14 (a) Representative volume renderings from μCT (yellow arrows indicate fusion); (b)Digital sagittal section through the fusion mass from an animal treated with 100 ng BMP-2 and PA 1 nanostructures (the volume rendering was obtained from high-resolution synchrotron X-ray μCT); (c)Representative sagittal cross-sectional images of L4-L5 posterolateral spine specimens with H&E staining
4 总结与前景展望
近年来糖肽的合成得到了广泛发展,其中将糖基提前连接到氨基酸上构建糖基化氨基酸,再利用固相合成与其他氨基酸进行模块化拼装成为一种受欢迎的合成方式。然而,糖基化氨基酸的合成耗时较长,因为它通常需要多步溶液相程序,而且大多数构建块不是可商购的,即使少数构建块可以商购,但是价格通常极其昂贵,限制了这些结构单元在固相糖肽合成中的应用,此外,在糖基氨基酸插入和随后的肽合成期间,肽偶联反应的效率大大降低,可能是由于带有高聚糖的氨基酸的位阻所致。在糖肽材料的设计方面,仍然需要更精准地、动态地调控糖肽的结构和组装,以进一步探索糖基与蛋白之间的相互作用及相互作用过程中的动态变化。如何更高效地合成模块化的糖基化氨基酸,提高其在固相合成中的偶联效率,更简便地合成结构多样化的糖肽材料,仍然有待进一步探索。如何理解糖肽分子之间、糖肽与蛋白之间的相互作用及其给自组装性能带来的影响;理解体内各种环境因素对糖肽结构稳定性的影响以及分子在此过程中的动态变化,仍然是一项挑战。此外,人为调控糖肽的结构与功能,设计和合成更能模拟自然糖肽/糖蛋白的分子,有助于探索糖基在人体内复杂的生理、生化作用,综合评价糖肽/糖蛋白糖基化的作用也是一个非常有吸引力的方向。
