单次大剂量对比多次小剂量STZ诱导C57BL/6J小鼠糖尿病肾病模型的研究
2021-10-20冷昌龙皮明山龚晓康
冷昌龙皮明山龚晓康
(江汉大学武汉生物医学研究院,武汉 430000)
糖尿病肾病(diabetic nephropathy,DN)是以蛋白尿、水肿、高血压和肾功能不全为主要临床表现的糖尿病并发症,也是引起终末期肾病,导致糖尿病患者死亡的主要病因之一[1]。DN在我国的发病率呈逐年上升趋势,20%~30%的糖尿病患者会并发糖尿病肾病,严重影响了患者的生活质量[2]。目前对DN的研究虽然很多,但其具体的发病机制仍未完全阐明。因此,建立一种简单、经济、稳定可靠,同时病理表现与人类糖尿病肾病类似的动物模型对于深入研究DN的发病机制及新药开发有着非常重要的意义。DN动物模型主要分为诱发型和自发型[3-4]。自发型模型大小鼠价格昂贵,对环境要求高,严重限制了相关研究的开展。诱发型模型常用STZ进行诱导,造模过程中STZ的注射剂量直接影响动物模型成模率及成模稳定性,但国内外STZ造模法中STZ剂量选用报道众多,尚存有争议[5-6]。本研究选取单次大剂量单次注射和多次小剂量连续注射STZ联合高糖高脂饮食建立DN模型,对比观察造模过程中模型的稳定性,旨在探索更为合理的糖尿病肾病的造模方法。
1 材料和方法
1.1 实验动物
6周龄SPF级雄性C57BL/6J小鼠(18~20)g,共48只,购于北京维通利华公司[SCXK(京)2016-0006]。饲养于江汉大学医学院动物实验中心[SYXK(鄂)2018-0042],恒温恒湿(温度:(23±2)℃,相对湿度:60%~70%),12 h明暗交替,动物自由进食饮水。本实验通过江汉大学医学院实验动物伦理审查(IACUC20191210),依据优化、减少、替代的3R原则进行实验设计。
1.2 主要试剂与仪器
链脲佐菌素(美国Sigma公司),用pH=4.2的0.1 mol/L柠檬酸-柠檬酸钠缓冲液在冰浴中配制,现配现用;安准血糖仪及血糖试纸(瑞士罗氏公司);尿蛋白检测试剂盒、血清肌酐检测试剂盒、血清尿素氮检测试剂盒、总胆固醇检测试剂盒、甘油三酯检测试剂盒、低密度脂蛋白检测试剂盒由南京建成生物工程研究所提供;PAS染色试剂盒(上海源叶生物);高糖高脂饲料(10%猪油、20%蔗糖、2.5%胆固醇、1.0%胆酸盐、66.5%普通饲料,江苏美迪森生物医药有限公司)。小鼠代谢笼(上海玉研生物);AU5800全自动生化分析仪(美国Beckman);MULTISKAN GO酶标仪(美国Thermo);EC 350-1石蜡包埋机(美国Thermo);MICROM HM 340E石蜡切片机(美国Thermo);BX 51显微镜(日本OLYMPUS)。
1.3 实验方法
1.3.1 糖尿病肾病模型小鼠制备及分组
小鼠适应性喂养7 d后随机分为3组,即普通饲料喂养组(对照组)12只,高脂高糖饲料喂养+STZ单次大剂量组18只,高脂高糖饲料喂养+STZ多次小剂量组18只。STZ造模组喂养高脂饲料4周后,小鼠禁食不禁水12 h,随后对照组小鼠腹腔注射等体积柠檬酸缓冲液;多次小剂量组连续4 d腹腔注射STZ 50 mg/kg,单次大剂量组腹腔注射STZ 150 mg/kg一次,STZ注射2 h后给小鼠进食以防止低血糖。整个实验期间,STZ造模组小鼠均采用高脂高糖饲料喂养。实验期间,按照动物实验的3R原则给予实验动物人道主义关怀。
1.3.2 标本采集及检测
注射STZ前及注射STZ后2、4、6、8、10周测量并记录小鼠体重及饮水量;注射STZ前及注射STZ后2、4、6、8、10周各组小鼠禁食12 h后采取剪尾法测量空腹血糖;注射STZ后2、6、10周各组小鼠入代谢笼收集24 h尿液,采用考马斯亮蓝法测定24 h尿蛋白含量;注射STZ后第10周各组小鼠眼眶取血,2000 r/min离心取上清,用全自动生化分析仪检测血清TC、TG、LDL、Scr及BUN,其中Scr采用苦味酸法,BUN采用脲酶法;小鼠处死后迅速剥离双肾,生理盐水清洗,滤纸吸干,剥离外包膜后称双肾重量,采用公式:肾脏指数=m1/m2×100%(m1为小鼠双肾总重量;m2为小鼠的体重);将肾置于10%中性福尔马林中固定24 h,常规脱水、石蜡包埋并切片,石蜡切片梯度脱蜡至水,蒸馏水洗2 min,过碘酸溶液氧化10 min,流水洗10 min,希夫(Schiff)试剂染色10 min,流水洗5 min,苏木精染核2 min,流水冲洗10 min,常规脱水、透明、封片、拍照。
1.4 统计学方法
各组数据均采用平均数±标准误(±s)表示,采用Graph Pad Prism 5.0软件进行数据分析,组间比较采用one-way ANOVA和Duncantest检验方法,其中P<0.05表示差异显著。
2 结果
2.1 状态观察
注射STZ后,给予小鼠充足饲料及饮水,隔天更换垫料以保持环境清洁。STZ注射72 h后,单次大剂量注射组及多次小剂量注射组小鼠均出现多饮、多食、多尿情况。STZ注射后第4周和第5周,单次大剂量组小鼠均死亡1只。到实验结束时,单次大剂量组共死亡小鼠2只,而对照组和多次小剂量组无小鼠死亡。
2.2 小鼠体重变化
实验期间,单次大剂量组小鼠体重缓慢增加,而多次小剂量组小鼠体重出现负增长,注射STZ 10周后多次小剂量组小鼠体重显著低于对照组和单次大剂量组(P<0.05),见图1。
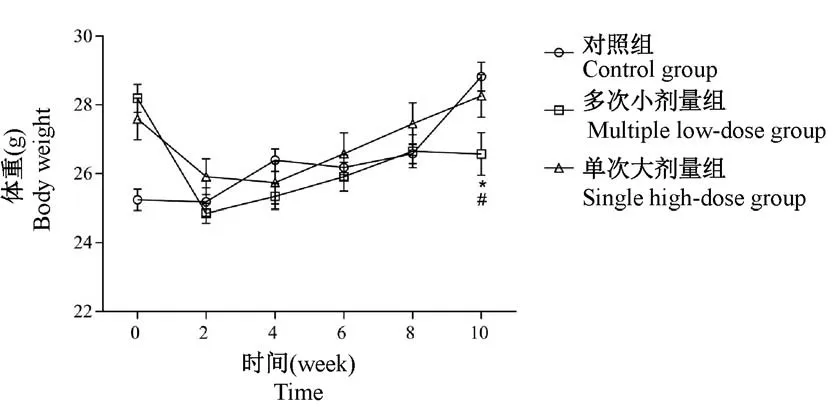
图1 各组小鼠建模前后体重的变化(±s)Figure 1 Change of body weight in each group before and after modeling
2.3 小鼠空腹血糖变化
注射STZ后,单次大剂量组空腹血糖迅速升高,在第4周达到峰值,且显著高于阴对照组及多次小剂量组(P<0.001,P<0.05),但此后呈逐渐降低的趋势;多次小剂量组空腹血糖持续升高并保持稳定在较高水平至实验结束,在注射STZ后的第8~10周,多次小剂量组空腹血糖显著高于单次大剂量组(P<0.01),见图2。

图2 各组小鼠建模前后空腹血糖的变化(±s)Figure 2 Change of fasting blood glucose in each group before and after modeling
2.4 小鼠饮水量变化
注射STZ后,单次大剂量组小鼠饮水量迅速增加,在第4周后达到峰值,且显著高于对照组及多次小剂量组(P<0.001,P<0.05),随后有所降低,但仍显著高于正常对照(P<0.001)。注射STZ后多次小剂量组饮水量持续升高并保持稳定至实验结束,在第8~10周时,显著高于单次大剂量组(P<0.01),见图3。

图3 各组小鼠24 h饮水量的变化(±s)Figure 3 Change of water intake in each group
2.5 小鼠24 h尿蛋白变化
STZ注射后的第2、6周,与对照组相比,单次大剂量组和多次小剂量组的24 h尿蛋白含量显著升高,差异具有统计学意义(P<0.001),但造模组之间差异无统计学意义(P>0.05)。第10周时,单次大剂量组24 h尿蛋白有所降低,且显著低于多次小剂量组(P<0.001),见图4。
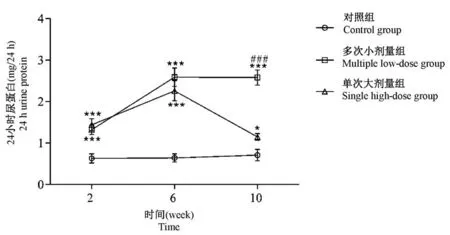
图4 各组小鼠24 h尿蛋白的变化(±s)Figure 4 Change of 24 h urine protein in each group
2.6 各组小鼠血清TC、TG及LDL比较
STZ注射10周后,与正常对照组比较,多次小剂量组血清TC、TG及LDL水平均显著升高,差异有统计学意义(P<0.001)。相较对照组,单次大剂量组血清TC及LDL水平显著升高,差异有统计学意义(P<0.001),两组间TG水平无显著性差异(P>0.05)。多次小剂量组血清TG水平显著高于单次大剂量组(P<0.001),见表1。
表1 各组小鼠血清TC、TG及LDL水平比较(±s)Table 1 Comparion of serum TC,TG and LDL in each group

表1 各组小鼠血清TC、TG及LDL水平比较(±s)Table 1 Comparion of serum TC,TG and LDL in each group
注:与对照组相比,***P<0.001;与单次大剂量组相比,###P<0.001。Note.Compared with the control group,***P<0.001.Compared with the single high-dose group,###P<0.001.
组别Groups n甘油三酯(mmol/L)TG胆固醇(mmol/L)TC低密度脂蛋白(mmol/L)LDL对照组Control 12 3.54±0.08 1.12±0.06 1.25±0.04多次小剂量组Multiple low-dose 18 6.86±0.38*** 2.04±0.25***###2.63±0.14***单次大剂量组Single high-dose 16 6.25±0.43*** 1.29±0.15 2.29±0.15***
2.7 各组小鼠血清肾功能及肾脏指数比较
STZ注射10周后,与正常对照组相比,多次小剂量组血清尿素氮、血清肌酐及肾脏指数显著升高(P<0.001)。与正常对照组相比,单次大剂量组血清尿素氮及肾脏指数显著升高(P<0.001,P<0.05),血清肌酐无显著性差异(P>0.05)。多次小剂量组血清肌酐及肾脏指数显著高于单次大剂量组(P<0.001,P<0.01),见表2。
表2 各组小鼠肾功能及肾脏指数比较(±s)Table 2 Comparion of kidney function and kidney index in each group

表2 各组小鼠肾功能及肾脏指数比较(±s)Table 2 Comparion of kidney function and kidney index in each group
注:与对照组相比,*P<0.05,***P<0.001;与单次大剂量组相比,##P<0.01,###P<0.001。Note.Compared with the control group, *P<0.05,***P<0.001.Compared with the single high-dose group,##P<0.01,###P<0.001.
组别Groups n血清尿素氮(mmol/L)BUN血清肌酐(mmol/L)Scr肾脏指数(%)KI对照组Control 12 21.19±0.85 19.95±3.01 1.20±0.04多次小剂量组Multiple low-dose 18 29.43±0.91*** 77.51±13.84***###1.69±0.18***##单次大剂量组Single high-dose 16 27.37±1.30*** 31.80±6.25 1.42±0.04*
2.8 各组小鼠肾病理的变化
为检测小鼠肾中的还原糖水平,对各组小鼠的肾进行PAS染色。与对照组相比,两种剂量组小鼠肾小球系膜细胞增生,系膜基质增多,且肾小球着色明显增多,还原糖水平显著高于对照组(P<0.001)。两种剂量组比较,发现多次小剂量组还原糖的累积显著高于单次大剂量组(P<0.001),表明多次小剂量组肾小球损伤更为显著,见图5。

图5 各组小鼠肾形态变化(PAS)Figure 5 Histological observation of kidney tissues in each group
3 讨论
目前DN动物模型的建立方法主要分为自发性模型[7]和诱发性模型[8]。自发性DN模型由于其存在遗传因素作用,糖尿病肾病的产生与临床患者更为相似,但是相较于普通诱导鼠类模型的获得渠道更为狭窄,价格较高,制约了其在DN研究中的广泛使用。诱发性DN模型采用腹腔或尾静脉注射一定剂量STZ,从而特异性损伤胰岛β细胞[9],使胰岛素分泌不足,模拟糖尿病的发生,在此基础上继续喂养4~8周,可出现DN早期症状。脂代谢紊乱是DN重要危险因素之一,芝敏等[10]比较不同饮食结构建立2型糖尿病肾病大鼠模型时发现,高糖高脂可导致糖尿病肾病大鼠更为明显的高血压和更加严重的微量白蛋白尿,且易导致肾小球硬化,病理损害相对较重。C57BL/6J小鼠是有腹部肥胖和2型糖尿病基因倾向的近交系小鼠,具有ob/ob遗传背景,对脂肪诱导血糖升高较敏感[11-12]。因此,本研究以C57BL/6J小鼠作为研究对象,首先利用高糖高脂饮食诱导出胰岛素抵抗,然后注射STZ引起β细胞受损并诱发形成糖尿病模型,在此基础上继续喂养高脂高糖饲料,大大缩短了DN的造模时间。已有研究表明STZ的剂量与胰岛的损伤程度呈明显的正相关[13-14],STZ剂量过大则小鼠易死亡[15],剂量过小则成模率低[16]。本研究选择150 mg/kg、50 mg/kg STZ分别进行单次大剂量腹腔注射及多次连续小剂量腹腔注射建立DN模型。结果显示两种处理方式均能使模型组小鼠出现尿量增多、饮水量增多,体重下降等糖尿病症状。单次大剂量组和多次小剂量组在STZ注射后的第4周空腹血糖分别为20.54 mmol/L和15.64 mmol/L,10周时血糖分别为13.75 mmol/L和18.30 mmol/L。这些结果说明单次大剂量STZ注射可使小鼠的血糖水平快速升高,但稳定性较差,随着实验的进行,血糖水平会有所恢复;而多次小剂量STZ注射组小鼠的血糖水平升高缓慢,但持续上升,并一直维持在较高水平。
蛋白尿的出现是肾受累的明显特征,表明了糖尿病的并发症—糖尿病肾病的产生[17]。实验中,对小鼠24 h尿蛋白量进行动态监测发现,注射STZ后,单次大剂量组24 h尿蛋白持续上升至第6周后开始下降,而多次小剂量组小鼠尿蛋白持续升高,在第10周多次小剂量组24 h尿蛋白显著高于单次大剂量组。造模10周后,多次小剂量组血清肌酐水平及肾脏指数均高于单次大剂量组,表明多次小剂量组小鼠肾功能损伤更为显著。基质增生和间质纤维化是糖尿病肾病进展的主要病理特征[18]。肾PAS染色显示,单次大剂量组肾小球系膜轻度增生,细胞外基质增多,改变不够典型,而多次小剂量组组肾已出现典型病理改变:系膜区明显扩张甚至弥漫性系膜硬化、系膜细胞增生及细胞外基质显著增多,肾小球、肾小管基底膜增厚。根据Mogensen对DN分期标准[19],单次大剂量组小鼠至少到达DN的Ⅱ期,多次小剂量组小鼠达DN的Ⅲ期。上述结果表明,相比于单次大剂量注射STZ,多次小剂量注射STZ对C57BL/6J小鼠造成的肾损伤更为明显。
综上所述,实验结果表明单次大剂量和多次小剂量注射STZ的方法均能诱发C57BL/6J小鼠DN。单次大剂量注射与多次小剂量注射方法相比,操作简单,用药量小,但对小鼠的毒性较大,死亡率较高,成模率较低,血糖水平波动幅度大,有些小鼠可逐渐恢复至正常血糖水平。多次小剂量连续注射STZ联合高糖高脂饮食,小鼠死亡率低,血糖稳定,肾病理改变典型,是理想的DN造模方法。
