洋葱γ-谷氨酰转肽酶AcGGT的克隆与鉴定
2021-10-20徐欢欢李逸高伟王永勤刘乐承
徐欢欢,李逸,高伟,王永勤,刘乐承
洋葱γ-谷氨酰转肽酶的克隆与鉴定
徐欢欢1,2,李逸1,高伟1,王永勤2,刘乐承1
1长江大学园艺园林学院,湖北荆州 434025;2北京市农林科学院蔬菜研究中心/农业农村部华北地区园艺作物生物学与种质创制重点实验室/蔬菜种质改良北京市重点实验室,北京 100097
【】葱属植物代谢产生的蒜氨酸具有重要的药学价值,γ-谷氨酰转肽酶是蒜氨酸合成中作为脱谷氨酰化步骤的关键酶。研究洋葱γ-谷氨酰转肽酶基因的功能,揭示γ-谷氨酰转肽酶在洋葱蒜氨酸合成途径中的作用,为体外合成蒜氨酸提供理论依据,为进一步深入研究洋葱蒜氨酸合成机制奠定基础。以洋葱为材料,依据洋葱RNA-seq数据库设计引物,利用RT-PCR从洋葱中克隆γ-谷氨酰转肽酶基因,并进行生物信息学分析;构建CaMV 35S-AcGGT-GFP载体,利用微粒轰击技术,以金粉-质粒微载体轰击洋葱内表皮细胞,构建带有的酿酒酵母表达载体,转化并诱导表达,利用γ-谷氨酰转肽酶催化谷氨酰对硝基苯胺生成对硝基苯胺的方法测定转入的酿酒酵母总蛋白的谷氨酰转肽酶活性;利用实时荧光定量PCR方法分析该基因在洋葱组织间差异表达模式;利用γ-谷氨酰转肽酶催化谷氨酰对硝基苯胺生成对硝基苯胺的方法测定组织间内源性转肽酶酶活性。克隆获得,长度为1 869 bp;生物学信息学分析显示,洋葱编码622个氨基酸,蛋白保守结构域预测显示具有谷氨酰转肽酶结构域,二级结构主要以α-螺旋为主,跨膜区分析推测GGT蛋白具有跨膜区,氨基酸多重比对结果显示植物中的GGT具有一定的保守性,进化分析表明AcGGT与大蒜AsGGT2亲缘关系最接近。CaMV 35S-AcGGT-GFP融合蛋白的荧光信号位于液泡中,表明该基因编码蛋白位于液泡。外源表达AcGGT蛋白的谷氨酰转肽酶活性测定结果显示,转入的酵母谷氨酰转肽酶活性显著高于对照,表明编码的蛋白具有转肽酶活性。组织差异表达结果分析显示,该基因的表达主要在叶鞘,鳞茎和叶鞘次之;不同组织谷氨酰转肽酶活性显示,在叶中活性最高,叶鞘次之。相关性分析显示组织间谷氨酰转肽酶活性与表达相关性不显著。克隆了洋葱。洋葱蒜氨酸合成途径中脱谷氨酰化先于S-加氧。的表达与洋葱内源性的谷氨酰转肽酶活性相关性不显著,洋葱中可能存在多个谷氨酰转肽酶基因。
洋葱;γ-谷氨酰转肽酶;生物信息学;亚细胞定位;真核表达;表达模式
0 引言
【研究意义】洋葱(L.)是葱属二年生草本植物,富含多种活性物质[1-4]。其中,含硫化合物是洋葱风味物质的主要成分,使洋葱不仅具有食用价值还有药用价值[5-6]。大量研究表明这类物质具有抗氧化活性,并且在抗癌细胞增殖和降低糖尿病和心血管疾病的风险中起重要作用[7-11]。蒜氨酸是洋葱中重要的含硫化合物,也是大蒜素合成的前体,γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)作为脱谷氨酰化酶参与蒜氨酸合成途径[12-14]。因此,克隆洋葱并鉴定功能,阐明该基因在蒜氨酸合成途径中的作用,对利用分子设计育种改善洋葱品质具有重要意义。【前人研究进展】在蒜氨酸生物合成途径中,GGT能够催化γ-谷氨酰基从γ-谷氨酰基肽移至其他肽,使γ-谷酰胺半胱氨酸化合物脱去谷氨酰基产生脱氧蒜氨酸(S-allyl-L-cysteine,SAC)[15-17]。因此,GGT作为脱谷氨酰化酶参与蒜氨酸的合成,是蒜氨酸合成的重要步骤。前人利用(NH4)2SO4沉淀和疏水作用层析(苯基-琼脂糖柱)的方法从枯草芽孢杆菌[18]、番茄果实[19]、香菇[20]、大蒜[21]和洋葱[22-24]中纯化获得GGTs并对蛋白的部分特性进行了鉴定。这些研究中发现,GGT通常由1个主要亚基和1个次要亚基组成[24]。其中,大蒜GGTs相对分子质量为68 kD,由2个异质亚基54和14 kD组成[21]。在洋葱中,发芽鳞茎的GGT由36—39 kD大亚基和25 kD小亚基组成,另一项研究发现休眠鳞茎中的GGTs为55 kD亚基和一个22 kD亚基。此外,研究还发现pH、金属离子、氨基酸对洋葱GGTs活性具有促进作用[23-24]。大蒜中已被鉴定了3个编码GGTs的基因、和,相应的重组蛋白可以使γ-谷氨酰基-S-烯丙基-L-半胱氨酸脱谷氨酰化,产生脱氧蒜氨酸[13]。【本研究切入点】洋葱中GGTs蛋白的部分特性已被鉴定,但编码GGTs的基因及功能鉴定的研究却鲜见报道。【拟解决的关键问题】本研究克隆,阐明该基因及编码蛋白的理化性质,并鉴定外源蛋白的谷氨酰转肽酶活性,检测在组织间的表达模式及组织间谷氨酰转肽酶活性的差异,为后续GGTs特性的深入研究奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 试验所用洋葱材料均为紫冠洋葱,取自北京市农林科学院蔬菜研究中心基地。
1.1.2 试验试剂 RNA提取试剂盒(Quick RNA Isolation Kit)购自北京华越洋生物科技有限公司;反转录试剂盒(Prime Script™ 1st Strand cDNA Synthesis Kit)、酵母转化试剂盒(Yeastmaker™ Yeast Transformation System2)购自上海宝生物有限公司;DNA marker、2×TransStart®FastPfu Fly PCR Mix、琼脂糖凝胶DNA纯化试剂盒、蛋白定量试剂盒(Easy Protein Quantitative Kit)购自TransGen Biotech。无缝克隆试剂盒(2×Seamless Cloning Mix)、大量质粒提取试剂盒购自(DP109-01)北京博迈德基因技术有限公司。
1.1.3 菌株及载体 pEASY-Blunt Zero载体、大肠杆菌感受态(Trans1-T1 Phage Resistant Chemically Competent Cell)购自TransGen Biotech;酵母菌株BY2777由NBRP(National BioResource Project)提供;pYES2、PYBA1332载体均由北京市农林科学院蔬菜研究中心公共平台实验室保存。
1.1.4 引物设计与合成 试验所用引物均由Primer5.0软件设计(表1),由博迈德生物科技公司(北京)合成。
1.2 洋葱总RNA的提取和cDNA合成
选择无病虫害的洋葱鳞茎,用RNA提取试剂盒提取洋葱总RNA,并用微量紫外分光光度计检测RNA的质量,反转录合成cDNA。
1.3 洋葱AcGGT的克隆
根据北京市农林科学院蔬菜研究中心公共平台实验室RNA-Seq数据库获得序列,用primer5.0软件设计引物(表1)扩增的编码区序列。PCR反应体系为洋葱cDNA 1 μL、10 μmol·L-1的上下游引物(GGT-F和GGT-R)各1 μL、2×TransStart®FastPfu Fly PCR Mix10 μL,加水补至20 μL。PCR扩增程序为94℃3 min;94℃30 s,56℃30 s,72℃2 min,30个循环;72℃7 min,4℃保存。PCR产物经1.5%琼脂糖凝胶电泳检测,拍照,切胶并利用胶回收试剂盒进行PCR产物的回收,纯化回收后连接到载体pEASY-Blunt Zero中。
转化筛选后,将阳性克隆送北京博迈德生物科技公司测序,测序得到的序列在NCBI上进行比对。利用DNAMAN软件及NCBI将测序验证正确的序列进行拼接,并通过NCBI数据库中的BLAST对其核苷酸序列和推导氨基酸序列进行比对。
1.4 生物信息学分析
利用ProtParam(http://web.expasy.org/protparam/)对氨基酸序列的蛋白质分子量和等电点进行分析;利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)在线分析蛋白质的信号肽;利用TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白质的跨膜结构域;利用DNAMAN对编码氨基酸序列进行同源性比对,利用MEGA5.0软件构建系统发育树。
1.5 AcGGT亚细胞定位载体构建及分析
用Ⅰ和Ⅰ双酶切PYBA1332植物表达载体,将pEASY-T5-质粒作为模板,使用PYBA1332-GGT-F及PYBA1332-GGT-R进行扩增,根据BM无缝克隆试剂盒提供的方法将回收的PCR产物与酶切产物进行连接。连接完成后使用Trans-T1感受态进行转化,筛选完成后将阳性克隆送博迈德生物科技公司测序,根据测序结果验证PYBA1332-GGT- EGFP与预期结果一致。
使用大量质粒提取试剂盒分别提取PYBA1332空载体以及PYBA1332-GGT-EGFP质粒,制作金粉-质粒微载体,靶距为9 cm,氦气压力为1350PSI以金粉-质粒微载体在基因枪介导下轰击已预培养8 h的洋葱内表皮(轰击条件为:氦气压为1 350 Psi,真空度为28 kPa,轰击聚类为9 cm),25℃培养12 h后,利用OLYMPUSFV300激光共聚焦显微镜观察,并拍照。
1.6 酿酒酵母表达载体pYES2-GGT的构建
使用Ⅰ及Ⅰ双酶切pYES2酿酒酵母表达载体,将pEASY-T5-GGT质粒作为模板,使用pYES2-GGT-F及pYES2-GGT-R进行扩增,BM无缝克隆试剂盒将回收的PCR产物与酶切产物进行连接。连接完成后使用Trans-T1感受态进行转化,筛选完成后将阳性克隆送博迈德生物科技公司测序,根据测序结果验证pYES-GGT与预期结果一致后,提取质粒备用。
1.7 AcGGT的真核表达与总蛋白质的提取
依据酵母转化试剂盒(Yeastmaker™ Yeast Transformation System2)将pYES2和pYES2-GGT转入酿酒酵母BY2777酵母中,利用SD Base-Ura筛选阳性克隆。培养2—3 d后挑选单菌落利用酵母阳性克隆快速检测试剂盒进行鉴定,鉴定完毕后使用2%D-半乳糖代替葡萄糖的SD Base-Ura培养2 d。总蛋白的提取按照北京酷来搏科技有限公司非变性酵母蛋白提取试剂盒提取,-80℃保存备用。
1.8 重组AcGGT酵母总蛋白的定量与酶活性测定
依据Bradford[25]方法定量酵母总蛋白。通过分析酵母总蛋白中γ-谷氨酰化化合物产生的脱谷氨酰化化合物的量来进行GGT酶活性的测定。在6 h的孵育期间,脱谷氨酰化的化合物的数量线性增加。根据Orlowski等[10]方法,通过分光光度法确定以γ-谷氨酰对硝基苯胺为底物的脱谷氨酰化活性。
1.9 不同组织AcGGT相对表达量及谷氨酰转肽酶测定
RNA的提取与cDNA的合成与1.2.1描述一致。实时荧光定量PCR总反应体系为:10 μmol·L-1上、下游引物各0.8 μL、2×SYBR Green Master Mix 10 μL、cDNA模板1 μL和ddH2O 7.4 μL。反应条件为95℃ 2 min;95℃ 15 s,60℃ 50 s,共40个循环。根据荧光定量PCR测定Ct值,利用2-ΔΔCT法计算相对表达量。
精确称取约0.1 g洋葱组织,加提取液1.0 mL充分研磨,于4℃,10 000 r/min离心15 min,取粗酶液上清液待测。通过分析粗酶液上清中γ-谷氨酰化化合物产生的脱谷氨酰化化合物的量来进行GGT酶活性的测定。
2 结果
2.1 AcGGT的克隆
以cDNA为模板,利用特异引物在预先筛选的退火温度下进行PCR扩增,得到约1 900 bp产物(图1),通过测序得到1 869 bp的CDS序列,经NCBI比对,发现与已报道的大蒜(GenBank:JQ409456.1)相似性达96%。在NCBI的ORF finder查找开放阅读框并翻译其对应的氨基酸,结果显示,所克隆得到的序列具有一个1 869 bp完整的开放阅读框,推导编码622个氨基酸(图2),命名为。
2.2 AcGGT的生物信息学分析
采用ProtParam在线分析工具,对AcGGT蛋白的理化性质进行预测,结果显示,该蛋白相对分子质量为67.7,等电点()为6.07,分子式为C3024H4755N811O895S28,不稳定指数为33.37,脂肪族指数为89.25。通过氨基酸多重比对结果发现,植物中的GGT除N端外都具有一定的保守性(图3),与前人预测的N-连接糖基化位点相似,并且也具有保守的蛋白裂解酶位点。
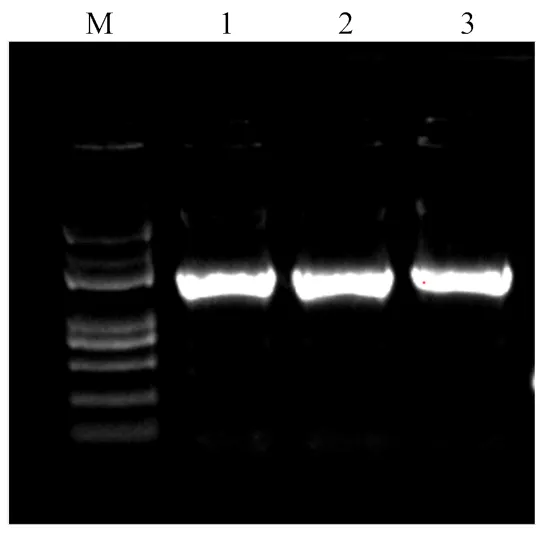
M:DL5000 DNA Marker;1—3:AcGGT

图2 AcGGT编码区序列
NCBI保守结构域预测分析结果显示,编码蛋白从氨基酸第66—622位为一个γ-谷氨酰转肽酶超级结构域(图4-A)。利用SOPMA对AcGGT蛋白二级结构进行分析,结果表明,该蛋白二级结构的形式及其所占比例分别为46.02%α-螺旋、15.17%延伸链、6.94%β-转角和31.88%无规则卷曲(图4-B);利用TMHMM Server V.2.0对AcGGT蛋白跨膜区进行预测,分析显示该蛋白第24—46位具有一个跨膜结构(图5)。
利用MegA6软件对21种GGT氨基酸序列进行同源性比对,并构建系统发育树(图6)。结果表明,洋葱GGT氨基酸序列与大蒜AsGGT1、AsGGT2、AsGGT3有较高同源性,在系统发育树中距离AsGGT2最近,GGT发育树与生物进化的物种树基本一致,符合物种进化规律,说明GGT基因编码区在物种间具有保守性。
2.3 AcGGT亚细胞定位载体的构建及分析
为了预测AcGGT编码蛋白在大葱中的亚细胞定位情况,利用基因枪介导在洋葱内表皮中瞬时表达带有GFP的,将轰击过后的洋葱内表皮组织在25℃暗培养12 h,在激光共聚焦显微镜下扫描拍摄其在细胞中的定位(图7)。结果发现,带有GFP的AcGGT重组融合蛋白在洋葱液泡中具有微弱信号,这一结果可能是由于的序列较长,含有靶向细胞器的信号序列,这与大蒜AsGGT2定位于液泡中的结果一致。

黑线:预测的GGT蛋白信号肽;*:预测的N-连接糖基化位点;箭头:表示大亚基和小亚基之间的保守蛋白酶切割位点
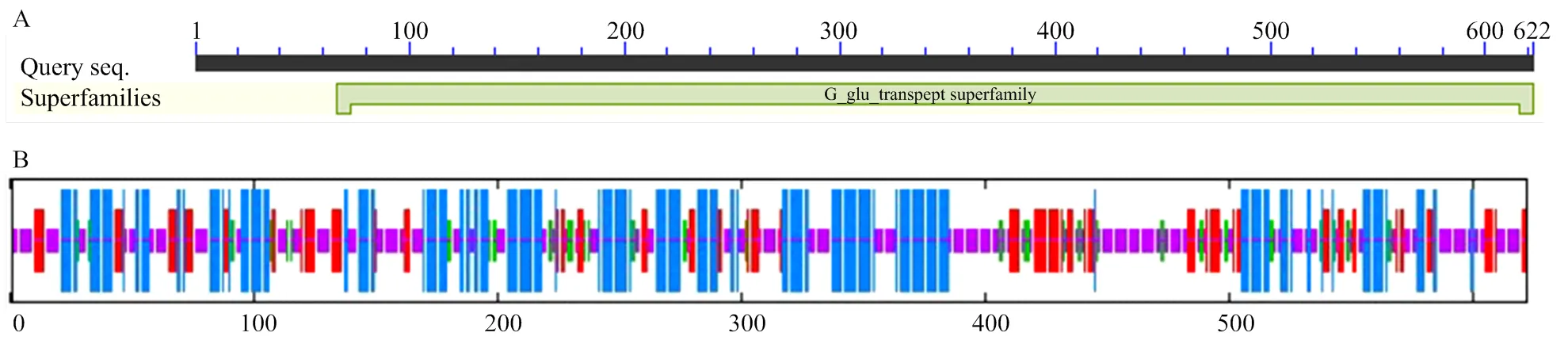
A:γ-谷氨酰转肽酶结构域预测;B:γ-谷氨酰转肽酶二级结构预测
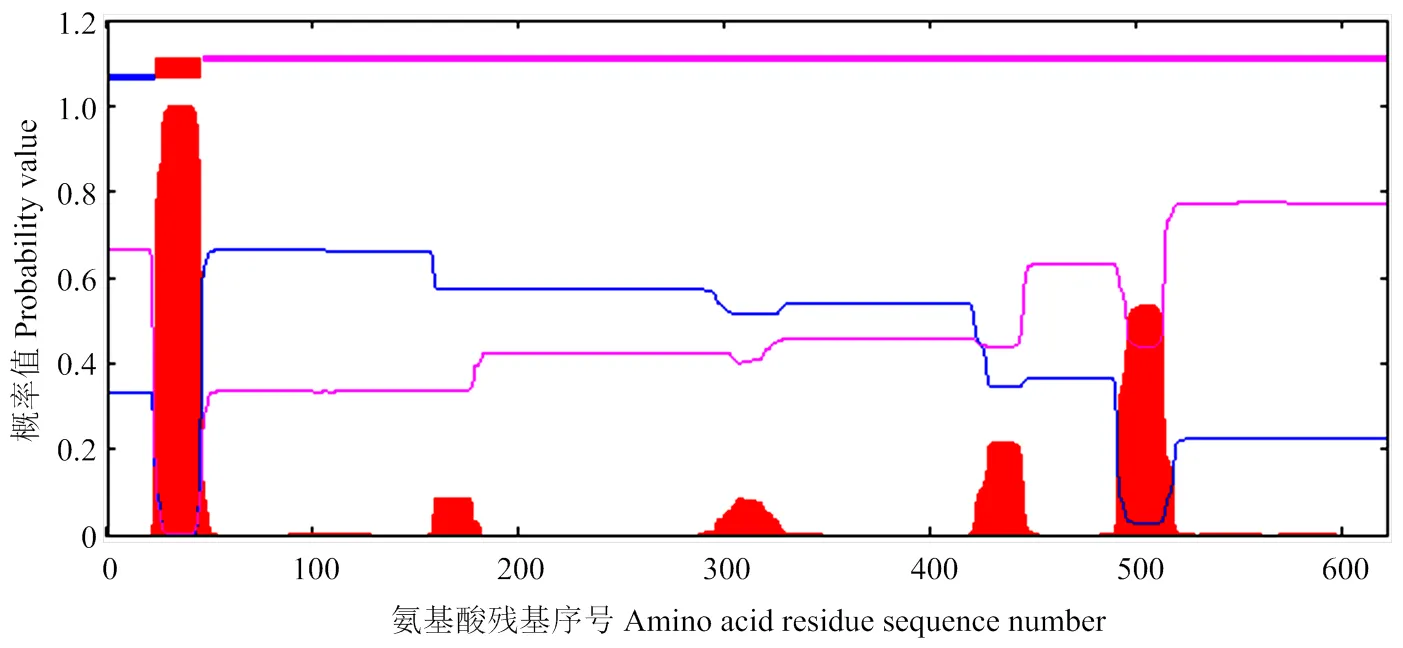
图5 洋葱AcGGT编码蛋白的跨膜结构预测
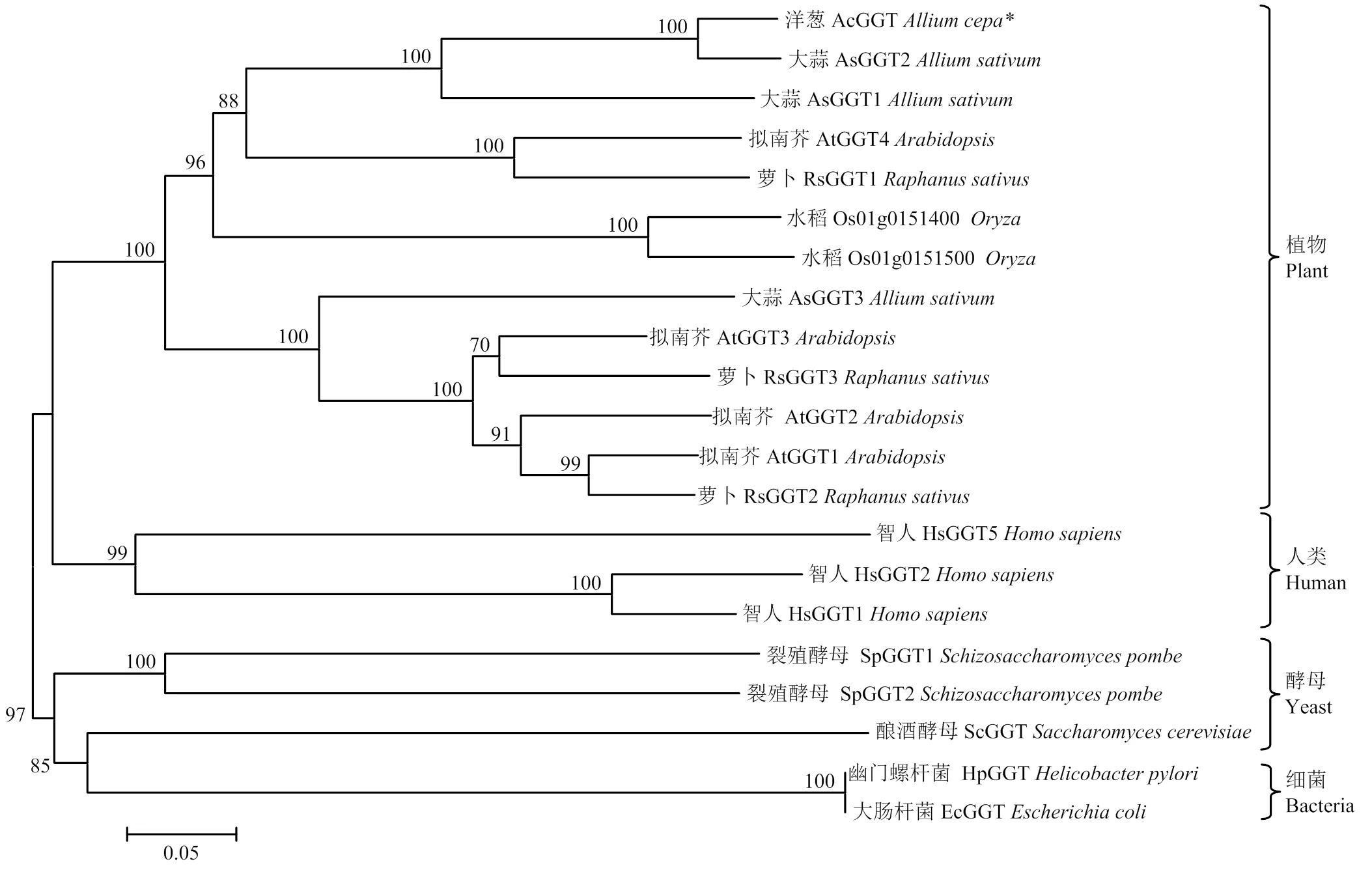
*:洋葱AcGGT *:Allium cepa AcGGT
2.4 AcGGT在酵母中的表达及活性分析
根据γ-谷氨酰转肽酶能够将谷氨酰对硝基苯胺中γ-谷氨酰基转移给N-甘氨酰甘氨酸,生成对硝基苯胺的方法测定酵母总转肽酶活性。按照上述方法,37℃孵育6 h后,转入的酵母总蛋白酶液催化生成0.76 μmol·mg-1对硝基苯胺;而转入PYES2空载体的催化生成0.54 μmol·mg-1(图8)。转入的酵母总蛋白的谷氨酰转肽酶活性显著高于未转入外源基因的酵母总蛋白,结果表明,AcGGT蛋白具有谷氨酰转肽酶功能。
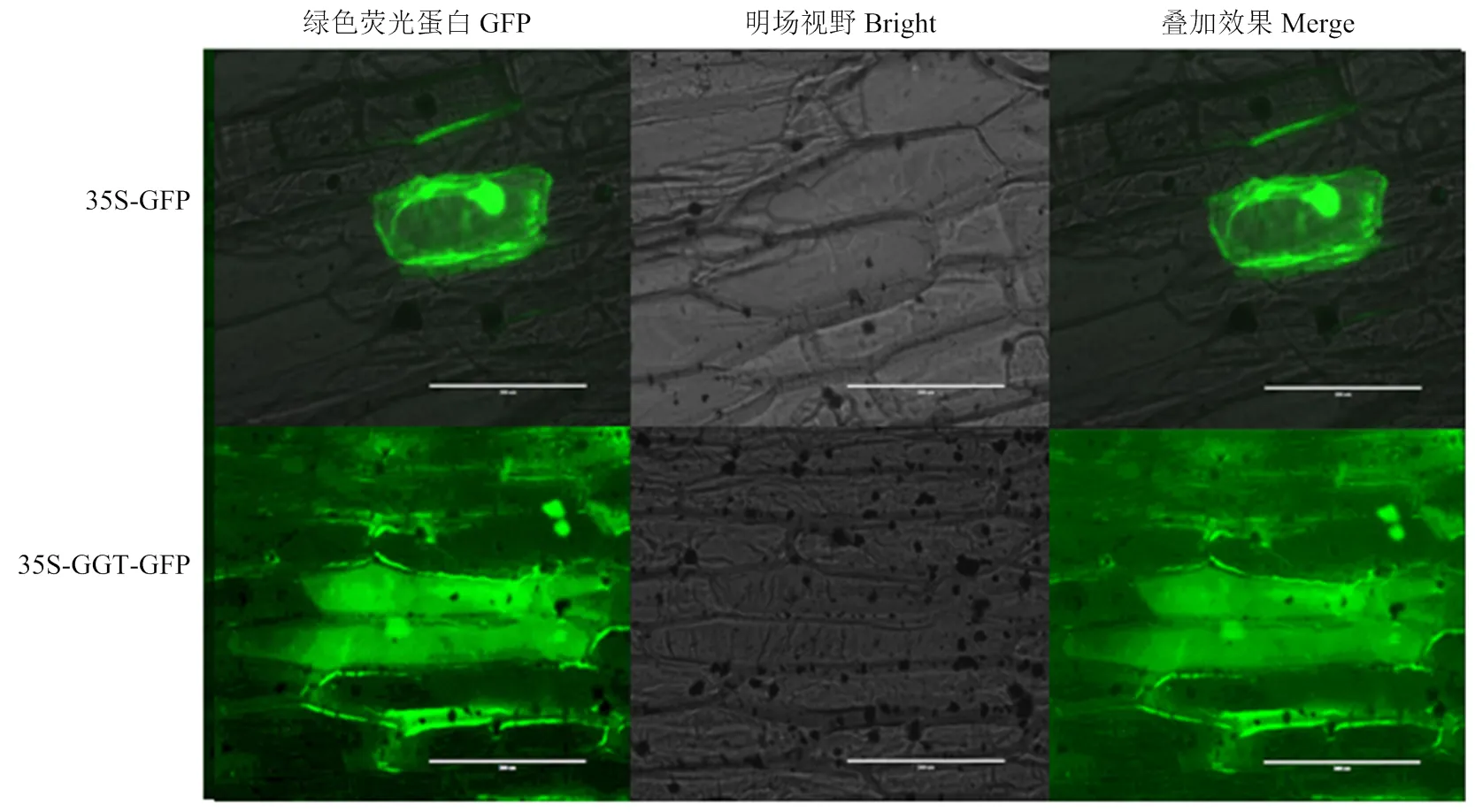
图7 35S-GGT-GFP 在洋葱表皮细胞中的亚细胞定位分析
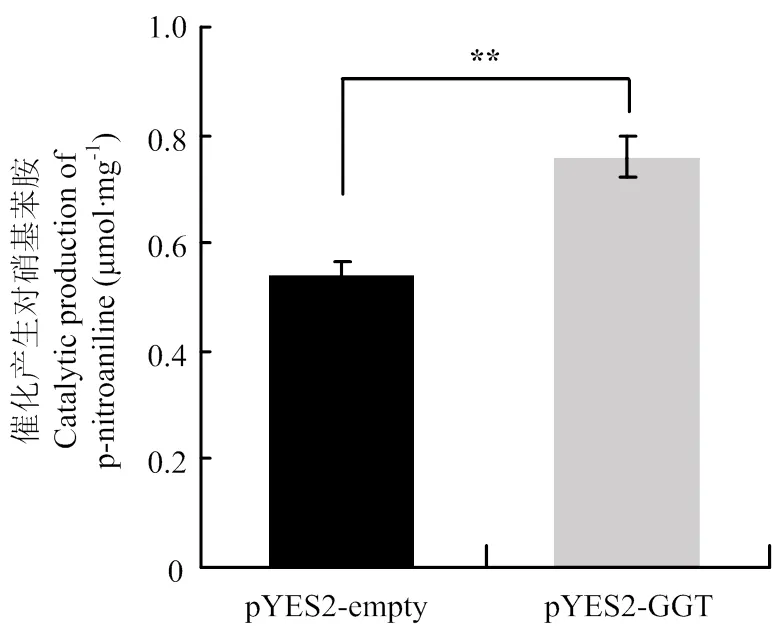
**:与对照组显著性差异(p<0.01)
2.5 AcGGT在洋葱中的组织表达差异性及内源性谷氨酰转肽酶活性分析
利用qRT-PCR方法检测在洋葱不同组织中的表达(图9)。结果表明,在叶中的表达量远远高于在其他组织中的表达量,其次是叶鞘,而在鳞茎中几乎不表达。
根据上述方法测定洋葱不同组织谷氨酰转肽酶活性,结果显示,在叶中活性最高,叶鞘和鳞茎次之。
相关性分析显示在洋葱中的表达与内源性转肽酶活性相关性不显著(=0.269,>0.05)。
3 讨论
蒜氨酸是葱属植物中富含的一类含硫化合物,也是大蒜素合成的主要底物[26]。前人根据放射性追踪法及化学分析的结果中提出的从大蒜中的半胱氨酸生物合成蒜氨酸的途径,其中研究最广泛的步骤是生物合成中间体中去除γ-谷氨酰基,γ-谷氨酰转肽酶(GGT)作为脱谷氨酰化酶参与蒜氨酸合成[26-29]。因此,γ-谷氨酰转肽酶在蒜氨酸合成途径中起着关键作用[24,27,29]。本研究克隆了一个编码洋葱GGT蛋白的一个基因,并利用生物信息学分析鉴定了该基因的基本性质,通过异源表达发现该基因编码蛋白具有转肽酶功能。
在前人提出的蒜氨酸生物合成途径中,根据脱谷氨酰化和S-加氧反应顺序的不同,从中间体γ-谷氨酰-S-烯丙基-L-半胱氨酸到蒜氨酸有2条不同路线[13,30-31]。大蒜AsGGT1、AsGGT2和AsGGT3对γ-谷氨酰-S-烯丙基-L-半胱氨酸具有脱谷氨酰化活性,而这些GGT对γ-谷氨酰S-烯丙基-L-半胱氨酸亚砜几乎没有脱谷氨基活性,表明大蒜蒜氨酸的合成主要是先脱谷氨酰化,然后加氧合成蒜氨酸[13]。在休眠的洋葱鳞茎中的GGTs对蒜氨酸的生物合成中间体表现出很高的底物特异性,证实GGT催化γ-谷氨酰S-烯丙基-L-半胱氨酸生物合成中的脱谷氨酰基的观点[23]。然而,在发芽的洋葱鳞茎中纯化的GGTs对谷胱甘肽和谷胱甘肽S-结合物表现出很高的亲和力,但利用γ-谷氨酰-S-丙烯-L-半胱氨酸亚砜作为底物的亲和力较差,这表明洋葱至少有2个不同的GGT蛋白,它们在体内具有不同的功能[24]。此外,在大蒜的膨大时期转录组测序结果中显示,在大蒜鳞茎膨大时期中均处于高度表达状态,表明该基因在大蒜鳞茎膨大过程中具有重要作用[32]。在本研究中鉴定的编码洋葱GGT的基因,该基因与同源性最高,进化分析显示与归于同一分支。由此,表明该基因在洋葱中的蒜氨酸合成途径中的作用与大蒜中一致。综上所述,推测在洋葱蒜氨酸合成过程中,γ-谷氨酰-S-烯丙基-L-半胱氨酸到蒜氨酸的顺序是脱谷氨酰化先于S-加氧反应。
另外,通过分析该基因的组织表达水平以及谷氨酰转肽酶活性发现,洋葱的表达与谷氨酰转肽酶活性相关性不显著,所以推测洋葱中可能存在多个谷氨酰转肽酶基因。然而,编码洋葱GGTs蛋白的其他基因有待进一步研究。
4 结论
克隆了洋葱,并提供了外源表达酶促反应数据。洋葱蒜氨酸合成途径中脱谷氨酰化先于S-加氧;的表达与洋葱内源性的谷氨酰转肽酶活性相关性不显著,表明洋葱中可能存在多个谷氨酰转肽酶基因。
[1] Jones M G, Hughes J, Tregova A, Milne J, Tomsett A B, Collin H A. Biosynthesis of the flavour precursors of onion and garlic. Journal of Experimental Botany, 2004(404): 1903-1918.
[2] Beesk N, Perner H, Schwarz D, George E, Kroh L W, Rohn S. Distribution of quercetin-3,4′-O-diglucoside, quercetin-4′- O-monoglucoside, and quercetin in different parts of the onion bulb () influenced by genotype. Food Chemistry, 2010, 122(3): 566-571.
[3] 张新茹, 杨晓虹, 王天晓. 葱属植物中甾体皂苷及其药理作用最新研究进展. 解放军药学学报, 2009, 25(2): 165-169.
ZHANG X R, YANG X H, WANG T X. Research progress of steroidal saponins and their pharmacological effects in Allium. Pharmaceutical Journal of Chinese People's Liberation Army, 2009, 25(2): 165-169. (in Chinese)
[4] 冯长根, 吴悟贤, 刘霞, 李生才. 洋葱的化学成分及药理作用研究进展. 上海中医药杂志, 2003(7): 63-65.
Feng C G, Wu W X, Liu X, Li S C. Chemical constituents and pharmacological effects of onion. Shanghai Journal of traditional Chinese medicine, 2003(7): 63-65. (in Chinese)
[5] 弓志青, 靳琼, 陈相艳, 王文亮. 不同品种洋葱粉营养成分分析. 食品科学技术学报, 2014, 32(5): 46-49.
Gong Z Q, Jin Q, Chen X y, Wang W L. Analysis of nutritional components of different onion powder. Journal of food science and technology, 2014, 32(5): 46-49. (in Chinese)
[6] 陈亦辉, 王卫东, 孙月娥. 洋葱中活性物质及生理药理作用研究进展. 中国调味品, 2015, 40(4): 129-132+140.
Chen Y H, Wang W D, Sun Y E. Research progress on active substances and physiological and pharmacological effects of onion. Chinese condiment, 2015, 40(4): 129-132+140. (in Chinese)
[7] NAOKO Y, KAZUKI S. Biosynthesis of S-Alk(en)yl-l-Cysteine Sulfoxides in Allium: Retro Perspective. Sulfur metabolism in higher plants. Fundamental, Environmental and Agricultural Aspects, 2017: 49-60
[8] Conrad M, Sandin A, Forster H, Seiler A, Frijhoff J, Dagnell M, Bornkamm G W, Rådmark O, Hooft van Huijsduijnen R, Aspenström P, Böhmer F, Ostman A. 12/15-lipoxygenase-derived lipid peroxides control receptor tyrosine kinase signaling through oxidation of protein tyrosine phosphatases. Proceedings of the National Academy of sciences of the USA, 2010, 107(36): 15774-15779.
[9] Tian S y, Hao C c, Xu G k, Yang J j, Sun R g. Optimization conditions for extracting polysaccharide from Angelica sinensis and its antioxidant activities. Journal of Food and Drug Analysis, 2017, 25(4): 766-775
[10] Orlowski M, Meister A. Gamma-glutamyl-p-nitroanilide: a new convenient substrate for determination and study of l- and d-gamma-glutamyltranspeptidase activities. Biochimica et Biophysica Acta- Proteins and Proteomics, 1963, 73(4): 679-681.
[11] Naoaki M, Nagatoshi I, Norbert W. Aged garlic extract inhibits CD36 expression in human macrophages via modulation of the PPARgamma pathway. Phytotherapy Research, 2010, 24(4): 602-608.
[12] 王辉, 李景明, 马钊. 洋葱中含硫化合物的生理功效. 食品工业科技, 2005, 26(5): 187-189.
Wang H, Li J M, Ma Z. Physiological effects of sulfur compounds in onion. Food industry science and technology, 2005, 26(5): 187-189. (in Chinese)
[13] Yoshimoto N, Yabe A, Sugino Y. Garlic γ-glutamyl transpeptidases that catalyze deglutamylation of biosynthetic intermediate of alliin. Frontiers in Plant science, 2014, 5: 758.
[14] Petropoulos S, Di Gioia F, Ntatsi G. Vegetable organosulfur compounds and their health promoting effects. Current Pharmaceutical Design, 2017, 23(19): 2850-2875.
[15] Hughes J, Tregova A, Tomsett A B, Jones M G, Cosstick R, Collin H A. Synthesis of the flavour precursor, alliin, in garlic tissue cultures. Phytochemistry, 2005, 66(2): 187-194.
[16] Yu T H, Wu C M, Ho C T. Meat-like flavor generated from thermal interactions of glucose and alliin or deoxy-alliin. Journal of Agricultural and Food Chemistry, 1994, 42(4): 1005-1009.
[17] Lanzotti V, Scala F, Bonanomi G. Compounds from Allium species with cytotoxic and antimicrobial activity. Phytochemistry Reviews, 2014, 13(4): 769-791.
[18] Shuai Y, Zhang T, Mu W, Jiang B. Purification and Characterization of γ-Glutamyl transpeptidase from Bacillus subtilis SK11.004.Journal of Agricultural and Food Chemistry, 2011, 59(11): 6233-6238.
[19] Melinda N M, Janet P S. Purified γ-glutamyl transpeptidases from tomato exhibit high affinity for glutathione and glutathione S-conjugates. Plant physiology, 2000, 122(4): 1417-1426.
[20] Li J, Huang J, Yin J, Wu N, Song J, Zhang L, Jiang T. Rapid purification and characterization of γ‐glutamyl‐transpeptidase from shiitake mushroom (). Journal of Food science, 2012, 77(4/6): C640-C645.
[21] Fujii T, Matsutomo T, Kodera Y. Changes of S- Allylmercaptocysteine and γ-Glutamyl- S-allylmercaptocysteine contents and their putative production mechanisms in garlic extract during the aging process. Journal of Agricultural and Food Chemistry, 2018, 66(40): 10506-10512.
[22] Urs W, Shaw M L, Lancaster J E. Effect of freezing upon alliinase activity in onion extracts and pure enzyme preparations. Journal of the Science of Food and Agriculture, 1994, 64(3): 315-318.
[23] Sun Y, Hu J, Wang W, Zhang B, Shen Y. Characterization of γ-lutamyl transpeptidases from dormant garlic and onion bulbs. Food Science and Nutrition, 2019, 7(2): 499-505.
[24] Shaw M L, Pither-Joyce M D, Mccallum J A. Purification and cloning of a gamma-glutamyl transpeptidase from onion (). Phytochemistry, 2005, 66(5): 515-522.
[25] Bradford M. A rapid and sensitive method for the quantitation of microgam quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[26] SUZUKI T, SUGII M, KAKIMOTO T. Metabolic incorporation of L-valine-[14C] into S-(2-carboxypropyl) glutathione and S-(2- carboxypropyl) cysteine in garlic. Chemical and Pharmaceutical Bulletin, 1962, 10(4): 328-331.
[27] Bayan L, Koulivand P H, Gorji A. Garlic: A review of potential therapeutic effects. Avicenna Journal of Phytomedicine, 2014, 4(1): 1-14.
[28] Turnbull A, Galpin I J, Collin H A, Smith J L. Comparison of the onion plant () and onion tissue culture: III. Feeding of 14C labeled precursors of the flavor precursor compounds. New Phytologist, 2006, 85(4): 483-487.
[29] Lancaster J E, Shaw M L. γ-Glutamyl peptides in the biosynthesis of-alk(en)yl-l-cysteine sulphoxides (flavour precursors) in. Phytochemistry, 1989, 28(2): 455-460.
[30] Dong Y, Lisk D, Block E, Ip C. Characterization of the bi-ological activity of gamma- glutamyl- Se- methylselenocysteine: A novel, naturally occurring anticancer agent from garlic. Cancer Research, 2001, 61(7): 2923-2928.
[31] Lancaster J E, And M L S, Randle W M. Differential hydrolysis of alk(en)yl cysteine sulphoxides by alliinase in onion macerates: flavour implications. Journal of the Science of Food and Agriculture, 1998, 78(3): 367-372
[32] Sun X, Zhu S, Li N. A chromosome-level genome assembly of garlic (L.) provides insights into genome evolution and allicin biosynthesis. Molecular Plant, 2020, 13(9): 1328-1339.
Cloning and identification of γ-glutamyl transpeptidasegene from onion ()
Xu Huanhuan1,2, Li Yi1, Gao Wei1, Wang Yongqin2, Liu Lecheng1
1College of horticulture and Gardening, Yangtze University, Jingzhou 434025, Hubei;2Vegetable Research Center, Beijing Academy of agriculture and forestry/Key Laboratory of Biology and Genetic Improvement of Horticultural (North China), Ministry of Agriculture and Rural Affairs, P.R. China/Beijing Key Laboratory of Vegetable Germplasm Improvement, Beijing 100097
【】Alliin metabolized by Allium plants had important pharmaceutical value. γ-glutamyl transpeptidase was a key enzyme in the deglutamylation step of the process of alliin synthesis. Studying the function of γ-glutamyl transpeptidase gene in onion can reveal the role of γ-glutamyl transpeptidase in alliin synthesis pathway, providing theoretical basis for alliin synthesisand laying a foundation for further study on alliin synthesis mechanism. 【】Using onion as material, the primers were designed according to onion RNA-seq database, and the gene, γ-glutamyl transpeptidase, was cloned from onion by RT-PCR and analyzed by bioinformatics. The CAMV 35S-AcGGT-GFP vector was used to bombard onion inner epidermis cells with gold powder plasmid microcarrier by particle bombardment technology, and the subcellular localization ofwas determined by fusion green fluorescent expression protein. The Saccharomyces cerevisiae expression vector withwas constructed, transforming and inducing the expression of, and using the method of transforming glutamyl-p-nitroaniline to p-nitroaniline by γ-glutamyl transpeptidase to determine the glutamyl transpeptidase activity of the total protein of Saccharomyces cerevisiae transferred into. Real time quantitative PCR was used to analyze the differential expression pattern of the gene in onion tissues. The activity of endogenous transpeptidase in onion tissues was determined by the method of γ-glutamyl transpeptidase catalyzing the production of p-nitroaniline from p-nitroaniline. 【】was cloned and its length was 1 869 bp. Bioinformatics analysis showed thatencoded 622 amino acids, protein domain prediction showed that it had glutamyl transpeptidase domain, secondary structure was mainly α - helix, transmembrane region analysis suggested that GGT protein had transmembrane region, amino acid multiple alignment results showed that GGT in plants had certain conservation, evolutionary analysis showed thatwas related to garlic, and the relationship is closest. The fluorescence signal of CaMV 35S-AcGGT-GFP fusion protein was located in the vacuole, indicating that the protein encoded by CaMV 35S-AcGGT-GFP was located in the vacuole. The results of glutamyl transpeptidase activity assay showed that the glutamyl transpeptidase activity of yeast transformed withwas significantly higher than the control, indicating that the protein encoded byhad transpeptidase activity. The results of differential expression analysis ofshowed that the expression ofwas mainly in leaf sheath, bulb and leaf sheath followed by. The activity of glutamyl transpeptidase in different tissues, the highest activity in leaf, followed by leaf sheath. Correlation analysis showed that there was no significant correlation between the activity of transglutaminase and the expression of. 【】The enzymatic reaction data of exogenousexpression were obtained. the deglutination of alliin synthesis pathway preceded S-oxygenation; there was no significant correlation betweenexpression and endogenous transglutaminase activity in onion, suggesting that there may be multiple transglutaminase genes in onion.
onion; γ-glutamyl transpeptidase; bioinformatics; subcellular localization; eukaryotic expression; expression pattern

10.3864/j.issn.0578-1752.2021.19.012
2020-11-12;
2021-01-08
国家自然科学基金(31972409,31572119)、北京市农林科学院科技创新能力项目(KJCX20200113)
徐欢欢,E-mail:sr19951010@126.com。通信作者王永勤,E-mail:wangyqly@163.com。通信作者刘乐承,E-mail:516119@yangtzeu.edu.cn
(责任编辑 李莉)
