桑叶通过影响瘤胃微生物区系调控湖羊脂肪沉积
2021-10-20侯启瑞戎世芳沈曼曼任永利赵卫国
侯启瑞, 谢 辉, 戎世芳, 吴 萍, 沈曼曼, 任永利, 赵卫国
(1.江苏科技大学 生物技术学院,镇江 212100) (2.河南省蚕业科学研究院,南阳 411321) (3.海安市蚕桑技术推广站,海安 226600)
自1993年卫生部确定桑叶既是食品又是药品以来,桑叶在食用、药用、饲用等方面得到进一步研究.桑叶在中药学上有降糖减脂的功效[1],在动物生产上也表现出调控脂代谢的功能.研究发现,桑叶通过调控育肥猪蔗糖酶、脂肪酶及肝脏糖代谢酶活性调控脂肪代谢,降低板油率和背膘厚度,提高肌肉脂肪沉积量,增加肌肉不饱和脂肪酸含量[2];以桑叶饲喂獭兔,可以降低獭兔的血脂含量,增强肝脏的抗氧化能力[3];饲喂青贮桑叶能显著影响陕北白绒山羊脂肪代谢相关基因mRNA的表达,这些基因的表达产物具有调节脂肪沉积、改善肉品质的作用[4].
近年来,桑叶作为反刍动物的蛋白饲料来源越来越受到重视[5].反刍动物依靠瘤胃微生物转化利用粗饲料中的碳水化合物和蛋白质得到能量.桑叶含有黄酮类化合物、多糖、植物甾醇、γ-氨基丁酸和酚类等活性物质,这些物质对瘤胃微生物的生长和繁殖有促进作用,可改善瘤胃功能,降低粪能和总氮排出量,提高饲粮的代谢能和氮的生物学价值[5-6].瘤胃微生物还可以通过不完全氢化作用或内源合成途径把日粮中的不饱和脂肪酸转为共轭亚油酸,而该物质具有抗动脉粥样硬化、降低胆固醇和抑制脂肪沉积等作用[7].但桑叶对反刍动物机体的脂肪代谢及其调控途径的研究还较缺乏.
羊草(Leymuschinensis)又叫碱草,叶较多,含有较丰富的粗蛋白,是肉羊养殖中的主要饲料[8].湖羊是太湖平原重要家畜之一,也是我国一级保护地方畜禽品种,在2000年和2006年先后两次被农业部列入《国家畜禽遗传资源保护目录》.实验以桑叶代替部分羊草饲喂湖羊,研究不同比例桑叶对湖羊瘤胃微生物区系、生长性能和脂肪沉积的影响,为桑叶在反刍动物饲料中的开发利用提供数据.
1 材料和方法
1.1 试验材料
风干桑叶(MorusalbaL.,丰驰桑)由中国农业科学院蚕业研究所提供,经检测营养水平为:水分10.25%、粗蛋白20.97%、粗脂肪8.20%、粗灰分7.66%、中性洗涤纤维33.46%、酸性洗涤纤维15.42%、钙1.47%、磷0.11%.
1.2 试验动物管理
采取完全随机试验设计.选取32只6月龄体重相近、健康状况良好的湖羊公羊,随机分为4组,每组8个重复,每个重复1只,单栏饲养.舍饲前对羊舍彻底清理,消毒,统一驱虫和免疫.试验期间每日饲喂2次(07 ∶00和17 ∶00),自由饮水,自然光照.
1.3 试验日粮
对照组(Control)饲喂以羊草为唯一粗饲料的基础饲粮,羊草占饲粮总重量的40%.试验组以桑叶代替部分羊草,桑叶与羊草的比例分别为20 ∶80(T20)、60 ∶40(T60)、80 ∶20(T80).各组饲粮组成及营养成分见表1.饲粮营养水平参照NRC(2007)建议的肉绵羊饲养标准,按照日增重200 g/d配置.预试期10 d,正试期55 d.
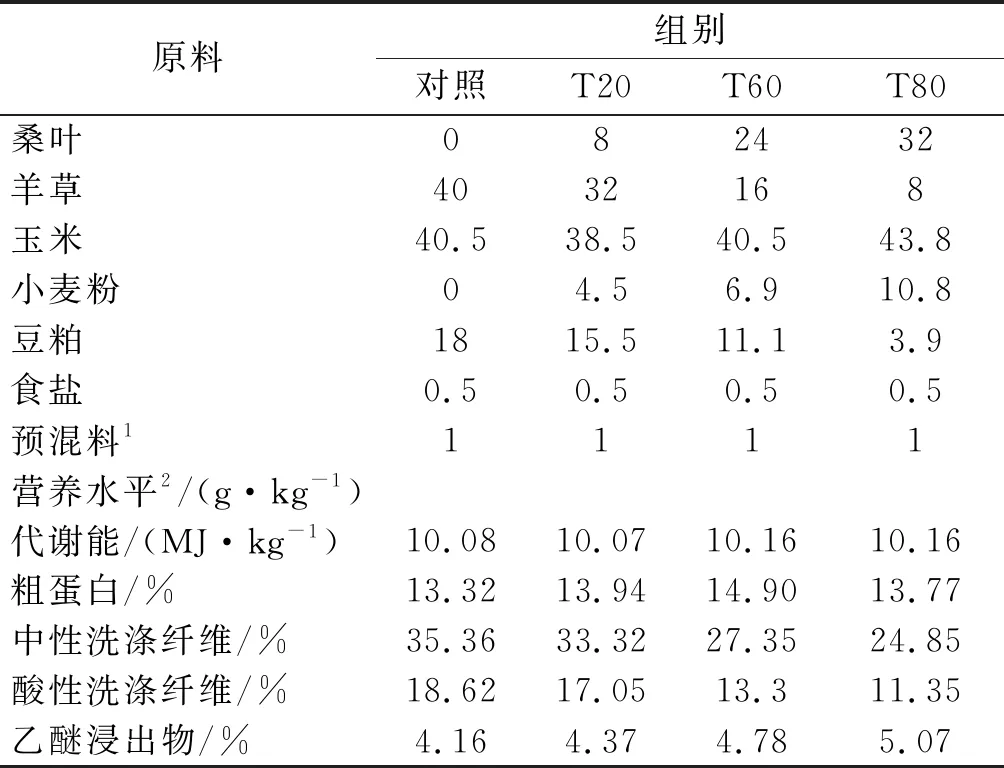
表1 各组饲粮组成和营养成分(干物质基础)
1.4 测定指标及方法
1.4.1 生长性能
试验开始和结束时称量试验羊空腹体重,每日记录饲料量和剩余料量.计算平均日增重、日采食量和料重比.
1.4.2 体脂肪沉积
试验结束时每组选取3只羊绝食24 h后称量体重,颈静脉放血屠宰.测量眼肌面积、皮下脂肪重、腹脂重、心周脂肪、肾周脂肪重、尾脂重、肋肉厚和背膘厚[9].其中,皮下脂肪重是指对覆盖于胴体外的背部和腹部的脂肪组织重量.腹脂重是指胴体腹部肠系膜和大网膜脂肪重的总和.肾周脂肪重是指从胴体完整摘取双肾及周边脂肪组织后剥离肾脏后的脂肪组织重.背膘厚是指位于胴体第12和13肋骨之间眼肌中部上方的脂肪厚度,肋肉厚为第12和13肋骨之间距背脊中线11 cm处的组织厚度,用数显游标卡尺测定.
1.4.3 瘤胃微生物基因组DNA提取
取T0和T80组羊瘤胃液,四层纱布过滤,立即将瘤胃固态内容物样品放入液氮保存.样品用珠磨破碎,十六烷基三甲基溴化铵(CTAB)提取总DNA.
取均质后的样品500 μL,加920 μL CTAB抽提液、75 μL 10%十二烷基磺酸钠(SDS)、5 μL蛋白酶K,37 ℃温浴1 h.液氮中快速冷冻3 min,迅速置于65 ℃水槽中温浴2 min,反复冻融2次,在珠磨仪上破碎5 min.3 000×g离心5 min,取上清液,加入260 μL 10 mol/L乙酸铵,混匀,置冰上冷冻5 min.16 000×g离心10 min,取上清液到离心管中加等体积酚 ∶氯仿 ∶异戊醇(25 ∶24 ∶1),12 000×g离心10 min.将上清液放到离心管中加入等体积异丙醇,混合均匀,置冰上冷冻30~60 min.16 000×g离心10 min,弃上清液.加入70%乙醇,混合均匀,16 000×g离心10 min,弃上清液,待乙醇全部挥发后,加入100 μL TE缓冲液溶解沉淀.
采用RS-232型核酸蛋白测定仪(伯乐SmartSpec Plus,美国)测定DNA溶液纯度与浓度,用1%琼脂糖凝胶进行电泳,电压为100 V,电泳时间为40 min,检测DNA片段的完整性.
参照文献[10]的方法进行细菌16S rRNA V4+V5可变区基因PCR扩增.PCR引物序列(5′-3′)为515F: GTGCCAGCMGCCGCGGTAA; 907R: CCGTCAATTCCTTTGAGTTT.扩增产物用2%琼脂糖凝胶检验,对目的条带使用Qiagen公司凝胶回收试剂盒回收产物,纯化PCR产物,使用TruSeq© DNA PCR-Free SamplePreparation Kit 建库试剂盒进行文库构建,构建好的文库经Qubit和Q-PCR定量,文库合格后送天津诺禾致源生物信息科技有限公司进行高通量测序,测序平台为IIIumina MiSeq PE300(Illumina,美国).
1.5 16S rRNA高通量测序及数据分析
测序平台得到的raw reads先根据overlap关系进行拼接,同时对序列质量进行质控和过滤.序列过滤后,将具有高度相似性(97%)的序列归为一个操作分类单位(OTU),运用Blast比对程序在Ribosomal Database Project数据库进行物种分类学分析.基于OTU分析结果,对样品在各个分类水平上进行分类学Alpha多样性及Beta多样性分析.包括利用Qiime软件绘制稀释性曲线IIII,应用软件Mothur中的summary.single命令和metastats命令,分别计算Chaol、ACE、Shannon、Simpson参数和两组之间的差异显著性分析.此外,将所有细菌按分类学统计并利用Unifrae算法通过R语言工具绘制样品间主坐标分析图(PCoA),以及组间多样性分析.
采用SAS 8.0统计软件进行单因素方差分析(one-way ANOVA),以Duncan 氏法进行多重比较.P>0.05为差异不显著判定标准,P<0.05为差异显著判定标准,P<0.01为差异极显著判定标准.
2 结果与分析
2.1 桑叶对羊生长性能的影响
由表2可知,以桑叶代替部分羊草饲喂湖羊,湖羊采食量和日增重有所增加,T60组采食量显著高于对照组(P<0.05),但日增重差异未达到显著水平(P>0.05).
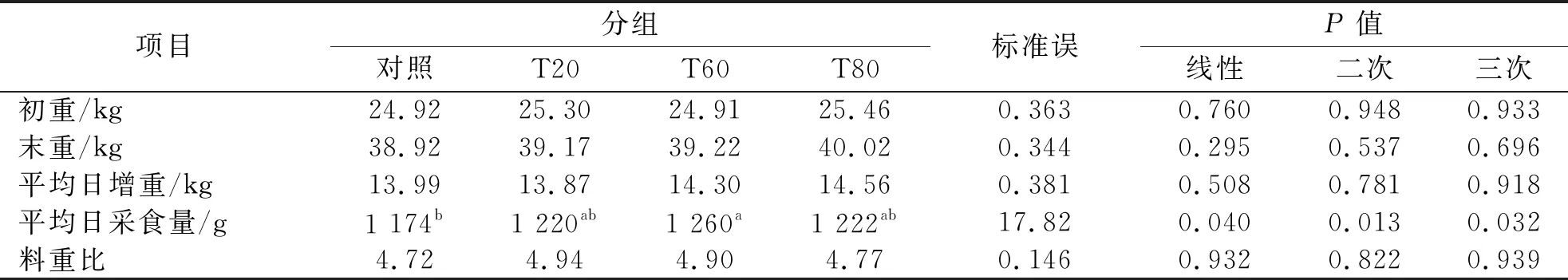
表2 桑叶与羊草不同比例组合对羊生长性能的影响
2.2 桑叶对羊体脂肪分布的影响
桑叶对湖羊的眼肌面积、皮下脂肪、心周脂肪和尾脂重量无显著作用,腹脂和肾周脂肪重量略有增加,但未达到显著水平(P>0.05).随着桑叶添加量的增加,肋肉厚和背膘厚显著升高,T80组肋肉厚显著大于对照组,背膘厚显著大于对照组和T20组(P<0.05),如表3.
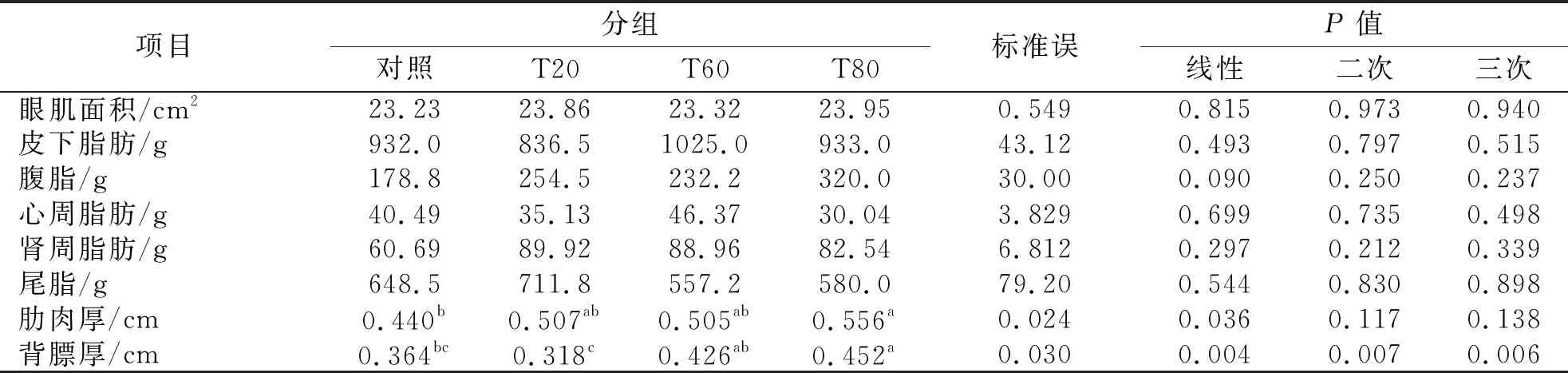
表3 桑叶与羊草不同比例组合对羊体脂肪分布的影响
2.3 桑叶对羊瘤胃细菌菌群结构的影响
2.3.1 OTU聚类分析
经过16S rRNA V4+V5可变区的IIIumina MiSeq双端测序,反映97%相似度下样品取样深度的稀释曲线如图1.
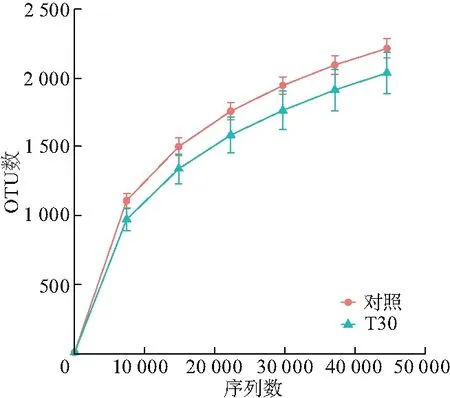
图1 对照组和T80组羊瘤胃微生物样品稀释曲线Fig.1 Dilution curve of rumen microbiological samples of sheep in the control and the T80 group
当抽取测序数据量在15 000以上时,对照组(Control)和T80组各样品稀释曲线趋向平坦,说明测序深度和数据量足够,更多的数据量只会产生少量新的物种(OTU).
2.3.2 微生物α多样性
对照组和T80组羊瘤胃微生物α多样性如表4.两组样品中所含OTU数目和种类相近,Ace指数、Chao1指数、Shannon指数、Simpson指数无显著差异(P>0.05),说明桑叶与羊草营养成分含量相近,饲粮中80%的羊草被桑叶替代不会引起瘤胃微生物显著变化.
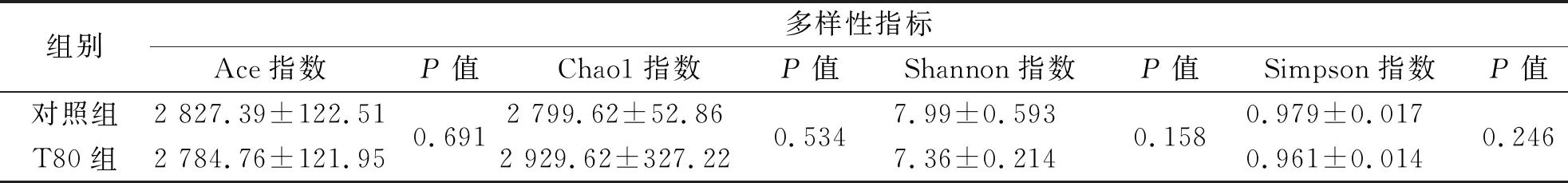
表4 对照组和T80组样品在97%一致性阈值下多样性指数分析
2.3.3 微生物β多样性
β多样性是对不同样品的微生物菌落构成进行比较分析,是物种组成沿环境梯度或在菌落间的变化率.由基于Unifrac的加权主坐标分析图(图2、3)可知,基于Unifrac的加权(Weighted Unifrac)和非加权(Unweighted Unifrac)的主坐标分析其第一主成分和第二主成分的贡献率分别为35.94%和27.35%、29.13%和24.97%,对照组主成分投射位置比较分散,T80组比较分散.说明桑叶能够使瘤胃菌落的β多样性差异增加.
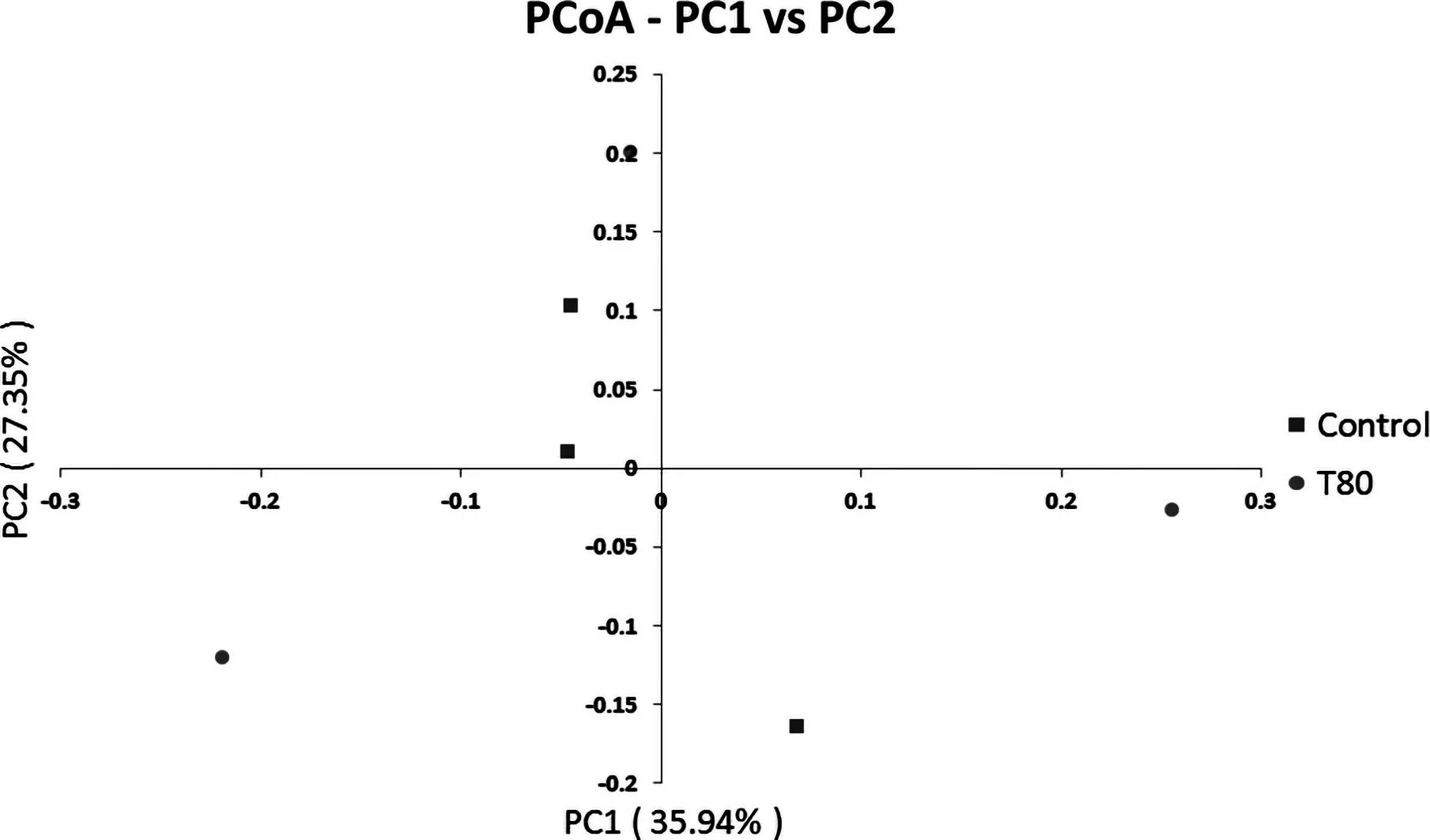
图2 基于Weighted Unifrac距离PCoA分析Fig.2 Analysis of PCoA based on Weighted Unifrac distance
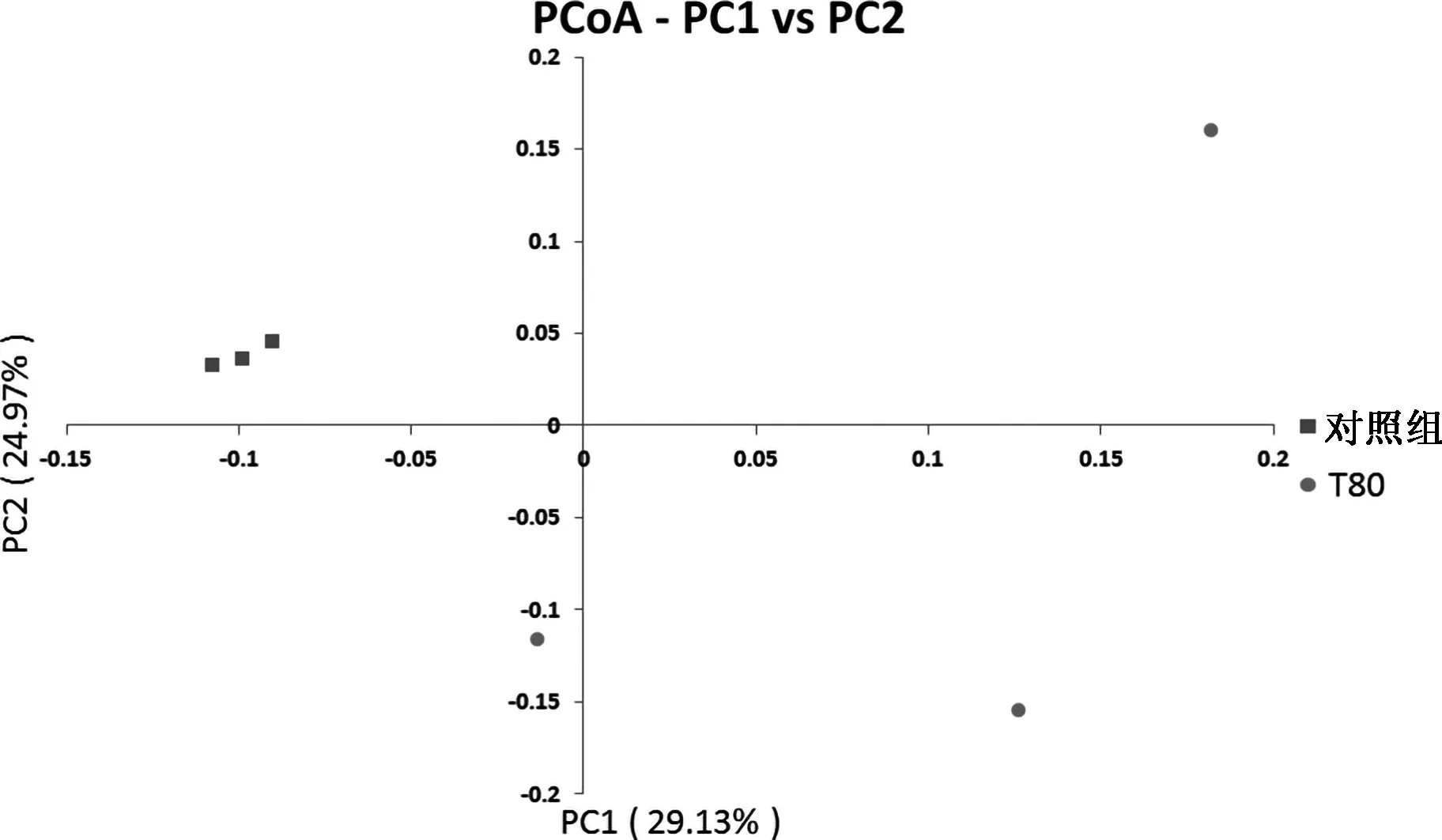
图3 基于Unweighted Unifrac距离PCoA分析Fig.3 Analysis of PCoA based on Unweighted Unifrac distance
2.4 桑叶对羊瘤胃细菌物种相对丰度的影响
门水平上,相对丰度排名前10的物种见图4.拟杆菌(Bacteroides)、厚壁菌(Firmictes)和变形菌(Proteobacteria)是羊瘤胃的主要菌属,细菌数量总和占各组样品中细菌总量的90%以上(图4(a)).与对照组相比,T80组厚壁菌和放线菌(Actinobacteria)增加,拟杆菌和变形菌减少,但均未达到显著水平(P>0.05),蓝细菌(Cyanobacteria)和黏胶球形菌(Lentisphaerae)显著减少(P<0.05,图4(b)).

图4 瘤胃微生物门水平上物种相对丰度Fig.4 Relative abundance of rumen microbe at phylum level of the sheep
由物种丰度聚类图5可知,对照组和T80组共同拥有35种菌,被聚为4类,对照组1(4种)和对照组2(5种)菌属首先聚到一起,再与对照组3(2种)、T80组3(11种)聚到一起,最后与T80组1(7种)和T80组2(6种)相聚.从中可以看出,两组瘤胃微生物物种丰度聚类明显分开,T80组物种丰度多样性比对照组丰富.
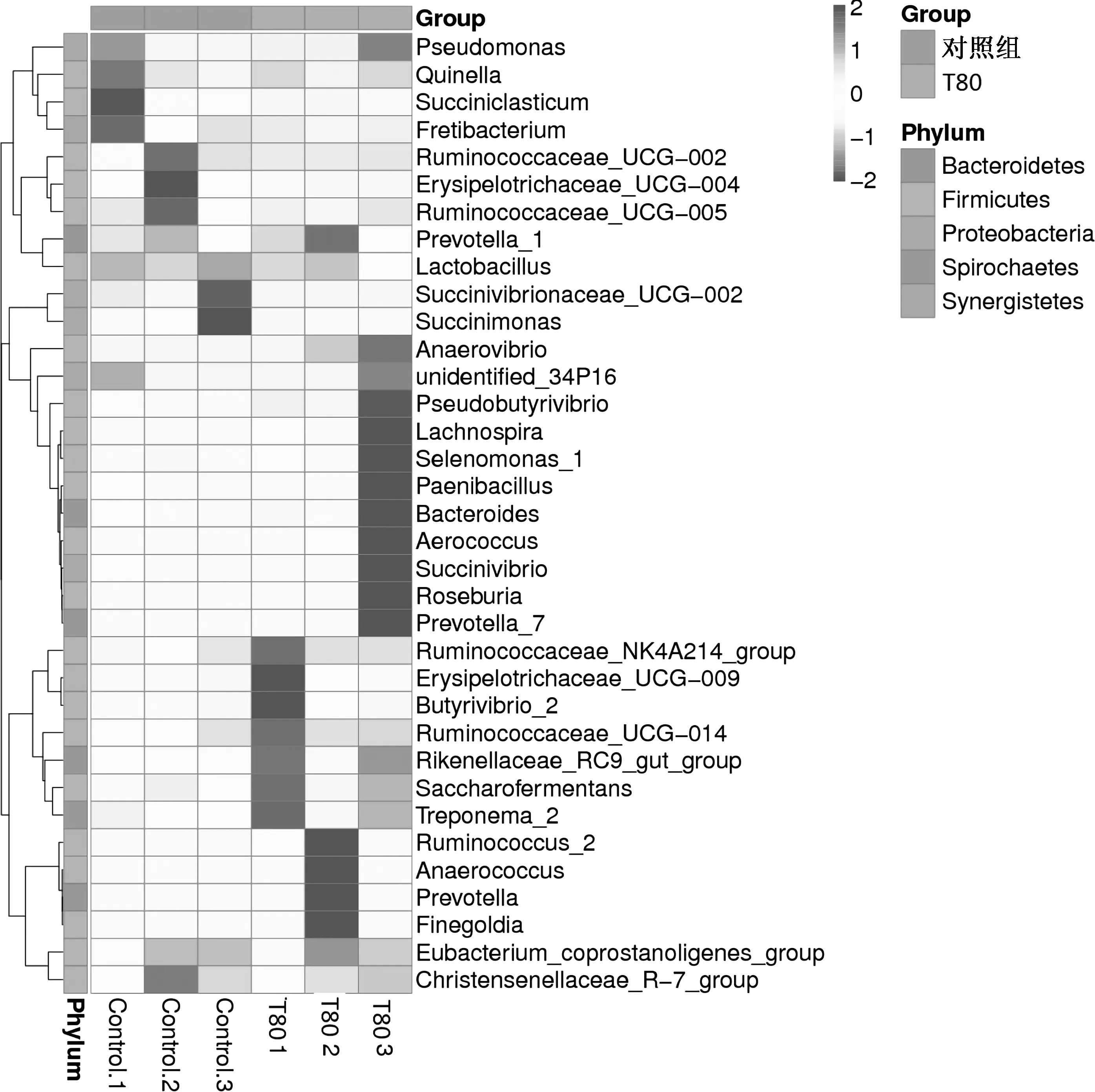
图5 对照组和T80组羊瘤胃细菌物种丰度聚类图Fig.5 Heat map of rumen species abundance in Control and T80 group
3 讨论
近年来,桑叶作为反刍动物饲料来源的研究从不同方面进行了阐述.日粮中添加10%~20%的青贮桑叶或10%~15%的干桑叶可提高生长育肥羊的生产性能,改善羊肉品质[11].饲喂青贮桑叶能显著影响山羊皮下脂肪、尾部脂肪、肾周脂肪、肝脏和背最长肌脂肪代谢相关基因mRNA的表达,调节脂肪沉积[4].本研究与前人研究结果一致.日粮中添加风干桑叶能提高脂肪在湖羊腹部、肾周、肋骨和脊背处的沉积,促进生长.通过对瘤胃微生物的分析,本研究还发现桑叶对湖羊脂肪沉积的调控与瘤胃微生物区系的改变有关.
瘤胃是反刍动物消化粗饲料的主要场所.本研究对瘤胃微生物16S rRNA基因扩增子文库的分析显示,拟杆菌、厚壁菌和变形菌是羊瘤胃的主要菌群,与前人研究结果一致[12].文献[13]发现,添饲木质素后,牛瘤胃的主导菌群从拟杆菌向厚壁菌转移.本研究中拟杆菌和厚壁菌之间丰度的变化趋势与文献[13]的发现一致,说明桑叶替代羊草可能增加了饲粮中木质素的含量.而随着桑叶含量的增加,饲粮中中性洗涤纤维和酸性洗涤纤维均降低(表1),分析中性洗涤纤维和酸性洗涤纤维的组成,桑叶替代羊草后,饲粮中的纤维素和半纤维素含量可能减少了.肠道中的厚壁菌有利于抑制肥胖和胰岛素抵抗,这与中药学上桑叶的抗肥胖和治疗二型糖尿病的作用一致[14-15],桑叶可能通过增加病患肠道厚壁菌的丰度进而调解糖脂代谢.
变形菌在生物膜的形成和发酵、可溶性碳水化合物与淀粉的消化等方面具有高度多样化的代谢功能[16].本研究中变形菌是湖羊瘤胃微生物中的第三大菌属,添饲桑叶后瘤胃变形菌相对丰度略有减少,说明桑叶替代羊草可能降低了饲粮中可溶性碳水化合物和淀粉的含量.
放线菌是瘤胃微生物的常规成员,约占瘤胃细菌总数的3%.瘤胃放线菌生态学和生物学方面的研究资料相当缺乏[17].自然界中,放线菌是天然药物的重要来源之一,能产生多种具有抗病毒、抗菌、抗肿瘤的活性物质[18].T80组湖羊瘤胃放线菌的增加可能有助于动物保持健康的机体状态,与桑叶的保健功能相符.另外,蓝细菌能够产生毒素[19],T80组湖羊瘤胃蓝细菌丰度显著降低也有利于动物健康.据报道,黏胶球形菌门与纤维二糖的降解有关.T80组瘤胃黏胶球形菌风度降低,可能是由于桑叶中中性洗涤纤维等纤维类物质低于羊草[20].
综上所述,在羊饲粮中添加一定量的桑叶(≤32%)能够减少瘤胃中拟杆菌和变形菌的比例,提高厚壁菌在瘤胃微生物中的相对丰度;同时,桑叶增加了瘤胃中放线菌的数量,减少了蓝细菌的数量,有利于动物健康,对动物的生长和局部脂肪沉积有促进作用.
