MiR-10b-3p通过靶向结合INHBA抑制乳腺癌细胞增殖、迁移和侵袭
2021-10-19张娜贤刘柳李刚刘琳瑞李元颖
张娜贤,刘柳,李刚,刘琳瑞,李元颖
(南阳市第二人民医院乳腺肿瘤科,河南南阳 473000)
乳腺癌是女性恶性肿瘤病死率最高的恶性肿瘤。随着现代生物分子诊断技术的飞速发展,乳腺癌的早期诊断与分子靶向治疗已取得了一定成果,但患者术后复发率及晚期患者预后仍不理想[1]。因此,深入分析乳腺癌的发生发展机制,探索新的分子靶点,对于乳腺癌的临床诊治有重要作用。研究显示,微小RNA(miRNAs)可结合靶基因3’非翻译区,调控其表达,参与恶性肿瘤的多种病理生理过程,发挥促癌或抑癌作用[2-3]。目前研究证实,miR-10b与乳腺癌[4]、肝癌[5]、结直肠癌[6]等多种恶性肿瘤的增殖、侵袭、转移密切相关。miR-10b-3p作为miR-10b 3’端臂加工产生的miRNA,Canu等[7]研究显示,miR-10b-3p可靶向精子相关抗原5,影响乳腺癌细胞的增殖。抑制素β A(INHBA)是性腺分泌的水溶性蛋白,可形成抑制素和激活素,调控机体生殖和发育,与多种恶性肿瘤的发生发展有关[8]。前期经miRWalk在线软件预测miR-10b-3p靶基因为INHBA,但miR-10b-3p是否可靶向INHBA在乳腺癌中发挥作用尚不清楚。基于此,本研究将结合GEO、TCGA数据库,分析miR-10b-3p对乳腺癌增殖、迁移及侵袭的影响及其潜在机制,旨在为乳腺癌的临床诊断和靶向治疗提供新的靶点及依据。
1 材料与方法
1.1 细胞株、动物及质粒来源
MCF-7和MDA-MB-231细胞株购自上海生命科学院细胞和生物化学研究所。16只雌性Balb/c裸鼠,6周龄,体质量18~22 g,购自南阳建兴实验动物有限公司,生产许可证号SCXK(豫)2018-0005。miR-10b-3p质粒、INHBA质粒来自于优宝公司。
1.2 主要试剂与仪器
miR-10b-3p mimics及其阴性对照、pcDNA-INHBA(美国Ambion);脂质体2000试剂盒、野生型及突变型INHBA荧光素酶报告基因载体(美国Invitrogen);PrimeScript RT Reagent Kit逆转录试剂盒、SYBR Premix Ex TaqqRT-PCR试剂盒(日本TaKaRa);引物序列由北京阅微基因技术有限公司提供;CCK8试剂盒(日本同仁);Transwell小室、基质胶(美国BD);β-actin、INHBA蛋白一抗(美国Cell Signaling Technology);双荧光素酶活性检测试剂盒(北京艾然生物科技有限公司);CFX96Touch实时荧光定量PCR仪、iMARK酶标仪(美国Bio-Rad)。
1.3 数据集的筛选与分析
下载GEO数据GSE45666乳腺癌相关数据矩阵,分析miR-10b-3p与乳腺癌发生发展关系;下载TCGA_BRCA乳腺癌数据矩阵和临床信息,以乳腺癌中INHBAmRNA表达水平的四分位数分组,将乳腺癌患者分为INHBA高(1/4)、低(3/4)表达两组,进行基因富集分析,观察INHBAmRNA表达水平与乳腺癌恶性临床表型的关系,利用R survival包分析INHBAmRNA在乳腺癌预后中的作用。
1.4 细胞传代培养与转染
将MCF-7、MDA-MB-231细胞于37℃水浴中快速解冻,800 r/min离心5 min,悬浮于含有10%(φ)胎牛血清的DMEM高糖培养基中,置于37℃、5%(φ)CO2条件培养,待细胞密度达80%及以上时,按1∶3比例传代培养。取生长状态良好的细胞,参照脂质体2000试剂盒说明书操作,转染miR-10b-3p、质粒,并用G418筛选并构建稳定过表达miR-10b-3p的乳腺癌细胞系。在稳定过表达miR-10b-3p的乳腺癌细胞中转染INHBA质粒,记作miR-10b-3p+INHBA组。
1.5 实时荧光定量PCR检测miR-10b-3p、INHBA mRNA水平
收集转染后细胞,添加Trizol试剂提取总RNA,选取A260/A280为1.8~2.0样本,参照PrimeScript RT Reagent Kit逆转录试剂盒说明书操作,合成cDNA模板链,再经SYBR Premix Ex TaqqRT-PCR试剂盒,进行实时荧光定量PCR扩增。扩增条件为:95℃预变性2 min,95℃变性5 s,60℃退火30 s,共38个循环。以GAPDH为内参,采用2-△△Ct法计算miR-10b-3p、INHBAmRNA相对水平,引物序列见表1。

表1 基因引物序列Table 1 Primer sequences of genes
1.6 CCK-8实验检测细胞增殖
将转染后细胞接种于96孔板,分别培养24、48、72、96、120 h后,向各孔加入10 μL CCK-8溶液,继续培养2 h,用酶标仪检测450 nm下各组细胞吸光度(A值),以A值表示细胞增殖能力。
1.7 划痕实验检测细胞迁移
将转染后细胞接种于6孔板,待细胞贴壁后,用200 μL移液枪头垂直于细胞孔板划痕,观察0 h和24 h时细胞的迁移情况,计算细胞迁移能力[(0 h划痕宽度−24 h划痕宽度)/0 h划痕宽度]。
1.8 Transwell小室实验检测细胞侵袭
预先将基质胶包被Transwell小室上室,取转染后细胞接种于Transwell小室上室,加入无血清培养基,下室添加含有10%(φ)胎牛血清培养基,正常培养24 h后取出Transwell小室,弃去小室内培养液,轻轻拭去上室内细胞,结晶紫染色10 min,显微镜下进行细胞计数,实验孔侵袭细胞数/对照孔侵袭细胞数表示相对侵袭能力。
1.9 裸鼠荷瘤模型的建立及检测
将过表达miR-10b-3p的MCF-7细胞调整密度为1×107/mL,于裸鼠第二乳垫下注射0.2 mL,若接种部位出现肿瘤结节,即可认为裸鼠荷瘤模型构建成功。肉眼可见瘤体后,每隔2天测量瘤体体积,14 d时处死裸鼠,剥离瘤体称质量并测量体积,采用实时荧光定量PCR检测miR-10b-3p水平。
1.10 双荧光素酶报告基因检测miR-10b-3p的靶向基因
经miRWalk在线软件预测miR-10b-3p靶基因为INHBA,将野生型及突变型INHBA荧光素酶报告基因载体与miR-10b-3p mimics和阴性对照分别转染MCF-7、MDA-MB-231细胞,参照双荧光素酶活性检测试剂盒说明书操作,检测各组荧光素酶读数。
1.11 蛋白印迹检测INHBA蛋白表达
收集转染后细胞,添加RIPA裂解液提取总蛋白,测定蛋白浓度后,混入上样缓冲液,沸水浴蛋白变性10 min,取70 μg变性蛋白经SDS-PAGE凝胶电泳分离后,再电转至PVDF膜,置于5%脱脂奶粉中,室温摇床封闭2 h,再加入1∶1 000稀释的蛋白一抗,4℃摇床孵育过夜,接着加入1∶8 000稀释的蛋白二抗工作液,37℃摇床孵育1 h,最后进行ECL化学发光。
1.12 统计学方法
采取统计学软件SPSS17.0分析处理数据,计量资料以均数±标准差()表示,两两均数比较采用t检验;计数资料以率(%)表示,采用χ2检验;采用受试者工作曲线描述miR-10b-3p、INHBAmRNA对乳腺癌的诊断价值,以曲线下面积(AUC)评价其诊断效能;生存分析采用Kaplan-Meier和Log-rank检验法,P<0.05为差异有统计学意义。
2 结果
2.1 miR-10b-3p在乳腺癌临床组织中的表达及其意义
如图1,GEO数据集中,与癌旁对照组织比较,乳腺癌组织中miR-10b-3p水平降低(P<0.05);miR-10b-3p对乳腺癌具有较高的诊断价值,AUC为0.998,95%CI为0.965~1.000;与临床分期Ⅰ期比较,Ⅱ~Ⅳ期患者miR-10b-3p水平降低(P<0.05);与T1~T3期 比 较,T4期 患 者miR-10b-3p水 平 降 低(P<0.05);与临床组织病理学分级G1~G2级比较,G3级患者miR-10b-3p水平降低(P<0.05)。

图1 miR-10b-3p在乳腺癌临床组织中的表达及其意义Figure 1 Expression and significance of miR-10b-3p in breast cancer tissues
2.2 INHBA mRNA在乳腺癌临床组织中的表达水平及其意义
如图2,TCGA数据集中,与癌旁正常组织比较,乳腺癌组织中INHBAmRNA水平升高(P<0.05);INHBAmRNA水平对乳腺癌具有较高的诊断价 值,AUC为0.935,95%CI为0.920~0.948;不 同TNM分期乳腺癌患者中mRNA水平的比较,差异有统计学意义(P<0.05);与N0期乳腺癌患者比较,N1期患者INHBAmRNA水平升高(P<0.05);与预后良好乳腺癌患者比较,预后不良患者INHBAmRNA水平升高(P<0.05);基因富集分析结果显示,细胞增殖、细胞迁移、肿瘤浸润及淋巴结转移基因集富集在INHBA高表达组;生存期分析显示,INHBA高表达乳腺癌患者总生存期明显低于INHBA低表达者(P<0.05)。
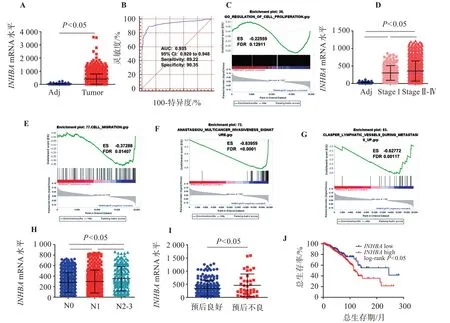
图2 INHBA mRNA在乳腺癌临床组织中的表达水平及其意义Figure 2 Expression and significance of INHBA mRNA in breast cancer tissues
2.3 过表达miR-10b-3p对乳腺癌细胞增殖、迁移和侵袭的影响
如图3,与miR-NC组比较,miR-10b-3p组MCF-7、MDA-MB-231细胞中miR-10b-3p水平上调,细胞增殖能力、迁移率及侵袭能力均降低(P<0.05)。
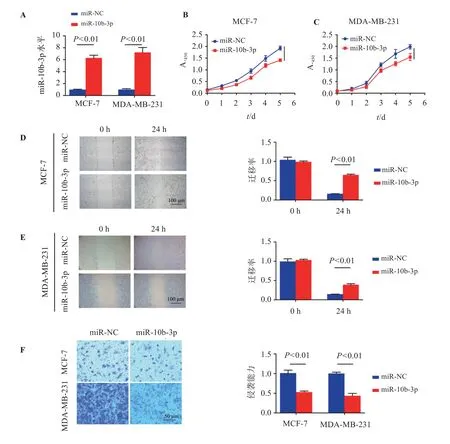
图3 过表达miR-10b-3p对乳腺癌细胞增殖、迁移和侵袭的影响Figure 3 Effect of miR-10b-3p overexpression on the proliferation,migration and invasion of breast cancer cells
2.4 过表达miR-10b-3p对裸鼠肿瘤生长的影响
结果见图4,与miR-NC组比较,miR-10b-3p组裸鼠瘤体体积、质量均降低,miR-10b-3p水平升高(P<0.05)。
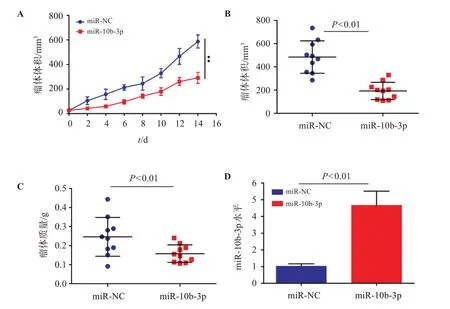
图4 过表达miR-10b-3p对裸鼠肿瘤生长的影响Figure 4 Effect of miR-10b-3p overexpression on tumor growth in nude mice
2.5 miR-10b-3p与INHBA的靶向关系
结果见图5,miR-10b-3p与INHBA3’非编翻译区存在结合位点,与对照组比较,共转染miR-10b-3p mimics、野生型INHBA荧光素酶报告基因载体组荧光素酶活性明显降低(P<0.05);与miR-NC组比较,miR-10b-3p组INHBAmRNA及蛋白表达明显降低(P<0.05)。
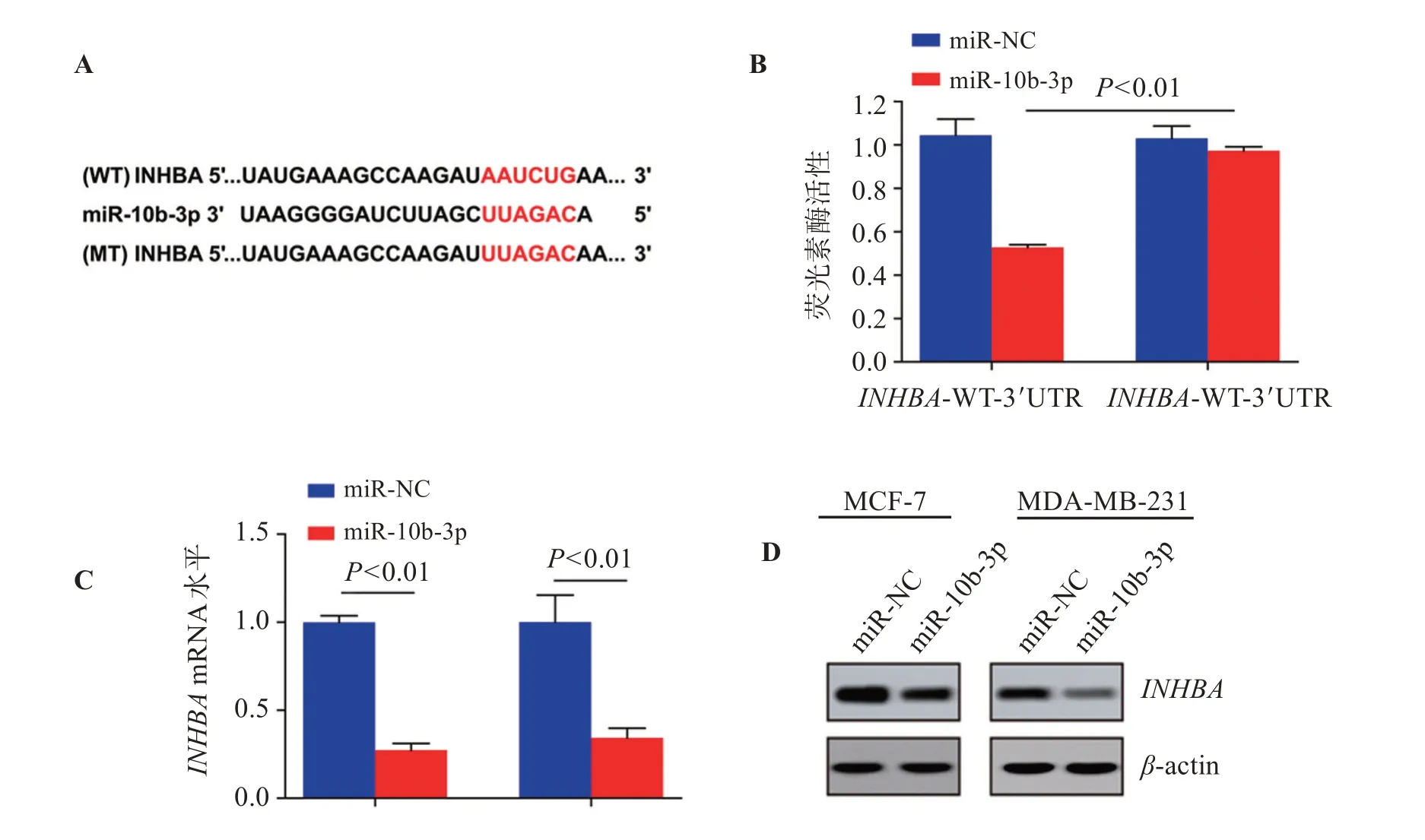
图5 miR-10b-3p与INHBA的靶向关系Figure 5 Targeted relationship between miR-10b-3p and INHBA
2.6 miR-10b-3p靶向INHBA对乳腺癌细胞增殖、迁移和侵袭的影响
如图6,与miR-10b-3p组比较,miR-10b-3p+INHBA组INHBA蛋白表达上调,细胞增殖能力、迁移率及侵袭能力均增加(P<0.05)
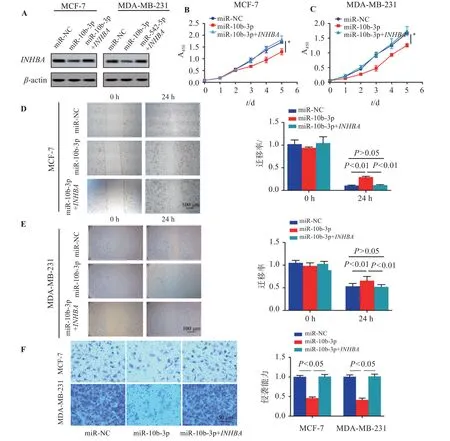
图6 miR-10b-3p靶向INHBA对乳腺癌细胞增殖、迁移和侵袭的影响Figure 6 Effect of miR-10b-3p on the proliferation,migration and invasion of breast cancer cells by targeting INHBA
3 讨论
近年来,乳腺癌的发病年龄呈年轻化趋势,严重影响患者生命安全,早期筛查乳腺癌对于改善患者预后尤为关键[9]。目前,乳腺癌的临床筛查仍缺乏血清学特异标记物,miRNAs有望成为乳腺癌的早期诊断分子[10]。miR-10b-3p是miRNAs家族成员之一,Guan等[11]研究结果显示,CMTM5是TCGA数据库中肝细胞癌的差异表达基因,miR-10b-3p与CMTM5存在靶向关系,miR-10b-3p过表达可靶向CMTM5促进肝细胞癌的增殖、侵袭和迁移能力。张超等[12]研究发现,miR-10b-3p可促进食管鳞癌细胞的增殖、侵袭和迁移,可能作为食管鳞癌基因治疗的潜在靶点。上述结果表明,miR-10b-3p在恶性肿瘤的调控中具有双重作用,可能介导不同靶基因的表达,在恶性肿瘤中发挥促癌或抑癌的作用。本研究通过分析GSE45666乳腺癌数据集,确定乳腺癌患者肿瘤组织中miR-10b-3p水平显著低于相应癌旁组织,提示miR-10b-3p可能在乳腺癌发挥抑癌作用。同时,miR-10b-3p对乳腺癌具有较高诊断价值,并在不同临床分级患者中存在差异表达,进一步表明miR-10b-3p是乳腺癌诊断的潜在生物标志物。
INHBA基因可编码βA亚基,通过形成抑制素和激活素,参与机体生殖、发育过程的调节[13]。越来越多的研究表明,INHBA在结肠癌[14]、胃癌[15]等恶性肿瘤中过表达,与患者临床预后相关。Liu等[16]对不同乳腺癌细胞系进行基因表达分析,发现INHBA是良性导管原位癌想侵袭型乳腺癌转变的关键调控因子,可能是潜在的预后指标。茅育蕾等[17]检测85例乳腺浸润性导管癌及35例癌旁乳腺组织中INHBA表达,结果显示,INHBA表达与乳腺浸润性导管癌患者肿瘤分化程度、淋巴结转移及KI-67增殖指数密切相关,可能参与乳腺癌的发生发展,可用于患者的预后评估。本研究选取TCGA数据集,发现促癌基因INHBA在乳腺癌芯片癌组织中表达上调,可用于乳腺癌的早期诊断、病情及预后的评估。基因富集分析结果显示,与细胞增殖、细胞迁移、肿瘤浸润及淋巴结转移相关的基因集均明显富集在INHBA高表达组,进一步证实INHBA作为促癌基因,参与乳腺癌的发生发展。
另外,本研究通过miRWalk在线软件预测miR-10b-3p靶基因为INHBA,且双荧光素酶报告基因检测显示,miR-10b-3p可特异性与INHBA3’非翻译区结合,靶向抑制INHBA的表达。构建miR-10b-3p过表达MCF-7和MDA-MB-231细胞系后,细胞增殖、迁移与侵袭能力明显减弱;同时,过表达miR-10b-3p的成瘤阳性裸鼠,瘤体生长也受到明显抑制。而INHBA过表达可逆转miR-10b-3p对乳腺癌细胞的抑制作用,提示乳腺癌细胞增殖、迁移及侵袭能力受到抑制的原因可能是miR-10b-3p直接靶向抑制INHBA,进而影响其下游基因的表达,诱导乳腺癌细胞产生上述细胞学行为。但乳腺癌的发生发展涉及多基因、多途径的共同调控,是否还有其他因素仍需要进一步探索研究。
综上所述,miR-10b-3p可能靶向调控INHBA,抑制乳腺癌细胞增殖、迁移和侵袭,这为转移性乳腺癌的靶向治疗提供了新思路,后续将深入分析miR-10b-3p在乳腺癌中的调控机制。
