Parkin蛋白对帕金森细胞模型中α-突触核蛋白表达的抑制作用及机制
2021-10-19胡霞陈方方侯蓓蓓林贞仿云小琴孟丹张力引黎松林李嘉鑫郭春
胡霞,陈方方,侯蓓蓓,林贞仿,云小琴,孟丹,张力引,黎松林,李嘉鑫,郭春
[1.四川省八一康复中心(四川省康复医院),四川 成都 611135;2.新疆医科大学第五附属医院神经内科,新疆乌鲁木齐 830011]
帕金森疾病(Parkinson's disease,PD)是继阿尔茨海默病(Alzheimer disease,AD)之后的第二最常见的神经系统退行性疾病[1],主要治疗手段是利用药物增加多巴胺在大脑中的浓度或者直接刺激多巴胺受体改善临床症状,但并不能从根本上延缓或抑制帕金森病的发展,所以探索帕金森病的病因和发病机制有着重要的意义。
在帕金森病的研究过程中,一个值得关注的致病基因是Parkin(PARK2),是PD中最为常见的染色体的隐性突变,Parkin基因突变首次由Kitada等发现跟帕金森病息息相关[2]。后来研究发现Parkin基因的缺失,直接影响某些蛋白降解,从而引起多巴胺类神经元的毒性损伤,导致常染色体隐性少年型帕金森病[3]。研究发现在正常人的大脑中,尤其在黑质致密部Parkin蛋白有丰富表达,而在PD患者脑内缺乏Parkin蛋白的表达。Parkin蛋白一般在脑中并不是以天然结构的α突触核蛋白(α-synuclein)为底物将其泛素化,而是通过对α-synuclein蛋白翻译后加工、构像改变等结构上发生作用,致使α-synu‐clein发生降解。Parkin基因突变致使Parkin蛋白缺失、功能以及酶活性减弱或消失,引起细胞内异常蛋白的堆积,最终导致多巴胺能神经元细胞死亡,进而引发帕金森病[4-5]。由此可知Parkin蛋白作为一种泛素蛋白的配体,能激活蛋白酶,水解过多αsynuclein蛋白,对多巴胺神经元细胞具有保护作用。
本研究以Parkin为目的基因构建过表达慢病毒重组质粒并转染PC12细胞,拟构建Parkin基因过表达的细胞模型,从Parkin基因的调控角度进一步探讨6-羟基多巴胺(6-OHDA)诱导的PD细胞模型的分子机制,为临床应用基因手段治疗PD提供实验依据。
1 材料与方法
1.1 材料和试剂
1.1.1 主要试剂PC12细胞购自广州辉园苑有限公司;6-OHDA、MEM培养液、DMEM高糖培养液、胎牛血清、LB培养基和Lipofectamine 3000转染试剂购于Sigma公司;无内毒素质粒大提试剂盒购于全式金有限公司;Bax、α-synuclein、Parkin和β-actin蛋白抗体购于abcam;氨苄青霉素和所有qPCR引物由上海生工生物工程股份有限公司合成。
1.1.2 主要仪器HCB-1300V超净工作台(海尔A2生物);5920R低温离心机(Eppendor,德国);Lepgen-96 PCR基因扩增仪(ABI公司,美国);1658001琼脂糖水平电泳槽(BIO-RAD);XJL-20/XJL-20BD普通光学显微镜(粤显,中国);HR1500-II生物安全柜(Thermo,美国);DSPM-508水套式CO2培养箱(Thermo,美国)。
1.2 方法
1.2.1 PC12细胞培养PC12细胞采用高糖DMED培养液加10%(φ)新生牛血清、100 μg/mL青霉素、100 μg/mL链霉素及1%L-谷氨酰胺中培养。
1.2.2 6 -OHDA诱导的PD细胞模型建立[8]PC12细胞在37℃5%(φ)CO2的培养箱中培养,每2天更换培养液,待细胞贴壁生长至80%~90%,用0.25%胰蛋白酶消化传代,传代至3代进行细胞实验。收集对数生长期细胞接种于96孔板中,每孔100 μL完全DMEM培养基。待细胞贴壁生长24 h,用含2%血清的DMEM培养基配置不同浓度(1~1 000 μmol/L)的6-OHDA溶液处理细胞,继续培养24 h后,吸掉细胞上清液,在每孔加入100 μL无血清培养基和10 μL CCK-8溶液,继续培养2 h。在酶联免疫检测仪450 nm处测量各孔的吸光度(A),同时用无血清培养基设置调零孔,每组设定3个复孔,重复3次。
1.2.3 质粒构建、摇菌及质粒提取 通过PCR方法扩增人Parkin基因(NM-004562)序列,将目的条带切割后纯化送至上海生工生物工程股份有限公司鉴定序列是否正确,同时将空骨架载体pLVSO2进行NheI和SalI双酶切,纯化回收大片段。用T4 DNA连接酶连接目的片段和线性化的空质粒pLVSO2,4℃反应过夜。转化DH5α感受态细菌,将转化的菌液涂于含有氨苄青霉素的LB平板上培养12 h,提取阳性克隆进行少量扩增、质粒小提,以BamHI单酶切鉴定阳性细菌克隆和序列测序验证。各取3 mL已灭菌的LB(含氨苄青霉素浓度为50 μg/mL)分别加入2 μL空载体对照菌液和鉴定正确的Parkin过表达菌液,混匀,37℃,180 r/min摇菌4~6 h,然后分别取2 mL进行扩大培养,用200 mL已加氨苄青霉素浓度50 μg/mL高压灭过菌的LB培养基混匀,37℃、210 r/min过夜摇菌培养。培养结束后按照QIAGEN plasmid purification midi kit操作对Parkin过表达质粒(pLVSO2-Parkin)和空载体对照质粒(pLVSO2)进行提取。
1.2.4 293 T细胞转染及慢病毒包装 目的质粒和对照提取成功后,利用Lipofectamine 3000脂质体转染法转染293T细胞,采用两包装质粒系统(psPAX2/pMD2.G)包装质粒,以质粒∶psPAX2∶pMD2.G(4∶3∶1)比例混合后用Lipofectamine 3000共转染293T细胞,分别收集48 h和72 h的病毒液,并用过滤器(Millipore)5 000 r/min×15 min过滤收集浓缩病毒液于-80℃保存。
1.2.5Parkin过表达PC12细胞株的构建 将PC12细胞铺板在6孔板中,细胞密度约为50%,按质粒病毒上清∶聚凝胺(polybrene)∶1640培养基(100 μL∶1 μL∶1 mL)试剂比例加入到6孔板中,接着用48孔板内以(5~8)×104cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验,细胞孵育过夜。待细胞长至70%~80%融合度时,分别加入嘌呤霉素(puromycin)至终质量浓度为2.4 μg/mL、3 μg/mL,3.6 μg/mL、4 μg/mL,处理48 h后细胞全部死亡的最低药物浓度为后续实验拟用的浓度。在6孔板中加入确定好的药筛浓度继续培养PC12细胞4 d后,用qPCR和WB方法验证Parkin过表达稳转细胞株。
1.2.6 荧光定量PCR检测稳转细胞株中ParkinmRNA表达水平Trizol法提取过表达ParkinPC12细胞系和对照质粒稳转PC12细胞系的总RNA,用Nanodrop光度计检测RNA浓度。1 μg总 量RNA采用TaKaRa反转录试剂盒进行逆转录反应,生成cDNA。SYBR Green荧光定量法检测ParkinmRNA水平,反应体系10 μL(SYBR premix Ex TaqII 5 μL;forward/reverse primer各0.5 mL;ddH2O 2 μL;模板cDNA 2 μL);RT-PCR运行条件为:95℃15 s,60℃30 s,72℃4 min 40个循环,其中Parkin正向引物序列5'-TTCCAATGTAACCACCGCCA-3',反 向 引 物序列5'-CACTCCTCGGCACCATACTG-3'。
1.2.7 Western blot检测稳转细胞株中Parkin蛋白表达水平 收集Parkin过表达细胞株和对照细胞,使用裂解液、蛋白酶抑制剂制备蛋白样本,BCA蛋白定量试剂盒测定蛋白样品浓度,取适量蛋白样品加入loading buffer混匀,100℃煮沸5 min使蛋白变性,等量上样,经SDS-PAGE电泳后并转至PVD膜。5%脱脂奶粉封闭2 h,分别用Parkin多克隆抗体(1∶1 000,abcam)和兔GAPDH抗体(1∶500,abcam)4℃孵育过夜,TBST洗4次,每次5 min,分别用辣根过氧化物酶标志的山羊抗兔(1∶8 000,abcam)二抗室温孵育1 h,TBST洗膜,用ECL化学发光显色液,显影读片,应用Image-J软件分析条带的灰度值。Parkin蛋白相对表达量以Parkin蛋白灰度值与GAPDH蛋白内参灰度值比值表示,重复3次取均值。
1.2.8 过表达Parkin的PD细胞模型建立 细胞培养同“1.2.1”,实验分组为不作处理组[PC12、PC12-对照(空载体对照质粒)、PC12-Parkin]和处理组(加30 μmol/L的6-OHDA作用时间48 h,建立PD细胞模型,后弃掉6-OHDA再继续后续实验,为PC12+6-OHDA和PC12-Parkin+6-OHDA组)。
1.2.9 CCK8法检测细胞凋亡 将“1.2.5”中生长状态良好的细胞消化下来,根据计数情况及接种量(5 000个/孔)制备细胞悬液(100 μL/孔),将制备好的细胞悬液接种到96孔板中,放在培养箱中预培养(37℃,5%CO2)4 h、24 h、48 h和72 h,向每孔(100 μL)加入10 μL CCK8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定在450 nm处的吸光度。
1.2.10 线粒体膜电位检测 将“1.2.5”中生长状态良好的细胞消化下来,PBS洗2次,弃去PBS,每管加入1 mL staining buffer,再加入1 μL JC-1(终浓度为2 μmol/L),另外阳性对照组加入1 mL CCCP(终浓度为50 μmol/L)轻轻混匀后将培养板在培养箱内避光孵育20 min,1 500 r/min离心5 min,弃上清,加入1 mL PBS重悬,重复该离心步骤1次,弃上清加入500 μL PBS重悬细胞,最后用流式检测结果。
1.2.11 细胞活性氧(reactive oxygen species,ROS)水平的检测 将“1.2.5”中生长状态良好的细胞消化下来,PBS洗2次,弃去PBS,每组加入1∶1 000稀释的探针1 mL,将培养板在培养箱(37℃,5%CO2)内避光孵育30 min。吸弃探针,加入1 mL PBS清洗,1 500 r/min,5 min,25℃,弃上清(重复1次),最后加入500 μL PBS重悬细胞,将细胞重悬液转移至流式上样管中,在激发波长535 nm,发射波长610 nm附近测定细胞内ROS水平。
1.2.12 Bax和α-synuclein mRNA和蛋白表达水平的检测 方法同“1.2.4”和“1.2.5”,其中Bax正向引物序列5'-GCCCTTTTGCTTCAGGGTTT-3',反向引物序列为5'-GGAAAAAGACCTCTCGGGGG-3';α-synuclein正向引物序列5'-GAGGGCGTCCTC‐TATGTAGGT-3',反 向 引 物 序 列5'-CCCTCTTGT‐GGGTACCCTTCT-3'。Western blot检测抗体情况。
1.2.13数据处理 应用SPSS 19.0统计软件进行数据统计和分析,结果以均值±标准差(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Parkin过表达质粒克隆及稳转株感染构建和parkin蛋白表达的鉴定
成功合成Parkin编辑区序列并克隆带有GFP荧光标签的过表达骨架获得过表达质粒(pLVSO2-Parkin),单酶切后,在8 000~10 000 bp之间有一条清晰且单一的条带(图1A),测序结果和NCBI上公布的Parkin基因序列完全一样,片段大小为1 413 bp。将成功构建的重组质粒(pLVSO2-Parkin)以及对照空载体质粒(pLVSO2)通过pCMV-VSV-G/pMDLg pRRE/pRSV-Rev三包装质粒系统转染到293T细胞中,48 h后可见大量绿色荧光(图1B)。包装目的质粒获得病毒颗粒后,感染PC12细胞,经嘌呤霉素筛选后传代培养获得过表达Parkin稳转细胞系,荧光检测证明99%以上细胞有荧光表达(图1C)。收集上述细胞用蛋白裂解液提取总蛋白,Western blot结果显示:转染pLVSO2-Parkin重组质粒后,293TParkin过表达细胞中Parkin表达显著升高(P<0.01,图1D),PC12-Parkin过表达稳转细胞系成功过表达PARK2蛋白,含量相对于对照组增加了约3倍(P<0.01,图1E)。进一步qPCR结果表明,与对照组细胞比较,PC12-Parkin过表达稳转细胞中的ParkinmRNA水平显著提高(P<0.05,图1F)。
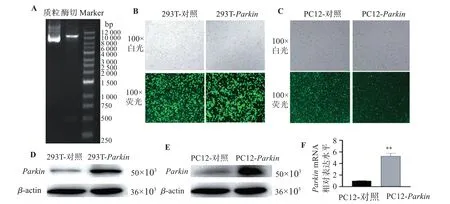
图1 Parkin过表达载体酶切鉴定及稳转株构建和Parkin表达效果鉴定Figure 1 Identification of Parkin overexpression vector by enzyme digestion,construction of stable cell line and identification of Parkin expression effect
2.2 PD细胞模型构建及Parkin的保护作用
6-OHDA处理PC12细胞可以构建诱导损伤的PD细胞模型。在0~200 μmol/L 6-OHDA作用48 h后,与正常对照组比较,细胞存活率呈剂量依赖性下降的趋势(见图2A),6-OHDA浓度为10 μmol/L时,细胞存活率为93.74%;50 μmol/L时,存活率为53.92%;100 μmol/L时,存活率为22.64%;200 μmol/L时,细胞存活率为11.02%。提示用50 μmol/L浓度的6-OHDA处理细胞时,6-OHDA有明显的细胞毒性作用。选择50 μmol/L作为过表达Parkin稳转细胞株以及PC12细胞株的PD造模剂量。
50 μmol/L浓度的6-OHDA处理Parkin过表达稳转细胞株(PC12-Parkin+6-OHDA)和PC12细胞株(PC12+6-OHDA),同时含有未用6-OHDA处理的Parkin过表达稳转细胞株(PC12-Parkin)、对照质粒稳转细胞株(PC12-对照)和PC12细胞株(PC12),分别观察4 h、24 h、48 h和72 h各组细胞存活率。结果表明,相对于其他未处理组,作用24 h后,PC12+6-OHDA组(PD模型组)和PC12-Parkin+6-OHDA组(Parkin基因过表达PD模型组)的A450水平显著降低(P<0.05);作用48 h和72 h后,PC12+6-OHDA组和PC12-Parkin+6-OHDA组A450水平进一步降低(P<0.01),但相对于PC12+6-OHDA组,PC12-Parkin+6-OHDA组的A450值较高(P<0.05)。见图2B。
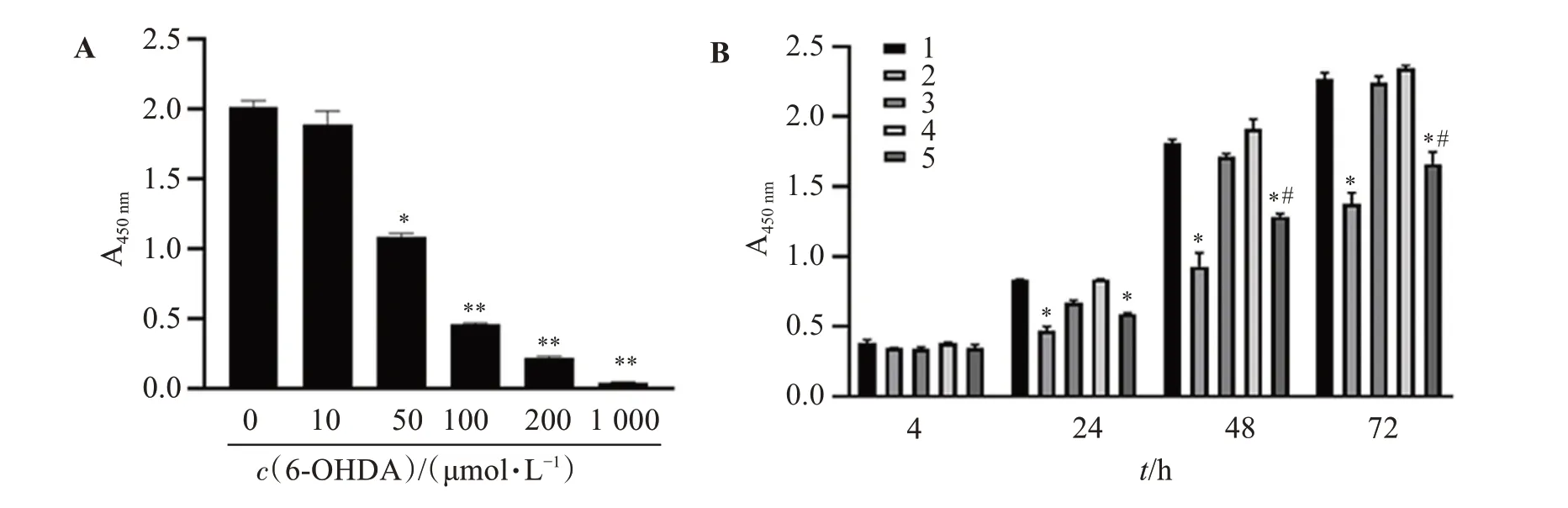
图2 PD细胞模型构建及Parkin过表达保护检测Figure 2 Construction of PD cell model and detection of Parkin overexpression protection
2.3 Parkin过表达对PD模型线粒体膜电位的影响
在没有6-OHDA处理条件下,PC12组、PC12空载对照组以及PC12-Parkin过表达组细胞线粒体膜电位水平无明显差异。当用6-OHDA处理刺激下,PC12组和PC12-Parkin过表达组细胞线粒体膜电位水平均显著降低(P<0.05),但PC12-Parkin过表达组细胞下降幅度明显减弱。见图3。

图3 流式细胞仪检测细胞线粒体膜电位Figure 3 Detection of the mitochondrial membrane potential of cells by flow cytometry
2.4 Parkin过表达对PD模型细胞ROS水平的影响
通过流式细胞术检测细胞内ROS含量结果如图4所示。结果表明,相对于PC12组、PC12-空载对照组和PC12-Parkin过表达组,PC12+6-OHDA组和PC12-Parkin+6-OHDA组细胞ROS含量显著增加(P<0.01,P<0.05),PC12+6-OHDA组比PC12-Parkin+6-OHDA组增加明显,两者差异有统计学意义(P<0.05)。
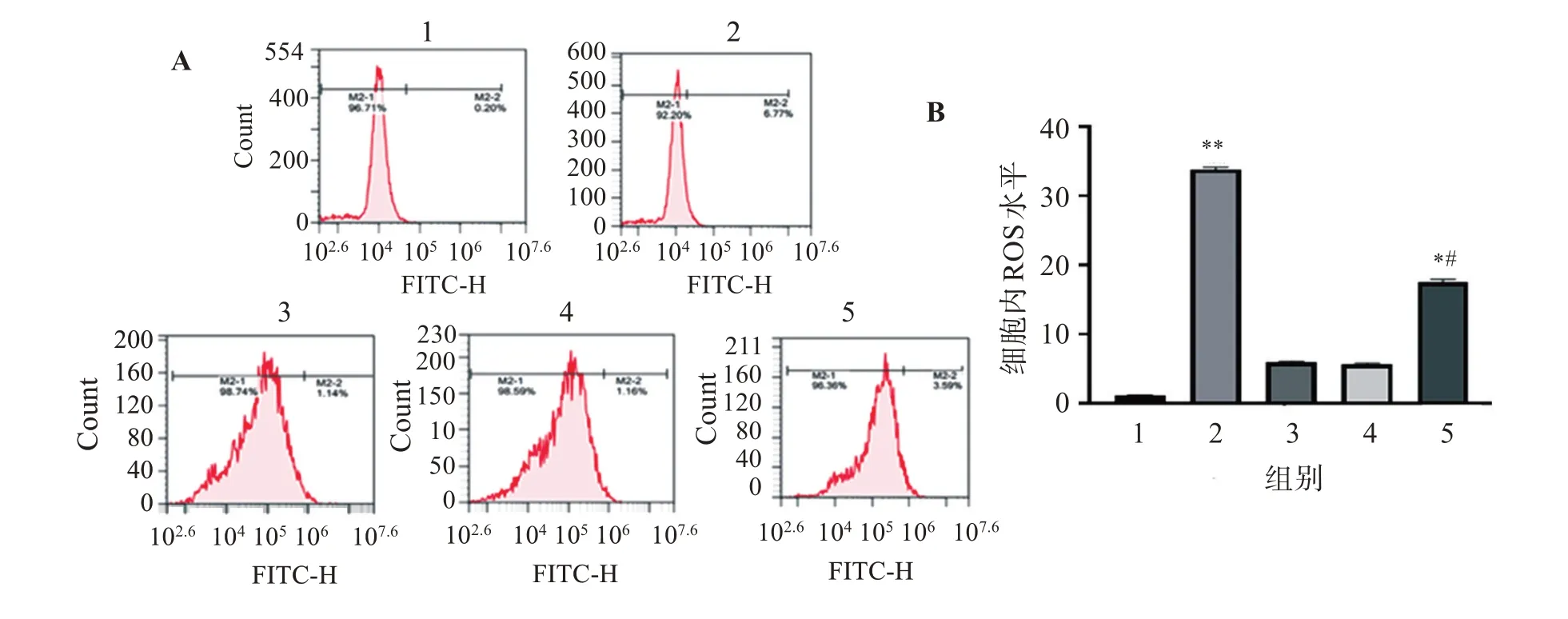
图4 流式细胞仪检测细胞内ROS水平Figure 4 Detection of intracellular ROS levels of cells by flow cytometry
2.5 Parkin过表达对PD模型细胞中关键指标Bax和α-synuclein表达的影响
PD模型中促凋亡相关蛋白(Bax)和α-synuclein是关键指标蛋白。采用荧光定量PCR和Western blot评估各组的Bax和α-synuclein的mRNA和蛋白表达水平,结果见图5。结果表明,与PC12+6-OHDA组比较,PC12-Parkin+6-OHDA组的Bax和α-synu‐clein的表达均显著下降(P<0.01),说明Parkin具有保护作用;PC12+6-OHDA组与其他3组(未加药组)比较,PC12+6-OHDA组的Bax表达显著上升(P<0.01),表明模型制备成功。PC12-Parkin过表达组相比于PC12-对照组的Bax和α-synuclein的表达也有下调(P<0.01),表明Parkin在未诱导损伤情况下也具有降低Bax和α-synuclein表达的作用,从而对细胞抗损伤起保护作用。

图5 Bax、α-synuclein指标检测Figure 5 Detection of the expression of Bax and α-synuclein
3 讨论
目前,人们对帕金森病的病因和发病机制尚未完全研究清楚,其中遗传和环境因素被认为是造成帕金森病患者多巴胺能神经元损伤的主要原因。本研究通过使用6-OHDA处理PC12细胞作为体外PD模型,研究过表达Parkin蛋白通过调节α-synu‐clein在PD发病机制中的作用。PC12细胞是目前用来研究PD发病机制最多的细胞株,其高分化能表达络氨酸羟化酶并且能合成多巴胺,在形态、生理和生化等方面都非常接近中脑边缘(SN)的多巴胺神经元(DA),所以被广泛用于建立PD体外模型的研究[6]。6-OHDA为儿茶酚胺的羟基化衍生物,进入细胞内会被氧化成具有神经毒性的羟自由基和醌类物质,是一种有效导致多巴胺神经元变性的神经毒剂,是体外PD建模最常用的一种药物[7]。叶锡勇等[8]探讨6-OHDA诱导PC12细胞损伤的可能作用机制研究中,结果表明6-OHDA能够导致PC12细胞凋亡,在一定范围内随着浓度增高细胞凋亡数量增加。李艳霞等[9]探讨6-OHDA对PC12细胞的凋亡及内质网应激的影响中,采用60 μmol/L 6-OHDA诱导PC12细胞24 h致接近细胞半致死率,成功建立PC12帕金森细胞模型,结果表明模型细胞的凋亡率较正常对照组细胞明显增高。在本研究中,用0~200 μmol/L 6-OHDA作用48 h细胞存活率呈剂量依赖性下降的趋势,当6-OHDA浓度为50 μmol/L时,PC12细胞存活率为53.92%,说明该剂量浓度有明显的毒性效应,同时也表明了在本实验中50 μmol/L 6-OHDA是成功建立PC12帕金森细胞模型的最佳浓度。
近几年来,人们对帕金森病相关基因的研究越来越多,给研究者帕金森病的发病机理提供了新的思路。在这些基因中,由PARK2基因编码的Parkin蛋白被认为与隐形遗传的帕金森病联系最为紧密[10]。Parkin属于E3泛素化连接酶,能特异性把底物打上泛素化标签,通过泛素化蛋白酶体系对底物起到降解作用。有文献报道,Parkin能够保护多巴胺能神经元抵抗神经毒素所造成的损伤[11]。在本研究中,成功构建了过表达Parkin稳转细胞株,为了验证Parkin蛋白在帕金森病中的重要作用,采用50 μmol/L浓度的6-OHDA处理过表达Parkin稳转细胞系和PC12细胞株,结果发现过表达Parkin能够抑制6-OHDA引起的细胞凋亡,与Houbo等[11]在Parkin对6-OHDA诱导的人神经母细胞瘤细胞凋亡的保护作用研究中的结果一致;在祁雪等[12对Parkin与线粒体稳定相关的帕金森病机制研究中,选择沉默PC12细胞内的Parkin蛋白,并与正常细胞内加等量MPP+比较,结果发现前者PC12细胞存活率降低更为明显。
近年的研究表明Parkin蛋白在维持线粒体的质量方面也发挥着重要的作用。本实验通过建立Parkin过表达细胞模型以及Parkin-PD细胞模型,进一步从Parkin基因的角度了解其对PD细胞线粒体功能的影响。本研究中,过表达Parkin对线粒体膜电位并无明显影响,值得注意的是6-OHDA会引起细胞线粒体膜电位下降,但是Parkin-PD模型组线粒体膜电位较PD模型组略高,说明Parkin蛋白在一定程度上维持了6-OHDA引起细胞线粒体膜电位下降的作用。细胞氧化应激水平变化检测结果表明,PC12细胞在6-OHDA的刺激下线粒体的ROS水平显著升高,与焦玲等[13]研究α硫辛酸抑制6-OHDA诱导的PC12细胞中α-synuclein表达及机制中对线粒体的ROS水平检测结果一致;Lee等[14]用6-OHDA处理PC12细胞后也发现细胞内氧化应激水平显著升高。本研究表明Parkin-PD模型组ROS水平显著高于未处理PC12细胞组,但与PC12-PD模型组相比,ROS水平有显著降低的趋势。Ashrafi等[15]发现Parkin突变患者体内有大量线粒体形态以及功能异常,包括ATP生产减少、膜电位降低、活性氧水平升高以及自噬功能改变等。其实Paikin在细胞内广泛表达,当线粒体的膜电位改变时,会由胞浆转移到线粒体内,在线粒体中表达促进细胞色素产生使异常的线粒体自噬,从而维持线粒体的正常运转,以减轻膜电位减低、ROS升高对细胞造成损伤。
目前已知α-synuclein是导致PD发生的重要因素[16-18],它是一种脑内广泛表达的神经蛋白,在机体发生的生理过程和多种神经退行性疾病的发生发展中起到了重要的作用[19]。研究报道,α-synuclein的积累会导致神经元的凋亡,甚至会死亡,会出现典型的PD症状[20],如何清除α-synuclein的聚集成为了研究PD发病机制的热点。当前研究最多的是通过泛素蛋白酶体途径对α-synuclein起到降解作用,在泛素蛋白酶体途径中涉及到一种关键蛋白——Parkin蛋白。Parkin蛋白主要是通过一种E1激活酶和E2结合酶共同激活一种或几种需要降解的蛋白质,促进其泛素化[21]。本研究中,6-OHDA诱导的PC12细胞模型α-synuclein表达显著升高,同时在PC12-Parkin+6-OHDA组中,α-synuclein表达较PC12+6-OHDA组显著降低,表明α-synuclein是Parkin蛋白酶的作用底物,通过泛素蛋白酶体途径对其泛素化降解并清除,发挥抗6-OHDA诱导细胞损伤的保护作用。细胞凋亡是一种自主性程序性死亡,在神经系统的发育过程及维持体内细胞稳态起到重要作用,研究报道AD、PD及ALS等神经退行性疾病发生发展过程中往往伴随着神经元的凋亡。在本实验中,通过检测促凋亡相关蛋白Bax的表达发现,6-OHDA处理后,PC12细胞组的Bax表达量明显升高,Parkin过表达PC12细胞组比PC12-6-OH‐DA组表达量有显著下降的趋势,因此推测Parkin蛋白在抗6-OHDA毒性作用机制可能与抑制线粒体凋亡通路和降低α-synuclein蛋白表达相关。
本研究结果显示,通过Parkin表达降低了6-OHDA对PC12细胞的神经毒性,起到了保护神经元的作用,这种作用可能是通过提高蛋白酶体的活性,促进α-synuclein的降解来实现的。本结果为进一步研究6-OHDA在神经系统损伤的作用机制提供依据,也为帕金森病的治疗提供新的理论依据。
