子痫前期胎盘样本的多肽组学分析及差异多肽功能的初步探究
2021-10-19邵慧静王天俊张嘉嘉杨娜娜孙丽洲
邵慧静,王天俊,张嘉嘉,杨娜娜,孙丽洲
南京医科大学第一附属医院产科,江苏 南京 210029
子痫前期(preeclampsia)是一种妊娠期特有疾病,主要表现为妊娠20周后出现高血压并伴随有蛋白尿,严重危害母儿健康[1],如不及时管理,母体可能会出现高血压、肾损伤、肝损伤、中枢神经损伤、卒中、心肌病、肺水肿等并发症,胎儿则有发生宫内生长受限、胎盘早剥、早产、新生儿呼吸窘迫征等并发症的风险。目前子痫前期的发病机制尚不清楚,普遍认为胎盘占中心地位,唯一的解决办法是尽早终止妊娠[2]。妊娠初期,滋养细胞侵袭子宫内膜和浅肌层,重塑螺旋动脉,使其由高阻低流型转化为低阻高流型,从而提供胎儿生长发育的供血需求[3]。而在子痫前期患者的胎盘中,出现滋养细胞侵袭不足,部分螺旋动脉重塑失败,未转化的螺旋动脉出现动脉粥样硬化等病理改变[4]。
随着质谱技术的不断发展,液相色谱⁃串联质谱(LC⁃MS/MS)技术为转化医学研究提供了有力工具,在寻找与特定疾病相关的蛋白、多肽、小分子代谢物过程中发挥了重要作用[5]。多肽组学就是以质谱技术为基础发展起来的一门全面研究内源性多肽结构、功能及变化规律的学科,是目前的热点研究领域。内源性多肽是指相对分子质量小于10 kDa的小分子物质,大多来自蛋白的降解,也可由基因直接翻译而来[6]。此前认为多肽仅仅是降解产物而无生物学活性,但越来越多的研究表明这些内源性多肽也能引起相应新陈代谢活动的改变,因此多肽组学研究对于了解疾病发生机制、标志物筛选及治疗具有重要意义,已广泛应用于多种疾病如肥胖、糖尿病、肿瘤的研究[7-9]。在子痫前期的多肽组学研究中,目前已有子痫前期血清、尿液以及羊水多肽组学,为了解子痫前期的发病以及寻找特异性标志物提供了重要的线索[10-12]。而胎盘作为子痫前期发病的起源器官,在多肽组学的水平上还未被研究。本文利用LC⁃MS/MS技术研究了子痫前期胎盘样本中多肽组的特征性变化,并通过体外研究发现了来自差异多肽405SPLFMGKVVNPTQK418对滋养细胞以及血管内皮细胞功能的影响,为子痫前期发病机制研究以及治疗提供了支持。
1 材料和方法
1.1 材料
选择2019 年5—9 月在南京医科大学第一附属医院产科住院分娩孕妇8 例,其中4 例正常足月妊娠,4例子痫前期病例。参照《妇产科学》第8版教材对子痫前期的诊断,即妊娠20 周后出现收缩压≥140 mmHg 和/或舒张压≥90 mmHg,伴尿蛋白阳性。或无蛋白尿但合并以下任何一项者:血小板减少;肝功能异常;肾功能损害;肺水肿;新发的中枢神经系统异常或视觉障碍。同时排除既往患高血压、糖尿病、甲状腺功能异常、妊娠期肝内胆汁瘀积症、肝脏以及肾脏疾病等合并症的孕妇。研究对象均无吸烟史以及长期服药史。所有患者均为剖宫产,分娩后留取胎盘组织并迅速转运至液氮保存。本研究获得南京医科大学附属第一医院伦理委员会批准,患者均签署知情同意书并同意自愿捐献少许胎盘组织标本。
离心超滤管(Millipore公司,美国);纯水、乙腈、甲酸、三氟乙酸(Thermo Fisher Scientific 公司,美国);碳酸氢铵(Sigma 公司,美国);胎牛血清、ECM培养基(Sciencell公司,美国);DMEM培养基、0.25%胰酶⁃EDTA、PBS 缓冲液(Gibco 公司,美国);CCK⁃8试剂盒、BCA 试剂盒(南京诺唯赞生物技术公司);Matrigel基质胶(Corning公司,美国);抗MMP⁃2兔一抗(武汉Proteintech 公司)、抗TIMP1 兔一抗、抗GAPDH鼠一抗(Abcam公司,美国)。辣根过氧化物酶标记山羊抗小鼠二抗、辣根过氧化物酶标记山羊抗兔二抗(北京中杉金桥生物技术有限公司);多肽委托上海科肽生物科技有限公司合成,通过RPLC⁃MS 检测其纯度为95%以上;人绒毛外滋养细胞系(HTR8/SVneo)以及脐静脉内皮(HUVECs)细胞株购自美国ATCC细胞库。
1.2 方法
1.2.1 样本预处理
胎盘样本采集后立即保存于液氮中。胎盘内源性多肽的提取采用超滤离心法。具体操作流程如下:预冷研磨器具及其他需要接触到样品的工具,加入液氮进行研磨,将冷冻粉末转移至EP 管中。在样品粉末中加入2 mL 提取液(1%甲酸水溶液),冰上超声10 min 裂解。超声后,4 ℃,20 000g离心30 min,取上清。吸取200 μL 样品溶液使用10 kDa超滤管10 000g下超滤至20 μL,添加100 μL 50 mmol/L 碳酸氢铵,继续超滤至20 μL,收集滤过液体,舍弃超滤管中分子量大于10 kDa的蛋白等大分子。使用200 μL 0.1% TFA,80% 乙腈活化除盐柱。使用400~600 μL 0.1%TFA,1%乙腈溶液平衡除盐柱。将样品加入除盐柱内,使样品缓慢流过除盐柱,多肽被除盐柱捕集,盐等其他非疏水性小分子流出舍弃。再添加200 μL 0.1%三氟乙酸,0.5%乙腈溶液清洗除盐柱,洗去残留盐类,添加300 μL 0.1%三氟乙酸,80%乙腈溶液,使液体缓慢流过除盐柱,将多肽洗脱下来,使用新EP管收集洗脱溶液,洗脱液冷冻干燥。
1.2.2 LC⁃MS/MS分析
色谱条件:采用NanoAcuity 超高压纳升级液相色谱系统进行分离。液相A 液为0.1%甲酸⁃水溶液,B液为0.1%甲酸⁃乙腈溶液。样品以200 μL A相溶解,由自动进样器吸取2 μL样品后,以10 μL/min流速传送到捕集柱上捕集2 min。捕集柱上的样品在分析柱上进行色谱分离,流速为300 nL/min。相关液相梯度为0~105 min,B 液线性梯度从5% 到30%;105~110 min,B 液线性梯度从30% 到90%;110~112 min,B 液维持在90%;112~113 min,B 液线性梯度从90%到5%;B液保持5%7 min。样本间用空白溶剂30 min流动相梯度清洗1次。
质谱条件:Q Exative HF 质谱仪离子源喷雾电压为2.0 kV,加热毛细管设定为300 ℃,采用数据依赖模式自动在MS 和MS/MS 间切换采集。全扫描MS 使用Orbitrap 进行一级扫描,扫描范围为m/z 350~1 600,分辨率设定为60 000(m/z 200处)。离子最大引入时间为50 ms,自动增益控制(automatic gain control,AGC)设定为3×106,随后使用高能碰撞解离(higher energy C⁃trap dissociation,HCD)对符合串级(MS/MS)碎裂条件的强度前10 名母离子进行碎裂并用orbitrap 进行扫描,扫描分辨率设定为15 000。扫描范围根据母离子质荷比自动控制,最低扫描范围固定为m/z=100处,最高到2 000。进行MS/MS的最低离子强度值设定为50 000。MS/MS时离子最大引入时间为100 ms,AGC 控制设定为2.0×105,母离子选择窗口设定为2 Da。对于2、3、4电荷数的离子进行MS/MS采集,动态排除设定为每个母离子在10 s 内进行1 次MS/MS,之后排除30 s,30%的碰撞能量。
1.2.3 质谱数据检索分析
Q Exative HF 质谱仪所采集的质谱数据利用MaxQuant(Version 1.6.5.0)进行搜索,检索数据库为SwissProt数据库(种属:Homo sapiens,包含20 422条reviewed序列)。检索参数设置为:甲硫氨酸残基和天冬酰胺残基为可变修饰;无酶切;一级质谱精度(4.5 ppm);二级质谱精度(20 ppm)。多肽筛选门槛设定如下:假阳性率(false discovery rate,FDR)小于1%;蛋白最少匹配1条独有肽段(unique peptides);肽段最少包含7个氨基酸。多肽定量采用MaxQuant软件(version 1.6.5.0)及iBAQ算法,FDR设置为0.01。
1.2.4 生物信息学和统计学分析
利用在线工具(http://web.expasy.org/compute)分析多肽的分子量和等电点分布情况。并利用GO(http://geneontology.org)和 KEGG(http://www.ge⁃nome.jp/kegg)分别对差异肽段匹配的蛋白质进行功能富集分析和通路富集分析。
1.2.5 细胞培养及多肽处理
HTR⁃8/SVneo 在含有10% FBS 的DMEM 中培养。HUVECs 在含有10% FBS 的ECM 培养基中培养。两者均置于37 ℃、5%CO2的潮湿恒温培养箱中常规培养。多肽干粉用高压蒸馏水溶解至终浓度为10 mmol/L 保存,使用前稀释至相应浓度。本实验中,实验组用50 μmol/L 浓度的多肽处理,对照组加入等量的高压蒸馏水,随后两组同时置于37 ℃、5%CO2的潮湿恒温培养箱中继续培养24 h 以待后续实验。
1.2.6 CCK⁃8法测定细胞增殖能力
多肽处理HTR⁃8/SVneo 细胞24 h 后,10%FBS DMEM重悬细胞并将细胞接种到96孔板,每组设置5 个重复反应孔,每孔2 000 个细胞。细胞培养0、24、48、72、96 h后分别加入10 μL CCK⁃8试剂,孵育2 h后在酶联免疫检测仪490 nm处测量各孔的吸光度。实验独立重复3次。
1.2.7 克隆形成实验
多肽处理HTR⁃8/SVneo 细胞24 h 后,10%FBS DMEM 重悬细胞。随后将细胞接种到6 孔板中,每组设置3 个重复孔,每孔600 个细胞,10%FBS DMEM 完全培养基继续培养10 d。10 d 后,PBS 洗涤细胞3次,甲醇固定,0.1%结晶紫染色。随后在倒置显微镜下随机取3个视野进行克隆计数。实验独立重复3次。
1.2.8 Transwell实验
多肽处理HTR⁃8/SVneo 细胞24 h 后,用无血清培养基重悬细胞,随后将细胞加入Transwell 小室,每组3个重复实验孔,每孔3×104个细胞。下室加入10%FBS DMEM 培养基,放入孵箱继续培养24~48 h。终止培养后,棉签擦去上室未穿膜细胞,甲醇固定,0.1%结晶紫染色。倒置显微镜100 倍视野下随机取5 个视野对穿膜细胞进行统计,并取平均值进行分析。实验独立重复3次。
1.2.9 HUVECs细胞成管实验
多肽处理HUVECs细胞24 h后,10%FBS ECM培养基重悬细胞。将基质胶提前置于4 ℃融化,96孔板中每孔铺胶50 μL 后放至37 ℃培养箱孵育40 min以上。然后将细胞均匀铺入含基质胶的96孔板中,每组3 个实验重复孔,每孔3×104个细胞。培养6~12 h 后置于倒置显微镜100 倍视野下观察,计数管腔形成数量。实验独立重复3次。
1.2.10 qPCR
TRIzol 提取总RNA,逆转录成cDNA 后,采用聚合酶链反应进行目的基因的扩增。引物序列如下:MMP2:5′⁃GCTCAGATCCGTGGTGAGAT⁃3′(正向),5′⁃GGTGCTGGCTGAGTAGATCC⁃3′(反向);TIMP1:5′⁃AATTCCGACCTCGTCATCAG⁃3′(正向),5′⁃GTT⁃GTGGGACCTGTGGAAGT⁃3′(反向);GAPDH:5′⁃GACTCATGACCACAGTCCATGC⁃3′(正向),5′⁃AGAGGCAGGGATGATGTTCTG⁃3′(反向)。最终结果以2-ΔΔCt计算。
1.2.11 Western blot
RIPA裂解液裂解细胞并提取总蛋白,BCA法测定蛋白浓度,随后上样进行SDS⁃PAGE 电泳。然后将分离后的蛋白转移到PVDF膜上,5%脱脂奶粉溶液封闭液封闭1 h,4 ℃孵育一抗过夜(抗MMP2一抗、抗TIMP1一抗、抗GAPDH一抗浓度均为1∶1 000),后室温孵育二抗1 h(二抗浓度为1∶5 000),洗膜后ECL 发光法显影。使用Image J 对条带进行半定量灰度分析。
1.3 统计学方法
采用SPSS 17.0和Graphpad prism8.0软件进行统计分析,计量资料以均数±标准差()表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 胎盘样本临床数据统计
对纳入研究的孕妇年龄、体重指数(body mass index,BMI)、孕周、收缩压、舒张压、蛋白尿、胎儿出生体重、Aparg评分等临床信息进行统计(表1)。
表1 胎盘样本的临床信息Table 1 Clinical characteristics between preeclampsia and healthy pregnancies()

表1 胎盘样本的临床信息Table 1 Clinical characteristics between preeclampsia and healthy pregnancies()
2.2 胎盘样本多肽组分的质谱分析
通过LC⁃MS/MS 共鉴定了3 582个多肽片段,来源于499个蛋白。检测到的肽段分子量主要分布在1 000~1 800 Da(图1A);肽段等电点主要分布在8.0~11.0(图1B);结合分子量的因素来看,肽段的分布并不均匀,主要集中在等电点为10.0左右的区域(图1C)。

图1 液相色谱⁃质谱鉴定的胎盘多肽性质分析Figure 1 Characteristics of placental peptide identified by liquid chromatography⁃tandem mass spectrometry(LC⁃MS/MS)
2.3 差异性多肽鉴定与筛选
利用统计学方法筛选差异多肽,差异多肽筛选标准为P<0.05 且Fold⁃change 值<0.83 或者>1.2,共筛选出48条差异多肽。其中18条多肽在子痫前期中上调,30条多肽在子痫前期中下调(表2)。
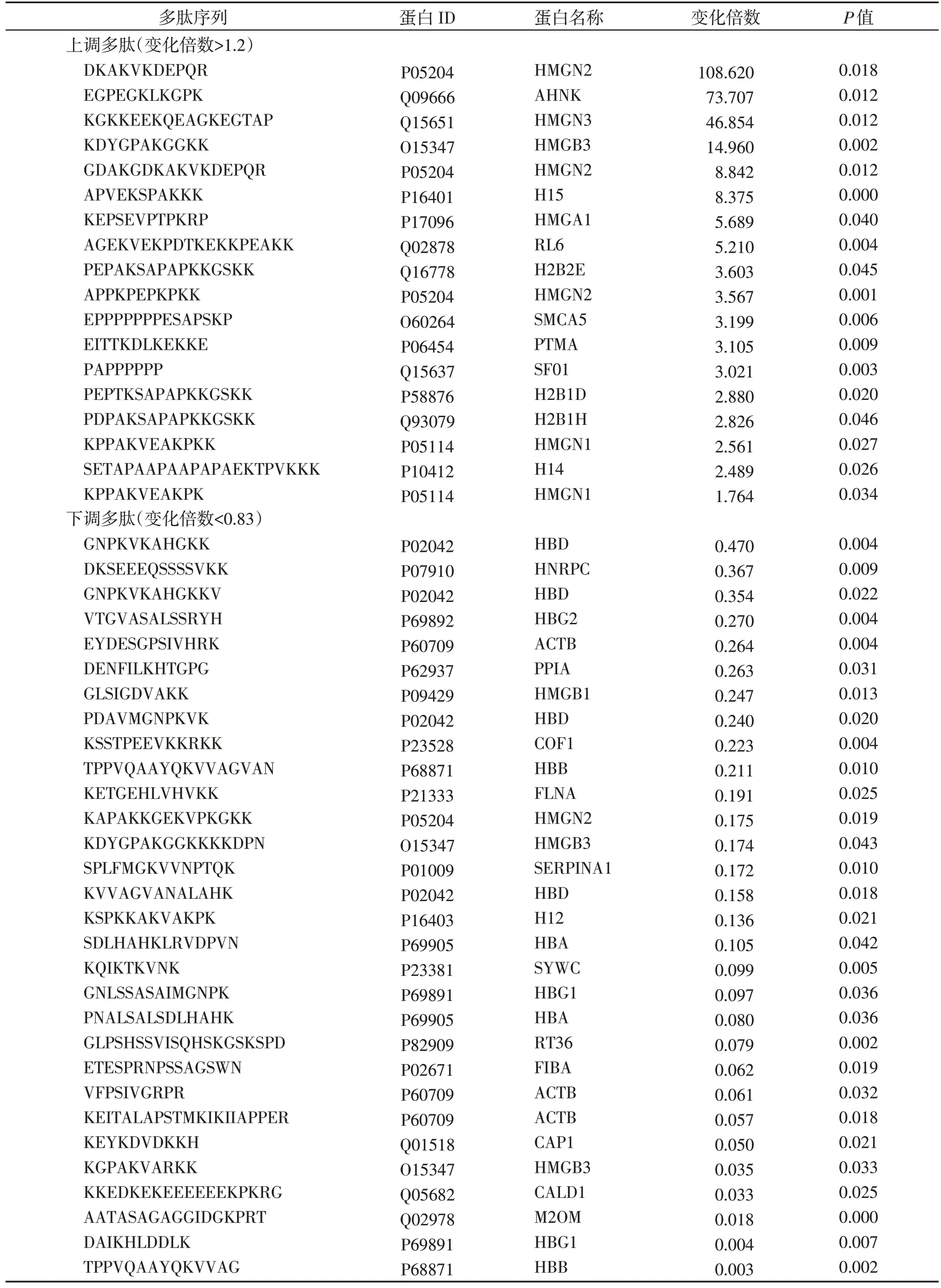
表2 多肽差异性表达Table 2 Differentially expressed peptides secreted from normal and preeclamptic placentas
2.4 胎盘差异性多肽所匹配蛋白质的生物学分析
2.4.1 GO功能分析
通过在线数据库对差异多肽所对应的前体蛋白质进行功能注释分析(图2)。结果表明,这些前体蛋白的功能类别主要涉及分子的结合,包括蛋白结合、DNA 与RNA 结合、转录因子结合以及有机环状化合物的结合,此外还涉及抗氧化以及分子载体的功能。这些蛋白多数位于细胞质中,还有一部分位于细胞外以及细胞核中。所参与的生物学过程主要包括代谢、基因表达调节、物质转运、生物合成以及免疫应答等。

图2 差异多肽所匹配的蛋白质的GO分析Figure 2 GO analysis of the differential peptide matched proteins
2.4.2 KEGG信号通路分析
对差异多肽的前体蛋白进行KEGG信号通路分析,结果显示这些蛋白质主要富集在凝血(coagula⁃tion cascade)、补体(complement cascade)和血小板激活(platelet activation)通路中。其中涉及AIAT 蛋白(又称SERPINA)、FIBA 蛋白(又称FGA)以及Ac⁃tin蛋白。
2.5 差异多肽405SPLFMGKVVNPTQK418的体外功能实验
选择了下调多肽405SPLFMGKVVNPTQK418进行研究,该多肽是SERPINA1 蛋白的C 端多肽,含有14 个氨基酸。根据此前研究报道,SERPINA1 在子痫前期孕妇的血清、尿液以及胎盘中表达上调。因此猜测,SERPINA1 以及其多肽可能在子痫前期的发病过程中发挥一定作用。而绒毛滋养细胞功能减退以及螺旋动脉重塑不足是子痫前期的主要发病因素,因此在滋养细胞以及脐静脉内皮细胞中研究该多肽的作用。
2.5.1 差异多肽405SPLFMGKVVNPTQK418对滋养细胞增殖以及迁移能力的影响
与对照组相比,多肽处理后的HTR⁃8/SVneo 细胞增殖能力显著增加(P<0.01,图3A)。克隆形成实验证实多肽处理后,HTR⁃8/SVneo 细胞生长活力较空载对照组增加(P<0.01,图3B)。此外,Tran⁃swell 实验证明了多肽处理后的HTR⁃8/SVneo 细胞较空载对照组的迁移能力增加(P<0.01,图3C)。
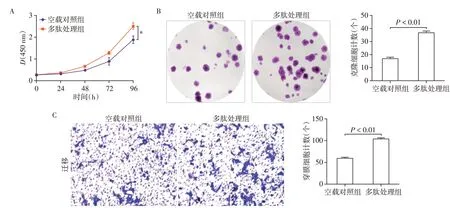
图3 多肽处理HTR⁃8/SVneo细胞后CCK⁃8、克隆形成及迁移实验结果Figure 3 Effects of peptide on the proliferation and migration capacity of HTR⁃8/SVneo cells detected by CCK⁃8,colony formation assay and transwell assays
2.5.2 差异多肽405SPLFMGKVVNPTQK418能够促进脐静脉内皮细胞管状形成
与空载对照组相比,多肽处理后HUVECs的管状形成能力显著增加(P<0.01,图4)。

图4 多肽处理HUVECs 细胞后对其管状形成能力影响(×100)Figure 4 Effects of peptide on the tube formation capaci⁃ty of HUVECs(×100)
2.5.3 差异多肽405SPLFMGKVVNPTQK418处理后HTR⁃8/SVneo细胞中MMP2和TIMP1的表达
qPCR 以及Western blot 结果显示,差异多肽处理后的HTR⁃8/SVneo细胞中MMP2的基因及蛋白水平明显上调,而TIMP1 的基因以及蛋白水平则明显下调(P<0.01,图5)。

图5 多肽处理后HTR⁃8/SVneo细胞中MMP2蛋白以及TIMP1 mRNA以及蛋白的表达情况Figure 5 Expression of MMP2 and TIMP1 in HTR⁃8/SVneo cells after peptide treatment
3 讨论
本研究首次以子痫前期胎盘为样本进行多肽组学层面的研究,通过对子痫前期以及正常孕妇胎盘样本的内源性多肽组的分析,筛选出了48条差异性多肽。这些差异多肽反映了子痫前期状态下胎盘内蛋白的合成、加工和降解过程的变化,因此我们对这些差异多肽的前体蛋白进行GO功能分析以及KEGG通路分析,发现这些前体蛋白主要与补体、凝血以及血小板激活通路密切相关,为子痫前期发病机制的研究提供了方向以及依据。此外,多肽往往在临床症状出现之前就已经发生变化,因此可以将胎盘差异多肽与此前子痫前期尿液、血液以及羊水差异多肽联合分析,寻找特异性生物标志物以提高对子痫前期早期诊断率。
此外,多肽虽为蛋白质的降解产物且结构简单,但近年来研究发现多个具有抗菌抗癌作用的多肽[13]。此前还发现多肽对于基因表达、物质代谢有调节作用,比如,早期研究认为C肽(含有31个氨基酸)无生物学活性,且由于其不通过肝酶代谢,清除缓慢,将C 肽作为临床判断胰岛β细胞功能的良好指标。但近年来多项基础以及临床研究发现C肽具有重要的生物活性作用,如可以调节糖代谢,改善糖尿病微血管病变以及糖尿病神经病变[14]。本研究在差异多肽中挑选了来自SERPINA1蛋白的C端多肽405SPLFMGKVVNPTQK418,该多肽位于SERPI⁃NA1 的C 端末端,由最后的14 个氨基酸组成,此前未有相关研究报道。而其前体蛋白SERPINA1被报道在子痫前期的尿液、血液以及胎盘中表达上调,表明该多肽有参与子痫前期发病的可能[15]。通过体外功能实验发现该多肽确实能促进滋养细胞的增殖、迁移以及脐静脉内皮细胞的血管形成,由此推测该多肽在子痫前期的发病中起保护性作用。
MMPs是一类能够降解细胞外基质的金属蛋白水解酶,TIMPs 为体内细胞分泌的一类能够选择性抑制MMPs活性的家族蛋白。在正常妊娠过程中两者相互作用、相互制约以维持胎盘的正常功能。子痫前期的发病过程中,MMPs 以及TIMPs 发生异常表达,相关的发病机制涉及滋养细胞的迁移侵袭以及血管内皮功能失调。Li 等[16]检测子痫前期大鼠模型中MMPs 所对应底物的变化,发现与正常妊娠大鼠相比,子痫前期模型大鼠的胎盘以及主动脉中的胶原含量增加,从而阻碍滋养细胞的迁移和侵袭。此外,MMPs 可以将大分子内皮素降解为ET1⁃32,后者具有舒张血管的作用。有研究发现,与正常妊娠大鼠相比,子痫前期模型大鼠中的MMPs 以及ET1⁃32表达减少,从而使其介导的血管舒张作用减少,导致血管收缩和血压增高[17]。本研究通过qPCR以及Western blot方法发现多肽405SPLFMGKV⁃VNPTQK418处理后的滋养细胞中MMP2 表达量上调,而TIMP1表达量下调,说明差异多肽405SPLFMG⁃KVVNPTQK418可能通过促进滋养细胞的生长和侵袭以及保护血管内皮功能而起到缓解子痫前期发生发展的作用。
但子痫前期的发病是多种因素共同作用的结果,本研究也仅通过体外实验初步探究了子痫前期胎盘多肽的变化以及差异多肽的潜在功能。多肽影响子痫前期发病的具体机制以及其他胎盘差异多肽的生物活性还需进一步研究。此外,本研究在选择临床样本时主要考虑了子痫前期这一变量因素,而忽略了孕周对于多肽组学可能的潜在影响,存在对照组以及子痫前期组孕周不匹配的情况。因此在未来研究中,将会选取更加合适的对照组,如孕周为非足月臀位破水剖宫产(排除感染因素)以及非足月前置胎盘伴出血剖宫产进行研究。从而为子痫前期发病机制研究以及子痫前期的治疗提供更多有效的线索。
