纳米零价铁(nZVI)对蚯蚓-微生物-土壤生态系统的毒性效应研究*
2021-10-19刘嫦娥岳敏慧谭辉林张维兰肖艳兰段昌群
刘嫦娥,岳敏慧,谭辉林,张 悦,张维兰,肖艳兰,潘 瑛,段昌群
纳米零价铁(nZVI,nano-zero-valent iron)是一种高氧化还原活性金属,由于其高还原活性和优越的吸附性能可快速去除环境中重金属离子、卤代有机物及其他无机阴离子等多种污染物[1],对持久性有机污染物也有很好的去除效果[2],在环境污染修复中具有不可比拟的优势。但其产生的环境效应和生态影响尚不明确[3],尤其缺乏综合系统研究,需要进一步探讨其环境安全性。由于对纳米粒子在环境中的行为和最终存在形态的研究有限[4],因此对生态系统尤其是土壤生态系统的影响难以预测。目前,多数研究采用nZVI对受试对象的毒性效应来确定其对自然界中多种生物体和大环境的影响; 只有少数研究调查了nZVI对土壤动物的影响,发现其毒性和浓度呈正相关。研究表明,nZVI对细菌[5-6]、鱼(Oryzias latipes)[7]、浮游植物(Isochrysis galbana)和水蚤(Daphnia magna)[8]均有影响,但nZVI对土壤生态系统的毒性研究较少。Chen等[9]研究了nZVI 对土壤理化性质包括pH、阳离子交换容量、溶解性有机质等的影响,但少见nZVI 与土壤组分相互作用及其效应的系统阐述[10]。蚯蚓作为大型土壤动物在土壤中广泛分布,不仅可通过自身活动改善土壤团粒结构与质量,还作为土壤的指示生物对土壤生态系统发挥重要作用[11],在一定程度上nZVI对蚯蚓的毒性效应可以指示nZVI对土壤生态系统的影响。目前关于nZVI对蚯蚓-微生物-土壤生态系统的生态影响需综合、系统地展开研究。
因此,本研究构建室内模拟试验,研究nZVI对蚯蚓、土壤微生物及土壤质量的影响,进一步探讨其对土壤生态系统的影响,为nZVI应用于土壤污染修复的潜在风险评估提供科学依据。
1 材料与方法
1.1 试验材料
自制圆柱状PVC管作为试验装置,管内径13 cm,高12 cm,上端开口。供试土壤采于云南省昆明市云南大学多年无污染废弃地(24°49'N、102°51'E)0~10 cm土层红壤,采集地海拔1980 m; 商用腐殖土购于云南圣比科技有限公司。将红壤和商用腐殖土按照质量比2∶1混合均匀得到试验土壤。试验土壤大团聚体、小团聚体和黏土质量占比分别为3%、77%和20%,镉、有机质、全氮、碱解氮、全磷和速效磷含量分别为0 g·kg-1、96.59 g·kg-1、2.74 g·kg-1、342.34 mg·kg-1、1.18 g·kg-1和 434.32 mg·kg-1。
供试nZVI选用粒径为 50~70 nm 的nZVI颗粒,具有核-壳结构,即核心为立方结构的单质铁,表面包裹一层铁氧化物,兼具还原和吸附的性能,购于北京德科岛金科技有限公司,型号为DK-Fe-001。
供试蚯蚓选用评估土壤污染物毒性的模式动物且具有广泛敏感反应的国际标准蚓种赤子爱胜蚓(Eisenia foetida),系寡毛纲(Oligochaeta)后孔寡毛目(Opisthopora)正蚓科(Lumbricidae)爱胜蚓属,食碎屑类表栖型蚯蚓,购于云南圣比科技有限公司。试验前选择大小一致(300~500 mg)、性成熟的蚯蚓置于供试土壤驯化1周,清肠处理24 h后,用蒸馏水清洗体表后,添加至试验装置中。
1.2 试验方法
1.2.1 试验设计
在PVC装置中加入500 g的试验土壤,加入去离子水,土壤含水率保持45%,稳定28 d后风干; 投加nZVI搅拌均匀,设置nZVI为0、0.05%、0.25%和0.50% 4个含量处理,再次加入去离子水,使其含水率保持45%,之后投加蚯蚓,设每桶0和5条2个处理,共计8个处理。装置上端用纱网封口,防止蚯蚓逃逸及外来物干扰,每组处理设12个平行; 分别在第15 d(3个)、第30 d(3个)和第45 d(6个)进行分批收样,测定第15 d、30 d、45 d蚯蚓存活率、生物量及抗氧化酶活性等及第45 d的土壤团聚体稳定性、土壤理化指标性质及土壤微生物多样性。
1.2.2 测定指标与方法
蚯蚓生物量(鲜重)减少量采用重量法测定,生物量减少量=试验开始蚯蚓生物量-试验结束时蚯蚓生物量。蚯蚓酶活的测定方法:用蒸馏水清洗蚯蚓体表5次,吸水纸吸干蚯蚓体表水分,称取0.1 g蚯蚓,依据生物试剂盒说明书按比例加入提取液,用研磨枪研磨,按照说明书进行离心,将样品置于4 ℃低温保存待测。蚯蚓体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醇(MDA)和脯氨酸(Pro)均采用生物试剂盒进行测定,试剂盒购买于上海优选生物科技有限公司。
土壤理化指标测定方法:采用重铬酸钾氧化外加热法(GB 9834-88)、硫酸-高氯酸消煮法(GB 9837-1988)、凯氏定氮法(HJ 717-2014)、碱解扩散吸收法(GB 7849-1987)、双酸浸提-钼锑抗比色法(GB 1229-1990)、电位法(HJ 962-2018)分别测定土壤有机质、全磷、全氮、碱解氮、速效磷含量和pH。
土壤团聚体稳定性:采用团聚体尺寸分布(aggregate size distribution,ASD)和平均重量直径(mean weight diameter,MWD)指标来评价[12]。具体方法为:采用湿筛法对土壤水稳性团聚体进行筛分,将风干土壤样品浸入蒸馏水5 min,使土壤样品快速崩解,然后2 min内以3 cm幅度手动上下震动筛子50 次,筛分为大团聚体(>250 μm)、小团聚体(53~250 μm)和黏土、泥沙(<53 μm)3种组分。之后用蒸馏水将土壤筛中的各组分全部洗入容器中,自然风干,称重并计算不同团聚体比例。团聚体尺寸分布(ASD)和平均重量直径(MWD)计算公式如下:
式中:W为土壤团聚体总质量,Wi为i尺寸团聚体质量。
式中:Xi为i尺寸团聚体平均直径。
土壤微生物:随机选取6个装置中3个装置,用高温灭菌的钥匙取土壤样品,装在高温灭菌的离心管中,-20 ℃低温保存,待检测。从样本中提取基因组DNA后,扩增16S rDNA的V3-V4区。引物序列为:338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),扩增子长度约460 bp。PCR扩增产物切胶回收,用Quanti-FluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,Hiseq 2500 PE250上机测序,并使用Illumina MiSeq高通量测序平台对其进行双末端(Paired-End)测序。DNA的提取和测序委托广东基迪奥公司完成。本文采用生物多样性指数(Shannon指数、Simpson指数)和丰富度指数(Ace指数、Chao指数)、细菌相对丰度来评价nZVI对土壤细菌生物多样性与群落构成情况的影响。
1.3 数据处理方法
本研究试验数据使用EXCEL、SPSS进行分析,所有数据均满足正态分布和齐次性要求。其中,平均值以平均值±标准差表示,采用皮尔逊相关性分析并进行双尾检验、单因素重复测量方差分析、双因素重复测量方差分析和Duncan检验法进行统计分析。
2 结果与分析
2.1 nZVI对蚯蚓毒性效应的影响
2.1.1 对蚯蚓存活率和生物量的影响
nZVI对蚯蚓的存活率不存在显著性影响(图1a);暴露15 d和45 d,除添加0.05% nZVI处理蚯蚓存活率(均为93.33%)变化不显著外,其他处理蚯蚓存活率随着暴露时间的延长而下降,暴露15 d,0和0.25%nZVI处理中蚯蚓存活率相同,均由93.33%显著降低为45 d的66.67%,但0.50% nZVI处理蚯蚓存活率由93.33%降为66.67%,但差异不显著。可见,nZVI不是导致蚯蚓存活率下降的主要原因,蚯蚓存活率下降可能与暴露时间有关,蚯蚓进入新的生境可能需要付出适应代价。
如图1b所示,同一nZVI浓度下,暴露时间显著影响蚯蚓生物量减少量,整体呈随暴露时间增长生物量减少量增大的趋势。但是,相同暴露时间下不同nZVI浓度对蚯蚓生物量减少量无显著影响。15 d时,0和0.25% nZVI处理中蚯蚓生物量减少量小于0.05%和0.50% nZVI处理; 45 d时,0.50% nZVI处理中生物量减少量最大,平均为0.9514 g,但与其他处理组并无显著差异。
2.1.2 对蚯蚓生理的影响
如图所示2a,在不同暴露阶段,0.50%、0.05%和0.25% nZVI处理蚯蚓体内SOD活性无显著性差异; 但是对照处理中,暴露时间显著影响蚯蚓体内SOD活性(P<0.05); 15 d时,对照处理中蚯蚓体内SOD活性最低,为48.986 U·g-1,0.50%、0.05%和0.25% nZVI处理蚯蚓体内SOD活性显著高于对照处理; 30 d时,0.50%、0.05%和0.25% nZVI处理中蚯蚓体内SOD活性与15 d相比显著降低,而对照处理蚯蚓体内SOD活性升高,但此时不同处理之间无显著性差异; 45 d时,nZVI浓度影响蚯蚓体内SOD活性,0.50% nZVI处理蚯蚓体内SOD活性最高,为147.117 U·g-1,显著高于0.25% nZVI处理(P<0.05)。
由图2b所示,蚯蚓暴露在不同浓度nZVI下,体内CAT活性随暴露时间基本呈现先升高后降低的趋势。0.25%和0.50% nZVI处理中,暴露时间显著影响蚯蚓体内CAT活性(P<0.05); 30 d和45 d时,nZVI的浓度显著影响蚯蚓体内CAT活性(P<0.05)。15 d和45 d,0.25% nZVI处理中蚯蚓体内CAT活性均最高,分别为132.513 U·g-1和280.3167 U·g-1。0.50%nZVI处理蚯蚓体内CAT活性随暴露时间呈现急剧升高后迅速下降趋势,30 d蚯蚓体内CAT活性最高,为379.702 U·g-1。
如图2c和2d所示,相同暴露时间下,nZVI浓度对蚯蚓体内MDA和Pro含量无显著影响。对照处理中15 d蚯蚓体内MDA含量显著低于45 d(P<0.05),在处理时间内各处理蚯蚓体内MDA含量差异不显著。相同nZVI浓度下,蚯蚓体内Pro含量整体呈先降低后升高趋势,但差异均不显著。
本研究通过暴露45 d蚯蚓相关指标进行了相关分析(表1)。从表1可以看出,蚯蚓存活率与生物量减少量呈显著负相关,与其他指标不相关。从本相关分析可以看出,随着蚯蚓存活率增加,生物量减少量显著降低,也就是说,蚯蚓生物量随着存活率增加而显著增大。
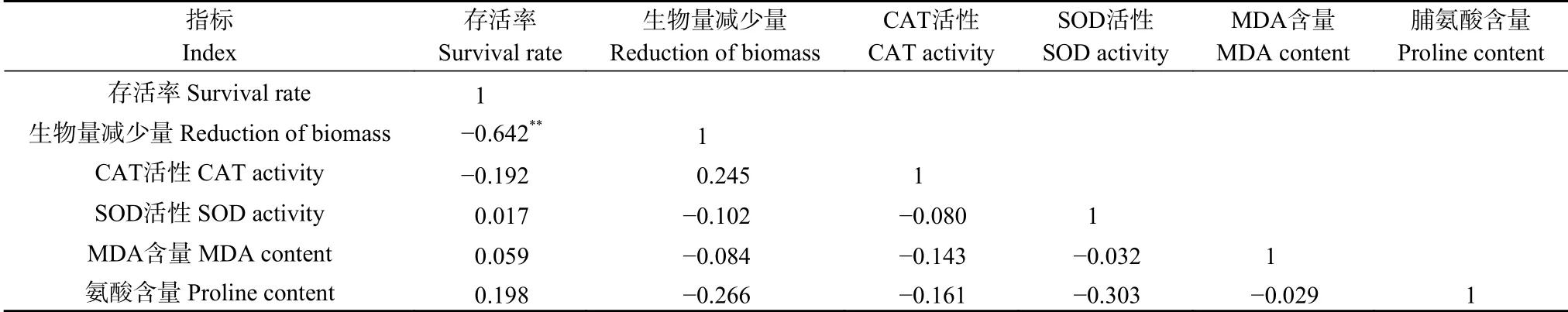
表1 纳米零价铁(nZVI)暴露45 d后蚯蚓指标间的相关分析(R值)Table 1 Correlation analysis of earthworm indicators after 45 days of exposure to nano-zero-valent iron(nZVI)(R value)
2.2 nZVI对土壤微生物的影响
基于OUT水平的Sobs指数和Good-coverage指数的结果构建稀释曲线表明,各样本的Sobs指数随测序深度的加深逐渐趋于平缓,nZVI和蚯蚓对Goodcoverage指数不存在显著影响,所有处理组Goodcoverage指数均大于88%,从而说明样本测序所得数据合理,N50指示的tag测序长度可覆盖土壤中V3-V4区域中的细菌,具有可靠性。
蚯蚓和nZVI对土壤细菌丰度与多样性的影响如表2所示。蚯蚓和nZVI浓度不会显著影响土壤中微生物多样性指数(Shannon指数、Simpson指数)和丰度指数(Ace指数、Chao指数)。无蚯蚓介导下,土壤细菌多样性指数和丰度指数与nZVI处理浓度无关,其中0.50% nZVI处理中,土壤细菌多样性指数和丰度指数均为最大值,与对照相比差异不显著; 蚯蚓介导下,0.05% nZVI处理中,土壤微生物丰度指数高于其他处理,Ace指数和Chao指数分别为3242.72和3197.37,与对照差异不显著。可见,试验各处理nZVI对土壤-蚯蚓生态系统中土壤微生物组成、多样性和丰度不产生负面影响,不会破坏土壤中微生物的生态。
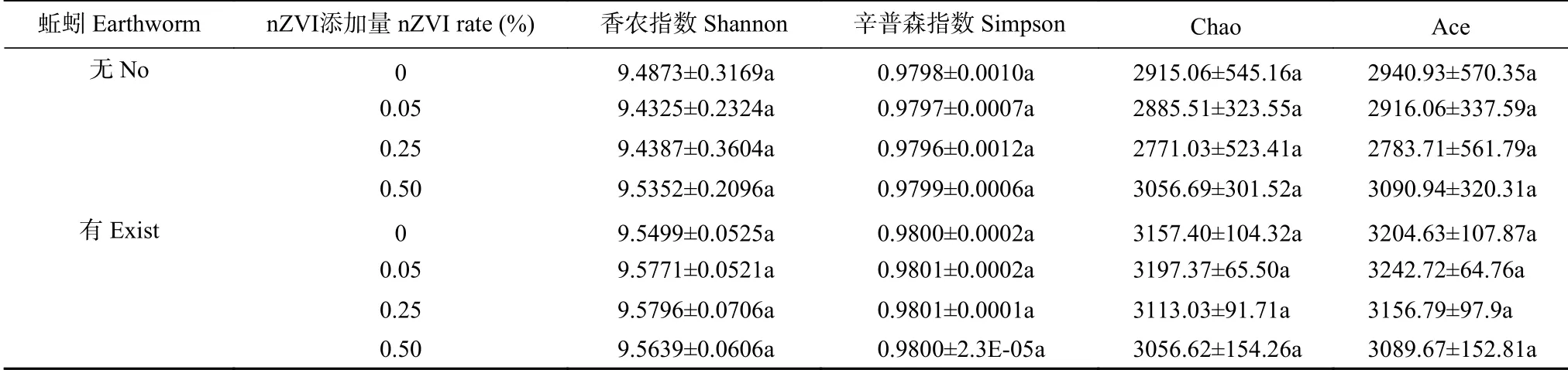
表2 不同添加量纳米零价铁(nZVI)和蚯蚓对土壤细菌丰度和多样性的影响Table 2 Effects of nano-zero-valent iron(nZVI)on abundance and diversity of soil bacteria(16S rRNA gene)(97% similarity level)
对试验第45 d的土壤样品通过高通量测序对16S r DNA V3-V4区土壤细菌进行分析,总结土壤细菌群落结构特征,结果如图3所示。在门水平下土壤中超过99%的细菌均已分类,主要包括浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、Pates-cibacteria、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、其他菌门和非分类菌门。其中浮霉菌门、变形菌门、酸杆菌门、绿弯菌门为主要的优势菌门。不同处理中土壤微生物组成相同,但是每个菌门所占比例和丰度略存差异。nZVI和蚯蚓对绿弯菌门的相对丰度存在显著影响(P<0.05),对其他菌门相对丰度均无显著影响,有无添加蚯蚓的高浓度nZVI处理均不会对土壤细菌门水平的相对丰度产生负面影响。
2.3 nZVI对土壤质量的影响
2.3.1 对土壤团聚体的影响
nZVI对蚯蚓-土壤-微生物系统影响研究中,nZVI和蚯蚓活动对土壤团聚体结构稳定性的影响如图4所示。
从图4A可见,蚯蚓活动和nZVI浓度会极显著影响土壤大团聚体(d>250 μm)质量比(P<0.01),并显著影响小团聚体(53<d<250 μm)质量比(P<0.05); 添加蚯蚓未投加nZVI的土壤中,大团聚体质量比最高,为44.00%; 在蚯蚓和nZVI复合处理中土壤大团聚体质量比高于同浓度处理的单一添加nZVI处理,且不管复合处理还是单一处理,大团聚体质量比随nZVI浓度的升高呈现下降趋势。 在蚯蚓和0.05%nZVI复合处理中,土壤中小团聚体质量比最高,为38.34%; 单一的nZVI处理中,土壤小团聚体质量比随nZVI浓度升高而降低; 蚯蚓-nZVI复合处理中,高浓度的nZVI没有促进土壤中小团聚体的形成,0.50% nZVI处理中小团聚体质量比为33.10%。然而,蚯蚓和nZVI对土壤黏土质量比不存在显著性影响(P=0.3),单一的nZVI处理中,土壤黏土质量比随nZVI浓度升高而增大,但是蚯蚓-nZVI复合处理中黏土质量比不同处理间无显著差异。
蚯蚓和nZVI对土壤团聚体平均重量直径的影响如图4B所示。蚯蚓介导下0.05%、0.25%和0.50%nZVI处理中土壤团聚体平均重量直径分别为515.49、531.25 和536.38,显著高于无蚯蚓的单一nZVI处理及空白处理(P<0.001),蚯蚓活动极显著影响土壤团聚体平均重量直径(P<0.001)。可见,蚯蚓和nZVI复合作用显著提高了土壤团聚体结构的稳定性。
2.3.2 对土壤化学性质的影响
nZVI对蚯蚓-土壤-微生物生态系统影响研究中,nZVI和蚯蚓活动对土壤理化性质的影响如表3所示。nZVI和蚯蚓会显著影响土壤全氮含量和速效磷含量(P<0.01),对土壤有机质含量、碱解氮含量和全磷含量不存在显著性影响。无论单一的nZVI处理还是蚯蚓-nZVI复合处理,土壤有机质含量随nZVI浓度的升高而逐渐减少,且蚯蚓和nZVI复合处理土壤有机质含量低于与之对应的单一nZVI处理; 其中空白处理土壤有机质含量最高,为114.78 g·kg-1,蚯蚓介导下0.50% nZVI处理土壤有机质含量最低,为88.29 g·kg-1。蚯蚓和nZVI复合处理土壤中全磷含量均低于与其对应的单一nZVI处理; 单一nZVI处理中0.25% nZVI处理中土壤全磷含量最高,为1.45 g·kg-1; 蚯蚓和nZVI复合处理0 nZVI处理土壤全磷含量最高,为1.28 g·kg-1。蚯蚓和nZVI复合处理,土壤速效磷含量随nZVI浓度的升高而呈现升高趋势;蚯蚓介导下 0.50% nZVI处理土壤速效磷含量最高,为540.84 mg·kg-1,蚯蚓活动和高浓度nZVI有利于全磷向速效磷转化。单一的nZVI处理中土壤全氮含量随nZVI浓度的升高而逐渐升高,复合处理中呈现相反趋势。无nZVI投加,有、无蚯蚓土壤碱解氮含量分别为392.92 mg·kg-1和395.68 mg·kg-1,高于nZVI各处理土壤碱解氮含量,高浓度nZVI抑制其他组分的氮转化为碱解氮,蚯蚓活动和0.25% nZVI的复合作用会将这种抑制作用降到最低。

表3 纳米零价铁(nZVI)胁迫下蚯蚓活动对土壤化学性质的影响Table 3 Effects of earthworm activities on soil chemical properties under nano-zero-valent iron(nZVI)stress
nZVI和蚯蚓活动对土壤团聚体组成和化学指标的双因素分析结果如表4所示。nZVI极显著影响土壤中大团聚体所占比例、小团聚体所占比例和碱解氮含量(P<0.01); 蚯蚓活动极显著影响土壤中大团聚体所占比例、小团聚体所占比例、全氮含量、速效磷含量和平均重量直径; 蚯蚓和nZVI复合作用显著影响土壤中大团聚体比例(P<0.05)并对速效磷含量产生极显著的影响(P<0.01)。蚯蚓和nZVI复合作用不会造成土壤中碳、氮和磷的损失,对土壤中结构稳定性不会产生显著的负面影响。

表4 纳米零价铁(nZVI)胁迫下蚯蚓活动对土壤质量的双因素方差分析Table 4 Two factor analysis of variance of earthworm activity on soil quality under nano-zero-valent iron(nZVI)stress(P values)
3 讨论
3.1 nZVI影响蚯蚓保护膜系统和渗透调节能力
一般来说,外来物质nZVI可能影响蚯蚓生存、生长、生理和行为等[13-14]。本研究发现,蚯蚓在暴露期间出现死亡与生物量减少等情况,但存活率及生物量减少均与0.50% nZVI浓度(未投加蚯蚓)无显著相关,这表明nZVI赋予的应激和毒性不同于其他金属/类金属,如As、Cu、Pb、Zn[15]或银纳米粒子[16],造成这种差异的原因可能是,铁是土壤中的一种常见元素,也是所有生物所必需的元素。其他研究也表明,nZVI低于500 mg·kg-1时对粉正蚓(Lumbricus rubellus)和赤子爱胜蚓的趋避行为、体重变化和死亡率均无显著影响; 低浓度nZVI污染组(100 mg·kg-1)几乎没有引起赤子爱胜蚓生殖、组织病理学和ANN的明显变化[13]。但是,发现蚯蚓体组织铁浓度的依赖性增加、脂质过氧化和C-nZVI对DNA分子的损伤等产生不同效应; 且nZVI暴露浓度为60 mg·kg-1时诱发蚯蚓的氧化应激和组织铁浓度与DNA损伤有关[17-18]。
本研究表明,与暴露第15 d相比,第45 d蚯蚓体内MDA含量和脯氨酸含量降低,CAT活性和SOD活性升高。可能是蚯蚓在nZVI胁迫下,其保护膜系统和渗透调节能力受到影响,包括抗氧化酶保护(SOD、CAT活性)、脂质过氧化作用(MDA含量)与渗透调节系统(脯氨酸含量)可能发生改变。
尽管铁是许多生物体内酶催化活性的一种必需元素,但过量摄入也会产生严重后果,比如因活性氧(ROS)的形成引起的氧化损伤。从nZVI中释放Fe2+是组织摄取和利用的基础[19]。大量研究表明,nZVI在土壤中发生一系列的氧化还原反应后以Fe2+的形式存在[20],Fe2+进入生物体内的细胞,刺激细胞产生的ROS和自由基(-OH)是破坏细胞结构和细胞膜的主要机制[13,21],最终导致细胞死亡并对生物体产生负面影响。同时,蚯蚓SOD、CAT活性和MDA含量的变化表明,nZVI可诱导赤子爱胜蚓产生氧化应激[14]。蚯蚓体内脯氨酸含量降低,表明在nZVI胁迫下蚯蚓机体受到了损伤,其渗透调节能力下降[22]。然而,随着胁迫时间的延长,nZVI对蚯蚓的负面影响明显减弱。主要原因是随着反应时间的增加,nZVI会发生一系列的化学反应,被氧化为Fe3+并以铁氧化物或铁氢氧化物(如 FeOOH,Fe3O4,α-Fe2O3和β-Fe2O3)的形式存在[23-24],外层的氧化铁薄膜对nZVI颗粒活性存在很大影响,因此会降低其团聚和生物毒性[25]。
此外,虽然铁是生物体内酶催化活性的基本元素,但过量摄入也会产生高活性物质,即通过Fenton反应从超氧化物和过氧化氢(H2O2)中产生羟基自由基(OH·)。自由基连锁反应的刺激有可能通过脂肪酸转化为脂质过氧化氢和羰基化合物的复合物(如MDA)、修饰核酸和组织而引起损伤[26]。此外,脂质过氧化的连锁反应将进一步加剧。本研究表明,蚯蚓体内MDA含量呈现先升高后降低趋势。赤子爱胜蚓MDA含量的升高反映了显著的氧化应激/损伤,这种损伤可能与蛋白质、脂质等细胞成分相互作用,同时从多不饱和脂肪酸的双键中提取一个氢原子,产生一种新的自由基,从而建立链式反应。MDA等是在链式反应中形成的脂质过氧化氢分解后产生的,其结果可能对信号产生影响,然后导致不可逆的亚致死或致死毒性作用[27]。蚯蚓暴露在不同浓度的nZVI下,体内CAT活性随暴露时间呈现先升高后降低的趋势。表明CAT有足够的时间排出过量的H2O2。除此之外,由于SOD的早期激活,CAT活性显著增强,表明两者在蚯蚓体内的互补机制。此外,在暴露初期nZVI对蚯蚓存在一定的负面影响,但随着暴露时间延长,蚯蚓体内抗氧化酶不断清除因环境胁迫产生的ROS和-OH[17],nZVI被氧化与周围物质发生反应[28],使其对蚯蚓负面影响减弱。因此,nZVI不会导致蚯蚓大量死亡、生物量骤减和严重的生理胁迫。
此外,研究表明非纳米ZVI(non-nano-ZVI)颗粒已被证明无毒,不会对蚯蚓产生显著的毒性作用[29]。因此,可以推测本研究中SOD、CAT和MDA等变化主要受纳米特异性影响。此外,研究发现铁离子可能有能力进入细胞,诱导氧化应激并进一步损伤细胞膜[6]。假设的机制可能是nZVI附着在蚯蚓表面,将电子转移到不同的生化物质上,进而对蚯蚓生理产生反应。
3.2 nZVI胁迫下蚯蚓活动改善了土壤质量
本研究表明nZVI胁迫下蚯蚓活动可显著提高土壤团聚体结构的稳定性,土壤中有机质含量降低、全氮含量增加并促进土壤中全磷转化为速效磷。研究表明:蚯蚓活动促进土壤中微团聚体和黏粒结合转化为大团聚体(d>2 mm),其他各粒级团聚体比例均降低,蚯蚓粪便可增加土壤中水稳性团聚体含量[30];赤子爱胜蚓、南美岸蚓(Pontoscolex corethrurus)、壮伟远盲蚓(Amynthas robustus)和参状远盲蚓(A.aspergillum)均可显著提高红壤中大团聚体(d>2000 μm)所占比例(P<0.05)[31]。这可能是由于土壤动物蚯蚓新陈代谢过程中会消耗和排泄植物与残留物,并通过自身运动加速植物和残留物与土壤团聚体融合,促进土壤团聚体的形成和稳定[32]。也有研究表明,蚯蚓活动有利于土壤中不稳定的碳组分吸附在黏土上,促进土壤中微团聚体的形成[33],同时蚯蚓的运动和食用促进土壤有机质的分解,导致土壤中有机质含量减少[34]。随着nZVI浓度的升高,土壤有机质含量降低,其主要原因是蚯蚓分解有机质[34]以及不溶性有机质黏附在nZVI表面的活性位点上[17],土壤团聚体的稳定性提高和土壤质量改善的同时抑制了不利因素导致的土壤中氮的损失[35],因此全氮含量增加。单一的nZVI处理中土壤全氮含量随nZVI浓度的升高而逐渐减少,蚯蚓-nZVI复合处理中呈现相反趋势。这与蚯蚓和微生物分解有机质,促进土壤中的物质向全氮和全磷转化有关[36-37]。
nZVI浓度相同,添加蚯蚓的土壤微生物相对丰度显著提高,主要原因与蚯蚓活动提高土壤团聚体的稳定性并改良土壤环境[38]以及蚯蚓自身通过新陈代谢携带微生物进入土壤系统有关[22]。本研究表明,nZVI暴露浓度不会影响土壤微生物组成、多样性和丰富度。而有研究表明,土壤中芽孢杆菌可促进Fe3+还原并富集于nZVI外层附近,形成更稳定的固体相[25,39]。然而,nZVI会抑制革兰氏阴性菌如酸杆菌属(Acidobacterium)等和革兰氏阳性菌的生长,其根本原因是革兰氏阴性菌细胞壁中没有肽聚糖层[3],nZVI被氧化为Fe2+进入细胞破坏细胞膜和细胞结构[23]; 革兰氏阳性菌细胞壁的主要组成部分是磷酸脂,nZVI与其结合形成铁氧化物沉淀物,堵塞细胞膜的孔隙,阻止其吸收外部环境营养物质,从而导致细菌死亡[2,39-40]。
当然,蚯蚓活动、土壤质量与nZVI之间的关系是复杂相互的。土壤质地和有机质含量强烈影响蚯蚓的行为以及纳米颗粒在土壤中的流动性和有效性[41-42];相反,土壤中纳米颗粒的毒性也会受到黏土和有机质等土壤成分的影响[43]。
4 结论
1)nZVI导致蚯蚓氧化酶保护(SOD、CAT活性)、脂质过氧化作用(MDA含量)与渗透调节系统(脯氨酸含量)改变,但随着暴露时间延长,蚯蚓不断适应环境、nZVI被氧化或与周围物质发生反应,没有显著造成蚯蚓的大量死亡和生物量骤减现象。因此,一定浓度范围内的nZVI对土壤动物不会产生明显的毒性影响。
2)蚯蚓介导下,nZVI胁迫土壤会降低土壤有机质含量,但不会造成土壤氮和磷的损失; 同时蚯蚓活动可显著提高土壤团聚体结构的稳定性,促进土壤全磷向生物有效磷的转化,且不影响土壤微生物多样性。可见,在一定时间一定浓度范围内,nZVI对蚯蚓-微生物-土壤生态系统没有显著的负面影响,同时改善了土壤质量。
