低盐胁迫下饲料中添加α-硫辛酸对凡纳滨对虾生长、抗氧化能力及肠道健康的影响
2021-10-18符振强董扬帆汤上上李二超
符振强 董扬帆 汤上上 周 利 徐 畅 李二超
(海南大学海洋学院,海南省水产种业工程研究中心,海南省热带水生生物技术重点实验室,海口 570228)
凡纳滨对虾(Litopenaeusvannamei)是全球三大养殖对虾品种之一,因具有广盐性特征,能够适应0.5‰~50.0‰的盐度环境,因此近年淡化养殖在内陆不断推广[1-2]。但低盐度养殖环境对凡纳滨对虾的生长[3]、肝胰腺免疫[4]、肠道菌群[5]等方面均会造成较大的负面影响。同时,不同水体条件下的凡纳滨对虾肠道菌群也会发生相应的变化,肠道微生物与机体的营养代谢、健康状态和疾病爆发有着重要联系[6]。而低盐度养殖水体环境的菌群与正常海水之间本就存在差异[7]。在对虾养殖中,添加饲料添加剂是减轻低盐胁迫负面影响的一种有效方法[8]。为了满足现代水产绿色发展的需要,通常会在水产饲料中添加功能性饲料添加剂,以此提高水产动物的生长性能以及抗病能力,并能够使宿主肠道菌群达到最佳的平衡状态,从而维持水产经济物种的健康,提高养殖产量[9]。α-硫辛酸(α-lipoic acid,α-LA)是一类天然的二硫醇抗氧化剂,又被称为硫辛酸或辛酸,其在线粒体脱氢酶反应中起着至关重要的作用,除了能帮助细胞将葡萄糖转换为能量以外,还可起到解毒、抵御皮肤发炎和稳定血糖等作用[10]。此外,α-LA作为一种强抗氧化剂,能够清除体内外的活性氮(RNS)和活性氧(ROS)[11]。有研究证实,一定剂量的α-LA对机体是安全、无毒的,因此可以用作饲养动物的饲料添加剂[12-13]。到目前为止,α-LA在家养禽畜中得到广泛的应用,如鸡[14-16]、猪[17]、羊[18]等;同时也在水产养殖动物如鱼类[19-20]、蟹类[21-22]和贝类[23]中应用并获得良好的效果。尽管α-LA是一种通用抗氧化剂,但其对凡纳滨对虾的生理生化及肠道菌群影响的研究仍然十分有限,且对于凡纳滨对虾在抵抗低盐胁迫中的应用研究尚属空白。因此,本研究旨在探讨α-LA对低盐度(3‰)环境饲养的凡纳滨对虾生长、抗氧化能力和肠道菌群的影响,以期为内陆低盐度凡纳滨对虾养殖提供改善生长性能和减轻环境胁迫压力的实用解决方案,提高凡纳滨对虾淡水养殖的产量和规模。
1 材料与方法
1.1 试验饲料
α-LA,纯度>99%。参照Li等[24],配制以鱼粉和豆粕作为蛋白质源,以鱼油、豆油、胆固醇和卵磷脂作为脂肪源,以小麦淀粉作为糖源的4种等氮等能、粗蛋白质含量约为35%、粗脂肪含量约为9%的试验饲料。试验饲料组成见表1,营养水平见Li等[24]。饲料原料经粉碎机粉碎后过80目网筛,将筛下物按饲料组成进行配比并逐级充分混合均匀,在基础饲料组成水平的基础上分别称量0、0.3、0.6、1.2 g/kg的α-LA并加入到饲料的油脂中,用玻璃棒搅拌均匀溶解后,倒入混匀的饲料原料中制成4种不同α-LA含量的试验饲料。与油脂混合后过20目网筛,将油脂团打散后混合均匀,按照30%的比例添加双蒸水,通过搅拌器搅拌均匀后通过双螺旋压条机(F-26,广东华工光机电科技有限公司)挤压成条,自然通风处阴干至水分约为10%后,粉碎过20、16和12目的网筛,制成不同直径的沉性颗粒料,标记分装于自封袋,放入-20 ℃冰箱储存备用。
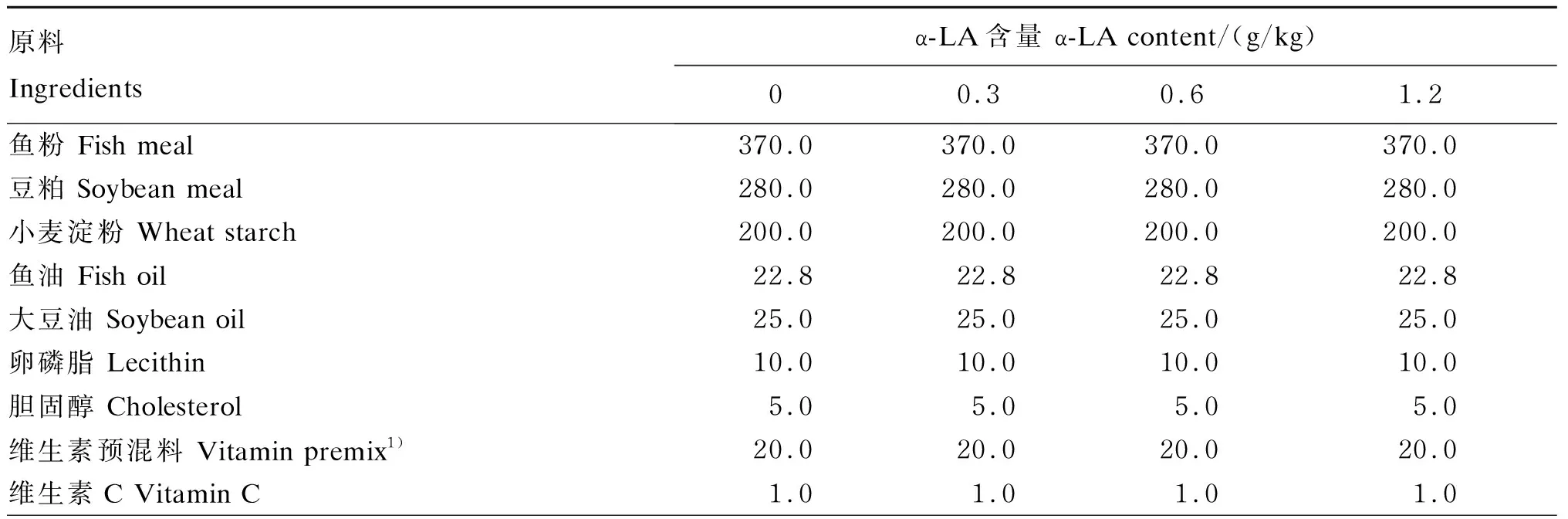
表1 试验饲料组成(干物质基础)Table 1 Composition of experimental diets (DM basis) g/kg

续表1原料Ingredientsα-LA含量 α-LA content/(g/kg)00.30.61.2矿物质预混料 Mineral premix2)5.0 5.0 5.0 5.0 羧甲基纤维素钠 Sodium carboxymethyl cellulose30.0 30.0 30.0 30.0 纤维素 Cellulose 11.2 10.9 10.6 10.0 α-硫辛酸 α-lipoic acid0.3 0.6 1.2 碳酸钙 CaCO3 20.0 20.0 20.0 20.0 合计 Total1 000.01 000.01 000.01 000.0
1.2 试验设计与饲养管理
凡纳滨对虾取自海南省儋州市某幼虾繁育基地。试验开始前对凡纳滨对虾幼虾进行为期2周的暂养,暂养期间将对虾分成2部分,盐度均保持在25‰。通过添加充分曝气、紫外消毒的淡水到过滤消毒过的天然海水中,逐渐降低养殖水体盐度,最终将对虾的养殖水体盐度分别控制为25‰和3‰。
选取体质健壮、初始体重为(0.061±0.005) g的幼虾1 000尾,分别按照暂养水体盐度将幼虾随机平均分配到20个玻璃养殖箱(110 cm×80 cm×40 cm)内,其中4个养殖箱水体盐度为25‰,16个养殖箱水体盐度为3‰。试验设置2个对照组(25‰海水对照组和3‰低盐对照组)和3‰盐度下3个α-LA添加水平(0.3、0.6、1.2 g/kg)的试验组,每组设置4个重复,每个重复50尾幼虾。
养殖过程中,25‰海水对照组和3‰低盐对照组全程投喂基础饲料,另外3个试验组在3‰水体盐度下分别投喂含0.3、0.6、1.2 g/kg α-LA的试验饲料。试验期间,每日于08:00、14:00、20:00以5%对虾重量定量投喂,残饵和粪便及时用虹吸管进行清理。试验周期为8周,每天定量更换1/3养殖水体,使水体保持pH为7.5~7.9,水温为26~30 ℃,溶解氧含量≥6.4 mg/L,总氨氮含量<0.02 mg/L。
1.3 样品采集
养殖结束后,对虾禁食24 h后进行冰浴麻醉,统计各个养殖箱内对虾数量、体长和体重,用以计算存活率(survival rate,SR)、增重率(weight gain rate,WGR)、和肥满度(condition factor,CF);快速分离对虾肝胰腺组织并进行称重,以计算肝体指数(hepatosomatic index,HSI);肝胰腺和肠道组织放入冻存管中经液氮速冻,储存于-80 ℃超低温冰箱,用以生化分析及肠道菌群结构分析。同时,于每个养殖箱中随机抽取3只对虾,收集中肠组织,使用4%多聚甲醛溶液固定,以备制作肠道组织切片,观察肠道组织学响应。
1.4 指标测定
1.4.1 生长性能
增重率、肝体指数、肥满度和存活率采用下列公式进行计算:
增重率(%)=100×(最终体重-
初始体重)/初始体重;
肝体指数(%)=100×湿肝胰腺重量/体重;
肥满度(g/cm3)=体重/体长3;
存活率(%)=100×最终对虾数量/初始对虾数量。
1.4.2 抗氧化能力
随机挑选凡纳滨对虾的肝胰腺样本(n=4),按比例(组织重量∶生理盐水=1∶9)进行组织匀浆,分别检测超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、过氧化氢酶(CAT)活性以及丙二醛(MDA)含量,以上指标均采用南京建成生物工程研究所生产的试剂盒,按说明书所述方法进行测定。
1.4.3 肠道微生物分析
测序得到的原始数据,经拼接、过滤掉干扰序列后得到有效数据。将样本区分后以97%的一致性进行操作分类单元(OTU)聚类和物种分类分析,并对其代表序列进行物种注释。基于OTU进行alpha多样性分析,并对不同样本进行beta多样性分析。使用生物信息学软件包PICRUSt预测肠道菌群的功能谱,并使用京都基因与基因组百科全书(KEGG)进行注释。
1.5 统计分析
运用Excel 2019进行数据整理,运用SPSS 26.0统计软件对3‰低盐度对比下的数据作单因素方差分析(one-way ANOVA)和Duncan氏多重比较变量检验;25‰盐度与3‰盐度处理对比的数据采用t检验(ttest)进行分析,试验结果用“平均值±标准误(mean±SE)”表示,P<0.05表示显著差异,P<0.01表示差异极显著。
2 结 果
2.1 低盐胁迫下饲料中添加α-LA对凡纳滨对虾生长性能的影响
如图1所示,3‰低盐对照组的存活率极显著低于25‰海水对照组(P<0.01),显著低于1.2 g/kg α-LA组(P<0.05)(图1-A)。各组之间的增重率无显著差异(P>0.05)(图1-B)。3‰低盐对照组和0.3、0.6、1.2 g/kg α-LA组的肝体指数均显著低于25‰海水对照组(P<0.05)(图1-C)。1.2 g/kg α-LA组的肥满度显著低于3‰低盐对照组和25‰海水对照组(P<0.05)(图1-D)。
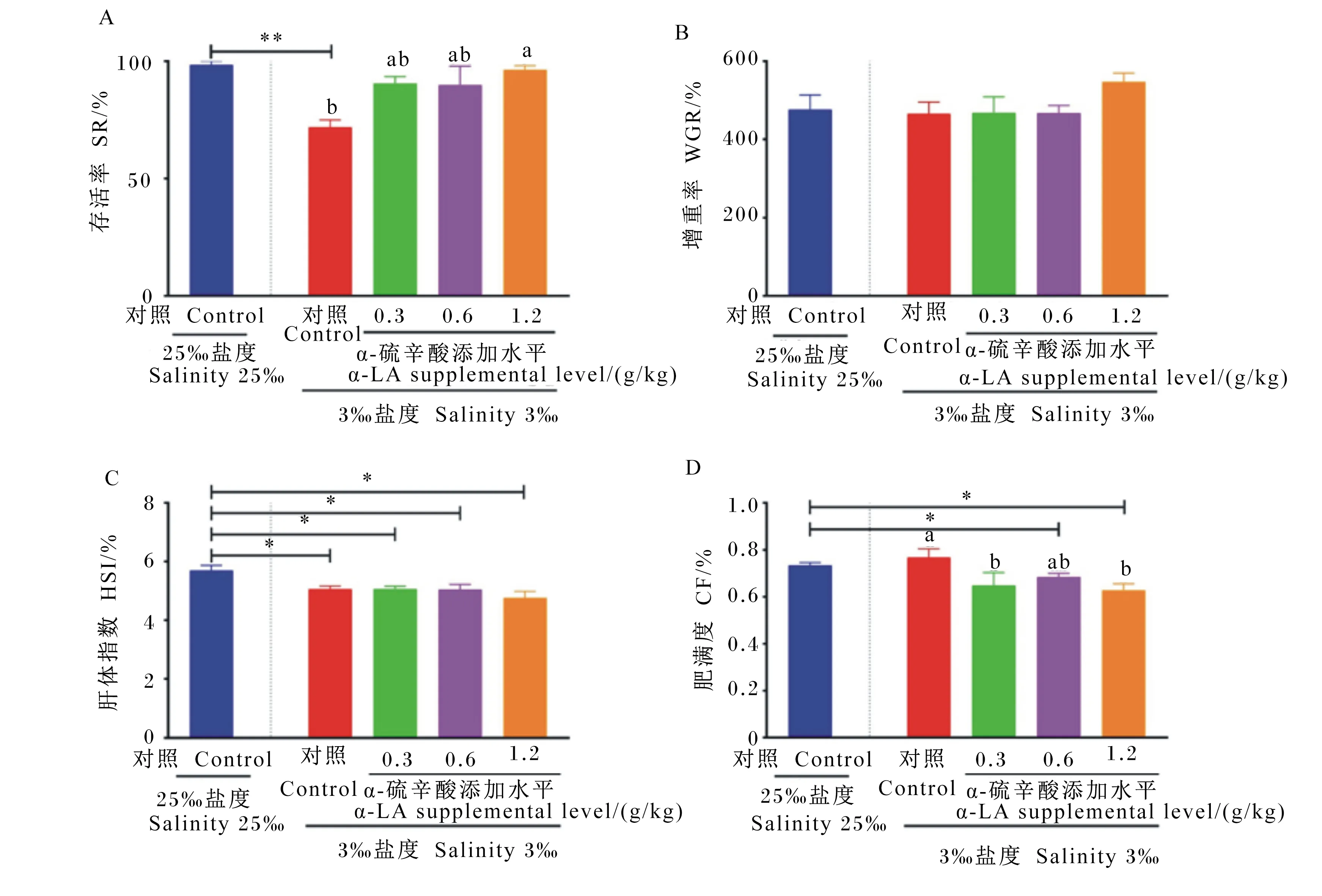
数据柱标注不同小写字母表示差异显著(P<0.05),*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下图同。
2.2 低盐胁迫下饲料中添加α-LA对凡纳滨对虾抗氧化能力的影响
由图2可知,与25‰海水对照组相比,3‰低盐对照组和0.3、0.6 g/kg α-LA组的肝胰腺MDA含量显著增加(P<0.05);1.2 g/kg α-LA组的肝胰腺MDA含量与25‰海水对照组无显著差异(P>0.05),但显著低于3‰低盐对照组(P<0.05)(图2-A)。各组之间的肝胰腺CAT活性无显著差异(P>0.05)(图2-B)。与25‰海水对照组相比,3‰低盐对照组和0.3 g/kg α-LA组的肝胰腺SOD活性极显著降低(P<0.01);与3‰低盐对照组相比,0.6、1.2 g/kg α-LA组的肝胰腺SOD活性显著升高(P<0.05)(图2-C)。与25‰海水对照组相比,3‰低盐对照组和0.3 g/kg α-LA组的肝胰腺LDH活性极显著升高(P<0.01);与3‰低盐对照组相比,1.2 g/kg α-LA组的肝胰腺LDH活性显著降低(P<0.05)(图2-D)。

图2 低盐胁迫下饲料中添加α-LA对凡纳滨对虾抗氧化能力的影响Fig.2 Effects of dietary α-LA on antioxidant capacity of Litopenaeus vannamei under low salinity stress
2.3 低盐胁迫下饲料中添加α-LA对凡纳滨对虾肠道组织学形态的影响
如图3所示,25‰海水对照组、3‰低盐对照组和1.2 g/kg α-LA组的肠道组织学形态存在明显差异。与25‰海水对照组(图3-A、图3-B)相比,3‰低盐对照组(图3-C、图3-D)的肠道黏膜上皮细胞与基底膜存在明显剥离现象;与3‰低盐对照组相比,1.2 g/kg α-LA组(图3-E、图3-F)的肠道壁较平滑。
2.4 低盐胁迫下饲料中添加α-LA对凡纳滨对虾肠道菌群组成的影响
2.4.1 alpha多样性分析
肠道微生物检测共得到1 201 941条高质量序列,平均每个样本有85 028条序列,序列平均长度为412 bp。相似度在97%以上的序列聚类为OTU。如图4-A所示,在肠道菌群丰度指数结果中,25‰海水对照组与3‰低盐对照组的肠道菌群Chao1、ACE指数无显著差异(P>0.05),但是均显著或极显著低于1.2 g/kg α-LA组(P<0.05或P<0.01)。在肠道菌群多样性指数结果中,3‰低盐对照组的肠道菌群Simpson、Shannon指数最低,25‰海水对照组最高,且3‰低盐对照组与1.2 g/kg α-LA组差异显著(P<0.05);25‰海水对照组与3‰低盐对照组差异极显著(P<0.01),与1.2 g/kg α-LA组差异显著(P<0.05)。
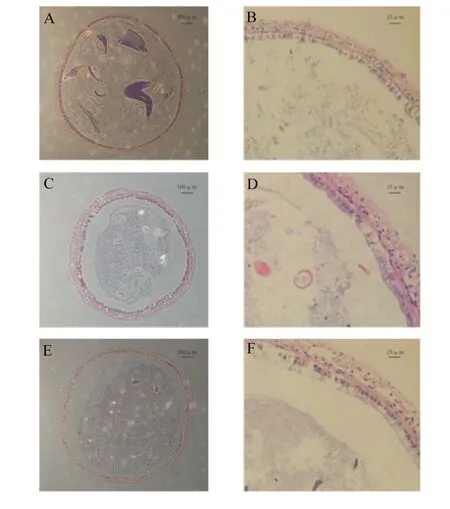
A:25‰海水对照组(100×);B:25‰海水对照组(400×);C:3‰低盐对照组(100×);D:3‰低盐对照组(400×);E:1.2 g/kg α-LA组(100×);F:1.2 g/kg α-LA组(400×)。
2.4.2 beta多样性分析
基于Unweighted Unifrac来进行主坐标分析(PCoA),并选取贡献率最大的主坐标组合进行作图,如图4-B所示,25‰海水对照组(红色正方形)与3‰低盐对照组(蓝色圆形)、1.2g/kg α-LA组(绿色三角形)用不同色块区别开,在主成分1(PC1)方向上所代表的25‰海水对照组与其他2组疑似影响因素占41.15%,表明群落结构差异较大;在主成分2(PC2)方向上3‰低盐对照组与1.2 g/kg α-LA组相聚较近,疑似影响因素仅占12.68%,群落结构差异不明显。PCoA结果表明,低盐处理因素对肠道菌群的影响要高于饲料中添加α-LA对肠道菌群的影响。
2.4.3 Venn图分析
如图4-C所示,由凡纳滨对虾肠道菌群Venn图分析可知,25‰海水对照组、3‰低盐对照组、1.2 g/kg α-LA组的OTU数目分别为307、317、399个,其中,3个试验组共同含有196个相同的OTU,占25‰海水对照组、3‰低盐对照组和1.2 g/kg α-LA组的比例分别为63.84%、61.83%、49.12%。25‰海水对照组、3‰低盐对照组、1.2 g/kg α-LA组特有的OTU数目分别为60、16、89个,分别占总OTU数目的19.54%、0.05%、22.31%。
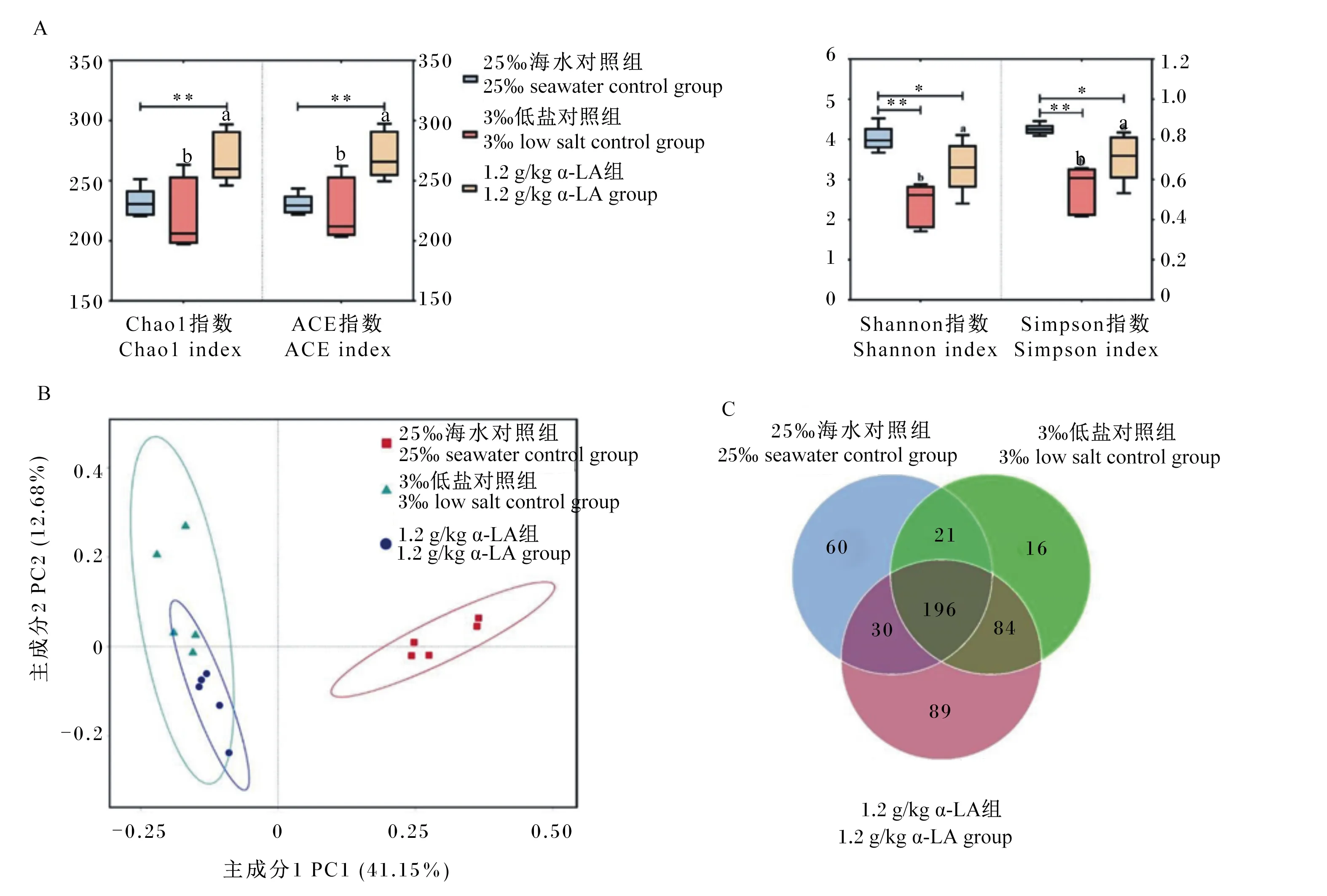
图4 25‰海水对照组、3‰低盐对照组和1.2 g/kg α-LA组凡纳滨对虾肠道菌群多样性差异图Fig.4 Diversity difference map of intestinal microflora of Litopenaeus vannamei in 25‰ seawater control group, 3‰ low salt control group and 1.2 g/kg α-LA group
2.4.4 肠道菌群群落组成分析
如图5-A所示,25‰海水对照组肠道中占主导的优势菌门为变形菌门(76.03%)和拟杆菌门(20.72%);3‰低盐对照组肠道中占主导的优势菌门为拟杆菌门(68.17%)和变形菌门(25.91%);1.2 g/kg α-LA组肠道中占主导的优势菌门为拟杆菌门(61.24%)和变形菌门(29.77%),上述优势菌门总和均占到对应肠道总细菌门类的90%以上。如表2所示,与25‰海水对照组相比,3‰低盐对照组的肠道中拟杆菌门相对丰度显著升高(P<0.05),变形菌门和梭杆菌门相对丰度显著降低(P<0.05)。与3‰低盐对照组相比,1.2 g/kg α-LA组的肠道中厚壁菌门、放线菌门相对丰度显著升高(P<0.05)。

表2 25‰海水对照组、3‰低盐对照组和1.2 g/kg α-LA组凡纳滨对虾肠道菌群门水平组成Table 2 Composition of intestinal microflora at phylum level of Litopenaeus vannamei among 25‰ seawater control group, 3‰ low salt control group and 1.2 g/kg α-LA group %
如图5-B所示,25‰海水对照组肠道中占主导的优势菌属分别为鲁杰氏菌属、Celeribacter、Tenacibaculum和Roseivivax;3‰低盐对照组肠道中占主导的优势菌属分别为Algoriphagus、副球菌属、Rheinheimera;1.2 g/kg α-LA组肠道中对占主导的优势菌属分别为Algoriphagus、副球菌属、黄杆菌属和溶杆菌属。如表3所示,1.2 g/kg α-LA组的肠道中黄杆菌属、Actibacter、Tropicimonas、Shinella相对丰度显著高于25‰海水对照组(P<0.05),Algoriphagus相对丰度显著低于3‰低盐对照组(P<0.05)。3‰低盐对照组的肠道中鲁杰氏菌属、Celeribacter、Tenacibaculum、Roseivivax、Sungkyunkwania、Roseovarius、Hoppeia、Shimia、假交替单胞菌属、Tamlana相对丰度显著低于25‰海水对照组(P<0.05),Algoriphagus、副球菌属、Rheinheimera、Defluviimonas相对丰度显著高于25‰海水对照组(P<0.05)。1.2 g/kg α-LA组的肠道中黄杆菌属、Shinella和Actibacter相对丰度显著高于3‰低盐对照组(P<0.05)。

表3 25‰海水对照组、3‰低盐对照组和1.2 g/kg α-LA组凡纳滨对虾肠道菌群属水平组成Table 3 Composition of intestinal microflora at genus level of Litopenaeus vannamei among 25‰ seawater control group, 3‰ low salt control group and 1.2 g/kg α-LA group %
如图6所示,根据全部样本在肠道菌群属水平的丰度信息及物种注释,筛选丰度在前35的菌属,根据其在每个样本中的丰度信息,从样本和物种2个层面进行聚类,绘制成热图。与3‰低盐对照组相比,1.2 g/kg α-LA组的肠道中希瓦氏菌属、红杆菌属、墨氏菌属相对丰度显著降低(P<0.05),而Donghicola、Haloferula、Xanthomarina、Marivita等菌属相对丰度显著增加(P<0.05)。
2.4.5 PICRUSt肠道菌群功能预测
通过PICRUSt预测,3‰低盐对照组和1.2 g/kg α-LA组的肠道具有显著差异的细菌的相关基因功能列于表4。具有显著差异的肠道微生物富集的KEGG通路分为六大类:新陈代谢(metabolism)、细胞过程(cellular processes)、生物体系统(organismal systems)、人类疾病(human diseases)、环境信息处理(environmental information processing)以及未分类的(unclassified)。其中,肠道菌群编码的大多数差异基因与新陈代谢有关。值得一提的是,与3‰低盐对照组相比,1.2 g/kg α-LA组的肠道微生物编码的基因中与加压素调节的水重吸收(vasopressin-regulated water reabsorption)、胞吞作用(endocytosis)以及FcγR介导的吞噬作用(Fc gamma R-mediated phagocytosis)有关的KEGG途径显著富集(P<0.05)。

表4 低盐胁迫下饲料中添加α-LA对凡纳滨对虾肠道菌群功能预测的相对丰度的影响Table 4 Effects of dietary α-LA on relative abundance of intestinal microflora function prediction of Litopenaeus vannamei under low salinity stress
3 讨 论
3.1 低盐胁迫下饲料中添加α-LA对凡纳滨对虾生长性能的影响
有研究表明,在3‰低盐胁迫下饲养的凡纳滨对虾的增重率和存活率较正常盐度下要低[24]。本研究中,3‰低盐对照组对虾的存活率降低验证了以上观点,而添加了α-LA组中的对虾存活率较3‰低盐对照组相比增加,与5‰海水对照组相比略低但不存在显著差异。与5‰海水对照组相比,低盐胁迫下的所有组别的肝体指数均显著下降,这可能是低盐胁迫造成的结果[1]。摄入含0.3、0.6 g/kg α-LA饲料的凡纳滨对虾生长性能表现良好,饲喂含1.2 g/kg α-LA饲料的凡纳滨对虾肥满度与5‰海水对照组和3‰低盐对照组相比均显著降低,这可能是由于高添加量的α-LA导致,但其他生长指标并未受到显著影响,这与此前有研究提出的1.2 g/kg α-LA会抑制草鱼的食物摄入从而降低最终体重的结果相悖[25]。除却试验对象不同可能导致的作用剂量差异这一原因以外,低盐胁迫下的养殖环境使得饲料中的α-LA发挥抗氧化作用从而出现不同的结果或许是另一原因。除此之外,有报道称在甲壳类动物中华绒螯蟹的饲料中添加1.2或2.4 g/kg α-LA能够使蟹获得最佳的生长性能,且更高剂量的α-LA添加量则会抑制其生长[22];在皱纹盘鲍的研究中也同样得到了类似结论[23]。因此,本研究结果得出,饲料中添加1.2g/kgα-LA并未对凡纳滨对虾的摄食造成抑制,且能够提高凡纳滨对虾在低盐胁迫下的存活率和生长性能。试验中的α-LA高添加量并未与低添加量形成显著差异,因此1.2 g/kg的α-LA添加量可能仍未达到可提升生长表现的最大剂量,但具体的适宜添加量仍需要进一步的探讨。
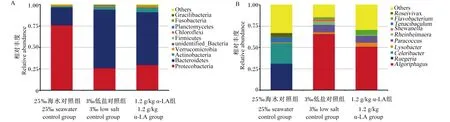
Protecobacteria:变形菌门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Acidobacteria:酸杆菌门;Verrucomicrobia:疣微菌门;Chloroflexi:绿弯菌门;Planctomycetes:浮霉菌门;Fusobacteria:梭杆菌门;unidentified_Bacteria:未知菌门;Ruegeria:鲁杰氏菌属;Lysobacter:溶杆菌属;Paracoccus:副球菌属;Shewanella:希瓦氏菌属;Flavobacterium:黄杆菌属;Others:其他。
3.2 低盐胁迫下饲料中添加α-LA对凡纳滨对虾抗氧化能力的影响
凡纳滨对虾在低盐胁迫下会被诱导氧化产生过量的ROS,导致对虾的细胞和组织被破坏[1,26-27]。由于对虾生理结构简单,因此抗氧化酶在清除过量ROS过程中起到至关重要的作用。α-LA作为一类天然的抗氧化剂,具有非常出色的抗氧化能力[10,28]。为了研究α-LA对凡纳滨对虾低盐胁迫下的保护作用,本试验筛选了SOD、CAT作为评价标准。SOD是一类机体天然存在的超氧自由基清除因子,并且是重要的内源性抗氧化剂,能够将超氧自由基转化为过氧化氢,而CAT则能够将过氧化氢立即分解成完全无害的水,因此SOD和CAT活性增高在清除ROS中起重要作用,可抵抗低盐胁迫带来的氧化应激。Wang等[16]研究发现,α-LA的添加极大提高了肉鸡的SOD活性;Xu等[21-22]的研究也充分证实了一定剂量的α-LA能够提升中华绒螯蟹的SOD活性。而本研究结果与上述报道相似,饲喂0.6、1.2 g/kg α-LA的凡纳滨对虾肝胰腺SOD活性显著高于3‰低盐对照组。值得一提的是,本研究中α-LA的添加未能使凡纳滨对虾的肝胰腺CAT活性有显著变化,但与3‰低盐对照组相比有降低的趋势,这与此前Zhang等[23]对幼鲍饲喂α-LA的研究结果一致。MDA含量是反映机体抗氧化能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度。Bast等[29]研究发现,束缚应激下的大鼠在服用α-LA后,组织MDA含量显著降低至正常水平;在中华绒螯蟹[21]中也得到相似的结果。本研究结果与上述报道类似,1.2 g/kg α-LA组的凡纳滨对虾肝胰腺MDA含量相比低盐胁迫下的其他组别降低。此外,LDH作为广泛存在于水生动物机体组织的一种重要同工酶,组织受损时其活性升高[30]。Hernández-Palomares等[31]报道了凡纳滨对虾在缺氧胁迫下肝胰腺LDH活性会显著升高,但添加了α-LA后肝胰腺LDH活性没有发生变化。本研究中,凡纳滨对虾肝胰腺LDH活性在低盐胁迫下升高,可知肝胰腺组织在低盐胁迫下会造成损伤,但在饲喂了α-LA后,肝胰腺LDH活性得到升高,因此,α-LA能够缓解低盐环境对凡纳滨对虾的负面效应。

Actinobacteria:放线菌门;Bacteroidetes:拟杆菌门;Protecobacteria:变形菌门;Verrucomicrobia:疣微菌门;unidentified_Bacteria:未知细菌门;Ruegeria:鲁杰氏菌属;unidentified_Rhodobacteraceae:未鉴定的红杆菌属;unidentified_Bacteria:未知细菌;Rhodobacter:红杆菌属;Erythrobacter:赤细菌属;Flavobacterium:黄杆菌属;Paracoccus:副球菌属;Microbacterium:微杆菌属;Cytophaga:噬细胞菌属。
以上结果表明,饲料中添加α-LA能够提高凡纳滨对虾抗氧化酶的活性和抗氧化能力,从而减轻其在低盐胁迫下的氧化压力。但α-LA调节凡纳滨对虾应对低盐胁迫的具体的作用机制尚未完全清楚,仍需进一步的深入研究。
3.3 低盐胁迫下饲料中添加α-LA对凡纳滨对虾肠道组织学形态和菌群结构的影响
肠道是凡纳滨对虾行使消化和营养物质吸收的主要器官,完整的肠道组织结构对机体保持良好的消化性能至关重要。环境因素能够直接影响对虾的肠道组织学,一旦肠道结构被破坏,可能会增加病原体入侵宿主的风险。本研究证实,低盐胁迫会导致凡纳滨对虾肠道皱襞细胞受损,肠上皮细胞变短,肌肉层变薄。1.2 g/kg α-LA组的凡纳滨对虾肠道对比3‰低盐对照组,并没有出现组织空泡现象,但其他特征并无明显差异。因此,凡纳滨对虾在摄入含有α-LA的饲料后,能够对低盐胁迫下对虾造成的肠道组织损伤起到一定的修复作用。
肠道微生物的菌群结构组成与宿主的免疫反应、营养吸收密切相关,能够参与宿主各项生命机能的调节[32]。凡纳滨对虾肠道菌群的构成受环境、生长阶段以及饲料等多重因素的影响,健康平衡的肠道菌群有益于对虾的健康生长[33]。王元等[34]的研究表明,凡纳滨对虾在海水和淡水2种养殖模式中呈现的肠道菌群存在较大差异。而在本研究中,与25‰海水对照组相比,3‰低盐对照组的菌群丰度并无显著差异,但菌群多样性降低。Jones等[35]研究表明,肠道菌群多样性降低可能会破坏菌群结构稳态,增加机体致病风险;这是低盐养殖下对虾产量受到制约的因素之一。值得一提的是,饲喂添加了1.2 g/kg α-LA饲料的凡纳滨对虾的肠道菌群丰度和多样性均较3‰低盐对照组有所提升,使得肠道微生态环境保持相对平衡,一定程度上缓解了低盐胁迫导致的肠道菌群氧化应激。在张蓉等[36]关于小鼠的研究中,也发现α-LA具有调整肠道氧化还原状态的功效。
根据先前的报道,变形菌门是海水虾的优势肠道菌群[37-38]。然而在本研究中发现,低盐胁迫使得25‰海水对照组和3‰低盐对照组间的肠道菌群群落结构差异巨大,25‰海水对照组占主导地位的变形菌门在低盐胁迫后被拟杆菌门所取代,肠道菌群结构的失衡使得条件致病菌,如黄杆菌属和希瓦氏菌属等相对丰度上升,极易导致凡纳滨对虾受到病害侵袭。值得一提的是,在饲喂1.2 g/kg α-LA之后,凡纳滨对虾肠道中的希瓦氏菌属相对丰度相比3‰低盐对照组显著下降,黄杆菌属相对丰度显著升高。黄杆菌属是潜在的致病菌,常常造成养殖鱼类的死亡[39],目前尚未清楚α-LA与黄杆菌属之间的联系,还需要进一步的研究。此外,研究表明,Donghicola有很大潜力被用作益生菌[40];Marivita同样被证明能够有效降低条件致病菌弧菌的相对丰度和种类[41]。并且根据这项研究产生的属水平热图发现,1.2 g/kg α-LA组中这2种菌株显著聚集。本研究从肠道菌群的角度探讨了α-LA对凡纳滨对虾的影响,但α-LA影响肠道菌群的机制尚未明晰,仍需要进一步的探究。
3.4 低盐胁迫下饲料中添加α-LA对凡纳滨对虾肠道菌群功能预测的影响
PICRUSt分析显示,在胞吞作用调节途径中,3‰低盐对照组与1.2 g/kg α-LA组之间存在显著差异,由于低盐胁迫下的对虾更容易感染病害,并且胞吞作用还能够通过受体介导的内吞过程将细菌吸收到细胞中,然后在脂质体中将其破坏以充当针对细菌的防御机制,因此胞吞作用对甲壳类动物的抗病毒免疫非常重要[42]。据此,本研究推测,α-LA能够通过控制微生物介导的功能从而参与胞吞作用的调节。此外,1.2 g/kg α-LA组中加压素调节的水重吸收的功能途径显着增加,因此,本研究推测α-LA也能够对机体的渗透压进行调节从而使对虾适应3‰盐度的低盐胁迫。此外,Fcγ受体参与多个免疫系统作用,例如吞噬细胞的吞噬作用、炎症介质释放和抗体依赖性细胞的细胞毒性等[43]。吞噬作用主要是由Fcγ受体在白细胞与吞噬颗粒接触的位点聚集而触发,它是先天免疫反应的重要组成部分,通过对感染性病原体的吞噬和破坏,在宿主防御机制中发挥着关键作用[44]。本研究中,1.2 g/kg α-LA组别与3‰低盐对照组相比,FcγR介导的吞噬作用的预测通路显著富集,因此,本研究推测,α-LA能够通过刺激对虾肠道菌群的Fcγ受体功能聚集从而增强其在低盐胁迫下的免疫能力。
4 结 论
在3‰盐度的低盐胁迫下,凡纳滨对虾肠道组织受损,肠道菌群组成改变。饲料中添加0.6 g/kg α-LA可以提高低盐胁迫下凡纳滨对虾的存活率和抗氧化能力,对肠道损伤具有一定的修复作用,并能够提高肠道菌群组成多样性和功能。因此,α-LA能够作为凡纳滨对虾低盐养殖环境下的有效饲料添加剂,缓解低盐养殖的负效应。
