骨髓间充质干细胞经肾动脉移植对阿霉素慢性肾病大鼠肾脏炎症的影响
2021-10-18李天祎万珊杉杨素萍李嘉琦王家平
李天祎, 杨 扬, 万珊杉, 杨素萍, 李嘉琦, 王家平
慢性肾病(chronic kidney disease,CKD)发生率近年来逐渐增高,我国约有成年患者1.2 亿,患病率高达10.8%,患者经济负担也越来越重[1]。 多项研究表明肾脏免疫介导性炎症是CKD 重要致病因素之一。 目前CKD 治疗手段有限, 仅能延缓肾衰竭进展,达不到根治目的,寻找特异性治疗方法成为亟待解决的问题[2]。 转化医学与再生医学不断兴起,为治疗提供了新思路。 骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)作为再生医学源于中胚层的未分化成体干细胞,具有定向分化为成骨细胞、脂肪细胞等潜在能力,并可通过抑制氧化应激、减少细胞凋亡、促进新毛细血管形成和抑制炎性反应、刺激内源性再生等,减轻肾损伤并促进受损肾组织重构[3]。 目前,BMSC 主要通过尾静脉和肾动脉移植,不同移植方法会对BMSC 归巢数量产生影响,对肾组织修复效果也会产生差异。 本研究旨在评价经肾动脉移植BMSC,对阿霉素CKD大鼠受损肾脏的修复作用及对肾脏炎症的影响。
1 材料与方法
1.1 实验动物与材料
37 只健康清洁级16 周龄雄性Sprague- Dawley(SD)大鼠(购自昆明医科大学实验动物中心),体质量250~300 g,其中2 只4 周龄,用于分离BMSC。胎牛血清(FBS)、低糖培养基(L- DMEM)购自美国Gibco 公司,阿霉素购自美国Sigma 公司,肝素由实验室配置,苏木精- 伊红(HE)染色试剂盒、青链霉素双抗和0.25%胰蛋白酶- 乙二胺四乙酸(EDTA)消化液购自北京索莱宝科技公司,CD3、CD20 单体购自英国Abcam 公司。
1.2 BMSC 分离和培养
2 只4 周龄大鼠脱颈处死, 置于75%乙醇溶液中浸泡10 min,0.9%氯化钠溶液冲洗干净, 于超净台下分离双侧胫骨和股骨,剪去两侧骨骺端,磷酸缓冲液(PBS)冲洗骨髓腔3~5 次,至其变白;将骨髓腔冲洗液置于离心管, 充分吹打混匀后用100 μm细胞筛过滤,1 500 r/min 离心5 min,弃上清液,用含有10% FBS、1%青链霉素双抗的L- DMEM 重悬细胞, 再次吹打均匀后制成单细胞悬液, 接种至T25细胞培养瓶中, 置于37℃、5%CO2细胞培养箱中孵育;48 h 后首次换液并每间歇3 d 换液1 次;待细胞生长融合达75%时,用0.25%胰蛋白酶-EDTA 消化细胞,按1︰4 传代。 取P3 代细胞进行成骨、成脂诱导分化培养,流式细胞仪鉴定细胞表面抗原。
1.3 模型制作和分组
大鼠置于鼠笼,自由饮食饮水1 周。 取24 只制作CKD 动物模型: 全身麻醉后俯卧位固定于超净台,逐层切开左侧肋脊角皮肤和肌肉,暴露左肾,结扎左肾蒂后切除左肾, 待大鼠自然清醒后以3 mg/kg阿霉素经尾静脉注射,并于1 周后取同等剂量阿霉素再次注射,术后每周经眼内眦静脉取血检测肾功能。 参考陆发承等方法[4],以血红蛋白减少,血肌酐、尿素氮升高为造模成功标准。 造模过程中,3 只鼠因失血过多死亡,另随机选取3 只造模后补充。 将造模成功大鼠随机分为CKD 组、经肾动脉移植BMSC组(A 组)和经尾静脉移植BMSC 组(V 组),每组8只;余8 只健康大鼠为正常对照组(N 组),经尾静脉输注等量0.9%氯化钠溶液。
1.4 不同途径移植BMSC
将BMSC 用0.25%胰蛋白酶- EDTA 消化,含10%FBS L-DMEM 培养基终止消化后以1 500 r/min离心,弃上清液,PBS 重悬细胞,充分吹打混匀制成2×106个/mL 单细胞悬液,冰盒保存备用。 A 组大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉后仰卧固定,参考赵桂峰等[5]方法,选择左颈部距颈正中线约0.5 cm 处, 聚维酮碘备皮消毒铺巾后暴露颈部,于正中作一约2.0 cm 纵行切口; 逐层分离皮肤、肌肉组织,充分暴露视野,顿性分离左颈总动脉,眼科剪作T 形切口, 将无菌PE10 导管头斜形剪切塑形后,DSA 动态观察下向足侧推送至右肾动脉开口处,同时间推注肝素;注射少量对比剂确定导管在肾动脉,推注500 μL BMSC 悬液,结扎左颈总动脉后逐层缝合手术切口;术后肌内注射抗生素预防感染,将大鼠置于保温箱中密切观察,待其自然清醒后归笼继续饲养。 V 组大鼠经尾静脉注射等量BMSC 悬液。CKD 组经尾静脉注射等量PBS 溶液。N组经尾静脉注射等量0.9%氯化钠溶液。
1.5 标本采集与检测
观察指标为血肌酐、 血尿素氮及24 h 尿蛋白,肾脏病理切片HE 染色观察病理改变情况。 分别于移植BMSC 后7、14 d, 将各组大鼠放入代谢笼内,收集24 h 尿液,尾静脉采血分离血清,Chemray 240全自动生化分析仪检测24 h 尿蛋白、血肌酐和血尿素氮水平。 14 d 末处死各组大鼠,取肾组织,固定、脱水后制成5 μm 石蜡切片,HE 染色观察肾脏病理形态学变化,免疫组化染色观察CD3、CD20 浸润情况。
1.6 统计学方法
采用SPSS 21.0 软件对数据进行统计学分析。计量资料以均数±标准差(±s)表示,多变量重复测量资料用方差分析, 两两比较用最小显著性差异(LSD)-t 验检,P<0.05 为差异有统计学意义。
2 结果
大鼠BMSC 分离、纯化、鉴定结果显示,倒置相差显微镜下BMSC 呈梭形, 鱼群状或旋涡状贴壁生长;P4 代BMSC 表面抗原CD11b、CD45、CD29、CD90 表达率,分别为2.23%、1.94%、99.98%、99.97%,见图1。
图1 P4 代大鼠BMSC(×20)
N 组大鼠毛色光泽,精神良好;CKD 组、A 组、V组大鼠精神萎靡,毛色微黄,进食量、体质量减少,部分大鼠伴发腹水。 BMSC 移植治疗结果显示,CKD组、A 组、V 组与N 组相比,BMSC 移植后血肌酐、血尿素氮和24 h 尿蛋白均显著升高(P<0.01)。 移植后7、14 d,V 组、A 组血肌酐均较CKD 组降低(P<0.01),A 组在7 d 时下降更为显著(P<0.01);移植后7 d,V 组、A 组血尿素氮较CKD 组均显著下降(P<0.01),A 组变化更为显著(P<0.01),移植后14 d,V 组、A组较CKD 组稍降低,A 组变化更为显著(P<0.01);移植后7、14 d,V 组、A 组24 h 尿蛋白较CKD 组均显著降低(P<0.01),A 组下降更为显著(P<0.01),见表1。
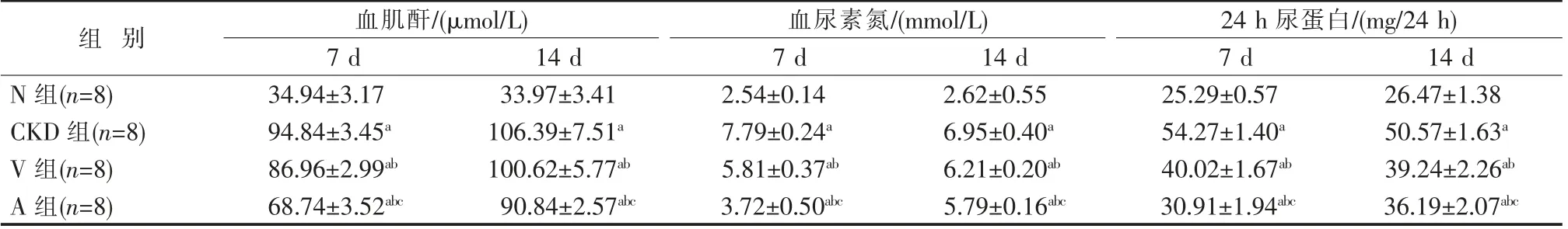
表1 BMSC 移植后各组大鼠血肌酐、血尿素氮、24 h 尿蛋白比较
免疫组化观察结果显示,N 组大鼠CD3、CD20表达为阴性;CKD 组大鼠CD3 在大量肾小管上皮细胞和肾间质中呈强阳性或阳性表达,CD20 在肾间质中呈强阳性表达, 在部分肾小球中呈阳性表达;A 组、V 组大鼠肾间质CD3、CD20 表达较CKD组减轻,但A 组较V 组减轻更为明显,见图2。 大鼠肾脏病理结果显示,N 组可见正常肾小球,肾小球血管襻薄而清晰, 周围肾小管正常;CKD 组肾小球出现萎缩,硬化,局部肾小球毛细血管襻扩张淤血,肾小管结构紊乱, 部分上皮细胞可见空泡样变性,腔内可见蛋白管型,且肾间质内大量炎性细胞浸润;A组、V 组肾脏近曲、远曲小管、髓襻和集合管上皮可见不同程度水肿变性,部分管腔扩张,腔内可见少量透明管型,部分肾小球有轻微萎缩,肾间质内可见少量轻- 中度淋巴细胞和浆细胞浸润的炎性反应,A 组病理形态学变化较V 组更为轻微,见图3。

图2 各组大鼠CD3、CD20 免疫组化染色结果(×200)

图3 各组大鼠肾组织HE 染色结果(×20)
3 讨论
CKD 在临床上主要表现为高血压、水肿、血尿、蛋白尿等,并会对肾组织造成不可逆损伤。 随着发病率逐年上升及治疗手段局限性,CKD 成为增长最快、导致死亡的第三大慢性疾病[6-7]。 目前CKD 模型制作方法有很多, 例如5/6 肾脏切除+阿霉素诱导法、单侧输尿管结扎法、腺嘌呤诱导法等。 本实验采用较为公认的单侧肾脏切除+尾静脉注射阿霉素法制作CKD 模型。 阿霉素常用于多种癌症治疗,对心脏、肝脏、骨髓、胃肠等有较强的不良反应,但经大鼠尾静脉注射后,其不良反应主要累及肾脏[8]。 单侧肾脏切除后,余肾代谢负荷加重,代偿不足,再加上阿霉素不良反应,呈现出肾功能恶化,并在病理上表现为肾小球萎缩、硬化,球囊粘连,局部肾小球毛细血管襻扩张淤血等, 更加符合慢性肾衰竭表现。随着对CKD 研究深入, 逐渐发现其发病与肾脏免疫介导炎症密切相关。 有文献报道,T 淋巴细胞和B淋巴细胞自身反应导致的免疫稳态破坏, 可能使CKD 炎性反应发生在不同部位[9-10]。 T 淋巴细胞介导的细胞免疫是促发肾小球和肾间质炎症的主要原因, 可与树突状细胞相互作用并加重肾小管损伤,而CD3 是T 淋巴细胞特异性表面抗原,且在肾组织中表达程度与肾损害严重程度保持一致,一定程度上可作为评估肾脏损伤严重程度的指标。 此外,CKD 持续性炎性反应与B 淋巴细胞增殖有关,且有研究证明抗CD20 单克隆蛋白(利妥昔单抗)可启动B 细胞免疫溶解过程, 靶向性杀伤B 细胞,阻断其对肾组织的损伤[11],这一结果证实CD20 可作为B 淋巴细胞特异性抗原参与CKD 炎性反应[12]。因此, 可通过观察CD3、CD20 在肾组织中浸润情况,判断肾损伤严重程度。
近年来多项研究表明BMSC 具有修复损伤肾组织的能力,但具体修复机制仍不明确。Aghajani-Nargesi 等[13]研究显示,BMSC 可通过与多种免疫细胞相互作用达到抑制炎性反应的目的。Lindoso 等[14]研究发现,BMSC 可过表达CXCR4 受体或丝氨酸蛋白酶激肽释放酶改善肾功能,并增强肾损伤中抗炎作用。 多项研究证明上述结论,BMSC 具有改善肾小球滤过率、减轻细胞衰老和炎性反应并增加细胞增殖的作用[15]。 然而治疗过程中如何提高BMSC 归巢率和实验动物存活率是亟待解决的问题。 白彝华等[16]经肾动脉移植BMSC 治疗CKD 大鼠,结果发现肾动脉移植组24 h 尿蛋白和尿微量蛋白下降程度与尾静脉移植组相比更为明显,提示经肾动脉移植BMSC 对CKD 受损肾组织修复效果更佳。
本实验通过对比肾动脉和尾静脉两种途径移植BMSC 治疗CKD 大鼠发现, 两种途径对受损肾组织均起到修复作用。 BMSC 移植后7 d,V 组、A 组与CKD 组相比,24 h 尿蛋白均显著降低(P<0.01),直至14 d 末A 组血肌酐、血尿素氮与V 组、CKD 组相比下降显著(P<0.01),证明BMSC 经肾动脉移植的效果优于经尾静脉移植;免疫组化染色结果也显示,CKD 组、A 组、V 组CD3、CD20 均呈强阳性表达,A 组表达较V 组减弱;此外,A 组、V 组炎性浸润均较CKD 组减轻, 其中A 组肾小管和肾间质仅有少量炎性细胞浸润,萎缩的肾小球数量减少,肾小管扩张情况得到改善。 综合以上结果可得出结论,BMSC 可通过抑制炎性反应达到修复CKD 肾组织损伤的目的, 观察时限内经肾动脉移植效果优于经尾静脉移植。
总之,BMSC 通过抑制免疫介导性炎症修复受损肾脏组织,观察时限内经肾动脉途径移植效果优于经尾静脉途径移植。 本实验不足在于,未对炎性因子浸润进行定量分析,BMSC 抑制肾脏炎症的具体机制尚不明朗,而经肾动脉移植BMSC 修复受损肾组织的效果优于经尾静脉移植的原因可能与BMSC 归巢数量有关, 但BMSC 归巢数未加检测。BMSC 通过何种信号通路介导炎性反应及BMSC 归巢的影响因素等,仍需进一步研究证实。
