《2020年心力衰竭合并心房颤动管理的专家共识》要点解读
2021-10-16田芸巫文丽汪汉徐俊波李锦余秀琼蔡琳刘汉雄
田芸 巫文丽 汪汉 徐俊波 李锦 余秀琼 蔡琳 刘汉雄
(西南交通大学附属医院 成都市第三人民医院,四川 成都 610031)
心力衰竭(heart failure,HF)和心房颤动(atrial fibrillation,Af)在临床中都很常见,由于人口老龄化以及心脏代谢异常和其他日益普遍的危险因素的影响越来越大,这两种疾病造成的健康负担也越来越重。这两种疾病常合并存在,带来诊断和治疗方面的挑战。考虑到Af合并HF的预后较差,制定有效和安全的治疗策略对于预防或逆转HF患者Af的发生至关重要。2020年Springer旗下的HeartFailureReviews杂志发表了《心力衰竭合并心房颤动管理的专家共识》[1],现就其部分要点内容做一简要解读。
1 流行病学
流行病学研究表明,Af是HF的常见合并症,存在于24%~44%的急性HF患者、1/3的慢性HF患者和超过一半(57%)的新发HF患者中[2]。在欧洲心脏病学会(ESC)对14 964例急性或慢性HF患者进行的长期登记分析中,Af的总患病率为30%,在射血分数降低性心力衰竭(heart failure with reduced ejection fraction,HFrEF)患者中Af占27%,在射血分数保留性心力衰竭(heart failure with preserved ejection fraction,HFpEF)患者中Af占39%。且Af发作与年龄密切相关,在80岁以上的患者中Af比例为50%[3]。与非HF患者相比,伴有HF的患者的Af发生率高出近10倍。Af是HF住院的另一个诱因,占HF住院人数的19%[4]。值得注意的是,在大多数有Af病史的患者中,HF是住院的主要原因,而HFpEF或中间范围射血分数心力衰竭[即左室射血分数(left ventricular ejection fraction,LVEF)≥40%]的患病率是HFrEF(LVEF<40%)患病率的两倍[5]。HFpEF或HFrEF的存在又增加了Af患者的死亡风险[6],而Af也增加了HFrEF或HFpEF患者的死亡率[7]。
2 病理生理学
Af和HF都可能通过多种机制相互作用,从而形成一种相互依赖的恶性循环,一种疾病会导致另一种疾病的发生与恶化。HF可通过增加充盈压、舒张功能障碍、二尖瓣反流和神经激素激活而导致Af,从而增加心房牵张并诱导心房纤维化和重构[8]。Af反过来由于心室率过快和不规则,心房搏动丧失,从而影响血流动力学和心输出量,即心动过速引起心肌病和神经激素激活,从而产生HF[9]。此外,这两种疾病还有共同的危险因素和致病机制,如衰老、心脏代谢异常和全身炎症,这些都是Af和HF的易患因素[10]。
在过去几年中,“左房心肌病”或“左房疾病”等术语用于描述Af发生前的心房结构、功能和电学异常的状态,并将Af与HF进一步联系在一起(图1)[11]。这种情况考虑是由于Af和HF的共同危险因素、全身条件与遗传易感性等多种因素所致。其特点是:(1)电学重构:动作电位延长,钙转运调控异常,不应期异质性增加等;(2)机械功能障碍:存储、管道和收缩阶段心房形态变形受损等;(3)结构异常:间质纤维化、纤维脂肪替代、炎症浸润和心肌细胞肥大等;(4)全身神经激素和炎症激活等[12]。这些异常先于Af,同时也可能发生在HF的早期,因为其似乎与心室肌的相应改变有关。不论这种情况是否被认为是左房心肌病或心房疾病,它都代表早期干预的“机会窗口”,进而可能预防Af的发生,并且预防HFpEF。然而,如何通过现有的诊断手段识别其存在仍具有挑战性。敏感的诊断方式,如心房形态变形成像、磁共振成像和生物标志物等,可能在这方面会有所帮助。

图1 左房心肌病或心房疾病概念的示意图注:使用Servier Medical Art提供的插图改编,获得Creative Commons Attribution 3.0 Unported Licence许可授权。
3 诊断
Af可能会影响HF的诊断,特别是在LVEF保留的情况下,因这两种情况有许多共同的诊断特征,包括症状、超声心动图异常(即心房增大)和脑钠肽(brain natriuretic peptide,BNP)水平升高。实际上,在最近的HF研究中,有Af时诊断HF的应用BNP截断值高于无Af时。例如,在PARAGON-HF研究中,诊断Af患者的HFpEF需N末端脑钠肽前体(NT-proBNP)>900 pg/mL,而无Af的患者仅需300 pg/mL。考虑到Af患者诊断HFpEF的困难,HFpEF在这些患者中仍有被低估的潜在风险。似乎大多数有呼吸困难和高水平BNP的Af患者也患有HF,因此,除非有其他原因,否则应将其视为HF[13]。所以,Af患者应仔细调查是否存在HF。在这种情况下,可通过评估心脏超声的舒张功能指数、左房容积和应变,以及经Af校正后的BNP水平来促进HF的诊断(即NT-proBNP>660 pg/mL或BNP>240 pg/mL)[14]。近年ESC HF协会提出的HFA-PEFF诊断算法可能在这方面有所帮助[14]。
另一方面,Af也可能在HF中被低估,因为在Af风险增加的个体中可能会频繁发作无症状或亚临床Af[15]。因此,诊断为HF的患者应定期检查Af的情况。对植入式装置患者记录的心律失常事件进行分析,以及应用可穿戴传感器、智能手表和智能手机等新技术,可能对Af的诊断有很大帮助。
4 Af的处理
4.1 心室率控制
Af合并HF的治疗目前并无一个统一的目标心室率,且在不同的学会之间存在差异(表1)。同时,与窦性心律的HF患者相比,合并Af的HF患者心室率对于预后的重要性受到荟萃分析证据的质疑。研究结果已显示心室率不影响预后,使用β受体阻滞剂降低心室率不能给这些患者带来生存益处[16]。在获得更多确凿证据前,对于Af合并HF的患者将心率控制在100~110次/min以下似乎是合理的[17]。根据最新的欧洲心脏节律协会(EHRA)指南,长期控制心室率的治疗方案包括LVEF保留(≥40%)的患者使用地尔硫/维拉帕米、β受体阻滞剂和地高辛;LVEF降低(<40%)的患者使用β受体阻滞剂和地高辛,最初作为单药治疗,如需要可随后进行两种药物的联合治疗,同时采取避免心动过缓的预防措施[18]。

表1 不同学会对有/无HF的Af患者推荐的目标心率 单位:次/min
4.2 节律控制
根据一项随机对照研究(AF-CHF),以及另一项包含25项试验的荟萃分析[19]显示,在射频导管消融时代之前,HF患者的心室率控制与药物节律控制策略之间的比较显示,包括死亡率和卒中在内的结果并无显著差异。相反,在射频导管消融时代到来之后,Af合并HFrEF患者比较射频导管消融与药物心室率控制的小样本研究表明,射频导管消融在改善HF症状、LVEF、峰值耗氧量和生活质量方面优于对照组[20]。AATAC研究是一项针对203例Af合并HFrEF患者的随机试验,研究结果表明,与胺碘酮的药物节律控制相比,射频导管消融治疗显著降低患者死亡和计划外住院的风险[21]。另外,根据小样本的PABA-HF研究进一步证明,射频导管消融在改善HFrEF的运动耐力、生活质量和LVEF方面优于房室结消融联合双心室起搏[22]。CASTLE-AF随机对照研究则包含363例Af合并HFrEF的患者,研究结果显示,射频导管消融治疗与药物治疗(节律或心室率控制)相比,60个月时HF患者全因死亡或住院的风险显著降低[23]。在另一项对1 112例患者的随机数据的汇总分析中,将射频导管消融与任一药物治疗进行比较,消融与较低的全因死亡率和住院率、较低的Af复发率以及较高的LVEF和生活质量的改善有关,但卒中发生率相似[24]。
但另外一些研究则得到相反的结果。在CABANA试验中(仅包含15%的HFrEF患者),研究结果并未显示出射频导管消融组在60个月时与较低的全因死亡、致残卒中、严重出血或心搏骤停以及不良心血管事件发生率等相关的优势[25]。另一项研究的亚组分析表明,有HF病史的Af患者的主要终点降低(HR0.61),与无HF患者的中性效应(HR0.95)相比无显著差异。因此,这些研究结果表明,选择适宜的HF伴Af患者可从射频导管消融中受益,其中又以心律失常诱发心肌病患者受益最大(超反应者)[26]。
有研究表明,在HF患者中,有许多因素可确定Af消融的潜在最佳疗效者,包括非缺血性病因、LVEF≥35%以及左房纤维化程度≤10%[20,23],以及年龄小、新近发作Af、无明显左房扩张或左室纤维化以及无合并症[27]。
一般来说,节律控制策略更适用于Af的发作具有可逆继发原因、明显诱因或部分尽管优化了心室率控制和HF治疗但仍有症状的Af患者。
5 存在Af时HF的处理
存在Af时HF的治疗一般应遵循适用于一般HF患者的相应指南建议。然而,在Af存在的情况下,一些治疗方法的疗效可能会改变。如上所述,之前的荟萃分析表明,β受体阻滞剂可能对伴有Af的HFrEF患者的预后无影响[16]。在一项包含整个LVEF范围的HF患者的荟萃分析显示,在基线为窦性心律的患者中,β受体阻滞剂改善HFrEF患者的LVEF,降低全因死亡率和心血管疾病死亡率,但在HFpEF患者中却无此作用;相反,在基线为Af的患者中,尽管β受体阻滞剂改善了HFrEF患者的LVEF(不是HFpEF患者),但它们对任何LVEF分类患者的存活率并无影响[28]。相反,在PARADIG-HF研究中,与依那普利相比,沙库巴曲/缬沙坦在有/无Af的HFrEF患者中一致地降低了心血管疾病死亡率和因HF再住院率[29]。关于近期研究的钠-葡萄糖共转运蛋白2抑制剂作为潜在的HF治疗药物,在EMPA-REG OUTCOME研究中,涉及患有心血管疾病的2型糖尿病患者,在有/无Af的患者中恩格列净均显著地降低全因死亡和心血管疾病死亡率,以及因HF住院率和新的或恶化的肾脏病风险[30]。
在器械治疗方面,无足够的证据表明心脏再同步化治疗(CRT)对伴有Af的HFrEF患者的疗效以及该治疗的其他适应证(尽管采用了最佳药物治疗,但仍持续有症状;LVEF≤35%,QRS波群时限≥130 ms)[31]。将CRT与药物治疗进行比较的小型研究在Af患者中得出相互矛盾的结果。而RAFT研究的一项亚组分析将单纯使用植入型心律转复除颤器(ICD)或伴CRT(CRT-D)进行比较时,发现CRT并未增加获益,但该CRT-D组的双心室夺获率非常低[32]。ESC指南建议对伴有Af和上述适应证的HFrEF患者推荐使用CRT,推荐级别为Ⅱa类推荐,B级证据,前提是需要有确保双心室夺获率高或预期患者恢复窦性心律的策略[31]。但对于高度房室传导阻滞需心室起搏的HFrEF患者或尽管有药物控制仍持续快心室率(>110次/min)需接受房室结消融的患者,CRT似乎比传统的右心室起搏更有效[31]。在ICD或CRT-D患者中,Af引发的不适当放电也是一个问题,这可通过恰当的装置程控来处理,以确保在较高的心室率的情况下触发电击,并延长识别和治疗之间的延迟时间[33]。
6 结论和未解决的问题
图2概述了HF和Af患者的治疗方案。正如前面强调的,诊断为两种疾病之一的患者,应仔细和定期检查另一种疾病的潜在共存可能。
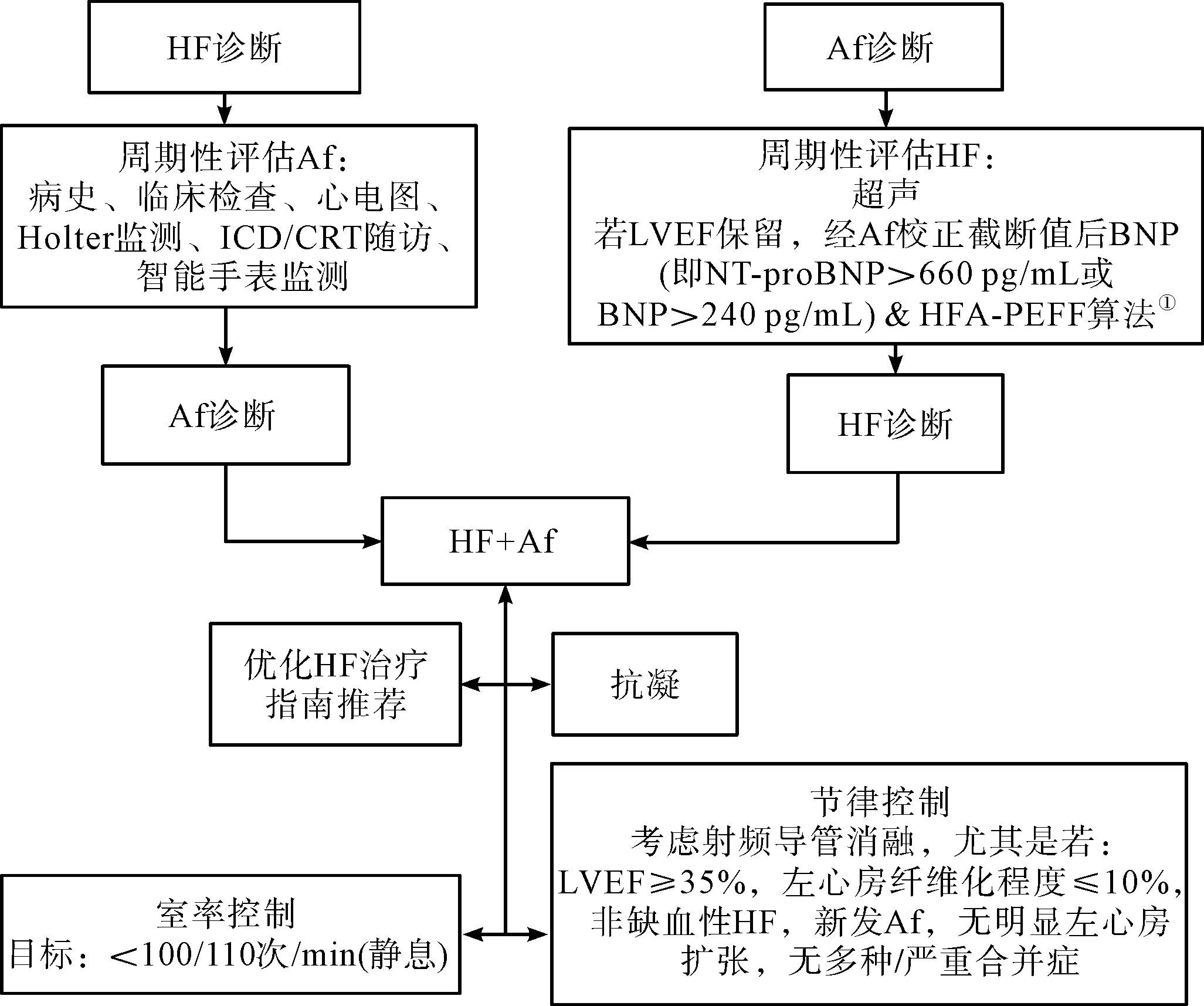
注:①表示出自:Pieske B,et al. Eur Heart J,2019,40(40):3297-3317[14]。图2 HF和Af患者的治疗概述
关于HF和Af之间关联的多个问题仍有待解决(表2)。在流行病学方面,如前所述,考虑到Af患者的常见症状、超声心动图异常和BNP水平,HFpEF诊断似乎被低估。Af特异性BNP截点值诊断HF可能在这方面有所帮助,这在近期涉及HFpEF患者的研究中有所采用。Af也可能在HF中被低估,这是由于临床上无症状的Af发作也很常见。分析植入ICD和CRT的HFrEF患者的记录可能有助于确定这部分患者Af的真实患病率和发病率。
左房心肌病或心房疾病可很好地将HF和Af的病理生理联系起来,并为预防提供了一个“机会窗口”,然而其定义和诊断仍不清楚。先进的影像学手段,例如斑点跟踪心房形态变形情况和心脏磁共振心房组织特征,以及针对与疾病相关的局部和全身异常(如神经激素和炎症激活或纤维化)的生物标志物,也许能更好地了解和识别这些疾病的发病机制。在射频导管消融时代出现了与节律和心室率控制策略相关的其他问题,见表2。

表2 HF患者Af处理中存在的问题
