产γ-聚谷氨酸菌株的筛选与培养基优化
2021-10-15车顺松冉光雨乔宗伟邱俊杰杨雷军毕长富王风青
车顺松,安 蕊,冉光雨,乔宗伟,邱俊杰,吴 杰,杨雷军,毕长富,王风青
(四川轻化工大学生物工程学院,四川宜宾644005)
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是一种由微生物生产的细胞外高分子氨基酸聚合物,由L-谷氨酸(L-Glu)、D-谷氨酸(D-Glu)单体通过酰胺键连接而成[1]。它具有成膜性[2]、可食用性[3]、生物相容性[4]、水溶性[5]、生物可降解性[6]和无毒[7]等特性,广泛用于食品[8]、化妆品[9]、生物医药[10]、农业[11]、环境[12]等领域。
γ-PGA作为食品增稠剂、稳定剂,加入带鱼鱼糜可显著提高带鱼鱼糜的凝胶强度,且对鱼糜的白度值影响较小[13];加入到冰激凌中可以改善油脂固体颗粒的分散度,减少冰晶形成,提高混料黏度,改善口感,提高膨胀率和融化率[14];分子量低于200 kDa的γ-PGA具有极好的抗冻性,其抗冻活性明显高于目前公认的具有高抗冻活性的葡萄糖,对需要反复冻融或者对冷冻敏感的食品有很好的保护作用[15]。γ-PGA水凝胶处理可以抑制香菇贮藏过程中的褐变,抑制PPO活性,延缓维C的降解,控制香菇的失重,保持菇体的含水量,使香菇保持良好的保鲜品质,并延长香菇的贮藏期[16]。γ-聚谷氨酸添加于面包中,可以提高面包在贮藏期中的品质,抑制面包的老化,延长面包的贮藏期[17]。
通过高产γ-PGA菌株的筛选,并对发酵条件经行一系列优化以实现高产γ-PGA。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酸菜水(四川、东北、湖北),黄浆水(湖北、东北),黄水(四川),传统大豆发酵食品(四川、湖北)等。
1.1.2 试剂
CTAB,上海麦克林生化科技有限公司提供;谷氨酸钠,成都市克隆化学药品有限公司提供;其他试剂均为国产分析纯。
1.1.3 培养基及培养条件
(1)固体培养基(LB培养基)。酵母浸粉5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,谷氨酸钠10 g/L,琼脂20 g/L,pH值7.4~7.6。用于产γ-PGA菌种的分离纯化,37℃下培养24 h。
(2)斜面培养基。蛋白胨10 g/L,牛肉浸粉3 g/L,氯化钠5 g/L,琼脂20 g/L。用于菌种保藏,37℃下培养24 h。
(3)种子培养基。蛋白胨10 g/L,牛肉浸粉3 g/L,葡萄糖20 g/L,氯化钠5 g/L。种子培养:装液量50/250 mL,温度37℃,转速150 r/min,摇床培养18 h。
(4)基础发酵培养基。谷氨酸钠40 g/L,蛋白胨5 g/L,葡萄糖50 g/L,氯化钠10 g/L。接种量2%(V/V),装液量50/250 mL,温度37℃,转速150 r/min,摇床培养48 h。
1.2 仪器与设备
THZ-A型气浴恒温振荡器、DHG-9070A型电热恒温鼓风干燥箱,上海助蓝仪器科技有限公司产品;PHS-25型台式酸度计,上海雷磁公司产品;YXQ-75SII型立式压力蒸汽灭菌器、YXQ-LS-18SI型手提式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂产品;752N型紫外可见分光光度计,上海诺科仪器仪表有限公司产品;FA2004N型精密电子天平,杭州万特衡器有限公司产品;R1-TGC-N50型高速离心机,无锡市瑞江分析仪器有限公司产品;H10-50133型生化培养箱,天津宏诺仪器有限公司产品;ZWY-2102型摇床培养箱,太仓市华利达实验设备有限公司产品。
2 试验方法
2.1 菌种筛选
2.1.1 初筛
分别取少量传统大豆发酵食品、黄水、黄浆水、酸菜水,在无菌操作台中用无菌生理盐水稀释,吸取0.1 mL涂布于LB平板,于37℃下恒温培养24 h,挑选出形态大、表面光滑、高黏湿润的单菌落,将挑选出来的单菌落再次在固体分离培养基上进行三区划线,于37℃下恒温培养24 h,挑选出具有相同特点的单菌落,并且接种到斜面上。
2.1.2 复筛
取斜面保藏的初筛菌种,转接入50 mL/250 mL装液量的种子培养液,在温度37℃,转速150 r/min条件下,摇床振荡培养10 h,然后按2%的接种量转接到50 mL/250 mL装液量的酵培养基中,在温度37℃,转速150 r/min条件下,振荡培养48 h,发酵结束后测定γ-PGA的产量。
2.1.3 生长曲线测定
选取复筛菌株中γ-PGA产量最高的菌株接种至50 mL/250 mL装液量的种子培养液,于37℃下以转速150 r/min恒温振荡培养24 h。按2%接种量接种至50 mL/250 mL装液量的种子培养液,37℃下以转速150 r/min恒温振荡培养24 h,每隔2 h取样,于波长600 nm处测定其吸光度,记录数据并绘制其生长曲线。
2.2 菌株鉴定
2.2.1 菌落及菌体形态特征鉴定
(1)菌落形态特征。观察菌株在LB平板上37℃下恒温培养24 h的菌落形态特征。
(2)菌体形态特征。取平板上培养了24 h的菌种进行革兰氏染色,将制备好的样片置于显微镜下观察,拍照记录。
2.2.2 生理生化管鉴定
在无菌操作台中,用接种环从斜面培养基上分别挑取适量菌体于蔗糖、半乳糖、七叶苷、乳糖等21种生化管中,再用灭菌后的棉花团塞住,培养24 h后对比其与初始管的颜色变化,从而鉴别细菌的菌属。
2.2.3 细菌16S DNA鉴定
将复筛中γ-PGA产量最高的菌株送至苏州金唯智生物科技有限公司进行16S DNA测序。
2.2.4 CTAB比浊法测定聚谷氨酸
γ-PGA可与十六烷基三甲基溴化铵(CTAB)的氢氧化钠溶液反应形成混悬液,CTAB溶液质量浓度为2 g/L,反应温度为环境温度,络合时间为3 min,于波长250 nm处测定其吸光度[18]。
(1)CTAB-NaOH溶液的配置。准确称取5 g NaOH于烧杯中,加入少量纯净水完全溶解后转入100 mL容量瓶中,用纯净水定容至100 mL,再准确称取0.2 g CTAB于NaOH溶液中,待药品完全溶解后,装入小药瓶中低温干燥环境下放置备用。
(2)γ-PGA标准曲线的测定。准确称取0.010 0 g γ-PGA标准品,用蒸馏水或去离子水定容至50 mL,配置成200 μg/mL的γ-PGA母液,用母液稀释配置成5,10,15,20,25,30,35,40 μg/mL的γ-PGA溶液,分别与2 g/L的CTAB溶液(用5%的NaOH溶液配制)1∶1混合,反应3 min左右,于波长250 nm处测定其吸光度,以γ-PGA质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
(3)γ-PGA粗品测定。将发酵液稀释后,取2 mL稀释的发酵液加入2 mL离心管中,以转速12 000 r/min离心3 min后取出,加入等体积十六烷基三甲基溴化铵(CTAB)的氢氧化钠溶液反应形成混悬液,络合3 min左右于波长250 nm处测定吸光度,并带入标准曲线得出实际产量。
2.3 γ-PGA液体发酵培养基的优化
2.3.1 氮源种类及浓度对γ-PGA产量的影响
在基础发酵培养基中分别加入5 g/L的蛋白胨、大豆分离蛋白、胰蛋白酶胨、牛肉浸粉、酵母浸粉、硫酸铵、氯化铵、柠檬酸三铵、尿素为氮源,其他成分与基础发酵培养基一致,50 mL/250 mL装液量,2%接种量,37℃下以转速150 r/min摇床培养48 h后测定发酵液中γ-PGA的含量,确定最优氮源种类。最优种类氮源进行3,4,5,6,7,8 g/L的梯度培养,确定最佳氮源质量浓度。
2.3.2 碳源的种类及质量浓度对γ-PGA产量的影响
在基础发酵培养基中分别加入50 g/L的葡萄糖、糊精、玉米糖化液、蔗糖、尿素、柠檬酸三铵为碳源,氮源以优化后为准,其他成分与基础发酵培养基一致,50 mL/250 mL装液量,2%接种量,37℃下以转速150 r/min摇床培养48 h后测定发酵液中γ-PGA的含量,确定最优碳源,最优碳源进行30,40,50,60,70,80 g/L梯度培养,确定最佳碳源质量浓度。
2.3.3 前提物谷氨酸钠质量浓度对γ-PGA产量的影响
在基础培养基中分别加入20,30,40,50,60,70 g/L的谷氨酸钠,碳源、氮源以优化后的为准,其他成分与基础发酵培养基一致,培养方法同上,测定其最佳质量浓度。
2.3.4 氯化钠质量浓度对γ-PGA产量的影响
在基础培养基中分别加入6,8,10,12,14,16 g/L的氯化钠,碳源、氮源、前提物以优化后为准,培养方法同上,测定其最佳质量浓度。
2.3.5 金属离子的种类及质量浓度对γ-PGA产量的影响
在优化后的培养基中分别梯度添加如下3种金属离子:
(1)硫酸镁(W/V)。0.05%,0.10%,0.15%,0.20%,0.25%;
(2)磷酸氢二钾。0.4%,0.6%,0.8%,1.0%,1.2%,1.4%;
(3)硫酸锰。0.002%,0.004%,0.006%,0.008%,0.010%,0.012%。
50 mL/250 mL装液量,2%接种量,150 r/min摇床,于37℃下培养48 h后测定发酵液γ-PGA含量,确定最优金属离子种类及质量浓度。
2.3.6 最佳发酵时间的确定
在优化后的培养基的基础上,50 mL/250mL装液量,分别接入2%的种子液,转速150 r/min,37℃下培养,分别培养24,48,72,96 h,测定γ-PGA含量,确定最佳发酵时间。
3 结果与分析
3.1 γ-PGA生产菌的筛选与鉴定
3.1.1 γ-PGA的生产菌筛选
从传统大豆发酵食品、黄水、黄浆水、酸菜水等多种材料中,经过平板初筛得到8株菌落直径大而湿润、黏稠的菌株。初筛菌株发酵48 h,测γ-PGA的产量,γ-PGA产量最高得菌株即为目标菌株。
菌株筛选见图1。
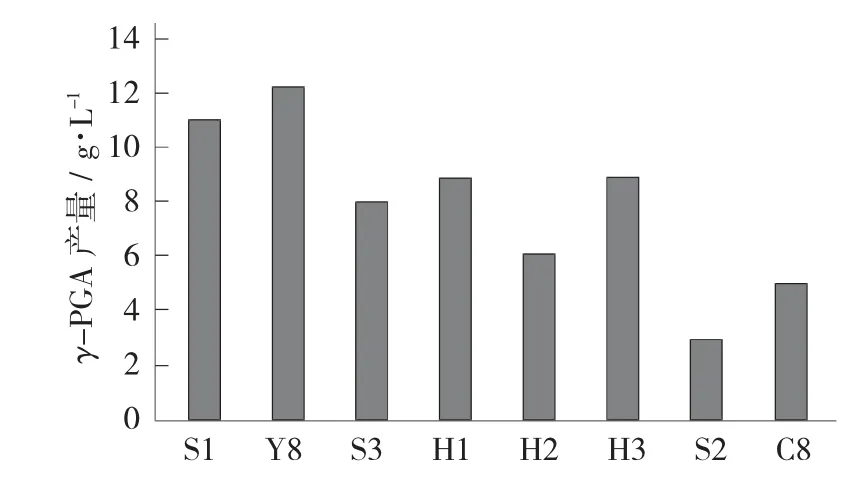
图1 菌株筛选
3.1.2 菌株Y8的鉴定
(1)菌株Y8的菌落和菌体形态特征。对菌株Y8的菌落形态、革兰氏染色、芽孢染色等特征进行了观察。该菌株在LB平板上培养24 h后,菌落呈无色到乳白色、半透明、圆形、突起、边缘齐整,直径4~5 mm,表面光滑、黏稠、能拉丝。显微镜观察后,其菌体个体较大,直杆状,大小一般在1.7~2.1×0.5~0.8 μm,革兰氏染色阳性,有芽孢。
3.1.3 生理生化管鉴定结果
对YB18菌株菌种进行细胞形态观察及生理生化特征试验,该菌株细胞形态为杆状、革兰氏染色阳性,可形成芽孢、孢囊不膨大,接触酶阳性、氧化酶阳性,能够利用α-D-葡萄糖、明胶、D-麦芽糖、D-果糖-6-磷酸、D-海藻糖、D-半乳糖醛酸、半乳糖酸内酯、葡萄糖醛酰胺、β-甲基-D-葡糖苷、N-乙酰-D-葡糖胺、蔗糖、龙胆二糖、甘油、肌醇、D-甘露醇、D-山梨醇、松三糖、D-甘露糖、D-果糖、L-丙氨酸、L-精氨酸、L-天冬氨酸、L-谷氨酸、L-焦谷氨酸、L-丝氨酸、果胶、D-葡糖酸、粘酸、糖质酸、L-乳酸、柠檬酸、L-苹果酸、糊精、甲酸生长,不能利用D-葡萄糖-6-磷酸、D-纤维二糖、D-葡萄糖醛酸、甘氨酸-L-脯氨酸、β-羟基-D,L-丁酸、D-半乳糖、肌苷、L-鼠李糖、L-岩藻糖、D-岩藻糖、D-水杨苷、水苏糖、D-棉子糖、α-D-乳糖、D-蜜二糖、乙酸、丙酸、乙酰乙酸、α-丁酮酸、α-羟丁酸、γ-氨基丁酸生长,对萘啶酸、万古霉素、林可霉素、1%乳酸钠、醋竹桃霉素、十四烷硫酸钠敏感。
生理管鉴定结果见表1。

表1 生理管鉴定结果
参照《伯杰氏细菌鉴定手册》第8版对芽孢杆菌的阐述结合对该菌株的观察,确定该菌为芽孢杆菌属。
3.1.4 分子生物学鉴定
菌株16S rDNA测序及比对结果如下:


所测菌株与数据库里对比相似度最高的是:Bacillus subtilis。将此菌株命名为枯草芽孢杆菌Bacillus subtilisYB18。
3.2 培养优化
3.2.1 γ-PGA生产菌生长曲线的测定
选取复筛菌株中γ-PGA产量最高的菌株接种至50 mL/250 mL装液量的种子培养液,于37℃下以转速150 r/min恒温振荡培养24 h。按2%接种量接种至50 mL/250 mL装液量的种子培养液,于37℃下以转速150 r/min恒温振荡培养24 h,每隔2 h取样,于波长600 nm处测定其吸光度,记录数据并绘制其生长曲线。
由图2可知,在0~14 h,菌体数量主要呈上升趋势,10 h后进入生长对数期,12 h后逐渐进入稳定期,14 h时达到最大值,之后进入衰亡期,结果表明种子液的培养时间为10 h。
γ-PGA生产菌的生长曲线见图2。

图2 γ-PGA生产菌的生长曲线
3.2.2 氮源种类及质量浓度对γ-PGA产量的影响
培养基不同种类氮源质量浓度均为5 g/L,其他成分及质量浓度与基础发酵培养基相同。接种量2%,装液量50 mL/250 mL,于37℃下以转速150 r/min恒温振荡培养48 h,测定不同物质作为氮源时发酵液中γ-PGA的含量。
氮源种类对γ-PGA产量的影响见图3。

图3 氮源种类对γ-PGA产量的影响
由图3可知,牛肉浸粉作为氮源的发酵液中γ-PGA产量最高,由此可见牛肉浸粉为最优氮源。
基础发酵培养基加入牛肉浸粉作为氮源,设置牛肉浸粉质量浓度梯度,其他条件同上,培养48 h,测定γ-PGA产量,得牛肉浸粉质量浓度与γ-PGA产量关系图。
牛肉浸粉质量浓度对γ-PGA产量的影响见图4。
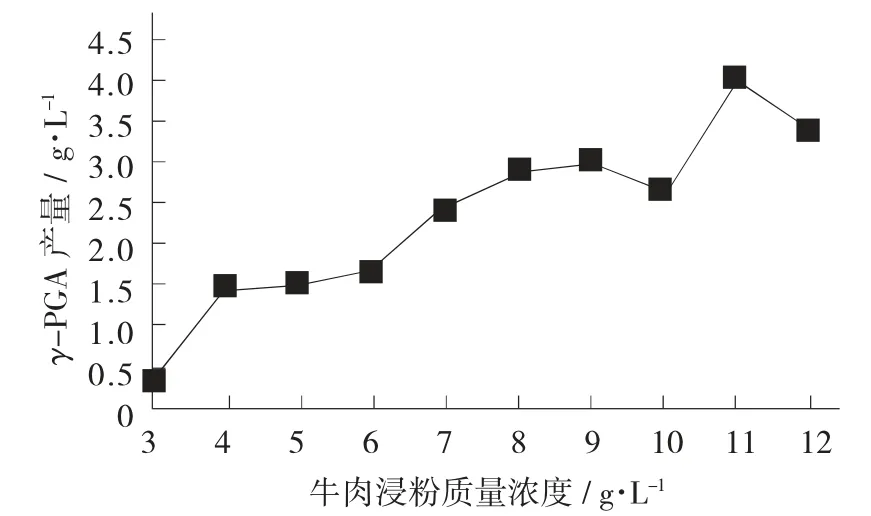
图4 牛肉浸粉质量浓度对γ-PGA产量的影响
γ-PGA产量在牛肉浸粉质量浓度为11g/L时出现最大值4.05 g/L,之后产量下降,由此可得牛肉浸粉最优质量浓度为11 g/L。
3.2.3 碳源种类及质量浓度对γ-PGA产量的影响
在基础发酵培养基中分别加入50g/L的葡萄糖、糊精、玉米糖化液、蔗糖、尿素、柠檬酸三铵为碳源,氮源以优化后为准,其他成分与基础发酵培养基一致,50 mL/250 mL装液量,2%接种量,37℃下以转速150 r/min摇床培养48 h后测定发酵液中γ-PGA的含量,确定最优碳源。
碳源种类对γ-PGA产量的影响见图5。
由图5可知,其中玉米糖化液作为碳源时γ-PGA产量最大,最大产量为1.02 g/L,由此可得最优碳源为玉米糖化液。

图5 碳源种类对γ-PGA产量的影响
以玉米糖化液为碳源,设置玉米糖化液质量浓度梯度,相同条件培养48 h,测定γ-PGA产量。
玉米糖化液质量浓度对γ-PGA产量的影响见图6。
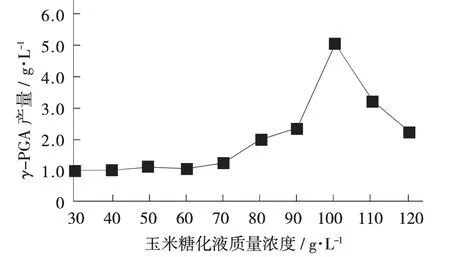
图6 玉米糖化液质量浓度对γ-PGA产量的影响
由图6可知,玉米糖化液质量浓度为100g/L时γ-PGA产量最大,最大产量为5.04g/L,由此可得玉米糖化液最优质量浓度为100g/L。
3.2.4 前体物谷氨酸钠质量浓度对γ-PGA产量的影响
在基础培养基中分别加入20,30,40,50,60,70 g/L的谷氨酸钠,碳源、氮源以优化后的为准,其他成分与基础发酵培养基一致,培养方法如前,测定其最佳质量浓度,48 h后测定γ-PGA产量。
前体物质量浓度对γ-PGA产量的影响见图7。

图7 前体物质量浓度对γ-PGA产量的影响
由图7可知,前体物质量浓度为30 g/L时γ-PGA产量最大,最大产量为5.25 g/L,由此可得前体物聚氨酸钠最优质量浓度为30 g/L。
3.2.5 氯化钠质量浓度对γ-PGA产量的影响
在基础培养基中分别加入6,8,10,12,14,16 g/L的氯化钠,碳源、氮源、前提物以优化后为准,培养方法同上,48 h后测定γ-PGA产量。
氯化钠质量浓度对γ-PGA产量的影响见图8。

图8 氯化钠质量浓度对γ-PGA产量的影响
由图8可知,氯化钠浓度为10 g/L时γ-PGA产量最大,5.87 g/L,由此可得氯化钠最优质量浓度为10 g/L。
3.2.6 金属离子的种类及质量浓度对γ-PGA产量的影响
在以上培养基优化的基础上,选择硫酸镁、磷酸氢二钾、硫酸锰3种金属化合物作为金属离子的添加药品,分别设置其质量浓度梯度,培养方法同上,48 h后测定γ-PGA产量。
硫酸镁质量浓度对γ-PGA产量的影响见图9,磷酸二氢钾质量浓度对γ-PGA产量的影响见图10,硫酸锰质量浓度对γ-PGA产量的影响见图11。

图9 硫酸镁质量浓度对γ-PGA产量的影响

图10 磷酸二氢钾质量浓度对γ-PGA产量的影响
由图9~图11可知,磷酸二氢钾质量浓度为0.3 g/L时γ-PGA产量最大,11.78 g/L,由此可得最优金属离子为钾离子,磷酸二氢钾最优质量浓度为0.3 g/L。

图11 硫酸锰质量浓度对γ-PGA产量的影响
3.2.7 发酵时间对γ-PGA产量的影响
使用以上优化培养基,设置发酵时间梯度,测定不同发酵时间发酵液中γ-PGA含量。
发酵时间对γ-PGA产量的影响见图12。

图12 发酵时间对γ-PGA产量的影响
由图12可知,发酵时间为72 h时γ-PGA由最大产量24.27 g/L,由此可得最优发酵时间为72 h。
4 结论
从传统大豆发酵食品、黄水、黄浆水、酸菜水中筛选出一株γ-PGA产生菌株,经形态分析、生理管鉴定和16S rDNA序列鉴定为枯草芽孢杆菌,并将此菌株命名为枯草芽孢杆菌(Bacillus subtilisYB18.)设计梯度试验对培养基各个成分进行了优化,在试验条件下该菌株的最佳氮源为牛肉浸粉,其最佳质量浓度为11 g/L;最佳碳源为玉米糖化液,其最佳质量浓度为100 g/L;谷氨酸钠作为前体物,其最佳质量浓度为30 g/L;氯化钠最佳质量浓度为10 g/L;最优金属离子为磷酸二氢钾所提供的钾离子,其最佳质量浓度为0.3 g/L,最佳发酵时间为72 h,采用优化培养基配方进行发酵,所得γ-PGA的产量为24.27 g/L。
