CNV-seq结合STR多态性分析在检测孕早期流产物中潜在葡萄胎病例的应用价值
2021-10-14郭芳芳彭海山万志彬李怡杨洁霞
郭芳芳?彭海山?万志彬?李怡?杨洁霞

【摘要】目的 评估基因组拷贝数变异测序(CNV-seq)结合短串联重复序列(STR) 多态性分析技术在检测孕早期(≤9周)流产物组织中潜在葡萄胎病例的应用价值。方法 收集行流产物组织CNV-seq结合STR多态性检测的孕早期病例,挑取部分新鲜绒毛组织进行CNV-seq结合STR多态性检测,其余组织常规固定后进行病理组织学检测。结果 共纳入782例孕早期病例,经CNV-seq结合STR多态性检测共检出66例(8.44%)潜在葡萄胎病例,其中57例(7.29%)為三倍体,9例(1.15%)为全基因组同源单亲二倍体。57例三倍体中有52例随访到病理形态学结果,其中19例提示为宫腔内绒毛,12例为部分绒毛间质水肿,12例为偶见绒毛、极少许绒毛和少许绒毛,9例未见绒毛。病理形态学提示未见绒毛和少许绒毛的3例三倍体病例的STR基因分型检测示染色体异常三倍体2例、部分性葡萄胎1例。9例全基因组同源单亲二倍体中,经病理形态学及p57Kip2蛋白免疫组织化学染色提示为完全性葡萄胎8例,余1例病理形态学提示少许绒毛,随后经STR基因分型检测证实该病例也为完全性葡萄胎。结论 CNV-seq结合STR检测孕早期流产物对发现潜在的葡萄胎病例有一定的价值,特别是完全性葡萄胎;相较于病理组织学检测,STR基因分型检测在孕早期葡萄胎标本中更易获得可靠的结果。
【关键词】孕早期;葡萄胎;短串联重复序列多态性分析;产前诊断;基因分型
CNV-seq combined with STR polymorphism in detection of potential hydatidiform mole in abortion tissues of early pregnancy women Guo Fangfang, Peng Haishan, Wan Zhibin, Li Yi, Yang Jiexia. Medical Genetics Center, Guangdong Women and Children Hospital, Guangzhou 510010, China Corresponding author, Yang Jiexia, E-mail: yjxfimmu@ 126. com
【Abstract】Objective To evaluate the value of CNV-seq combined with short tandem repeat (STR) polymorphism in the detection of potential hydatidiform mole in abortion tissues of early pregnancy women (≤ 9 weeks). Methods Clinical data of early pregnancy women whose abortion tissues were subjected to CNV-seq combined with STR polymorphism analysis were collected. The villi tissues were partially prepared for CNV-seq combined with STR detection, and the remaining tissues were routinely fixed for histopathological diagnosis. Results A total of 782 early pregnancy women were recruited. Among them, potential hydatidiform mole was detected in 66 cases (8.44%) by CNV-seq combined with STR including 57 cases of triploid (7.29%) and nine cases of whole genome isodisomy (1.15%). Pathomorphological results were obtained in 52 of the 57 triploid cases. Normal villi were observed in 19 patients. Partial villi stromal edema was seen in 12 cases. Villi were occasionally noted or a slight or extremely slight amount of villi could be found in 12 cases. No villis were seen in nine cases. Pathomorphological examination prompted that among three triploid cases with no villi and a slight amount of villi receiving STR genotyping, two patients were diagnosed with chromosomal abnormal triploid and one case of partial hydatidiform mole. Among nine cases of whole genome isodisomy, eight patients were indicated as complete hydatidiform mole by pathomorphological diagnosis and p57Kip2 immunohistochemistry, and the remaining one patient with a slight amount of villi was subsequently confirmed as complete hydatidiform mole by STR genotyping. Conclusions The combination of CNV-seq and STR has certain value in the detection of potential hydatidiform mole in the abortion tissues of women with early pregnancy, especially for complete hydatidiform mole. Compared with pathomorphological diagnosis, STR genotyping is more likely to obtain reliable results in detecting potential hydatidiform mole in early pregnancy women.
【Key words】Early pregnancy;Hydatidiform mole;Short tandem repeat polymorphism;Prenatal diagnosis;Genotyping
葡萄胎主要包括完全性葡萄胎和部分性葡萄胎,几乎所有的完全性葡萄胎为完全父源性单亲二倍体,部分性葡萄胎是具有双雄单雌来源的三倍体[1]。随着检测技术的进步,越來越多的孕早期流产妊娠物被发现为葡萄胎。但是,孕早期葡萄胎往往没有典型的临床症状,超声对孕早期葡萄胎的总体检出率也仅为50%左右[2]。2018年我国发布的妊娠滋养细胞疾病诊断与治疗指南(第四版)中,明确了病理组织学检测是葡萄胎最重要和最终的诊断方法[3]。但是孕早期葡萄胎病理组织形态学表现可能不典型,水肿性流产与葡萄胎病理组织形态学表现差异可能会不明显,且病理学家对此的解读也存在一定的主观性[4]。因此,对孕早期流产妊娠中葡萄胎的精准诊断仍然存在挑战。近年来,国内外学者对基于下一代测序技术的基因组拷贝数变异测序(CNV-seq)临床应用的相关探索表明,CNV-seq结合短串联重复序列(STR)多态性分析技术可应用于流产物样本分析,以检测覆盖全染色体非整倍体、大片段缺失/重复及全基因组CNV,与此同时还可以发现三倍体及同源单亲二倍体[5]。为此,本研究回顾性分析了经CNV-seq结合STR多态性检测在孕早期(≤9周)流产物中发现的潜在的66例葡萄胎病例,希望为此类病例的临床管理提供一定的依据。
材料与方法
一、标本来源
收集2019年1月至2020年1月在广东省妇幼保健院进行流产物CNV-seq结合STR检测的孕早期(≤9周)782例病例基本资料及其流产物组织(自然流产排出或稽留流产清宫术取出)。从新鲜流产物中挑取少量绒毛组织用于CNV-seq及STR检测,剩余标本常规固定后用于病理组织学检测。所收集病例基本资料包括年龄、孕周、超声检查结果等。本研究已通过广东省妇幼保健院伦理委员会审批,检测前患者均已签署知情同意书。
二、病理组织学检查
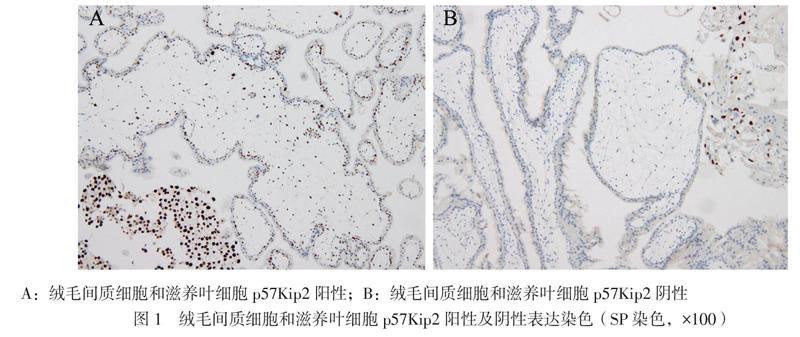
将流产物组织置入适量的4%中性甲醛溶液中固定,常规石蜡包埋并制作HE切片,由2位病理医师对HE 切片进行组织形态学观察,判断是否有绒毛水肿并记录其程度,具体指标包括绒毛积液水肿程度、是否有绒毛水池形成(大小超过绒毛的50%)、是否有细胞滋养叶细胞增生及其增生程度等[6]。对所有的经CNV-seq及STR检测提示为同源单亲二倍体的标本进行p57Kip2蛋白免疫组织化学染色(免疫组化),采用广州安必平医药科技股份有限公司的p57Kip2鼠抗人单克隆抗体行链霉菌抗生物素蛋白-过氧化物酶连结(SP)染色检测p57Kip2蛋白在绒毛和蜕模组织中的表达情况,若绒毛间质细胞和细胞滋养叶细胞无棕色或者棕黄色染色,结果判定为阴性,即完全性葡萄胎,见图1。
三、STR检测
1. STR多态性检测流程
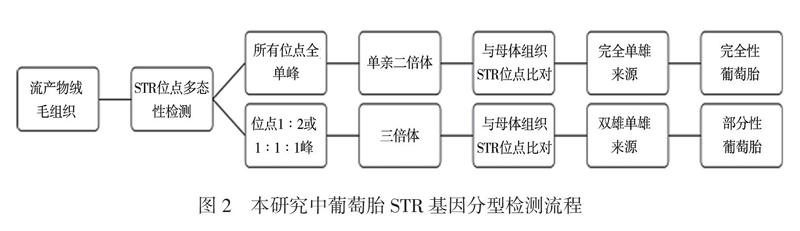
提取流产物组织及其母体外周血DNA,具体操作流程参照Magen磁珠法通用核酸提取试剂盒说明书。NanoDrop 2000评估所提取 DNA的浓度和纯度。将DNA浓度稀释至20 ~ 40 ng/μl,利用荧光标记多重PCR技术扩增13个常染色体STR位点(21号染色体5个、18和13号染色体各4个)。扩增产物经ABI 3500 xL测序仪毛细管电泳检测出各基因座的等位基因电泳数据,将电泳数据导入数据分析软件GeneMarker V2.2.0,进行数据分析及结果判断。根据GeneMarker V2.2.0软件分析结果,计算各个位点峰面积比值得出染色体倍体正常或异常的结论(二倍体、同源单亲二倍体、三倍体)。
2. STR葡萄胎基因分型检测流程
将经STR多态性检测为同源单亲二倍体及三倍体的流产物病例,进一步与母体外周血DNA STR位点进行比对,分析其亲代来源,从而鉴定出完全性葡萄胎(单雄来源单亲二倍体)及部分性葡萄胎(双雄来源三倍体),见图2。
四、CNV-seq检测
取流产物组织DNA 100 ng进行片段化处理,具体操作流程参照试剂盒NEBNext dsDNA Fragmentase Kit说明书进行。按照晶芯? 胎儿染色体非整倍体(T21、T18、T13)检测试剂盒说明书对片段化后的DNA进行文库构建及定量,然后上机测序。测序完成后,将样本的DNA序列与已知人类参考基因组序列进行比对,运用环状二元分割算法分析样本的CNV情况。通过检索数据库及查阅文献,参考美国医学遗传学会指南,对这些变异进行五分类(致病性、可能致病、临床意义不明确、可能良性、良性),判断样本是否存在全基因组致病性及可能致病性拷贝数变异[7]。
五、统计学处理
连续型变量如符合正态分布以表示,否则以中位数(最小值 ~ 最大值)表示;分类资料以例(%)或例(相对比)表示。
结果
一、一般资料
2019年1月至2020年1月在广东省妇幼保健院进行流产物CNV-seq结合STR检测的孕早期(≤9周)病例共782例,其中潜在的葡萄胎妊娠共66例(8.44%),包括57例(7.29%)三倍体和9例(1.15%)同源单亲二倍体。57例三倍体病例妊娠年龄为30 (24 ~ 41)岁,检测时孕周为6 (5 ~ 9)周。9例同源单亲二倍体妊娠年龄为28(24 ~ 31)岁,检测时孕周为6(6 ~ 7)周。
二、57例三倍体病例分析
1. 总体情况
57例三倍体中,以69,XXY最常见(25例,43.85%),69,XXX次之(20例,35.09%),69,XYY 最少见(2例,3.51%),其余病例包括1例亚三倍体、8例超三倍体以及1例三倍体合并染色体部分三体和部分单体,即69,XXY, 3p12.1-pter(dup), 3q11.2-qter(del), 13q21.1-qter(del)。其中52例随访到病理组织形态学结果,提示为宫内绒毛及蜕膜组织19例、提示为部分绒毛间质水肿12例,提示为偶见绒毛、极少许绒毛和少许绒毛12例,未见绒毛9例。
2. 未见绒毛和少许绒毛的三倍体病例分析
3例病理形态学结果提示未见绒毛和少许绒毛的三倍体病例,经与母体外周血DNA STR位点比对(即STR基因分型检测),发现2例为染色体异常三倍体(双雌单雄来源三倍体),1例为部分性葡萄胎(双雄单雌来源三倍体),见表1及图3A ~ C。
3. 全基因组同源单亲二倍体病例分析
9例全基因组同源单亲二倍体均随访到病理组织学结果,其中8例提示为完全性水泡状胎块,且7例进一步p57Kip2蛋白免疫组化结果均为阴性,提示此8例均为完全性葡萄胎病例;其余1例提示宫腔内少许绒毛及蜕膜组织(病例4),但经母体外周血与流产物组织DNA STR位点比对,证实该病例流产物组织为完全父源单亲二倍体,见图3D。结合该病例超声结果为妊娠(胚芽长3 mm,未见胎心搏动)合并混合回声区,提示该标本可能为妊娠合并完全性葡萄胎。9例完全性葡萄胎病例中有3例(3/9)呈现完全性葡萄胎的典型超声表现(蜂窝状回声和密集光点波动)。
讨论
葡萄胎具有进展为持续性滋养细胞疾病的危险性,且完全性葡萄胎的进展率(15% ~ 20%)比部分性葡萄胎(0.5% ~ 4.0%)更高[8]。因此精确区分完全性和部分性葡萄胎以及非葡萄胎流产对指导后续合理的临床管理具有重要的临床意义。
在孕早期依靠单纯的病理形态学检测难以准确区分完全性葡萄胎、部分性葡萄胎以及非葡萄胎流产,因此常常需要进一步辅以p57Kip2蛋白免疫组化分析。其中完全性葡萄胎p57Kip2蛋白免疫组织化学染色阴性,部分性葡萄胎和非葡萄胎流产p57Kip2蛋白免疫组织化学染色阳性。因此,病理组织形态学结合p57Kip2蛋白免疫组织化学染色基本可以较好地将完全性葡萄胎鉴别出来,但是却无法区分部分性葡萄胎和其他非葡萄胎流产[9]。目前研究显示,葡萄胎的遗传学病因是存在过剩的父源性基因组,STR基因分型技术通过将母体组织与流产物组织DNA进行STR位点比对,分析流产物DNA的亲代来源,可以检测出完全性葡萄胎(完全单雄来源单亲二倍体)及部分性葡萄胎(双雄单雌来源三倍体),从而对完全性葡萄胎及部分性葡萄胎做出精确诊断并明确分型[9-10]。
本研究中经CNV-seq结合STR多态性检测共发现9例同源单亲二倍体,其中7例同源单亲二倍体经病理形态学和进一步免疫组织化学检测验证为完全性葡萄胎。1例病理形态学提示为水泡状胎块,患者未选择进一步免疫组化检测。这提示在STR位点足够多的情况下,經CNV-seq结合STR检测发现的同源单亲二倍体是完全性葡萄胎的可能性较大,建议进一步对这部分病例抽取母体外周血进行STR分型检测,以明确是否为完全性葡萄胎。其余1例同源单亲二倍体比较特殊,其病理组织学检测提示宫腔内少许绒毛及部分蜕膜组织,但经母体外周血与流产物组织 STR位点比对,证实该病例流产物组织为父源单亲二倍体,结合该病例超声结果为妊娠合并混合回声区,提示该标本应该是妊娠合并完全性葡萄胎。如果排除病理学观察者主观因素导致的误差,推测可能是由于标本取材问题导致的病理组织学检测结果与STR基因分型检测结果不一致,即经CNV-seq结合STR检测的标本组织取自于完全性葡萄胎组织,而经病理检测的标本取自于正常妊娠组织。因此,对于怀疑双胎之一合并葡萄胎的病例取材时需特别注意,精确分离不同来源的妊娠物成分并分别进行检测对于保证准确的结果是至关重要的。Liu等[11]的研究也认为对于难以分离的混合妊娠物标本建议采用病理形态学检测筛查、免疫组化分析和STR基因分型相结合的方法,对可能合并葡萄胎的双胎妊娠的混合妊娠产物组进行诊断。
本研究中,共有4例病理组织学提示未见绒毛(2例)和少许绒毛(2例)的病例进行了进一步的STR基因分型检测(即将绒毛组织STR位点与母体组织STR位点比对),结果显示其中1例为部分性葡萄胎、1例为完全性葡萄胎。因此,相比较于病理组织形态学检测,STR基因分型检测仅需极少的标本量,且结果判断不受主观因素影响,在孕早期可获得的绒毛数量较少的情况下更易获得准确的结果。
本研究中确诊的9例完全性葡萄胎和1例部分性葡萄胎的超声结果均提示未见卵黄囊,仅见混合回声团,其中9例完全性葡萄胎病例中仅3例呈现完全性葡萄胎的典型超声表现(蜂窝状回声和密集光点波动)。既往研究者发现在孕早期(≤12周)葡萄胎中,超声检查对早期葡萄胎的检出率约为50%,其中对完全性葡萄胎和部分性葡萄胎的检出率分别约为70%和20%[2]。本研究收集到的完全性葡萄胎标本量较少,且孕周更早(≤9周),所以超声检查对早期葡萄胎的检出率更低,仅为3/9。但是以往的研究结果及本研究的结果均提示,超声对早期葡萄胎的检出率有限,应重视孕早期非活胎妊娠物的送检,通过STR 基因分型检测有利于对可疑葡萄胎病例进行精确诊断并明确分型,减少葡萄胎的漏诊。
本研究的不足之处在于,大部分经CNV-seq及STR检测发现的潜在的葡萄胎病例(三倍体及同源单亲二倍体)没有经过STR基因分型检测验证,日后我们将对这部分病例进行及时的临床反馈并建议进一步的精确诊断明确葡萄胎分型。
综上所述,CNV-seq结合STR检测孕早期流产物对发现潜在的葡萄胎病例有一定的价值,特别是完全性葡萄胎;相较于病理组织学检测,CNV-seq及STR检测仅需要极少的标本量,且不受主观因素判断影响,当结合母体DNA 进行STR基因分型检测时,在孕早期(≤9周)葡萄胎标本检测中更易获得可靠的检测结果。建议对经CNV-seq及STR检测发现的潜在葡萄胎病例进行及时随访及进一步的精确诊断并明确分型,为此类病例后续合理的临床监测及预后管理提供依据。
参考文献
[1] 刘岩, 刘从容.葡萄胎诊断进展与STR基因分型的应用. 妇产与遗传(电子版),2016,6(4):18-22.
[2] 焦澜舟, 尤淑艳, 王亚萍, 朱成功, 姜继勇. 早期葡萄胎的临床特点及诊断方法探讨. 中华妇产科杂志, 2019, 54(11):756-762.
[3] 向阳, 周琦, 吴小华, 刘继红, 李力, 朱笕青, 白萍, 盛修贵. 妊娠滋养细胞疾病诊断与治疗指南(第四版). 中国实用妇科与产科杂志,2018,34(9):994-1001.
[4] Kubelka-Sabit K, Jasar D, Filipovski V, Bozinovski G, Plaseska-Karanfilska D. Molecular and histological cha-racteristics of early triploid and partial molar pregnancies. Pol J Pathol, 2017, 68(2):138-143.
[5] 中华医学会医学遗传学分会临床遗传学组, 中国医师协会医学遗传医师分会遗传病产前诊断专业委员会, 中华预防医学会出生缺陷预防与控制专业委员会遗传病防控学组. 低深度全基因组测序技术在产前诊断中的应用专家共识. 中华医学遗传学杂志, 2019, 36(4): 293-296.
[6] 郑兴征, 秦旭颖,王鹏, 徐飞, 马建慧, 王喜立, 陈素文,冯旺琴, 朱力, 阴赪宏, 吴秉铨. STR基因分型在葡萄胎及非葡萄胎妊娠流产诊断中的应用. 中华病理学杂志, 2018, 47(8):609-615.
[7] Wang Y, Li Y, Chen Y, Zhou R, Sang Z, Meng L, Tan J, Qiao F, Bao Q, Luo D, Peng C, Wang YS, Luo C, Hu P, Xu Z. Systematic analysis of copy-number variations associated with early pregnancy loss. Ultrasound Obstet Gynecol, 2020, 55(1):96-104.
[8] Heller DS. Update on the pathology of gestational trophoblastic disease. APMIS, 2018, 126(7): 647-654.
[9] Madi JM, Braga A, Paganella MP, Litvin IE, Wendland EM. Accuracy of p57KIP2 compared with genotyping to diagnose complete hydatidiform mole: a systematic review and meta-analysis. BJOG, 2018, 125(10):1226-1233.
[10] Colgan TJ, Chang MC, Nanji S, Kolomietz E. DNA genotyping of suspected partial hydatidiform moles detects clinically significant aneuploidy. Int J Gynecol Pathol, 2017, 36(3): 217-221.
[11] Liu Y, Zheng X, Wang Y, Li Y, Liu C. Identification of a hydatidiform mole in twin pregnancy following assisted reproduction. J Assist Reprod Genet, 2020, 37(3): 603-610.
(收稿日期:2021-01-22)
(本文編辑:林燕薇)
