CT 引导脊柱内镜后外侧入路腹侧减压术治疗脊髓型颈椎病*
2021-10-14陈新荣温新院刘
魏 俊 王 建 冉 兵 杨 俊 付 敏 钟 琼 陈新荣 温新院刘 勇 吴 韵 邓 欣
(1 赣南医学院第一附属医院疼痛科;2 赣南医学院疼痛医学研究所;3 赣州市疼痛医学工程技术研究中心,赣州341000;4 赣南医学院,赣州 341000)
脊髓型颈椎病 (cervical spondylotic myelopathy,CSM) 临床较常见,多由颈椎局部骨组织增生和或椎间盘组织巨大脱出致椎管重度狭窄,压迫相应层面脊髓,引起脊髓神经不同程度损伤,导致相应症状。临床常规以开放手术治疗为主,开放手术除创伤大、常规需植入物固定缺点外,亦存在术后退变加剧、疼痛等诸多不足[1,2],而能否通过微创技术达到开放手术类似效果,仍是目前临床尚未解决的问题。近年,脊柱内镜技术不断完善发展,已能常规、高效解决神经根型颈椎病[3],结合CT 等精准引导应用和配套器械开发,在特定适应证基础上,用微创替代开放手术日益成为可能。本研究团队在前期CT引导后路脊柱内镜颈椎手术经验基础上,复习局部解剖学资料,结合CT 引导和内镜下可变向硬性钻头器械优势,改变现有手术入路通道角度,以解决硬膜囊腹侧脊髓致压因素为主要手术目的,并考虑各环节安全保障,自主创新提出CT 引导下的脊柱内镜后外侧入路腹侧减压术 (posterolateral full-endoscopic ventral decompression, PLEVD)(见图1),用于治疗单节段CSM,本研究初步探讨该技术可行性、安全性和有效性,拟为临床提供一种可行的微创解决方案。

图1 PLEVD 手术示意图Fig. 1 Schematic diagram of PLEVD
方 法
1. 一般资料
经赣南医学院第一附属医院伦理委员会批准(201908050),选取2018 年5 月至2020 年3 月就诊于我院疼痛科确诊为CSM 病人31 例,男14 例,女17 例,年龄 39~83 岁,平均(52.0±10.2)岁,病程12.4±20.5 月,平均 (0.3~84)月,其中C3-41 例、C4-510 例、C5-618 例、C6-72 例,4 例为严重中央型骨性狭窄。治疗前所有病人均同意治疗方案并签署知情同意书。
纳入标准:①具备肢体麻木、无力或躯体不适等脊髓损伤临床表现;②MRI 示:以单一节段脊髓受压致病为主,局部脊髓抑脂像高信号表现。
排除标准:①不能排除颅内、脊髓自身病变或颈椎感染、转移肿瘤等病变;②多节段脊髓受压损伤CSM;③心肺功能较差;④精神疾病、抑郁症;⑤凝血功能异常。
术前均行颈椎X 线、MRI 检查(见图2A, C)(如怀疑骨性压迫加做CT 检查),结合症状、体征明确诊断,确定脊髓主要致压区域节段,术前常规行脱水、营养神经治疗,俯卧位训练宣教,手术均在CT 介入室进行。
2. 手术方法
术中俯卧,暴露颈部术野,监测生命体征,常规右美托咪定静脉泵注镇静。CT 扫描确定经后外侧入路(脊髓主要致压侧)最佳角度和穿刺点、深度(见图3A),常规消毒铺巾,1%利多卡因行穿刺点及穿刺路径局部浸润麻醉,取12#×150 mm 穿刺针经设计入路穿刺达目标点,一般为下位椎体椎弓根内上缘和硬膜囊外侧缘之间,CT 扫描确定无误后,放置导丝,逐级扩展管扩张,置入ф7.5 mm×125 mm工作套管,CT 扫描确定工作套管位置(见图3B),镜下清理工作套管内椎板、关节突关节表面筋膜等结缔组织,明确椎板间隙及“V”点位置为目标大致参照点,用可变向硬性钻头(骨动力系统、中国西山DK-O-MVS、钻头直径3 mm、可变向头长度15 mm 、可变向角度0~40°,金刚砂球形磨头JZT29032WJ)磨除椎板和部分关节突关节内侧(不超过关节突关节外侧1/2 中线),骨性通道一般内侧暴露椎管内硬膜囊外侧1/3~1/2 区域,外侧达椎管外侧缘,下缘暴露下位椎体椎弓根水平,上缘暴露出口神经根。经同节段出口神经根腋下,使用骨动力系统打磨椎体后缘增生骨质,必要时少量磨除椎体后缘骨质,形成可弯钻头和其他器械在不明显刺激压迫脊髓情况下,进入硬膜囊腹侧的安全通道,如病人为骨性压迫,主要用可弯金刚砂球形磨头逐步深入,磨除脊髓腹侧致压骨组织,过程中密切观察病人血压、心率及四肢麻木等任何不适症状,如脊髓为椎间盘突出物为主致压,可用可弯髓核钳等钳夹取出突出物,过程注意血管保护和止血,镜下示脊髓腹侧致压物清除,硬膜囊回位,搏动良好(见图3C),必要时可CT 扫描确定手术效果,如无异常,可退出工作套管,再次CT 扫描检查手术效果(见图3D),手术结束。术后平车回病房,平卧2小时后如无异常,可佩带颈托保护后短时间下地活动,术后1 周复查MRI(见图2B, D),无异常出院。1 月内佩戴颈托,卧床休息。

图2 (A, C)术前病人MRI 显示C6-7 椎间盘突出、椎管狭窄,脊髓严重受压;(B, D) 术后MRI 显示脊髓受压明显改善Fig. 2 (A, C) The cervical MRI before operation showed C6-7 disc herniation and spinal stenosis that severely compressed the spinal cord; (B, D) The cervical postoperation MRI showed the lesion in the C6-7 level was completely removed and the affected spinal cord was decompressed.

图3 (A)术前设计手术入路,确定最佳穿刺点、角度及明确穿刺深度;(B)术中工作通道位置;(C)手术结束时,内镜下见脊髓、神经根压迫解除,血液循环恢复,搏动正常;(D) 术后CT 显示,骨性通道位置及脊髓受压解除Fig. 3 (A) The optimal surgical approach, puncture needle location and direction were designed under CT image guidance before surgery; (B) The work-channel location and direction corresponding with surgical approach that designed before surgery;(C) Endoscope view shows the spinal cord and nerve root achieve completely decompression after the lesion removed; (D)The bone work hole and decompressed spinal cord were demonstrated on the CT image after operation.
3. 观察指标
测量术中工作通道与矢状位角度,以及术前、术后椎管最小矢状径 (minimum sagittal diameter of spinal canal, MSDC),观察术前、术后1 天、7 天、1 月、3 月、6 月、12 月及末次随访时(visual analogue scale, VAS) 评分和颈椎日本骨科协会(Japanese orthopaedic association, JOA) 评分,JOA 恢复率评估治疗效果,JOA 恢复率(%) = [(术后JOA 评分-术前JOA 评分)/(17-术前JOA 评分)]×100,评分≥75%、50%至74%、25%至49%、< 25%分别为优、良、可、差。记录手术相关并发症。
4. 统计学分析
数据采用SPSS 22.0 软件处理和分析,计量资料以均数±标准差(±SD)表示,采用配对t检验进行统计学分析,P< 0.05 为差异有统计学意义。
结 果
所有病人均正常完成手术,手术时间2.78±0.75(1.75~4.25) h,住院时间15.52±5.74 (8.0~39.0)天,术中工作通道与矢状位角度为37.07°±6.11°(25.1°~50.5°)。术前、术后MSDC 分别为(0.60±0.17) cm、(1.05±0.19) cm,二者相比差异具有统计学意义(P<0.01,见图4),椎管最狭窄处前后径明显改善。

图4 术后手术节段颈椎管最小矢状径较术前明显增大***P < 0.01,与术前相比Fig. 4 The minimum sagittal diameter of spinal canal (MSDC)***P < 0.01, compared with pre-operation.
31 例病人,其中14 例(45%)完成1 年随访,22 例(71%)完成6 月随访,末次随访时间10.2±6.2(1~23)月。术前、术后1 天、7 天、1 月、3 月、6 月、12 月及末次随访时VAS 评分分别为4.6±2.5、2.6±1.4、1.2±1.2、0.7±1.2、0.6±1.1、0.6±1.2、0.5±1.2、0.8±1.3,术后各观察期较术前差异具有统计学意义(P< 0.01,见图5);术前、术后1 天、7 天、1 月、3 月、6 月、12 月及末次随访时JOA 评分分别为10.1±2.1、12.2±1.6、13.2±1.2、13.8±1.0、14.1±1.3、14.6±1.0、15.4±1.6、15.1±1.5,术后各观察期较术前差异具有统计学意义(P< 0.01,见图5);末次随访JOA 恢复率显示治疗效果:优17 例、良11 例、可3 例。
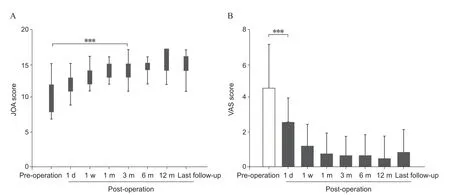
图5 (A)术后颈椎JOA 评分较术前升高; (B)术后VAS 评分较术前明显下降***P < 0.01,与术前相比Fig. 5 (A) The JOA score was gradually improved and significantly changed at each of the postoperative point compared with pre-operation; (B) The VAS score was significantly decreased in post-operation compared with pre-operation.***P < 0.01, compared with pre-operation.
3 例(2 例C4-5、1 例C5-6)病人在腹侧减压时出现心率下降趋势,暂停手术后即刻自行恢复。无硬膜囊撕裂、血肿、感染、椎间盘炎、椎间盘再突出等并发症。1 例术前无法行走病人,术后出现脊髓损伤加重,经处理9 月后恢复正常行走功能。
讨 论
CSM 是最严重的颈椎病类型,一旦发生,只要病人身体条件允许,临床常规需开放手术治疗[1,2]。CSM 在MRI 上表现为单节段或多节段狭窄,即使多节段狭窄的责任椎间盘往往只有一处,在相应脊髓层面T2 加权像上出现高信号,显示该部位脊髓受压缺血损伤[4]。由于微创手术工作范围的局限性,本研究探讨单节段CSM 脊柱内镜技术解决方案可行性。
CSM 常规手术有后路和前路二种,经多年不断改进,技术已趋稳定,存在创伤大等诸多不足。前路减压融合术较多用于中央型或旁中央型脊髓压迫,在手术中或术后可能出现与手术通路相关的损伤、邻近节段退变和假关节形成等并发症[5,6]。颈椎后路椎管扩大成形术,术后可能存在如颈背部肌肉痉挛、慢性轴性疼痛、颈部活动受限、以及颈椎后柱结构损伤分离导致的颈椎曲度改变等问题[7,8]。
近年颈椎微创手术逐渐为临床认可,包括前路和后路内镜技术,在合理选择适应证前提下,取得了与开放手术相同的良好效果,同时皮肤切口更小,减少了组织剥离损伤,且术中视野更清晰[3,9,10]。少数学者对治疗CSM 也进行了尝试,Akihito 等[11]比较了内镜椎板切开术 (cervical micro endoscopic laminoplasty, CMEL) 与传统颈椎扩大椎板成形术(expansive open-door laminoplasty, ELAP) 治疗CSM的疗效,随访5 年,结果显示两组病人的神经功能恢复情况相似(CMEL 组JOA 恢复率为57.6%,ELAP 组为55.5%);CMEL 组较ELAP 组术后轴性疼痛明显减轻,颈椎凸度改善,CMEL 组2 例,ELAP 组1 例,术中出现C5神经根损伤并发症。Deng 等[12]报道了1 例C4-5巨大型中央椎间盘突出的病人,行经皮脊柱内镜下经椎体前路椎间盘切除术,病人完全康复,无并发症发生。
CSM 病人主要问题是硬膜囊腹侧致压物压迫脊髓,前路技术虽可以去除硬膜囊腹侧致压物,但代价往往是椎体前柱稳定性破坏及气管、食道及颈前血管损伤风险,而后路手术常无法有效去除硬膜囊腹侧致压物,脊髓受压改善不彻底,导致残留症状。能否在避免前路损伤及风险基础上,有效消除硬膜囊腹侧致压物,缓解脊髓压迫,且能微创开展,临床尚无相应技术[2,13]。
本研究团队长期在CT 引导下开展各类脊柱内镜手术,有丰富后路颈椎内镜手术经验。临床中发现,如果将后路内镜工作通道外倾角度加大,利用颈椎解剖条件:①出口神经根从硬膜囊发出位置一般不低于同节段椎间盘;②神经根腋下存在相对安全三角区域;③硬膜囊腹侧、尤其后纵韧带腹侧没有难以控制出血的血管。配合特殊手术器械如可变向硬性钻头等角度变化,加上受压脊髓背侧椎板相应部位预先去除,结合CT 引导精准定位优势,理论上可以达到在硬膜囊腹侧近乎水平去除脊髓致压物可能(见图1),并有一定安全保障。
本研究运用CT 引导的PLEVD 技术成功治疗31 例CSM 病人。VAS 评分显示,术后颈、四肢疼痛明显减轻。随访期间病人脊髓功能逐渐恢复,末次随访JOA 恢复率示治疗效果:优17 例、良11 例、可3 例,优良率90.3%,疗效较常规文献报道更高[1],主要原因可能是PLEVD 从硬膜囊腹侧解决脊髓压迫,脊髓受压改善较为充分。3 例病人末次随访时仍有持续的感觉异常,四肢麻木和下肢肌肉无力(IV级)。分析原因,术前脊髓存在广泛的病理损伤,脊髓恢复时间会更长,另与椎管骨性狭窄严重,椎管改善不彻底有一定关系。3 例病人在腹侧减压时出现心率下降,暂停手术后即刻自行恢复,应该是由于操作时加重了脊髓损伤刺激引起。颈脊髓损伤后,脊髓发出的心交感神经的功能被抑制,而迷走神经功能相对占优势,导致心脏自主神经功能紊乱,加重脊髓损伤处刺激时易出现心率下降变化[14,15],由于该变化较为敏感,可作为术中脊髓刺激耐受的观察指标之一。1 例重度C4-5狭窄CSM 病人,术前无法行走,在手术开始时即出现双下肢无力、麻木加重(术后病人回忆)。由于术中忽视问询病人,在手术进行90 分钟,准备结束手术时发现上肢肌力I 级,下肢肌力0 级。考虑为俯卧体位造成脊髓受压加重,立即激素注射、脱水、营养神经治疗,配合康复理疗及高压氧治疗。复查MRI 示压迫脊髓突出物已去除,后期逐渐恢复,1 月余出院时肌力3 级,可旁人搀扶短距离行走,2 月后可自主扶助步器行走,术后9 月基本恢复正常行走功能。
PLEVD 区别于传统后正中入路或旁正中入路技术,首次提出了后外侧入路,其与矢状位角度更大。本研究中31 例病人的平均后外侧角为37.07°±6.11°(25.1°~50.5°),虽然具体的手术路径和角度取决于颈椎病灶的位置、椎管的狭窄程度和病人在手术中的位置,但考虑今后推广PLEVD 技术时,后外侧角可以作为一个初步的参考。
CT 引导可以提供术中病人当时体位下目标致压物、脊髓、神经根间准确三维位置关系,在评估安全性和有效达成手术目的前提下,术前术者模拟后外侧通道入口,设计最佳角度、穿刺深度及椎板、关节突关节需磨除部位、范围,初步明确需磨除骨质厚度并判断关节突关节磨除范围是否影响术后稳定性,术中不断通过CT 引导准确放置穿刺针及工作套管,在工作套管到位后,可再次CT 扫描预估工作套管开口与椎板间隙、V 点、关节突关节及前端进入椎管位置,必要时在术中骨质通道建立后,可再次CT 扫描确定通道位置、方向,确保安全性。
合理的手术路径和创造安全的手术空间是避免脊髓损伤等并发症的关键。颈椎神经根腋下为相对安全区域,以此作为切入点,组织解剖关系明确,有足够空间绕过硬膜囊和神经根进入腹侧;为进一步降低脊髓损伤可能,术中还需在两个区域进行扩大和减压:首先去除手术侧脊髓背侧的部分椎板和黄韧带,改善脊髓向背侧活动空间,其限制脊髓向背侧活动度;其次,磨除脊髓腹侧的增生骨质和部分椎体后缘骨质,从神经根腋下区域起,用骨钻在硬膜囊腹侧磨出逐渐向内延伸的安全通道。背部空间在进行硬膜囊腹侧操作时,提供了一个脊髓可以避让安全空间,腹侧空间为手术操作和器械进出硬膜囊腹侧提供安全通道。同时术中轻柔操作,尽量减少脊髓、神经刺激,局部麻醉下保留病人意识,操作中密切观察病人心率波动、四肢感觉、肌力变化至关重要,是避免脊髓、神经损伤基础。
PLEVD 术中使用的变向磨钻为金刚砂球形钻头,其优势有:精细磨除骨组织,无大块碎骨形成,可精细操作,且骨组织创面不易出血;脊髓、神经、血管等软组织可有效避让,直接损伤作用小,尤其脊髓、神经有腹侧后纵韧带、硬膜囊壁及神经鞘保护;术中发现CSM 病人大多数致压物伴随钙化及骨性增生,常规内镜下钳夹器械无法有效去除,需用钻头磨除。钻头可变向作用端长度为15 mm,本研究中样本硬膜囊宽度18.2±1.5 (15.6~22.0) mm,加上硬膜囊外缘在腹侧操作中可部分向背侧上抬,使保证安全情况下可以让钻头等器械更深入作用硬膜囊腹侧远端致压物,术中发现钻头最大作用距离可以达硬膜囊宽度三分之二以上,基本达到中央型致压物去除目的。本研究中,有2 例中央型骨性狭窄病人,由于受损脊髓术中无法承受过度挤压,受钻头可变向作用端长度限制。术后CT 显示,在对侧远端存在部分骨性组织残留(见图6),为解决上述问题,尝试双侧入路行PLEVD1 例(见图7),术后6 月随访病人治疗效果良好。
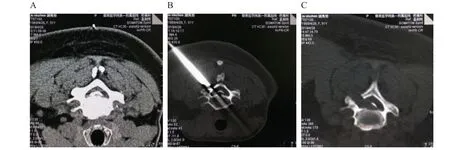
图6 一例椎管重度骨性狭窄的CSM 病人行PLEVD 手术(A)术前CT 图像椎管内重度骨性狭窄范围;(B)行PLEVD 术中工作通道位置;(C)术后CT 显示,术后CT 图像显示对侧椎管内后缘仍有小部分增生骨质残留Fig. 6 A patient with severe cervical bony spinal stenosis CSM underwent PLEVD(A) The CT image before operation shows the scope of bony spinal stenosis; (B) The work-channel of PLEVD during surgery showed on the CT image during surgery; (C) The CT image postoperation shows the ipsilateral bony lesion was removed, however a part of bony lesion at the opposite side hasn't removed.
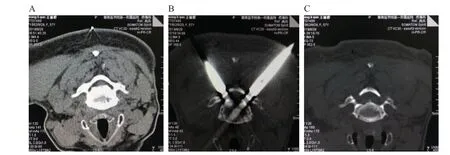
图7 另一例椎管重度骨性狭窄的CSM 病人行双通道PLEVD 手术(A)术前CT 图像椎管内重度骨性狭窄范围;(B)术中双侧工作通道位置;术后CT 显示,(C)双侧椎管内骨质均被去除Fig. 7 Another patient with severe cervical bony spinal stenosis CSM experienced bilateral PLEVD(A) The CT image before surgery shows the scope of bony spinal stenosis; (B) Position of bilateral working channels showed by CT image during surgery; (C) The postoperative CT image demonstrates that the bilateral lesion has been completely removed.
术中出血问题控制是PLEVD 技术安全开展基础,由于主要手术区域为神经根腋下及后纵韧带腹侧,该技术入路及术区基本无丰富血管分布。同时内镜手术在水环境下开展,冲洗液压力对静脉渗血有很好的控制作用,金刚砂钻头磨除的细小骨碎屑可有效封堵大多数骨面渗血,视野中出血可行双极射频止血,如有无法控制出血,可以封堵工作套管10 分钟左右,依靠生理凝血功能止血。
PLEVD 技术适应证主要为椎间盘突出、骨质增生、后纵韧带骨化等原因引起的单节段CSM,包括影像显示多椎间盘节段退变,但病因为单节段的CSM,不包括双侧重度骨性狭窄或重度中央型骨性狭窄,及脊髓主要致压范围向头端超过神经根袖5 mm病人,主要是被目前使用器械作用距离限制。
PLEVD 技术开展需重点注意:工作通道倾角大,术中工作通道方向容易偏移,容易误导术者判断,必要时术中CT 扫描;腹侧操作时密切注意病人心率下降变化,另外动态观察病人躯干及肢体麻木、无力变化,可作为术中脊髓损伤刺激是否加重观察指标;注意腹侧远端残留致压物处理、评估可能影响,合理设计手术方案,尤其中央型骨性狭窄病人;局部区域麻醉要完善,同时使用右美托咪定泵注可镇静镇痛,提高病人耐受性,同时保障配合;病人体位注意头部空间暴露,方便通气及观察交流。
本研究目前局限性在于:样本量偏小,随访时间短;为可行性研究,未与常规开放手术比较,目前本团队已在同步进行对比研究;尚未开展多中心研究;需CT 引导定位,对手术条件要求较高;由于样本量及随访时间问题,对术后中长期稳定性影响尚未做评估。今后进一步研究方向:加大样本量和开展多中心随机研究,更加客观反映疗效,探讨对不同病情病人合理解决方案及更全面反映可能存在的并发症问题;增加长期随访,明确椎体稳定性及邻椎影响;由于器械非为PLEVD 技术特制,部分内镜下器械需改进,可优化手术及扩大适应证范围;对部分双侧骨性狭窄或重度中央型骨性狭窄病例,将进一步探讨双侧入路解决可能性。
经初步探讨,本研究发现在CT 引导下PLEVD是一种安全、有效的治疗单节段CSM 技术,初步为临床提供了一种可行的微创解决方案,值得进一步研究。
