老年2型糖尿病患者衰弱的危险因素
2021-10-13修双玲穆志静孙丽娜韩青赵蕾付俊玲
修双玲,穆志静,孙丽娜,韩青,赵蕾,付俊玲
(首都医科大学宣武医院内分泌科,北京 100053)
衰弱是指机体由于储备减少或多种功能异常导致机体抗应激能力减退的一种状态,是一种常见的老年综合征,并可引起多种不良预后[1]。2型糖尿病(type 2 diabetes mellitus, T2DM)是影响全身多系统及多器官的老年常见病,随着疾病的进展,可导致衰弱的发生与发展。老年糖尿病发生衰弱是无糖尿病者的3~5倍[2],并且衰弱与老年糖尿病患者不良健康结局发生较高密切相关[3,4]。因此,在老年T2DM患者中早期筛查识别衰弱并采取干预措施,对于避免或延缓衰弱,进而改善老年T2DM患者的不良结局有重要意义。本研究旨在探索老年T2DM患者衰弱的相关危险因素,以利于T2DM患者衰弱的早期筛查和治疗。
1 对象与方法
1.1 对象
采用方便抽样法,纳入首都医科大学宣武医院2017年6月至2019年10月内分泌科住院的T2DM患者310例。根据FRAIL量表将患者分成3组。纳入标准:(1)年龄60~89岁;(2)符合2020年中国2型糖尿病防治指南糖尿病诊断标准。排除标准:(1)1型糖尿病及特殊类型糖尿病;(2)糖尿病急性并发症、严重肝肾功能不全和心力衰竭;(3)重症感染;(4)恶性肿瘤;(5)不能与调查者有效沟通;(6)不能站立测量身高及体质量。
1.2 方法
1.2.1 临床资料 测定患者的身高和体质量,计算体质量指数(body mass index,BMI)。空腹> 8 h采集静脉血测定血液指标,包括空腹血糖(fasting plasm glucose, FPG)、甘油三酯(triglyceride, TG)、 总胆固醇(total cholesterol, TC)、 高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、 低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、血肌酐和糖化血红蛋白(glycosylated hemoglobin A1c, HbA1c)。用慢性肾脏病流行病学合作研究公式计算肾小球滤过率(estimated glomerular filtration rate, eGFR)。电化学发光法检测25羟基维生素D3(25-hydroxyvitamin D3, 25-OHD3)。放射免疫分析法测定空腹胰岛素、空腹C肽,并计算胰岛素抵抗指数:HOMA-IR=FPG×FINS/22.5。
营养状况评估:选择微型营养评估表 (mini-nutritional assessment,MNA)评估营养状况,<24分为有营养不良风险,≥24分为正常。脑卒中病史为患者自述。
1.2.2 衰弱综合征诊断标准 采用FRAIL量表进行衰弱患者筛选。FRAIL量表[5]包含5个项目:自诉疲乏、近1年体质量下降超过5%、耐力情况、步行能力和是否合并≥5种慢性病。每个项目的比例为1分,得分≥3分为衰弱患者;得分1~2分为衰弱前期患者;得分为0分表示无衰弱状态。
1.3 统计学处理
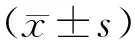
2 结 果
2.1 一般数据资料比较
本研究入组T2DM患者310例,年龄60~89(68.78±6.83)岁。衰弱组患者45例、衰弱前期组患者132例及正常组患者133例。3组患者性别、年龄、25-OHD3、eGFR水平、有营养不良风险及合并脑卒中比例比较,差异均有统计学意义(均P<0.05);3组患者的糖尿病病程、BMI、HOMA-IR、C肽、HbA1c、血脂、糖尿病伴发高血压、高血脂、冠心病比例及糖尿病慢性并发症等,差异均无统计学意义(均P>0.05;表1)。
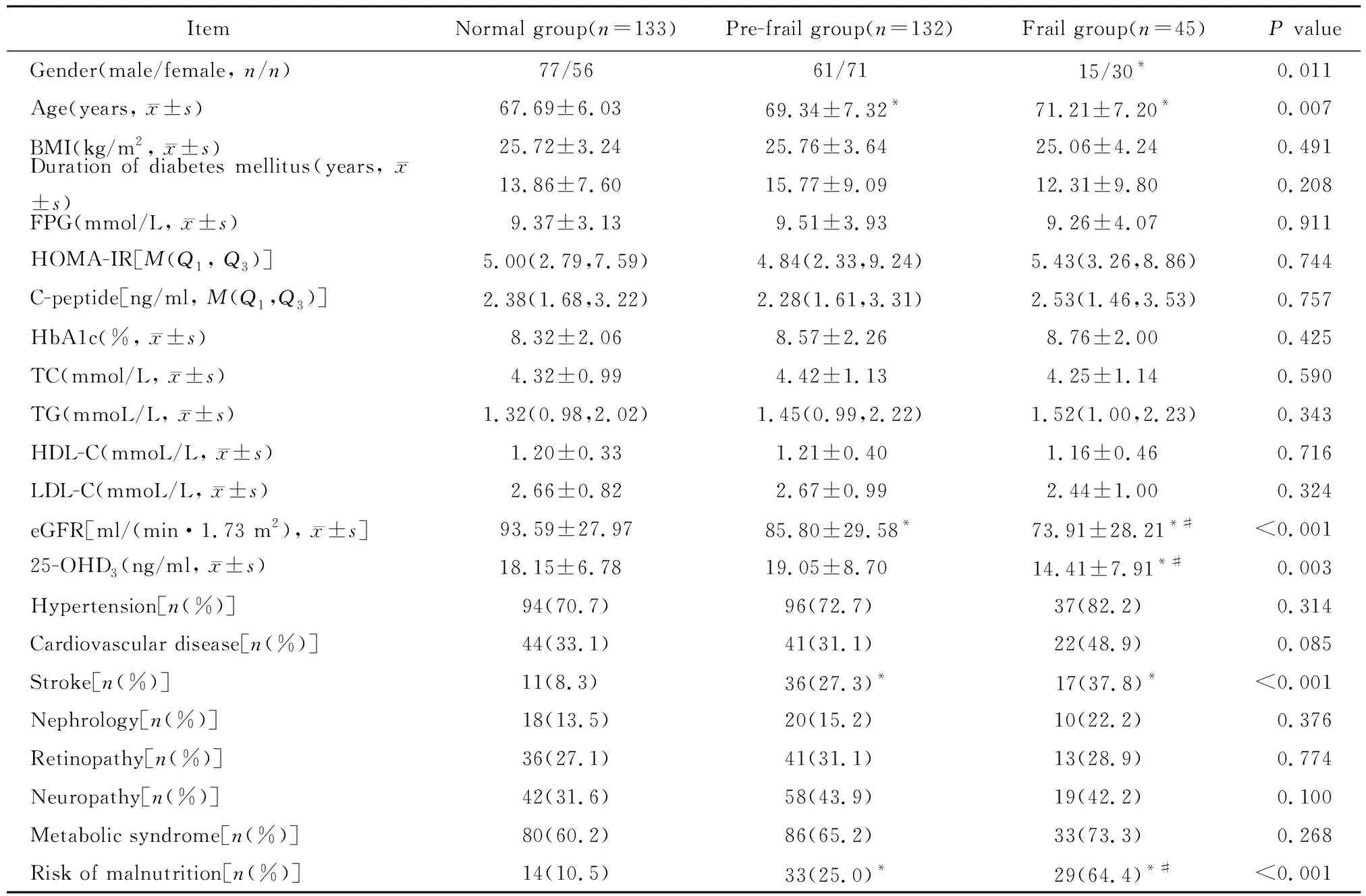
表1 3组患者一般资料比较
2.2 老年T2DM患者衰弱综合征的多元logistic回归分析
以是否衰弱为因变量,定义正常及衰弱前期=0,衰弱=1,将年龄、性别、25-OHD3、eGFR、有营养不良风险及合并脑卒中作为自变量,采用二元logistic回归进行分析。结果显示有营养不良风险、脑卒中是衰弱危险因素,25-OHD3为衰弱的保护因素(表2)。
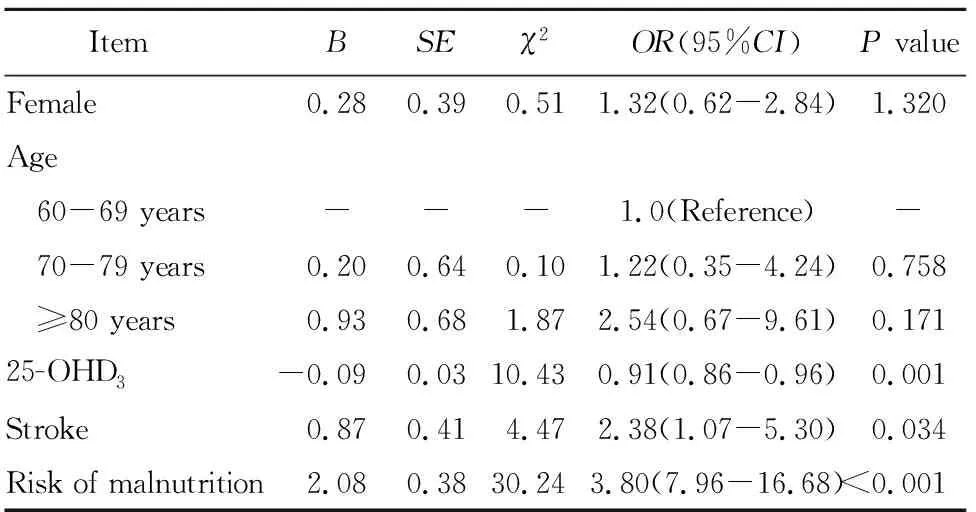
表2 老年T2DM患者衰弱影响因素的多元logistic回归分析
3 讨 论
本研究结果显示老年T2DM患者衰弱的比例为14.5%(45/310),衰弱前期的比例为42.6%(132/310)。关于T2DM衰弱的患病率,由于场所、人群及诊断标准不同,结果有所差异。最新的一项社区人群研究显示,T2DM患者衰弱的患病率为5.1%,衰弱前期患病率为41.4%[6]。Li等[7]对老年糖尿病住院患者进行衰弱筛查,结果发现衰弱患病率为15.1%,衰弱前期患病率为37.7%,与本研究结果类似。
糖尿病是一种老年常见慢性疾病,随着疾病进展,多个器官功能逐渐受损,更易出现衰弱状态[8]。衰弱和糖尿病存在共同的病理生理机制,包括内分泌、神经激素、血管和肌肉功能失调,并且二者有共同的危险因素如胰岛素抵抗、活动减少及肥胖等[9]。一项前瞻性队列研究显示[10],胰岛素抵抗与衰弱密切相关。胰岛素抵抗对衰弱的影响可能主要由于其对骨骼肌的影响,导致不同类型肌纤维含量的改变以及肌内脂肪的浸润等[11]。本研究未发现胰岛素抵抗与衰弱的相关性,考虑与样本量小及研究人群与既往研究不同有关系。
众多研究发现衰弱的发生与营养不良相关。一项meta分析显示[12],营养不良与衰弱显著相关,68%营养不良的老年人存在衰弱。本研究发现衰弱组营养不良风险的发生率为64.4%,明显高于另外2组。校正多项影响因素后,营养不良仍是衰弱的独立危险因素。营养不良导致衰弱的原因可能有以下几点。(1)老年T2DM患者为了控制血糖,可能存在过度控制饮食的情况;另外,一些降糖药物存在影响食欲、减重的效果。(2)慢性营养不良状态与炎症相互作用,营养不良既增加了炎症的风险和严重程度,同样其也是炎症的结果[13],这种相互作用加速了肌肉萎缩,导致衰弱。(3)老年人由于口腔和牙齿问题,影响食物的进食及营养摄入[14]。
老年人尤其老年T2DM患者卒中发生很常见。有脑卒中病史者衰弱的发生显著增加[15],有研究显示衰弱能预测卒中患者短期的生存率[16]。Katie等[17]的一项系统分析显示卒中患者衰弱前期及衰弱的患病率分别为49%和22%。卒中患者与非卒中患者相比,衰弱的风险增加2倍。本研究亦发现脑卒中是衰弱的独立危险因素。但由于本研究为横断面研究,不能确定卒中与衰弱的因果关系。
本研究发现高的25-OHD3水平是衰弱的保护因素。既往研究显示低水平的 25-OHD3与衰弱独立相关,还与衰弱表型中的缓慢、虚弱、低体力活动及疲乏有关[18]。低的25-OHD3水平影响衰弱的可能机制:(1)维生素D影响肌肉的功能与身体活动能力;(2)维生素D与慢性疾病相关,如高血压和糖尿病等,这些慢性疾病本身就可促进衰弱的发生和发展[19]。但本研究未校正季节因素对维生素D的影响,可能对结果有一定影响。
综上,对于有营养不良风险、合并脑卒中和维生素D水平低的T2DM患者,要注意早期筛查衰弱综合征,从而对衰弱进行早期的干预及管理。
