UPLC-MS测定动物组织中氯霉素过程中测量不确定度的评定
2021-10-13何莉媛王洪健李思柔谭文凤刘莹莹
何莉媛,陈 煜,王洪健,李思柔,谭文凤,刘莹莹
(1.广东省食品工业研究所有限公司湖南分公司,湖南长沙 410006;2.广东省食品工业公共实验室,广东广州 511442;3.广东省食品工业研究所有限公司,广东广州 511442;4.广东省食品质量监督检验站,广东广州 511442)
氯霉素是一种酰胺醇类抗生素,因其优越的抗菌性能,曾被广泛的运用到畜牧、家禽以及水产的养殖过程中,能有效控制革兰氏阴性菌、革兰氏阳性菌以及厌氧菌的生长[1-3]。近年来,越来越多的研究发现氯霉素对人体的毒副作用明显,美国、欧盟及中国等国家相继出台政策[3-6],在动物源性食品中限制氯霉素的检出。我国已于2002年对动物源性食品中氯霉素的残留量明确了限量标准[7],2019年再次发布公告明令禁止[8],但食品安全监督抽检时,仍不乏氯霉素残留量不合格的现象[9-13]。兽药残留超标是动物源性食品的最大安全隐患,高效准确地检测药物残留,不仅有助于食品安全的提升,也有助于规范畜禽水产的养殖。
在检测过程中检验员无法消除仪器测量结果与实际真值之间的差距[14-15]。通过赋予被测量值分散性、评定被测量值与测量结果之间联系,得到待测物质的测量不确定度[16-17]。测量不确定度可为检验合格判定提供真实有效的依据,完整的测量结果表述时应包含测量不确定度。尤其是当测量结果接近标准限值时,将测量不确定度纳入合格判定的考量范围,有助于检验检测机构评判产品是否符合标准要求[17]。随着《国家食品安全监督抽检实施细则(2021版)》的实施和推广,相较其他检测方法,《动物源性食品中氯霉素类药物残留检测》(GB 22338—2008)[18]的适用性更强,覆盖的样品基质类型更多,目前暂未有研究评定该方法的测量不确定度。本文依据GB 22338—2008研究鸡肉中的氯霉素检测,评定检测过程中的测量不确定度,依据相关准则[18-21]建立氯霉素测定的测量不确定度分析模型,分析检测过程中的相对扩展不确定度。
1 材料与方法
1.1 材料与试剂
鸡肉购于当地超市。氯霉素标准品(100±0.11)μg/mL,农业部环境保护科研检测所;氯霉素-D5标准品(100.1±3)mg/L,安谱;乙腈、丙酮、正丙醇、正己烷(色谱级),国药集团化学试剂有限公司。
1.2 仪器与设备
TRIPLE QUAD 4500液相色谱-串联质谱仪(UPLCMS):配有电喷雾离子源(美国AB SCIEX公司);ME204E/02分析天平(精密度:0.1 mg,梅特勒-托利多仪器(上海)有限公司);RE52AA旋转蒸发仪(上海亚荣生化仪器厂);3K15台式高速冷冻离心机(德国SIGMA公司);SPE-24固相萃取装置(上海汗诺仪器有限公司)等。
本次实验中所涉及的天平,超高效液相色谱质谱联用仪,量具等仪器均经过湖南省计量院计量溯源,仪器状态满足实验要求。
1.3 实验方法
依据标准《动物源性食品中氯霉素类药物残留检测》(GB/T 22338—2008)[22]中第3点液相色谱-质谱/质谱法,对草鱼进行前处理,测定氯霉素含量。
1.3.1 标准溶液的配制
(1)氯霉素标准中间液(100.0 ng/mL):用 100 μL移液枪移取浓度为100.0 μg/mL的氯霉素标准溶液100 μL至100 mL容量瓶中,乙腈定容至刻度。
(2)氯霉素 -D5标准中间液(1.001 μg/mL):准确移取浓度为100.1 μg/mL的氯霉素-D5标准溶液1 mL至10 mL容量瓶中,乙腈定容至刻度后准确移取1 mL至10 mL容量瓶中,乙腈定容至刻度。
(3)氯霉素 -D5标准工作液(0.100 1 μg/mL):准确移取浓度为1.001 μg/mL的氯霉素-D5标准中间液1 mL至10 mL容量瓶中,乙腈定容至刻度。
(4)氯霉素标准工作液:移取氯霉素中间液(100.0 ng/mL)0.025 mL、0.050 mL、0.100 mL、0.200 mL、0.500 mL、1.00 mL、2.00 mL于10 mL棕色容量瓶中,各加入氯霉素-D5内标溶液(1.001 μg/mL)1 mL,用V(水)∶V(乙腈)∶V(10 mmol/L乙酸铵)=70∶25∶5定容至刻度,混匀。此标准系列工作液浓度分别为0.25 ng/mL、0.50 ng/mL、1.00 ng/mL、2.00 ng/mL、5.00 ng/mL、10.00 ng/mL、20.00 ng/mL,内标浓度为10.01 ng/mL。
1.3.2 氯霉素残留量测定
液相色谱-质谱/质谱法测定试样中氯霉素残留量采用标准曲线法定量,定量结果按式(1)计算:

式(1)中:X为试样中氯霉素的含量,µg/kg;C为标准工作溶液的浓度,ng/mL;Csi为标准工作溶液中内标物的浓度,ng/mL;Ci为样液中内标物的浓度,ng/mL;As为标准工作溶液的峰面积;A为样液中氯霉素的峰面积;Asi为标准工作溶液中内标物的峰面积;Ai为样液中内标物的峰面积;V为试样定容体积,mL;W为样品称样量,g。
1.3.3 数据处理
本文中测试的数据,其平均值和相对标准偏差均用Excel计算。
2 不确定度分量的分析与计算
2.1 不确定度来源分析
根据测定方法的主要步骤,动物组织中氯霉素含量分析的不确定度主要来源于:①标准物质引入的相对标准不确定度;②标准曲线配制引入的相对标准不确定度;③样品处理引入的相对标准不确定度;④在重复条件下,进行6次测量的结果重复性引入的相对标准不确定度;⑤最小二乘法拟合标准曲线求样品浓度时产生的相对标准不确定度。不确定度主要来源详情如图1所示。
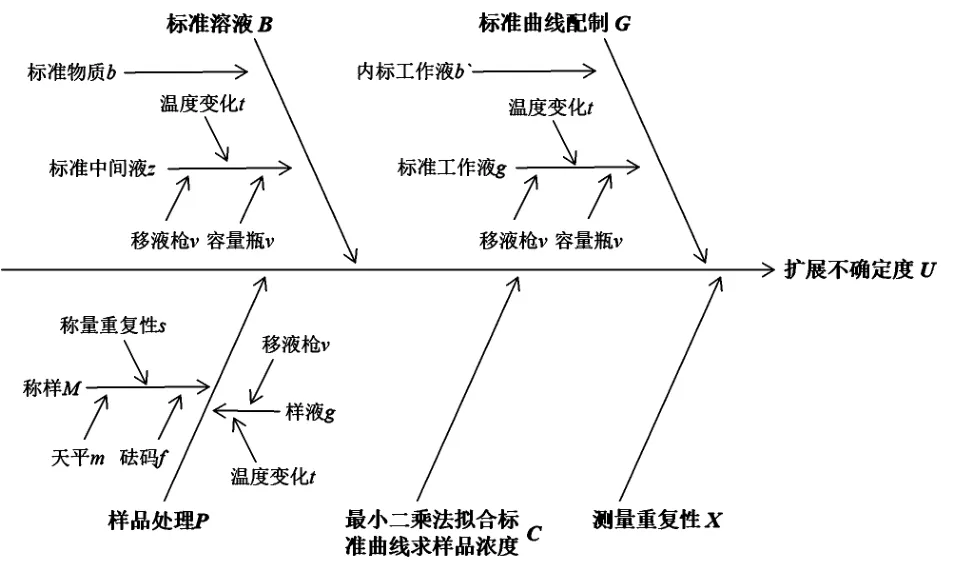
图1 动物组织中氯霉素含量分析不确定度的主要来源
2.2 标准不确定度的计算
2.2.1 标准物质引入的相对标准不确定度
配制标准中间液时引入的测量不确定度如图1所示。配制过程中所使用的量器均经过湖南省计量研究院检定且合格,标准物质及量具所带来的相对标准不确定度如表1所示。

表1 配制过程中标准物质、量器引入的相对标准不确定度
由于试样溶液和标准曲线所用内标溶液为同一氯霉素-D5标准中间液,加入的量一致,因此内标溶液配制过程中称取、稀释体积及纯度的不确定度的分量可忽略不计,只考虑内标溶液取样体积的不确定度。
移取标准物质过程中在(20±4)℃条件下进行,与检定标准温度20 ℃存在温度偏差,且液体的体积膨胀明显大于玻璃容器的体积膨胀,因此只考虑前者即可。采用乙腈溶解、定容氯霉素标准品,所以应当考虑乙腈的体系膨胀。乙腈的体积膨胀系数为1.37×10-3℃-1,由温度波动引起溶解体积偏差为u(vt1)、定容体积偏差为u(vt2),假设为均匀分布k=,则温度变化引入的溶解相对标准不确定度见式(2),定容对标准不确定度见式(3)。

标准储备液配制过程中引入的相对标准不确定度合成见式(4)。

标准物质引入的相对不确定度由标准物质纯度和标准溶液配制引入的相对不确定度合成见式(5)。

2.2.2 标准曲线配制引入的相对标准不确度
标准曲线配制过程中引入相对标准不确定度主要来源为容量瓶定容体积、移液枪移取溶液、实验室温度与检定标准温度之间的差距。实验在(20±4)℃条件下进行,配制用容量瓶具经鉴定均为A级,且移液枪和容量瓶均由湖南省计量研究院检定合格,按均匀分布计算,k=,定容溶液中,水占的比例较大,以水的膨胀系数计算,水的膨胀系数为2.1×10-4℃-1,容量瓶和移液枪的最大允差及温度变化引入相对标准不确定度的如表2。
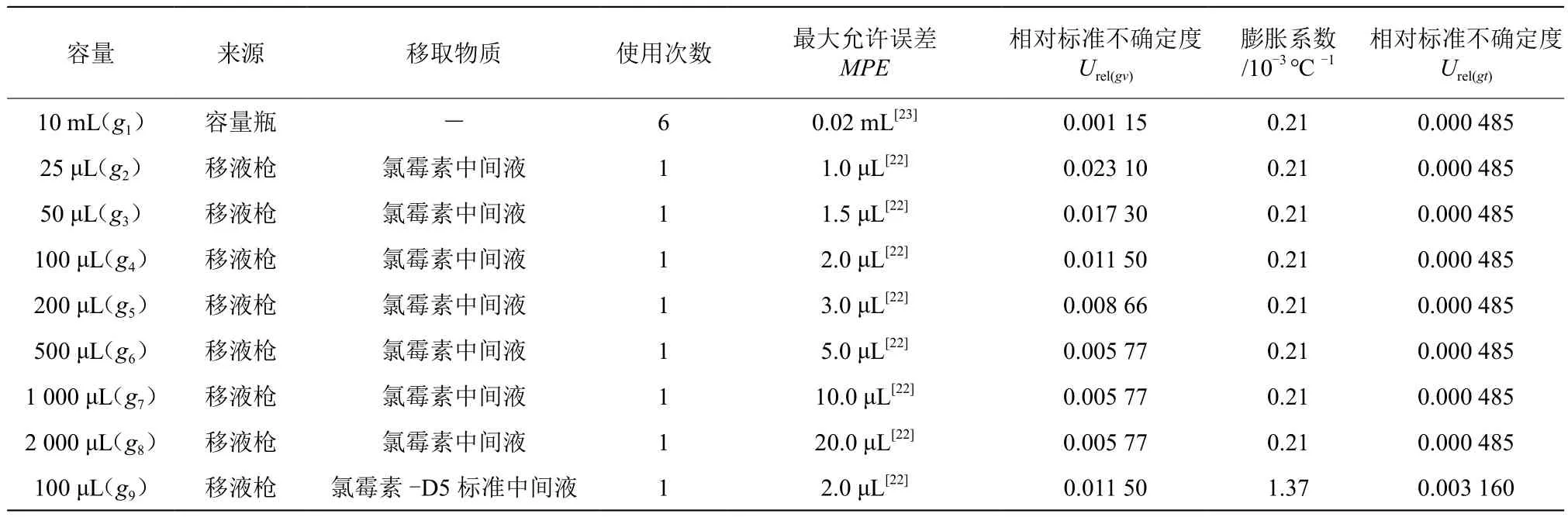
表2 标准曲线配制时使用容量瓶、移液器和温度偏差引入的相对不确定度
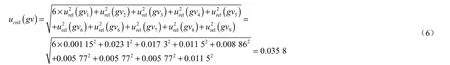
配制标准工作曲线时温度变化引入的相对标准不确定度为:

配制氯霉素标准工作溶液及标准曲线引入的相对不确定度为:
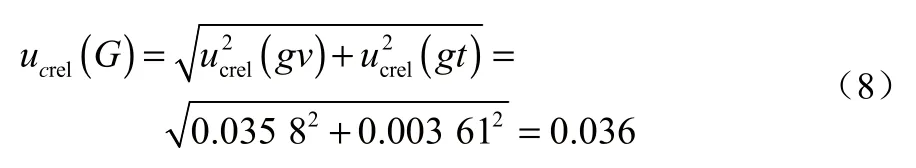
2.2.3 样品处理过程中引入的相对不确定度
称量过程中所使用的电子天平及F1砝码均经过湖南省计量研究院检定且合格,天平及砝码引入的相对不确定度,详见表3。用该天平重复秤量一份样品6次,得到5.018 5 g、5.018 9 g、5.016 7 g、5.020 4 g、5.017 3 g 和 5.019 9 g,均值为5.018 6 g,方差为1.03×10-5g2,称取样品产生的相对标准不确定度见式(9)。
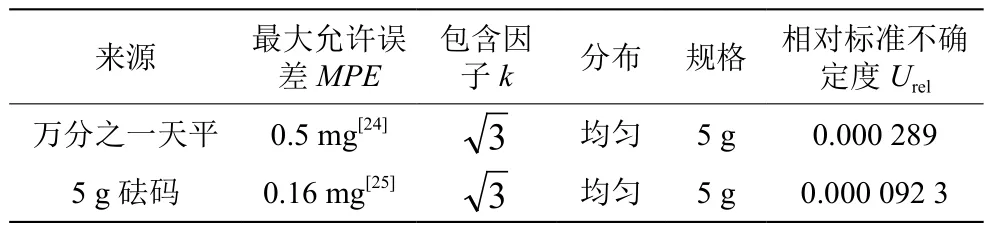
表3 天平和砝码引入的相对标准不确定度

样品按照标准[18]要求完成前处理后,加入100 μL内标氯霉素-D5标准中间液,在(20±4)℃条件下,用移液枪加入1 000 μL的水,样品处理过程中所用量器及温度引入不确定度见表4。
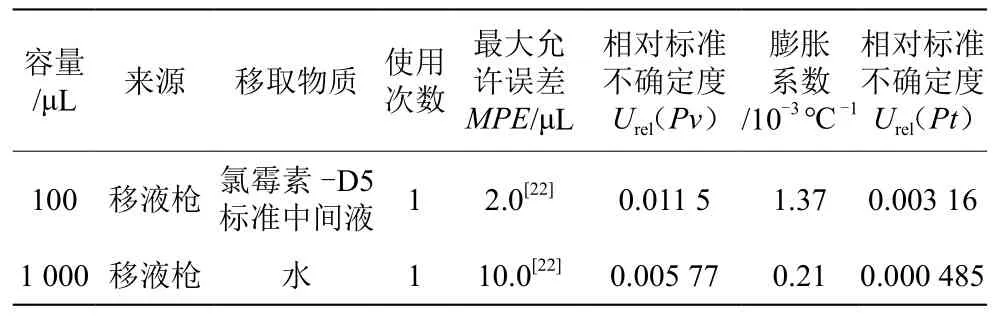
表4 样品处理过程中所用量器及温度引入的相对不确定度
样品处理过程引入的相对标准不确定度见式(10)


2.2.4 测量重复性引入的相对标准不确定度
选用一份阳性的样品,样品中氯霉素的含量为0.101 μg/kg,从中选取6份(n=6),经处理后,进行测定,测定结果见表5,测量结果重复性偏差引入的相对标准不确定度见式(11)。


表5 重复性测定结果
2.2.5 标准曲线拟合的标准偏差(峰面积残差的标准偏差)引入的相对标准不确定度
将氯霉素标准系列溶液测定3次(m=3),得到氯霉素标准系列溶液与氯霉素-D5标准系列溶液峰面积之比,取平均值。以氯霉素标准系列溶液浓度与氯霉素-D5标准系列溶液浓度之比为X坐标,氯霉素标准系列溶液与霉素-D5标准系列溶液峰面积之比作为Y坐标,用最小二乘法拟合求出一元回归方程及相关系数,计算结果见表6。
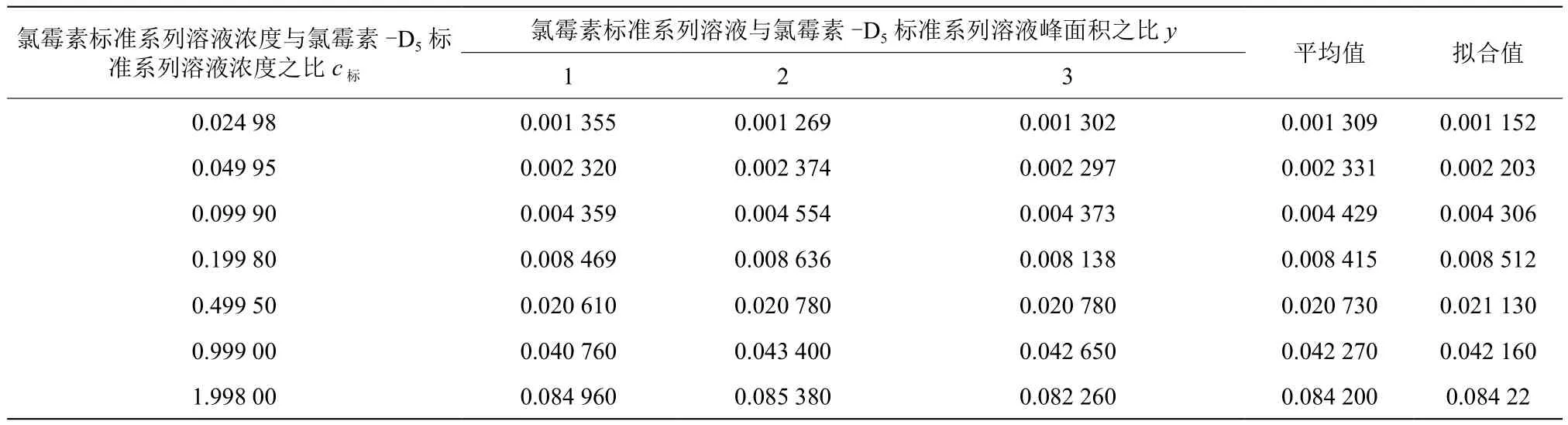
表6 氯霉素标准系列溶液3次测定的结果
采用最小乘法拟合浓度-峰面积之比的标准工作曲线,线性回归方程为y=0.042 1x+0.000 1;相关系数为:r=1.000 0>0.995,符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)标准要求,氯霉素标准系列溶液与氯霉素-D5标准系列溶液峰面积之比和氯霉素的浓度具有显著的线相关性。根据贝塞尔公式,标准曲线的剩余标准差SY见式(12),测量样品溶液6次(p=6)详见表5,平均浓度为0.498 μg/mL,最小二乘法拟合标准曲线求样品浓度时产生的标准不确定度见式(13)。

式中:yij为仪器实测各点峰面积之比;a为为线性回归方程的截距;b为线性回归方程的斜率;n为标准曲线测量点数,n=7;m为标准曲线测定的重复次数,m=3;C标ij为氯霉素标准系列溶液浓度与氯霉素-D5标准系列溶液浓度之比,ng/mL;为C标ij的平均值,ng/mL。
最小二乘法拟合标准曲线求样品浓度时产生的相对标准不确定度见式(14)。

2.3 合成相对标准不确定度和相对扩展不确定度的评定
2.3.1 合成相对标准不确定度
综合以上由标准物质、标准曲线配制、样品处理、最小二乘法拟合标准曲线求样品浓度、测量重复性5个方面引入的相对标准不确定度,得到合成相对标准不确定度见式(15)。

2.3.2 扩展不确定度的评定
假设该测量误差属于正态分布,置信区间为95%时,取包含因子k为2,相对扩展不确定度见式(16)。

样品中氯霉素检测为0.101 μg/kg,则其扩展不确定度见式(17)。

3 结论
分析得出,本文所用鸡肉样品中氯霉素残留量可表示为W=(0.101±0.008 76)μg/kg,其中包含因子k=2,不符合中华人民共和国农业农村部公告(第250号)《食品动物中禁止使用的药品及其他化合物清单》[8]对动物组织中氯霉素最大残留量的限制。鸡肉中氯霉素残留量测量不确定度的评定时发现,5个已分析的不确定度来源中,所占比重最大是标准曲线配制,其次是最小二乘法拟合标准曲线,其中多次使用容量瓶及移液枪的前处理步骤引入相对不确定度最大。在测量重复性实验中,液相色谱-串联质谱仪仪器性能稳定,有较好的重复性。因此,保证标准物质状态以及标准曲线的准确可靠、提高人员操作规范性,可有效提高实验的准确性。同时,增加多次测量等质量控制手段也能有效降低不确定度,保证结果的准确性。
