金龟子绿僵菌黏附素基因mad1的敲除及功能分析
2021-10-12闫多子蔡霓农向群王广君涂雄兵张泽华
闫多子 蔡霓 农向群 王广君 涂雄兵 张泽华

摘要 金龟子绿僵菌能够寄生昆虫,也能与植物共生。黏附素MAD1是绿僵菌与宿主互作初期的黏附因子。已知它在昆虫的侵染和致病中起重要作用,但与植物的互作机制报道甚少。为了研究MAD1在绿僵菌与植物共生中的作用,我们通过同源重组构建了金龟子绿僵菌mad1敲除株,并检测了敲除株的生长、产孢、孢子萌发及毒力等生物学特性,进一步利用qRT-PCR分析了MAD1在调节花生免疫响应中的作用。结果显示,与野生型菌株相比,敲除株产孢量降低了43.67%,分生孢子萌发中时为27.69 h,显著长于野生型菌株的13.43 h。敲除株对家蚕的半致死时间LT50为8.9 d,较野生型菌株的7.62 d显著延长。敲除株处理花生6 h后,花生免疫类基因CNGC1、PCD4,抗病基因SWEET10及转录因子WRKY41、MYB86的转录水平出现显著上调,而钙调素CML5、CML19的转录表达受到明显抑制。本研究证明了mad1是金龟子绿僵菌产孢、孢子萌发及毒力的正相关基因,并且MAD1在金龟子绿僵菌与植物相互作用初期,抑制植物抗性级联反应,减弱过敏反应,降低对微生物的抵御能力,同时增强共生信号的传导,这些作用有助于金龟子绿僵菌在花生根组织上定殖。
关键词 金龟子绿僵菌; MAD1; 基因敲除; 共生; 花生
中图分类号: S 476.12
文獻标识码: A
DOI: 10.16688/j.zwbh.2020629
Knockout and functional analysis of the adhesin gene mad1 in Metarhizium anisopliae
YAN Duozi1, CAI Ni1, NONG Xiangqun1*, WANG Guangjun1,2, TU Xiongbing1, ZHANG Zehua1
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. National Plant Protection
Xilinguole Observation and Experiment Station, Xilinhaote 026000, China)
Abstract
Metarhizium anisopliae is an entomopathogenic fungus and also an endophyte in plants. The adhesin MAD1 is the adhesion factor in the initial stage of interaction between M.anisopliae and insects or plant hosts. It is known that the adhesin is very important for infection and pathogenicity to insects, but its role in the interaction with plants is still unclear. Here, we aimed to explore the role of MAD1 in the symbiosis between M.anisopliae and plants. We constructed mad1 knockout strain by homologous recombination and tested the biological characteristics such as growth, sporulation, spore germination and virulence of the mad1 mutant. Furthermore, the effect of MAD1 on the peanut defense response was analyzed by qRT-PCR. The results showed that the spore production of the knockout strain reduced by 43.67%, and the spore semi-germination time was 27.69 h, which was significantly longer than 13.43 h of the wild type strain. The semi-lethal time LT50 of the knockout strain against the Bombyx mori was 8.9 d, which was significantly longer than 7.62 d of the wild type strain. In addition, 6 h after inoculating the knockout strain to peanut, the transcription levels of the immune genes CNGC1 and PCD4, disease resistance gene SWEET10 and transcription factors WRKY41 and MYB86 were significantly up-regulated, while the transcriptional expression of calmodulin CML5 and CML19 were significantly inhibited. This study suggested that mad1 was a positively correlated gene of sporulation, spore germination and virulence in M.anisopliae. Moreover, MAD1 inhibited the plant resistance cascade, weakened the allergic reactions and reduced the resistance to microorganisms, but synchronously enhanced the transduction of symbiotic signals at the initial stage of the interaction between M.anisopliae and plants. These effects were conducive to the colonization of M.anisopliae in peanut root tissues.
Key words
Metarhizium anisopliae; MAD1; gene knockout; symbiosis; peanut
绿僵菌Metarhizium作为一类昆虫病原真菌,经过漫长的适应性进化,形成了基物腐生、植物共生、昆虫寄生3种生活方式。由于具有广泛的杀虫能力,被用于防治多种农林害虫,如蝗虫、蛴螬等[1]。绿僵菌的致病机理相对复杂,有很多基因在绿僵菌对昆虫寄主的附着、定殖、穿透中发挥重要作用。已有研究发现,金龟子绿僵菌Metarhizium anisopliae在昆虫体表附着时产生黏附蛋白MAD1,促进真菌孢子稳定地吸附于昆虫体表,当mad1基因缺失后,金龟子绿僵菌分生孢子对寄主体表的黏附能力与毒力都显著降低[2]。对MAD1二级结构预测发现其含有8个半胱氨酸的CFEM功能域,是真菌细胞膜蛋白特有结构,可以作为细胞表面受体或信号转导器,参与细胞的黏附作用。研究表明mad1的缺失会抑制金龟子绿僵菌附着孢的形成和菌丝体分化,且影响细胞分裂和细胞骨架的形成[2]。所以研究MAD1对绿僵菌分生孢子的发育调控以及对菌株毒力的影响有重要作用。
近年研究发现,绿僵菌能够在植物根际和根内宿存,促进植物生长[3-5]。据检测,绿僵菌属真菌可以成功定殖于单子叶和双子叶植物根表皮,包括番茄Lycopersicon esculentum、蚕豆Vicia faba、油菜Brassica napus和菜豆Phaseolus vulgaris等[6-9]。有研究表明种植木薯Manihot esculenta的土壤用金龟子绿僵菌孢子悬浮液浸泡7~9 d后,木薯近根端金龟子绿僵菌定殖水平达80%。且在接种47 d后,定殖水平并未出现下降趋势[10]。Lahey等[11]通过对罗伯茨绿僵菌Metarhizium robertsii处理的玉米和大豆根表面和内部进行绿僵菌菌落数(cfu)的检测,发现植物茎基部下胚轴菌落数较多,表明绿僵菌可以定殖于植物根部,且对茎基部下胚轴部位有嗜好性。Wang等[12]研究发现金龟子绿僵菌可以抑制植物的基础免疫能力,同时促进植物生长及与微生物共生相关基因的表达。此外罗伯茨绿僵菌产生的3-吲哚乙酸可激活IAA调节相关基因表达,刺激拟南芥Arabidopsis thaliana根系生长[13]。虽然目前已有很多研究证实绿僵菌可以在植物根部定殖,但绿僵菌作为植物内生菌其黏附、定殖于植物的过程和机理研究甚少。而MAD1是否参与介导绿僵菌在植物上的黏附、定殖及其与植物互作的机制尚未见报道。为了研究黏附素MAD1在绿僵菌与植物互作中的作用,我们构建了mad1敲除突变株,并检测了其生长速率、萌发率、产孢量以及对家蚕Bombyx mori 的致死率等生物学特性,还检测了野生型菌株、突变株处理下的花生免疫相关基因的转录水平变化,以期为分析MAD1的功能作用、阐述绿僵菌与植物的互作机制提供基础数据。
1 材料与方法
1.1 生物材料
供试植物为花生Arachis hypogaea‘鲁花11品系,从农资商店采购。
金龟子绿僵菌 M.anisopliae Ma9-41为本实验室保存的潮霉素敏感菌株。
克隆载体PBM23含T7启动子及多克隆位点,购自博迈德生物公司。
基因敲除载体pKH-KO含潮霉素hyg抗性基因和氨苄青霉素Amp抗性基因,可以一步在hyg的两侧同时插入上下游同源重组片段,该载体由中國农业科学院植物保护研究所李梅研究员馈赠。
1.2 试剂及培养基
反转录试剂盒Prime ScriptTM 1st strand cDNA synthesis kit、限制性内切酶Xba I、Hind Ⅲ、T4 DNA连接酶购自TaKaRa公司,DNA纯化回收试剂盒、裂解酶 Lysing Enzyme from Trichoderma 购自威莱博生物技术有限公司。
马铃薯蔗糖琼脂培养基(PSAY):1 000 mL中含马铃薯200 g,蔗糖20 g,琼脂18 g,酵母粉5 g。
SDAY培养基:1 000 mL中含酵母粉10 g,葡萄糖40 g,蛋白胨10 g。
产菌丝培养基:1 000 mL中含硫酸镁2 g,酵母粉10 g,蔗糖20g,磷酸氢二钾5 g。
原生质体buffer:蜗牛酶0.2 g,用20 mL灭菌的0.7 mol/L的NaCl溶液溶解,0.45 μm的无菌滤器过滤。
TB3固体培养基:TB3中加入10%~15%的琼脂粉,121℃高压蒸汽灭菌15 min。
1.3 mad1敲除突变株的构建
1.3.1 敲除载体的构建
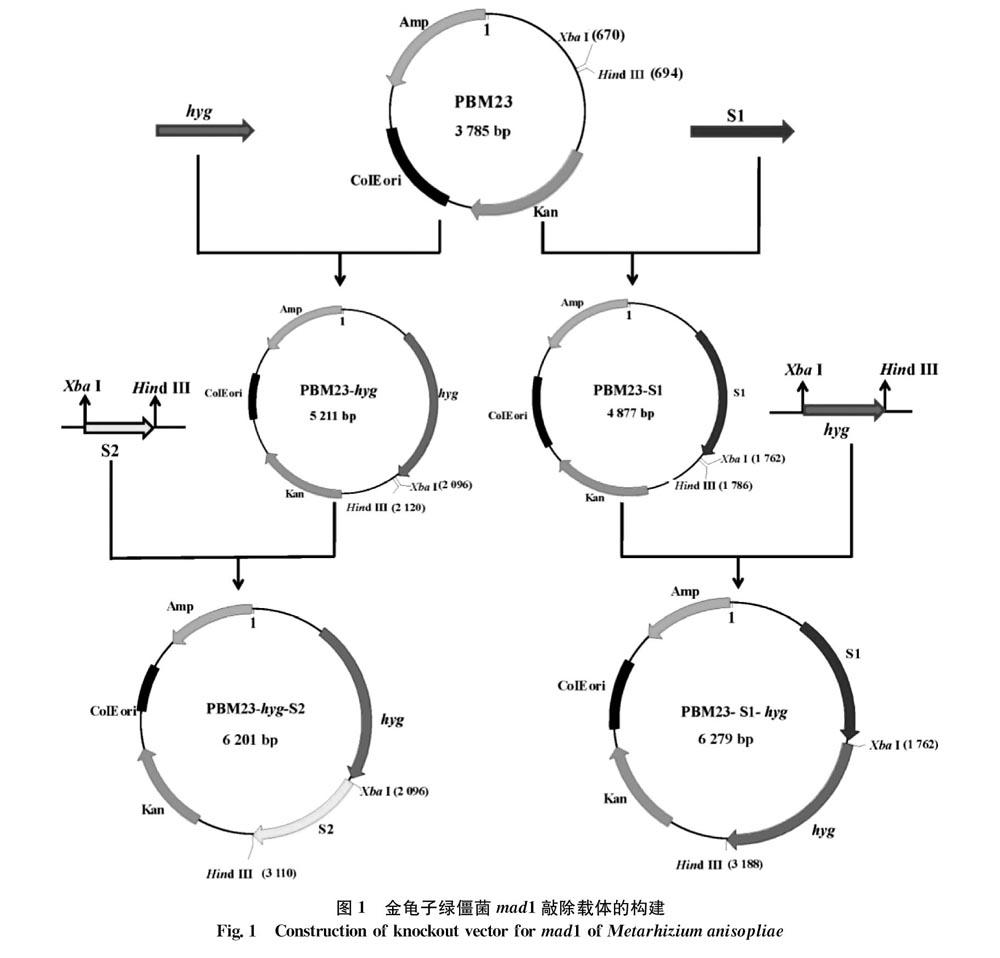
以 pKH-KO质粒DNA为模板,分别扩增潮霉素抗性基因hyg全长序列和加XbaⅠ和Hind Ⅲ 酶切位点的hyg。以金龟子绿僵菌Ma9-41基因组DNA为模板,分别扩增mad1基因的上游同源臂序列S1以及加有酶切位点XbaⅠ和Hind Ⅲ的下游同源臂序列S2。将扩增的hyg和S1分别连接到克隆载体PBM23上,获得重组载体PBM23-hyg和PBM23-S1。通过定点酶切和连接,将带有XbaⅠ和Hind Ⅲ酶切位点的hyg基因连接到PBM23-S1载体上,获得敲除载体PBM23-S1-hyg,同理,将带有XbaⅠ和Hind Ⅲ 酶切位点的S2基因连接到PBM23-hyg载体上,获得敲除载体PBM23-hyg-S2(图1)。所用引物信息见表1。
1.3.2 敲除片段的获得
以敲除载体PBM23-S1-hyg的质粒DNA为模板,扩增获得敲除片段1:S1+hyg前2/3片段;以敲除载体PBM23-hyg-S2的质粒DNA为模板,扩增得到敲除片段2:hyg后2/3片段+S2。所用引物信息见表1。优化后的PCR反应体系(50 μL):2×Taq PCR Master Mix 25 μL,10 μmol/L上、下游引物各4 μL,DNA 2 μL,补足RNase-free water(北京博奥拓达科技有限公司)至50 μL。PCR反应程序为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,35个循环;72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳,用Biomed回收试剂盒进行纯化回收。
1.3.3 敲除片段的转化
参照王晓玲等[14]的CaC12-PEG介导原生质体转化法,将敲除片段S1+hyg前2/3片段、hyg后2/3片段+S2转入金龟子绿僵菌Ma9-41原生质体中。其过程主要包括金龟子绿僵菌分生孢子在产菌丝培养基中培养30 h获得幼嫩菌丝,并在原生质体缓冲液中于30℃下酶解获得原生质体;将敲除片段导入金龟子绿僵菌原生质体中,与40% PEG 8000孵育20 min;最后在含低熔点琼脂糖的TB3固体培养基(含100 μg/mL Amp, 300 μg/mL潮霉素)上28℃恒温培养3 d,获得菌落为假定转化子。
1.3.4 转化子筛选及鉴定
挑选60个假定转化子,分别转接至含300 μg/mL潮霉素的PSAY 培养基上,继代培养5代。选取第5代的所有转化子,分别利用真菌提取试剂盒(北京天漠科技开发有限公司)提取基因组DNA。以基因组DNA为模板,以S1-F, 2/3hyg-R为引物扩增S1+hyg前2/3片段;以mad1-F/mad1-R为引物扩增mad1基因。同时以野生型菌株Ma9-41为对照进行扩增。扩增结果为S1+hyg前2/3片段阳性且mad1阴性的转化子初步判断为敲除菌株(Δmad1),挑选4株敲除菌株进行cDNA验证,检测mad1基因,保存阳性菌株,选取一个阳性转化子用于后续试验。
1.4 野生型菌株与敲除株生物学特性比较
1.4.1 野生型菌株和mad1敲除株生长速率及产孢量测定
参照蔡守平等[15]的方法并加以改善。将活化的金龟子绿僵菌野生型菌株Ma9-41、敲除株Δmad1的分生孢子用0.1%的吐温 -80配成1.0×106个/mL的孢子悬浮液,用微量移液器取10 μL分别点滴接种于 PSAY平板中央,各重复5次,于26℃培养。从第3天开始,每天用电子数显卡尺以十字交叉法测量1次菌落直径,取5个重复菌落的平均值,观察测量至第11天共9次,比较敲除株和野生型菌株的菌落生长速率。待培养12 d后菌落表面完全覆盖分生孢子时,用直径5 mm的打孔器在距离菌落中心1/2处打取菌饼,每菌落按十字对称取4个菌饼,置于定量的01%的吐温 -80无菌水溶液中,振荡使孢子充分分散。用血球计数板测定孢子浓度并换算成单位面积的产孢量,各菌株重复测定5次。
1.4.2 野生型菌株和mad1敲除株萌发率测定
参照曹月青等[16]的方法将金龟子绿僵菌野生型菌株Ma9-41、敲除株Δmad1的分生孢子置于含5 mL SDAY的试管中,调整孢子浓度为106个/mL,取10 μL孢子悬浮液滴加在载玻片上,涂成直径约1 cm的圆点,小心将其置于铺有2层湿滤纸的培养皿中,在28℃保湿培养,于6、12、24、48 h后在显微镜下观察孢子萌发情况,孢子萌芽长度大于孢子长度的一半视为萌芽,计数萌芽与未萌芽的孢子数量。每个时间点检测3个载玻片,每片观察的视野不少于100个孢子。计算萌发率及萌发中时。
分生孢子萌发率=(孢子萌发总数/镜检孢子总数)×100%。
萌发中时采用Excel 2010进行回归分析得出金龟子绿僵菌孢子萌发率与萌发时间的回归直线方程和相关性,计算孢子萌发率达到50%所需时间。
1.4.3 野生型菌株和mad1敲除株对家蚕毒力测定
采用喷雾法测定[17]。将野生型菌株Ma9-41与敲除株Δmad1分生孢子分别置于0.05%吐温-80中,配制成浓度为3×108个/mL的分生孢子悬浮液备用。将3龄家蚕(山东青州广通蚕农场室内饲养)饥饿处理4 h后分配到已消毒的25 cm×20 cm×9 cm生测框内,每框30头,每处理重复5框。接种处理时,将每框试虫分散置于直径为10 cm的无菌培养皿中,使用喷雾塔(Burkard Potter Precision Laboratory)喷施4 mL菌液,移回框内,1 h后每框给足量桑叶饲喂,试验在(28±2)℃,相对湿度为40%~65%的室内进行。处理后第3天开始记录家蚕死亡数,计算累计死亡率。
累计死亡率=(死亡总虫数/处理总虫数)×100%。
1.5 黏附素MAD1诱导花生免疫相关基因的响应
孢子悬浮液的制备。将Ma9-41、敲除株Δmad1接种于PSAY培养基上,26℃培养14 d,收集分生孢子,用灭菌的0.1%吐温-80水溶液配制并调整终浓度至1×108个/mL。
花生种植及接菌处理。花生种子表面消毒参照Sara等[18]的方法,于70%乙醇中浸泡1 min,无菌水冲洗3次,再用1%次氯酸钠溶液浸泡15 min,无菌水冲洗3次,完成消毒。将消毒后的种子置于含有50 mL ddH2O的直径为15 cm的培养皿中,并置于28℃黑暗培养箱中催芽24 h。挑选健康且萌芽一致的种子播种于装满灭菌蛭石的花盆中,于培养室(28℃,L∥D=14 h∥10 h,相对湿度40%~65%)中培养7 d至花生二叶期。挑选生长一致的植株,小心连根取出,将根部蛭石用蒸馏水冲洗干净,用1×108个/mL的金龟子绿僵菌Ma9-41、敲除株Δmad1孢子悬浮液浸泡花生根部,每个处理重复3株。处理6 h后将根取出,用吸水纸吸干,立即置于液氮中。快速将根剪成5~8 mm,同一处理不同的重复进行混样并分成 3份,保存于-80℃备用。
RNA提取及反转录。取花生根样品,置于液氮中研磨,然后用TRIzol试剂盒(Invitrogen)提取总RNA。用Prime ScriptTM 1st strand cDNA synthesis kit(TaKaRa)进行反转录,得到cDNA。并用NanoPhotometer微量分光光度计(IMPLEN, 德国)检测浓度。
实时荧光定量 PCR检测。基于之前的转录组分析确定候选基因設计的引物序列见表2,内参基因选用60S 核糖体蛋白L7(RPL7)。用SYBR Green荧光定量试剂盒(TaKaRa)在7500型(ABI)实时荧光定量PCR系统进行反应。反应体系为2×SYBR Green Master Mix 10 μL, 10 μmol/L正、反向引物各1 μL,cDNA 0.8 μL,补足RNase-free water至20 μL。PCR扩增程序为95℃预变性2 min;95℃变性5 s,60℃复性30 s,40个循环。每样品3次技术重复,基因相对表达量采用2-ΔΔCt的方法进行分析。
1.6 数据处理
试验数据利用SPSS 20.0进行分析,分析结果采用GraphPad Prism 6软件进行图表绘制。
2 结果与分析
2.1 mad1敲除突变株的构建
2.1.1 敲除载体的构建
用设计的mad1上、下游同源臂序列的特异性引物,从金龟子绿僵菌野生型菌株Ma9-41基因组DNA中扩增获得mad1上游同源臂序列S1,带有XbaⅠ和Hind Ⅲ 酶切位点的下游同源臂序列S2,长度分别为1 092、1 035 bp。以引物hyg-F/-R从质粒pKH-KO中扩增得到潮霉素抗性基因hyg,长度为1 426 bp(图2a)。以敲除载体PBM23-S1-hyg质粒DNA为模板,以S1-F、hyg-R为引物,扩增得到S1+hyg片段,长度为2 529 bp。以敲除载体PBM23-hyg-S2质粒为模板,以hyg-F、S2-R为引物,扩增得到hyg+S2片段,长度为2 455 bp,测序结果表明敲除载体PBM23-S1-hyg、PBM23-hyg-S2构建成功(图2b)。以测序成功的PBM23-S1-hyg质粒DNA为模板,以S1-F、2/3hyg-R为引物,扩增获得敲除片段S1+hyg前2/3片段,长度为2 037 bp,以测序成功的PBM23-hyg-S2质粒DNA为模板,以1/3hyg-F、S2-R为引物,扩增获得敲除片段hyg后2/3片段+S2,长度为1 954 bp(图2c)
2.1.2 原生质体转化及敲除株的验证
利用PEG介导的原生质体转化法,将敲除片段S1+hyg前2/3片段、hyg后2/3片段+S2转入Ma9-41原生质体中,获得原生质体再生细胞,通过继代抗性筛选获得假定转化子。提取第5代转化子的基因组DNA,并扩增mad1基因及S1+hyg前2/3片段,以野生型菌株Ma9-41为对照。结果 60个假定转化子中有7个成功扩增出S1+hyg前2/3片段,但未扩增出mad1基因,表明mad1敲除成功(图3a,b)。这7个阳性转化子分别为2-21,2-24,1-11,1-19,1-26,1-27,1-29,以其中4株阳性转化子的cDNA为模板,扩增 mad1基因(图3c),进一步验证mad1基因敲除成功。
2.2 mad1敲除株的生物学特性变化
2.2.1 野生型菌株和mad1敲除株的生长速率和产孢量
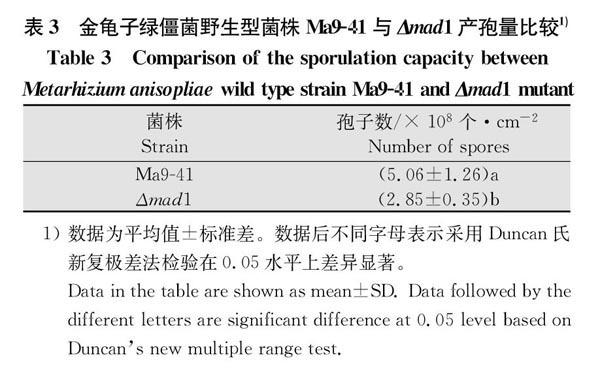
对野生型菌株Ma9-41与Δmad1在PSAY培养基上生长3~11 d的菌落直径分析显示,二者的菌落生长速率无显著差异(t测验,P>0.05)(图4)。产孢量有显著差异(表3),野生型菌株Ma9-41在第11天的产孢量为(5.06±1.26)×108个/cm2,而Δmad1菌株在第11天测得产孢量为(2.85±0.35)×108个/cm2,与Ma9-41相比,Δmad1产孢量下降了43.67%,表明mad1的敲除明显抑制了真菌产孢。
2.2.2 野生型菌株和mad1敲除株的孢子萌发率比较
野生型菌株Ma9-41和敲除株Δmad1孢子悬浮液制成的载玻片在28℃恒温培养箱中培养,结果表明, Δmad1菌株的萌发率在6、12、24、48 h均显著低于野生型菌株(P<0.05)(图5)。经计算Ma9-41菌株的萌发中时为13.43 h,而Δmad1菌株的萌发中时为27.69 h,显著长于野生型菌株,表明mad1的缺失抑制真菌的萌发。
2.2.3 野生型菌株和mad1敲除株对家蚕的毒力
在喷雾接种3×108个/mL分生孢子悬浮液的条件下,处理第9天时,野生型菌株Ma9-41处理的家蚕累计死亡率达到85.56%,Δmad1处理的家蚕的累计死亡率为56.67%,毒力显著降低。Ma9-41处理的LT50为7.62 d, Δmad1处理的LT50为8.9 d,这些结果表明mad1基因主要在金龟子绿僵菌侵染家蚕后期发挥毒力作用(图6)。
2.3 黏附素MAD1诱导花生响应的作用分析
通过检测野生型菌株Ma9-41、Δmad1处理花生根后8个免疫相关基因的转录水平,发现处理6 h后,与野生型菌株相比,Δmad1显著促进了免疫正调控因子WRKY41的转录,且差异倍数高达3.27倍;同时,环核苷酸门控通道CNGC1、抗逆转录因子MYB86、过敏反应引起的细胞程序性死亡基因PCD4、抗病基因SWEET10的转录水平也相对升高,转录水平分别是野生型菌株的1.7、1.3、1.4、116倍(图7)。相反,Δmad1显著抑制了钙调素CML5、CML19的转录水平,抑制程度分别为野生型菌株的033、0.44倍。由此结果得出,MAD1在金龟子绿僵菌接种花生植株初期6 h即可发挥作用,显著抑制植株的免疫反应相关基因表达,同时调控CML的相关反应。
3 讨论
MAD1作为黏附性蛋白,在绿僵菌与寄主(包括昆虫和植物)的互作初始识别中发挥重要作用,但是关于它的生物学功能研究甚少,本研究通过mad1缺失突变株证明,MAD1与金龟子绿僵菌产孢、孢子萌发及对家蚕的毒力相关。
MAD1在绿僵菌与植物识别中的作用未见报道。前人研究表明绿僵菌可以抑制花生根细胞微生物识别受体相关基因,对花生细胞反应进行重编程,促进植物共生基因SYMRK、CaM、CCaMK的转录,从而有利于绿僵菌的侵染定殖及植物生长[12,19]。然而,这种有益互作的机制还远未阐明。植物与微生物的交流源于两者相互感知及识别,而植物细胞识别微生物早期信号事件之一是Ca2+内流进入细胞质,在与植物的共生途径中,会存在钙离子的激增现象[20]。CMLs(钙调素类蛋白)具有保守的Ca2+结合结构域,在共生过程中具有信号传导的功能[21-22]。Jongho等[23]研究发现植物在受到丛枝菌根真菌根内球囊霉Rhizophagus irregularis侵染后,胞内Ca2+浓度迅速升高,推测 Ca2+-CaM/CML 信号通路被激活,最后促使植物与该真菌建立稳定的共生关系。WRKY是植物抗病相关的转录因子,参与植物与微生物互作[24]。拟南芥接种丁香假单胞菌番茄致病变种DC3000(Pseudomonas syringae pv. tomato DC3000)后诱导了WRKY41表达,表明WRKY41在拟南芥的抗逆中起着正调控作用[25]。CML可以与WRKY结合,调控植物免疫反应[26]。环核苷酸门控通道(CNGCs)是控制Ca2+穿过细胞膜的非选择阳离子通道,将Ca2+传导到细胞质内,作为病原体免疫信号级联的早期事件,介导植物的抗性[27-28]。研究表明,烟草在受茄科雷尔氏菌Ralstonia solanacearum誘导后,根中CNGC1高量表达,证明CNGC1是烟草青枯病抗性基因[29]。MYB86是一种转录阻遏子,应答环境变化与激素调节,与植物防御反应有关[30]。PCD4是细胞程序性死亡基因,是植物为了抵御病原物侵染而诱发局部的细胞死亡,可以将病原物限制在侵染点,阻止病原物的进一步扩散[31]。SWEET10编码一种细胞膜定位蛋白,具有蔗糖转运功能。有研究表明过表达SWEET10基因能够促进甘薯品系‘ND98叶片中糖分向外运输,降低叶片中的糖含量,减少了对病原菌生长繁殖的能量供应,提高植物的抗病性。SWEET10的过表达还可以增强甘薯对尖孢镰刀菌Fusarium oxysporum的抗性[32]。
本研究中,Δmad1處理花生6 h后,花生根中转录因子WRKY41、MYB86和免疫相关基因CNGC1、PCD4以及抗病相关基因SWEET10均显著上调,表明了MAD1在金龟子绿僵菌与植物作用初期,抑制了转录因子WRKY41、MYB86的转录水平,可进一步抑制花生植株对微生物的抵御能力;CNGC1的表达受到抑制,可弱化将Ca2+传导到细胞质内的能力,抑制植物抗性级联反应;并通过抑制PCD4,削弱植物的过敏反应,这些作用均为金龟子绿僵菌在植物上的定殖提供基础。同时MAD1抑制SWEET10的表达,可能是MAD1抑制植物的防御使植物与微生物兼容,MAD1抑制植物组织中蔗糖向外运输,从而为微生物提供能量。重要的是,MAD1增强了两种CML的转录水平,提高了与Ca2+的结合能力,这种机制在植物与微生物的共生信号交流中起着重要作用,有助于金龟子绿僵菌在花生根组织上定殖和建立共生。上述有关MAD1诱导调节植物免疫和共生相关基因的功能分析,可作为进一步阐述MAD1参与金龟子绿僵菌与植物定殖和共生机制的基础。
参考文献
[1] LEGER R J S, WANG Chengshu. Genetic engineering of fungal biocontrol agents to achieve greater efficacy against insect pests [J]. Applied Microbiology and Biotechnology, 2010, 85(4): 901-907.
[2] WANG Chengshu, LEGER R J S. The MAD1 adhesin of Metarhizium anisopliae links adhesion with blastospore production and virulence to insects, and the MAD2 adhesin enables attachment to plants [J]. Eukaryotic Cell, 2007, 6(5): 808-816.
[3] SASAN R K, BIDOCHKA M J. The insect-pathogenic fungus Metarhizium robertsii (Clavicipitaceae) is also an endophyte that stimulates plant root development [J]. American Journal of Botany, 2012, 99(1): 101-107.
[4] JABER L R, JUERG E. Fungal entomopathogens as endophytes: can they promote plant growth? [J]. Biocontrol Science and Technology, 2017, 27(1): 28-41.
[5] CAI Ni, WANG Feng, NONG Xiangqun, et al. Visualising confirmation of the endophytic relationship of Metarhizium anisopliae with maize roots using molecular tools and fluorescent labelling [J]. Biocontrol Science and Technology, 2019(6): 1-14.
[6] GARCA J E, POSADAS J B, PERTICARI A, et al. Metarhizium anisopliae (Metschnikoff) Sorokin promotes growth and has endophytic activity in tomato plants [J]. Advances in Biological Research, 2011, 5(1): 22-27.
[7] AKELLO J, SIKORA R. Systemic acropedal influence of endophyte seed treatment on Acyrthosiphon pisum and Aphis fabae offspring development and reproductive fitness [J]. Biological Control, 2012, 61(3): 215-221.
[8] BATTA Y A. Efficacy of endophytic and applied Metarhizium anisopliae (Metch.) Sorokin (Ascomycota: Hypocreales) against larvae of Plutella xylostella L. (Yponomeutidae: Lepidoptera) infesting Brassica napus plants [J]. Crop Protection, 2013, 44: 128-134.
[9] BEHIE S W, JONES S J, BIDOCHKA M J. Plant tissue localization of the endophytic insect pathogenic fungi Metarhizium and Beauveria [J]. Fungal Ecology, 2015, 13: 112-119.
[10]GREENFIELD M, GMEZ-JIMNEZ M I, ORTIZ V, et al. Beauveria bassiana and Metarhizium anisopliae endophytically colonize cassava roots following soil drench inoculation [J]. Biological Control Theory & Application in Pest Management, 2016, 95: 40-48.
[11]LAHEY S, ANGELONE S, DEBARTOLO M O, et al. Localization of the insect pathogenic fungal plant symbionts Metarhizium robertsii and Metarhizium brunneum in bean and corn roots [J]. Fungal Biology, 2020, 124(10): 877-883.
[12]WANG Feng, NONG Xiangqun, HAO Kun, et al. Identification of the key genes involved in the regulation of symbiotic pathways induced by Metarhizium anisopliae in peanut (Arachis hypogaea) roots [J/OL]. 3 Biotech, 2020, 10: 124. DOI: 10.1007/s13205-020-2105-x.
[13]LIAO Xinggang, LOVETT B, FANG Weiguo, et al. Metarhizium robertsii produces indole-3-acetic acid, which promotes root growth in Arabidopsis and enhances virulence to insects [J]. Microbiology, 2017, 163(7): 980-991.
[14]王曉玲, 蒋伶活, 张泽华. 以G418抗性为选择标记的金龟子绿僵菌原生质体转化的研究[J]. 安徽农业科学, 2007, 35(28): 8865-8866.
[15]蔡守平, 何学友, 曾丽琼, 等. 感染星天牛幼虫高致病力金龟子绿僵菌菌株的筛选[J]. 中国生物防治学报, 2012, 28(2): 293-297.
[16]曹月青, 朱祥先. 蝗翅上绿僵菌孢子萌发及附着胞观察[J]. 应用与环境生物学报, 2010, 16(5): 750-752.
[17]孙晓东, 刘丽, 张晶, 等. 一株防治棕榈害虫红棕象甲幼虫的绿僵菌[C]∥2014年中国植物保护学会学术年会论文集. 北京: 中国农业科学技术出版社, 2014: 534.
[18]SARA M, ELEONORA C, FRANCESCA S, et al. Development of a qPCR strategy to select bean genes involved in plant defense response and regulated by the Trichoderma velutinum-Rhizoctonia solani interaction [J/OL]. Frontiers in Plant Science, 2016, 7: 1109. DOI: 10.3389/fpls.2016.01109.
[19]HAO Kun, WANG Feng, NONG Xiangqun, et al. Response of peanut Arachis hypogaea roots to the presence of beneficial and pathogenic fungi by transcriptome analysis [J/OL]. Scientific Reports, 2017, 7(1): 964. DOI: 10.1038/s41598-017-01029-3.
[20]张超, 赵芊, 张哲, 等. 植物免疫应答过程中Ca2+及CaM/CML的功能[J]. 生物学杂志, 2014, 31(2): 69-72.
[21]BATISTI O, KUDLA J. Analysis of calcium signaling pathways in plants [J]. Biochimica et Biophysica Acta, 2012, 1820(8): 1283-1293.
[22]熊珊珊, 赵斌. 丛枝菌根真菌的钙调素基因在共生过程中的作用[J]. 湖北农业科学, 2014, 53(13): 3177-3182.
[23]JONGHO S, J.BENJAMIN M, EMMA G, et al. Activation of symbiosis signaling by arbuscular mycorrhizal fungi in legumes and rice [J]. Plant Cell, 2015, 27(3): 823-838.
[24]MEENA M, SWAPNIL P. Regulation of WRKY genes in plant defence with beneficial fungus Trichoderma: current perspectives and future prospects [J]. Archives of Phytopathology and Plant Protection, 2019, 52(5): 1-17.
[25]HIGASHI K, ISHIGA Y, TOYODA K, et al. Modulation of defense signal transduction by flagellin-induced WRKY41 transcription factor in Arabidopsis thaliana [J]. Molecular Genetics and Genomics, 2008, 279(3): 303-312.
[26]GALON Y, FINKLER A, FROMM H. Calcium-regulated transcription in plants [J]. Molecular Plant, 2010, 3(4): 653-669.
[27]NAWAZ Z, KAKAR K, SAAND M A, et al. Cyclic nucleotide-gated ion channel gene family in rice, identification, characterization and experimental analysis of expression response to plant hormones, biotic and abiotic stresses [J/OL]. BMC Genomics, 2014, 15(1): 853. DOI: 10.1186/1471-2164-15-853.
[28]MA Wei, BERKOWITZ G A. Ca2+ conduction by plant cyclic nucleotide gated channels and associated signaling components in pathogen defense signal transduction cascades [J]. New Phytologist, 2011, 190(3): 566-572.
[29]林世锋, 王仁刚, 余婧, 等. 一个受青枯病菌诱导的烟草功能基因NtCNGC1的克隆与表达分析[J]. 中国烟草学报, 2018, 24(6): 90-96.
[30]单天雷, 洪彦涛, 杜丽璞, 等. 抗根腐病的TaMYB86过表达转基因小麦的创制与分子功能鉴定[J]. 作物学报, 2016, 42(10): 1429-1436.
[31]李云霞, 程晓霞, 代小梅, 等. 植物在逆境胁迫中的细胞程序性死亡[J]. 生物技术通报, 2009(4): 7-11.
[32]LI Yan, WANG Yannan, ZHANG Huan, et al. The plasma membrane-localized sucrose transporter IbSWEET10 contributes to the resistance of sweet potato to Fusarium oxysporum [J/OL]. Frontiers in Plant Science, 2017, 8: 197. DOI: 10.3389/fpls.2017.00197.
(責任编辑:杨明丽)
