模拟增温对土壤真菌群落组成及多样性的影响
2021-10-12姚世庭芦光新邓晔党宁王英成张海娟颜珲璘
姚世庭,芦光新*,邓晔 ,党宁,王英成,张海娟,颜珲璘
1. 青海大学农牧学院,青海 西宁 810016;2. 中国科学院大学,北京 100049;3. 中国科学院生态环境研究中心/中国科学院环境生物技术重点实验室,北京 100085
以气候变暖和大气 CO2浓度升高为主要特征的全球气候变化,严重影响着生态系统的稳定性(牟雪洁等,2016)。青藏高原作为中国的重要生态屏障,拥有着世界上海拔最高、面积最大、类型最为独特的高寒草甸生态系统,其生态系统一旦遭到破坏,恢复重建的难度非常大。鉴于青藏高原独特的生态重要性和脆弱性,研究其高寒生态系统成为开展全球气候变化响应的重要课题,青藏高原地区由于受到过度放牧、农业垦植等人类活动的影响,大片草地开始出现退化,草原土壤理化性质发生变化(斯贵才等,2015)。模拟增温实验表明增温通过改变土壤温度和水分含量,将改变土壤微生物的群落结构、生物量及土壤酶活性(温小成等,2015),对植物、土壤以及微生物群落产生极大的影响(朴世龙等,2002)。
土壤微生物在对气候变化的反馈中起到了至关重要的作用,气候的变暖显著改变了土壤微生物的数量、丰富度和碳氮元素的转化功能(Xue et al.,2016;Cheng et al.,2017;Yu et al.,2018)。据估计,全球土壤中存在数万种微生物(Gans et al.,2005;刘国华等,2012)。土壤微生物包括真菌、藻类(蓝藻除外)、地衣等真核生物,和细菌、蓝藻、放线菌等原核生物(Jenkinson et al.,1981)。它们加速土壤有机物质转化,在土壤生态系统中起着很重要的作用(周桔等,2007)。目前对于青藏高原土壤微生物的研究较多,但是通过模拟增温研究青藏高原真菌变化的文献很少,李欣等(2017)研究发现增温有利于增加三大类群微生物数量,增幅表现为:细菌>放线菌>真菌。真菌在土壤-植物生态系统中发挥着至关重要的作用(Miao et al.,2016),真菌不但可以参与植物残体的分解,推动土壤养分的循环(盛玉钰等,2018),也会受到植物和土壤理化性质的影响(Rodriguez-Blanco et al.,2015),如温度(Mateos-Rivera et al.,2016)、水分(Watson et al.,2017)、土壤养分(程虎等,2017)和pH(Janczak et al.,2018)等。
高通量测序技术被广泛用于探索各种生态系统中微生物群落(包括细菌,古细菌和真菌)的多样性和组成结构(Gohl et al.,2016)。转录间隔区(ITS)是研究真菌最常用的测序靶点(Filippis et al.,2017)。ITS扩增子测序能够真实地反映真菌群落结构和多样性(Guo et al.,2020),目前在医学、农业、工业等微生物领域应用广泛(Bergsveinson et al.,2018)。对于真菌,一些基因组区域已被用作条形码标记,包括小亚基(SSU)和大亚基(LSU)核糖体RNA(rRNA)基因,以及两个非编码内部转录间隔区(ITS1和ITS2)。研究表明,ITS区提供了很大的丰富性和分类学分辨率(Tedersoo et al.,2016)。核DNA的整个ITS已被提名为真菌群落的通用基因条形码,由于其更高的扩增和测序成功率以及更高的分类学覆盖范围,从而实现了物种级的分辨率(Schoch et al.,2012)。但是,由于整个ITS区域太长无法完整测序,因此仅针对ITS1或ITS2区域是切实可行的。本论文通过在青藏高原高寒草地采用Illumina测序技术对高寒草甸土壤真菌进行ITS扩增子测序,深入全面研究模拟增温后高寒草甸真菌群落组成与多样性变化,为今后青藏高原土壤真菌多样性的功能研究和发展利用提供理论参考。
1 材料与方法
1.1 研究区概况
研究区位于青海省玉树州称多县珍秦镇的青海大学-清华大学三江源草地生态系统监测定位站,地理位置为 33°24′30″N,97°18′00″E,海拔 4270 m。气候类型属典型大陆性高原高寒气候,气候寒冷,四季不分明。年降水502.30 mm,主要集中在6—9月,占全年降水量的72.57%;土壤为高寒草甸土,植被为高寒草甸,存在轻度退化。建群种为高山嵩草(Kobresia pygmaea),伴生种有青藏薹草(Carex moorcroftii)、早熟禾(Poa pratensis)、垂穗披碱草(Elymus nutans)、异针茅(Stipaaliena keng)、洽草(Koeleria cristata)等;其他杂类草有黄花棘豆(Oxytropis ochrocephala)、钉柱萎陵菜(Potentilla saundersiana)、兔耳草(Lagotis ramalana)等。
模拟增温试验开始于2013年7月。采用开顶式气室增温方法,从2013—2018年连续增温使0—15 cm土壤温度年均增加2.50 ℃,15—30 cm土壤温度年均增加1.36 ℃。增温气室由6块梯形聚碳酸酯板链接成正六边形棱台体,梯形板下底边长91.4 cm,上底边长62.6 cm,斜边长为62.6 cm,高为61.0 cm,上底边与斜边的夹角为103.3°和下底边与斜边的夹角为76.7°,将下底边以宽度为5.0 cm的铝合金条固定,梯形板之间用螺丝固定。试验期内将增温气室底部的铝合金边扎入土中,保证增温小室和地面的密闭性,同时也避免冬季大风吹移。样地所处地点地势平坦,植物群落组成相对均一。为保证试验样地不受干扰和破坏,用围栏封闭,禁止放牧活动,文中用编号F、M分别代表增温样地与未增温样地,用a、b分别代表0—15 cm土层和15—30 cm土层,Fa代表增温0—15 cm,Fb代表增温15—30 cm,Ma代表不增温0—15 cm,Mb代表不增温15—30 cm。
1.2 试验方法
微生物测定方法参考Wang et al.(2019)的研究方法,用冷冻研磨法从2 g土壤中提取微生物群落基因组DNA,并使用PowerSoil®DNA分离试剂盒(MOBIO)进行纯化。DNA质量和浓度是根据用 NanoDrop分光光度计(Nano-100,Aosheng Instrument Co Ltd.)检测到的260/280 nm(>1.8)和260/230 nm(>1.7)的吸光度比评估的。土壤样品的DNA浓度在20—100 ng之间更适合PCR扩增。但是对于GeoChip杂交和Illumina测序,使用PicoGreen分析和Qubit荧光定量法(Thermo Fisher Scientific)来定量DNA量。对于真菌的ITSrRNA基因2区用成对的通用引物gITS-7F和4R,结合自行设计的条形码来区分样品。Illumina Miseq测序序列在(http://mem.rcees.ac.cn: 8080)平台进行,使用 UPARSE删除嵌合体并将序列分类为操作分类相似度为97%的单位(OTU),不丢弃任何单例;获得随机重采样OTU表。
1.3 环境因子数据采集
1.3.1 地上植物指标的观测
植物调查工作在 2013—2018每年植物生长季的生长高峰期(8月上旬)进行,在每个处理内随机设置1个0.5 m×0.5 m的植物调查样方,调查内容包括物种多度、高度、生物量。
1.3.2 土壤理化性质
全氮(Total nitrogen,TN)采用凯氏定氮法(李容榕等,2020);全碳(Total carbon,TC)采用重铬酸钾容量法(鲍士丹,2000);土壤微生物量碳(Soil microbial biomass carbon,SMBC)采用熏蒸提取-仪器分析法(马婷,2013);土壤微生物量氮(Soil microbial biomass nitrogen,SMBN)和土壤硝态氮(Nitrate nitrogen,NO3−-N)采用紫外分光光度法(苗杰等,2019);土壤铵态氮(Ammonium nitrogen,NH4+-N)采用靛酚蓝比色法(李志萍等,2013);碱解氮(Alkaline nitrogen,AN)采用碱解扩散法(李金彦,2010);有机质(Organic matter,OM)采用重铬酸钾氧化-油浴加热法(张旭等,2014);土壤pH值采用电位测定法(王瑞琨,2018)。
1.3.3 土壤水分、土壤温度、土壤电导率的测定
在试验样地安装 HOBO U30小型自动气象站和基于CR1000的土壤三参数分层测量系统,连续观测土壤水分、土壤温度、土壤电导率等指标(姚世庭等,2019;2020),并且在各处理小区内,分别在地上30、15 cm,地表,地下7.5、15、22.5 cm处安置温湿度自动记录仪探头(Onset公司生产的温湿度测定仪)。
1.4 数据统计与分析
本研究中使用Microsoft Excel 2010对各项分析测定数据进行运算,所有测序的原始数据均于中国科学院生态环境研究中心邓晔研究员课题组的Galaxy分析平台(http://mem.rcees.ac.cn:8080)完成。采用DPS 6.55,SPSS 2.0中的方差分析、最小显著差异法和相关性分析等方法进行数据统计分析,用 Origin 8软件进行非度量多维尺度分析(Non-metric multidimensional scaling analysis,NMDS)和主坐标分析图表绘制。
2 结果与分析
2.1 真菌多样性分析
2.1.1 土壤微生物群落稀释性曲线
利用高通量测序技术,分析高寒草地不同土壤微生物群落结构多样性,测序剔除不合格序列,所得真菌有效序列数介于74000—134000。通过个体数与物种数来构建稀释性曲线(图 1),反映测序的数据是否合理,样品中物种是否丰富。通过真菌群落稀释性曲线发现物种的丰富度(observed species)呈 Mb>Ma>Fb>Fa。
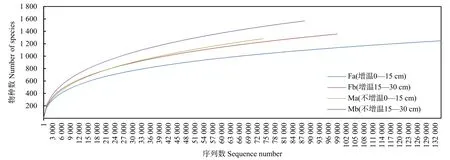
图1 土壤样品真菌群落的稀释曲线Fig. 1 Dilution curve of fungal communities in soil samples
由表 1可知,土壤真菌群落 Shannon指数和Simpson指数均呈现出 Mb>Fb>Ma>Fa,而 Chao1指数呈现Mb>Fa>Ma> Fb。说明相较于对照,增温会使真菌群落多样性有所降低;且增温后真菌群落丰富度也有所降低。

表1 真菌群落Alpha多样性指数特征Table 1 Alpha diversity index characteristics of fungal communities
2.1.2 土壤真菌群落组成
通过测序分析,土壤中真菌共检测出6个门,绘制其物种相对丰度累加图(图2),发现在Fa、Fb、Ma、Mb中子囊菌门(Ascomycota)分别为52.6%、48.9%、47.4%、66.6%,担子菌门(Basidiomycota)分别为7.0%、14.8%、10.3%、9.4%,接合菌门(Zygomycota)分别为3.4%、14.8%、3.6%、17.2%等,无法确定到门的物种(Unclassified)分别为37.0%、20.6%、38.7%、6.7%。
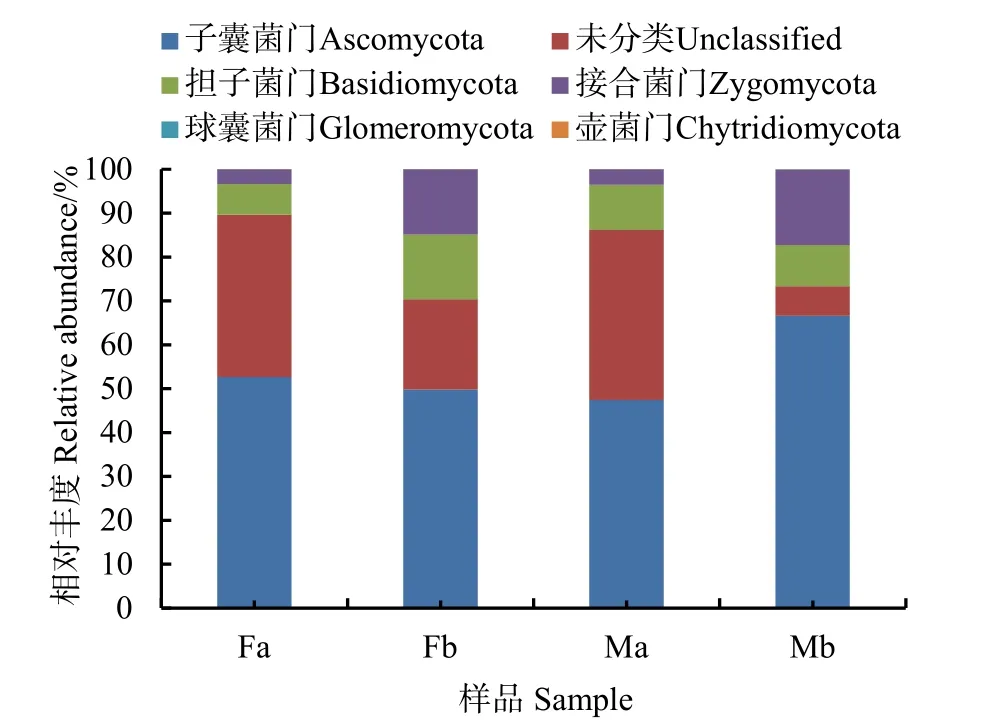
图2 真菌群落门水平相对丰度的比较Fig. 2 Comparison of relative abundance of fungal community gate levels
通过测序分析,土壤中真菌共检测出261个属。在属分类水平上,将丰度占比前 20的物种进行排序,其余物种合并成other,由物种相对丰度累加图(图3)可知,土壤真菌主要分布为Davidiella(8.77%—15.44%)、孢霉属(Mortierella 2.93%—10.89%)、盘菌(Aleuria 0.03%—4.72%)、隐球菌(Cryptococcus 1.17%—3.98%)、Tetracladium(0.32%—6.05%)、光黑壳属(Preussia 1.12%—1.91%)、丝盖伞属(Inocybe 0.00%—4.88%)、异茎点霉属(Paraphoma 0.75%—2.07%)、赤霉菌(Gibberella 0.74%—1.63%)等,但依然有 35.01%—61.56%无法鉴定到属水平上。发现Fb表现出在Davidiella上丰度最高,Ma表现出在 Thelebolus上丰度最高,Mb表现出在Mortierella上丰度最高。
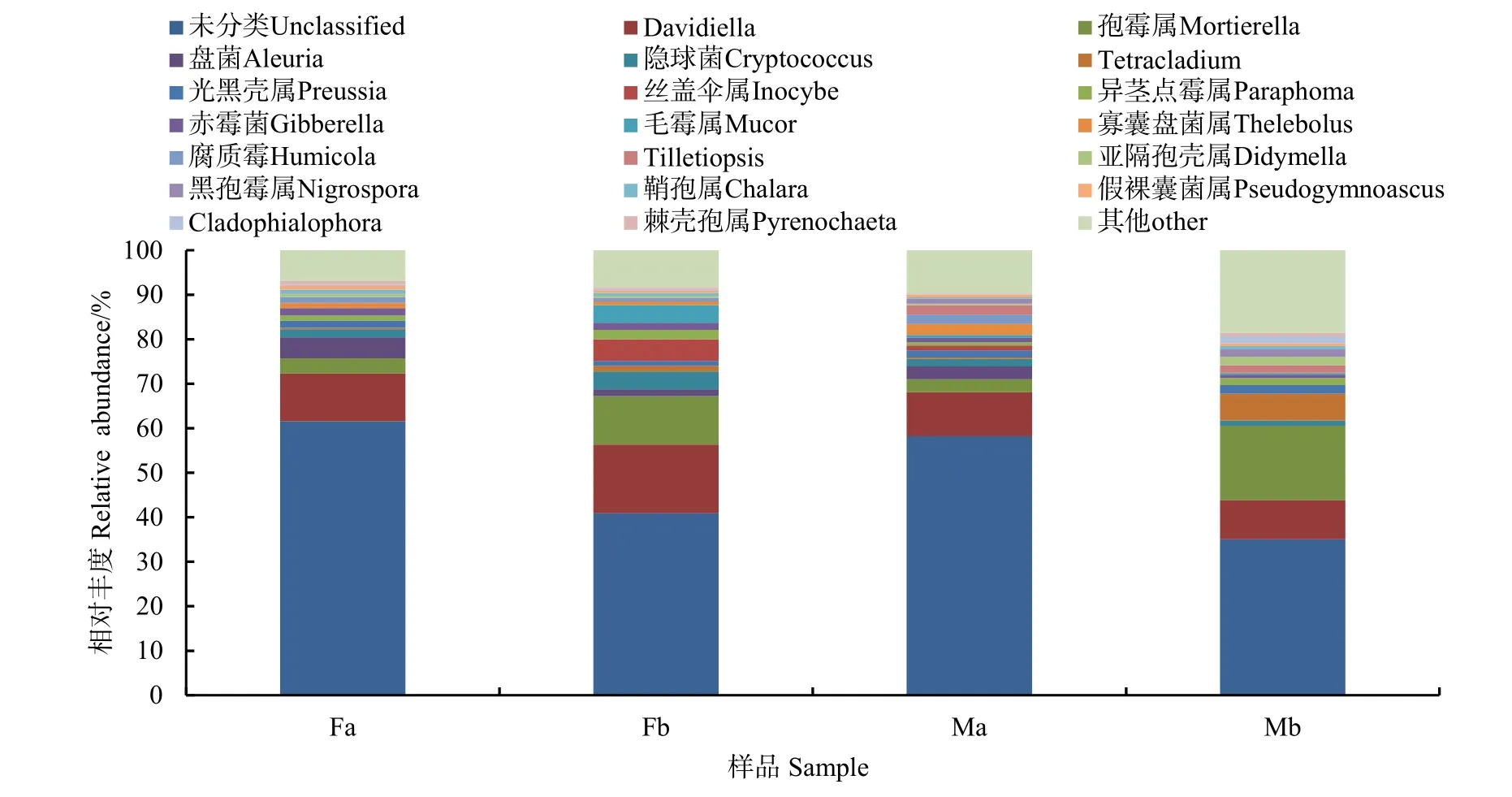
图3 真菌群落属水平相对丰度的比较Fig. 3 Comparison of relative abundance of fungal community genus levels
2.1.3 不同样品Dissimilarity test差异检测
对 Fa、Fb、Ma、Mb等 4个不同样品进行Bray-Curtis相异系数和Jaccard相似系数差异检测(表2),结果发现真菌中各组之间差异均不显著(P>0.05)。
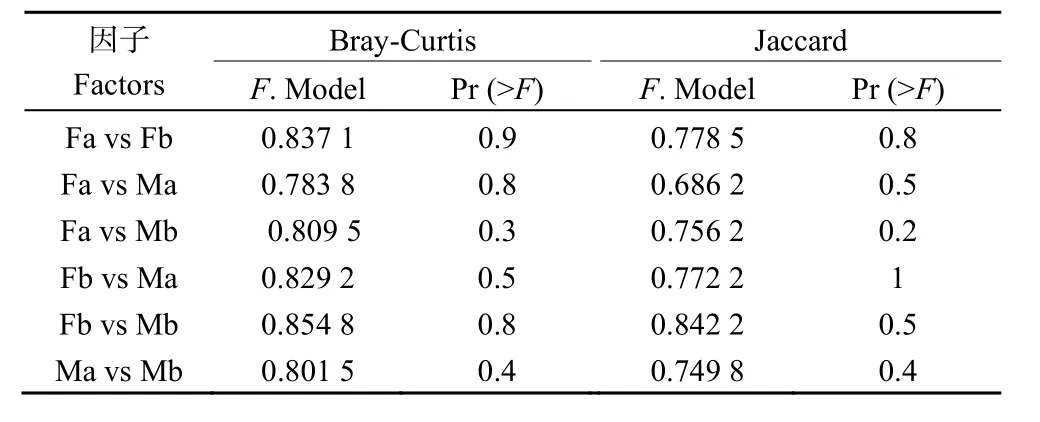
表2 不同样品Dissimilarity test差异检测Table 2 Dissimilarity test for different samples
2.1.4 非度量多维尺度分析
Bray-Curtis距离主要基于OTUs的计数统计比较两个群落的组成差异。相比于 Jaccard、Bray-Curtis,其包含了OTUs丰度信息。从图4可以看出,不同处理水平下土壤样品真菌群落组成差异不显著,真菌群落结构较为相似。
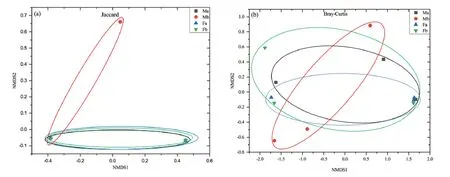
图4 不同处理土壤真菌的非度量多维尺度分析(NMDS)Fig. 4 Non-metric multidimensional scaling analysis (NMDS) of soil fungi with different treatments
2.1.5 主坐标分析样本群落组成
构组成较为相似主坐标分析(PCoA,Principal Co-ordinates Analysis),用于分析研究样本中群落组成的相似性或差异性。图 5中 PC1贡献率为66.8%,PC2贡献率为14.6%,累计贡献率达81.4%,可以反映数据主要信息。样品点距离越近,微生物群落的相似性度越高,PCoA结果表明,Fa、Fb、Ma和Mb微生物群落间的相似性都较高。
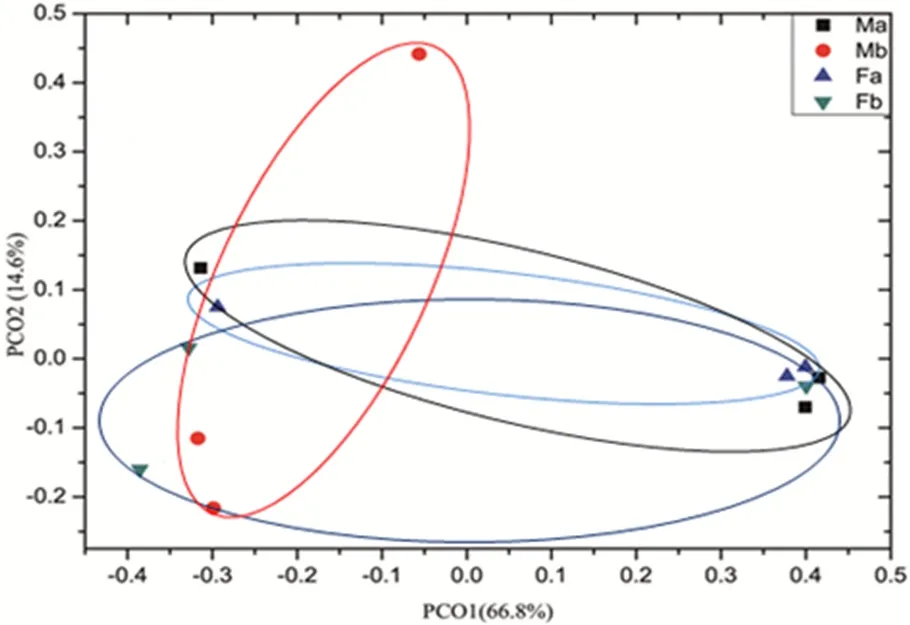
图5 不同处理土壤真菌主坐标分析Fig. 5 Analysis of principal coordinates of soil fungi in different treatments
2.2 真菌多样性指数与土壤环境因子相关性分析
2.2.1 不同环境因子之间的相关关系
应用Pearson相关性分析探究15种环境因子之间存在的相关性(表3)。结果发现:环境因子之间相关性显著,其中铵态氮与碱解氮,全氮与微生物碳,碱解氮与土壤微生物量碳,有机质与土壤微生物量氮,土壤微生物量碳与土壤微生物量氮,土壤温度与土壤含水量呈极显著正相关(P<0.001),全氮与全碳、pH,碱解氮与pH、全碳,全碳与土壤微生物量氮呈极显著负相关(P<0.001)。
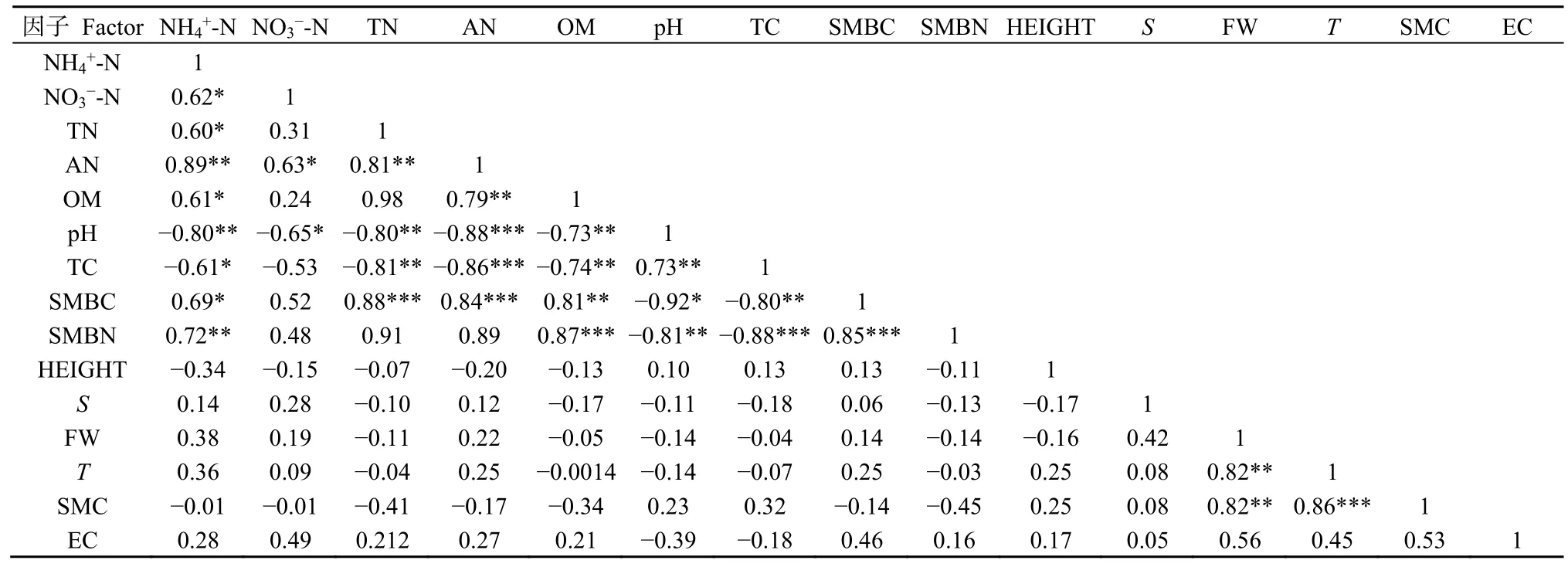
表3 环境因子相关关系Table 3 Correlation between environmental factors
2.2.2 真菌多样性指数与土壤环境因子相关性分析
微生物群落组成和分布受环境因子的影响而呈现出多样性,因此微生物群落的多样性与环境因子之间存在着一定的相关性。Pearson相关系数分析结果显示(表 4):Shannon指数与铵态氮、硝态氮、碱解氮、微生物碳、微生物量氮、物种鲜重生物量、土壤电导率呈现负相关的关系,而与其他指数均呈正相关关系。Simpson指数与pH、全碳、高度、温度、土壤含水量呈负相关关系,而与其他指数呈正相关关系,其中与物种数呈显著正相关(P<0.05),Chao指数与pH、全碳、高度、物种数呈正相关而与其他指数呈负相关。PD指数与pH、全碳、高度呈正相关,与其他指数呈负相关关系。
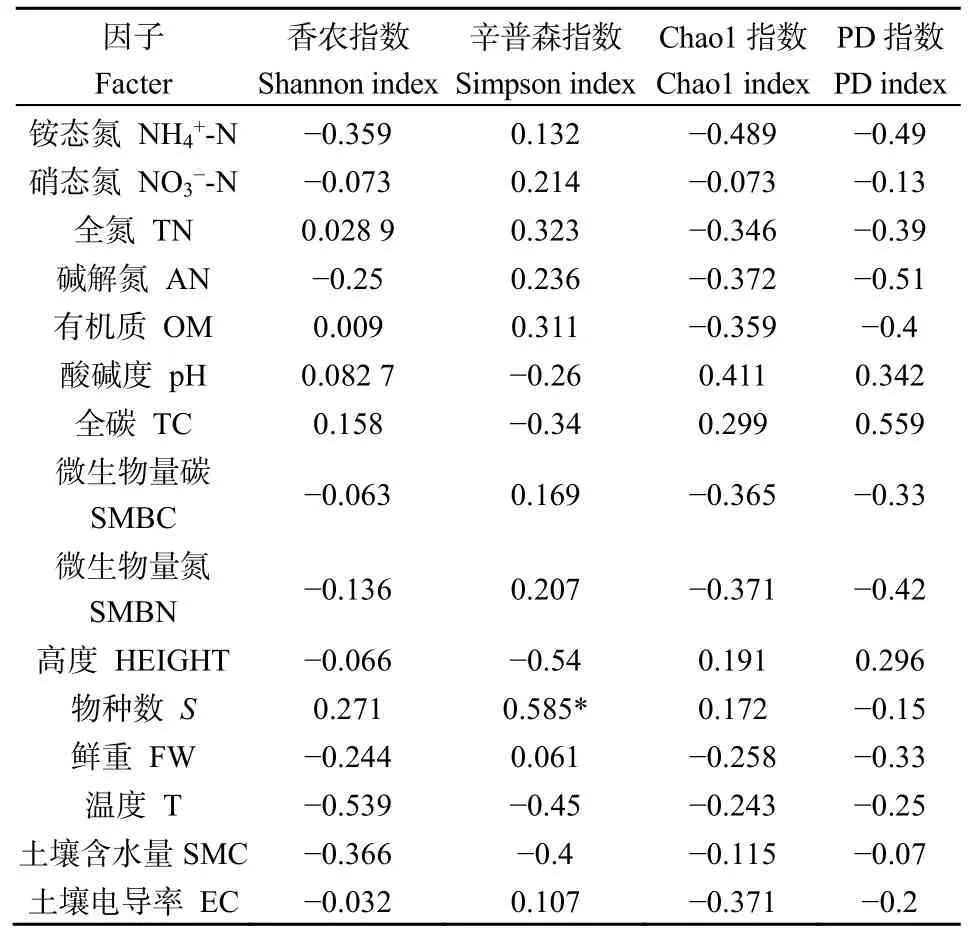
表4 微生物多样性与土壤环境因子Pearson相关系数矩阵Table 4 Pearson correlation coefficient matrix of microbial diversity and soil environmental factors
采用Mantel test分析微生物群落结构与土壤环境因子的关系(表 5),发现在真菌群落结构中发现 pH、微生物氮与真菌存在显著相关关系(P<0.05),相关系数分别为r=0.3218,r=0.2318。
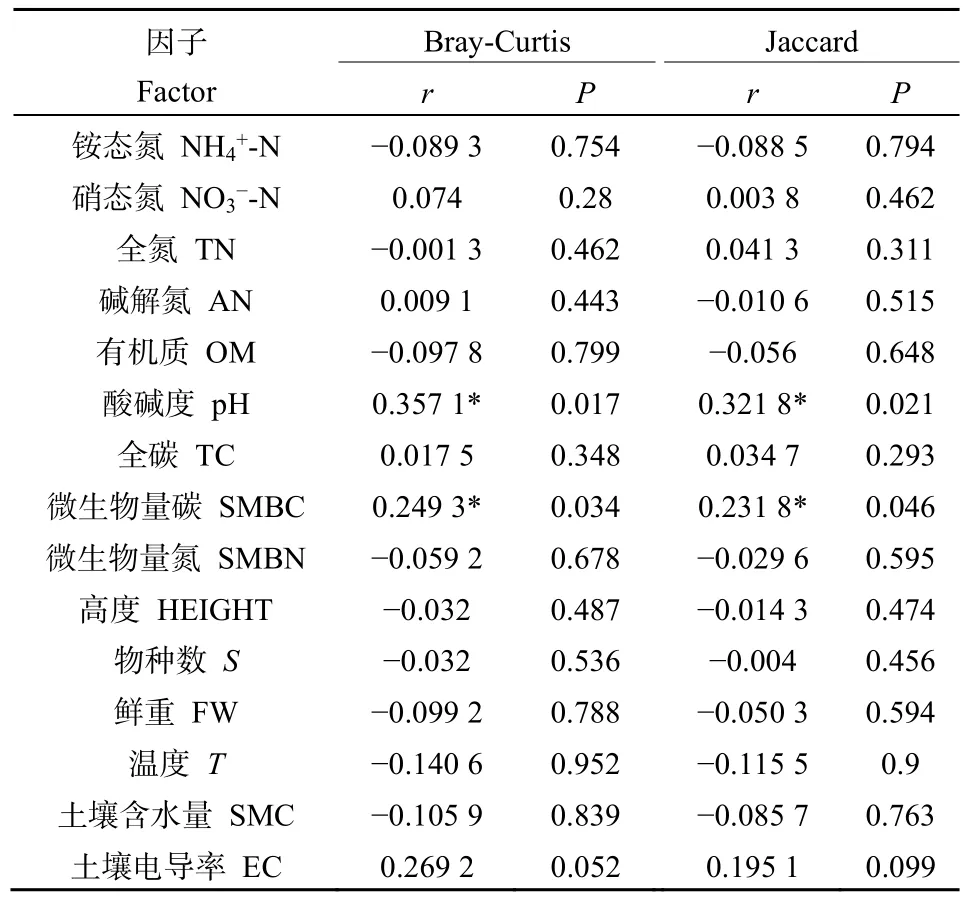
表5 Partial Mantel test分析微生物群落结构与土壤环境因子Table 5 Partial Mantel test analysis of microbial community structure and soil environmental factors
3 讨论
目前有关青藏高原高寒草地真菌对增温的响应研究很少,本文基于Illumina测序技术分析模拟增温后不同土层土壤真菌多样性的改变以及不同土壤环境因子与土壤真菌的相关性,为将来全球变暖研究提供数据基础。研究发现,模拟增温导致真菌群落多样性和丰富度有所降低。本次共检测出 6个门261个属,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)为主要门。子囊菌门(Ascomycota)丰度最高,可达 66%,其次是担子菌门,这与李定瑶(2014)在青藏高原多年冻土中发现子囊菌门和担子菌门两个类群为优势菌群的结果相似。王艳发等(2016)研究的青藏高原冻土区垂直剖面土壤子囊菌(Ascomycota)与担子菌(Basidiomycota)组成比例为75.3%和24.7%,冻土活动层的26个克隆序列均属于子囊菌,说明活动层土壤真菌多样性较低,推测与活动层较高的地温有关,这与我们研究所得增温后真菌丰度低于对照组真菌丰度的结果不谋而合。
在非度量多维尺度分析中发现在 Bray-Curtis距离和jaccard距离结果上,不同处理水平下土壤样品真菌群落组成差异不显著,F和M样品聚集在一起,说明这两个样品的真菌群落结构组成无显著差异。PCoA结果表明Fa、Fb、Ma和Mb微生物群落间的相似性都较高,原因可能是模拟增温年限不够温度增幅太小,或者是采集的土壤深度不够。Partial Mantel test分析微生物群落结构与土壤环境因子时发现 pH、微生物氮对真菌多样性群落结构影响显著,这与王楠等(2020)研究发现土壤 pH是构建土壤真菌群落结构的主要驱动力结果一致。代表着微生物群落稳定性的土壤真菌多样性,在一定程度上反映着群落对生态效应的响应(林先贵,2010)。土壤环境对真菌生长繁殖影响很大,土壤pH、温湿度及土壤的呼吸方式等都会给微生物生存造成不同程度的影响(马骢毓,2017)。在相似的环境下,微生物群落的结构由植物的类型来确定,土壤微生物多样性的不同与受到植被的影响、土壤碳氮含量、土壤含水量、酸碱度等息息相关。微生物作为青藏高原高寒草地生态系统中不可缺少的一部分,对土壤碳氮循环具有重要作用。
4 结论
通过对青藏高原高寒草地土壤微生物群落组成、多样性与环境因子进行相关性分析,初步探讨了土壤环境因子对微生物群落结构和多样性的影响,不同的环境因子对土壤微生物群落结构产生不同的影响。结果如下:
(1)群落结构分析和多样性分析,发现Fa(增温0—15 cm)、Fb(增温15—30 cm)、Ma(不增温0—15 cm)、Mb(不增温15—30 cm)在微生物组成上差异不明显,子囊菌门(Ascomycota),担子菌门(Basidiomycota)、接合菌门(Zygomycota),球囊菌门(Glomeromycota),壶菌门(Chytridiomycota)。子囊菌门(Ascomycota)丰度最高,最高可达66%,其次是担子菌门(Basidiomycota)。
(2)多维尺度分析及主坐标分析结果表明,Fa、Fb、Ma、Mb群落结构较相似。土壤真菌群落Alpha多样性指数表现为:Shannon指数Mb>Fb>Ma>Fa;Simpson指数 Mb>Fb>Ma>Fa;Chao1指数Mb>Fa>Ma>Fb。
(3)微生物与土壤环境因子相关性分析结果表明,pH、微生物氮是真菌群落结构中的主要影响因子。
