早/中孕期孕妇肠道菌群差异及其与妊娠期糖尿病的关系:前瞻性队列研究
2021-10-12马良坤刘俊涛
王 佩,马良坤,刘俊涛
中国医学科学院 北京协和医学院 北京协和医院妇产科, 北京 100730
全球妊娠期糖尿病(gestational diabetes mellitus, GDM)发病率呈逐年上升趋势[1],我国GDM发病率高达14.8%[2]。GDM可影响母婴结局[1,3],显著增加母婴远期患代谢性疾病的风险[4- 5]。GDM的发病与妊娠期胰岛素抵抗加重及胰岛β细胞功能障碍相关,但具体分子机制尚不明确[6]。近期研究发现,肠道菌群失调在2型糖尿病(type 2 diabetes mellitus, T2DM)[7]、肥胖[8]以及免疫性疾病[9]的发生发展中起重要作用,且可能参与GDM发病。目前关于孕妇肠道菌群和GDM相关性的报道较少,且研究对象多处于中/晚孕期[10- 13],缺乏早孕期研究证据。本研究探讨早/中孕期女性肠道菌群物种及功能特点,并分析其与GDM的关系。
1 对象与方法
1.1 研究对象及分组
1.1.1 研究对象
本研究为前瞻性队列研究。研究对象为2017年5月至12月北京协和医院产科招募的妊娠期女性。
纳入标准:(1):孕13+6周前建档产检;(2)单胎妊娠;(3)年龄20~45岁;(4)规律产检并可按要求进行随访。
排除标准:(1)孕前或早孕期明确诊断患有任何类型的糖尿病,包括1型糖尿病、T2DM和其他特殊类型糖尿病;(2)患有胃肠道疾病、高血压、自身免疫性疾病等;(3)孕前接受大型胃肠道手术者;(4)近3个月内服用抗生素者。
1.1.2 分组
根据《妊娠合并糖尿病诊治指南(2014)》[14],将妊娠24~28周经75 g口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)确诊为 GDM 的孕妇纳入研究组,无GDM的孕妇设为对照组。
本研究已在clinicaltrails.gov注册(注册号:NCT04420507),并通过北京协和医院伦理审查委员会审批(审批号:JS- 1535)。
1.2 研究方法
1.2.1 一般临床资料收集
在研究对象入组时进行问卷调查,内容包括:年龄、孕前体质量指数(body mass index,BMI)、本次妊娠情况(孕/产次、预产期、辅助生殖方式)、既往病史等。
1.2.2 粪便样本采集
分别于早孕期(9~13+6周)(T1)和中孕期(24~27+6周)(T2)使用可常温保存的粪便采样标本管(PSP® Spin Stool DNA Kit,德国Stratec公司)留取粪便标本(嘱孕妇使用适配的无菌采样器取新鲜粪便约1 g浸泡于标本管内保存液中),避光室温保存并于产检随访时上交,所有标本于留取1周内进行粪便DNA提取[15]。
1.2.3 样本DNA提取、扩增、纯化和测序
采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法对样本的基因组DNA进行提取,并将提取的DNA用无菌水稀释至1 mg/L。以稀释后的基因组DNA为模板,使用带Barcode的特异引物515F- 806R对16S rDNA的V4测序区域进行特异性扩增。PCR体系:Phusion Master Mix(2×)15 μL,Primer(2 μmol/L)3 μL,gDNA(1 mg/L)10 μL,无菌双蒸水补齐至30 μL。PCR反应条件:98 ℃预变性1 min;98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸5 min;4 ℃保存。根据PCR产物浓度与载样缓冲液进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳进行PCR产物检测。使用TruSeq®DNA PCR-Free Sample Preparation Kit(美国Illumina公司)建库试剂盒进行文库构建,构建好的文库经Qubit定量和文库检测,合格后使用HiSeq 2500平台(美国Illumina公司)上机进行高通量测序。
1.2.4 生物信息学分析
默认以97%的一致性将序列聚类为操作分类单元(operational taxonomic units,OTUs)。根据OTUs聚类结果进行物种注释并统计基于丰度的物种分布情况,然后对各样品的数据进行均一化处理并分析,包括:(1)Alpha多样性:采用Qiime 1.9.1软件进行分析,以Chao1指数评估菌群丰度,Shannon指数和Simpson指数反映菌群多样性;(2)Beta多样性:采用R 2.15.3软件的Adonis进行分析,以反映组间群落结构的相似性;(3)差异物种鉴别:采用线性判别分析(linear discriminant analysis effect size, LEfSe)1.40.0软件寻找组间相对丰度有统计学差异的物种(设置LDA score的筛选值为3);(4)Tax4Fun功能预测[16]与差异比较:提取京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库原核生物全基因组16S rRNA 基因序列并利用BLASTN 算法将其比对至SILVA SSU Ref NR数据库建立相关矩阵,将通过UProC(ultra-fast protein domain classification)注释的KEGG数据库原核生物全基因组功能信息对应至SILVA数据库中,实现SILVA数据库功能注释。所有标本的测序数据以SILVA数据库序列为参考序列聚类出OTUs,进而获取基因功能注释信息,采用reporter score的差异富集法分析各组包含的KEGG通路的丰度差异,其绝对值大于1.6(相当于正态分布90% CI),说明差异显著。
1.3 样本量估算
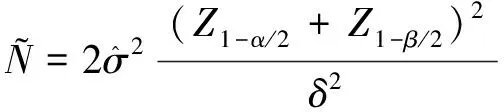
1.4 质量控制
本研究由经标准化培训的3名研究员进行研究对象的招募入组、标本收集指导和随访工作,并留存研究完整记录。采用常温粪便采样标本管留取标本以避免标本提取前变质失效,由研究员把控取样流程,严格遵循采样和检验的时效性要求。
1.5 统计学处理
采用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;非正态分布计量资料以中位数(四分位数)表示,组间比较采用Mann-WhitneyU检验。计数资料以频数(百分数)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析菌群各指标的最佳临界值。采用多因素Logistic回归分析肠道菌群Alpha多样性及菌群相对丰度与GDM的关系。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共145例符合纳入和排除标准的孕妇入选本研究。其中研究组34例、对照组111例。研究组孕妇年龄及75 g OGTT 0 h、1 h、2 h血糖值均明显高于对照组(P均<0.05),孕前BMI、GDM诊断孕周以及经产妇比率等与对照组差异无统计学意义(P均>0.05)(表1)。

表1 两组孕妇的临床特征比较
2.2 肠道菌群物种差异及与妊娠期糖尿病的关系
2.2.1 两组早/中孕期肠道菌群Alpha多样性和Beta多样性比较
Alpha多样性分析显示,研究组早孕期肠道菌群的Shannon指数和Simpson指数低于对照组(P均<0.05),Chao1指数无显著差异(P>0.05)(表2),中孕期时各指数与对照组比较差异均无统计学意义(P>0.05);两组患者早孕期与中孕期组内比较,各指数差异亦无统计学意义(P>0.05)。采用ROC曲线分析确定早孕期Alpha多样性各指数的最佳临界值(Chao1指数为1544.13、Shannon指数为6.51、Simpson指数为0.96)。多因素Logistic回归分析在调整年龄、孕前BMI后显示,早孕期Shannon指数≤6.51、Simpson指数≤0.96是中孕期发生GDM的危险因素(表2)。

表2 两组早孕期肠道菌群Alpha多样性比较及多因素Logistic回归分析
Beta多样性分析结果显示,研究组早孕期和中孕期肠道菌群组成结构与对照组比较均无明显差异(PT1=0.148,PT2=0.498);组内早/中孕期的比较中,对照组显示出明显差异(P=0.01),而研究组无显著差异(P=0.608)。
2.2.2 两组早/中孕期肠道菌群物种差异分析
早孕期时,研究组有15个类群的相对丰度明显低于对照组,在属水平上拟普雷沃菌属(Alloprevotella)和毛菌属(Leptotrichia)的相对丰度明显低于对照组(P<0.05)。中孕期时,研究组有13个类群的相对丰度与对照组存在显著差异(P<0.05)。研究组拟杆菌目(Bacteroidales)及其亲本分类群拟杆菌门(Bacteroidetes)和拟杆菌纲(Bacteroidia),以及巨单胞菌属(Megamonas)及其亲本分类群c_Negativicutes和o_Selenomonadales相对丰度均高于对照组(P均<0.05),梭菌目(Clostridiales)及其亲本分类群厚壁菌门(Firmicutes)和梭菌纲(Clostridia)的相对丰度均低于对照组(P均<0.05)(图1)。
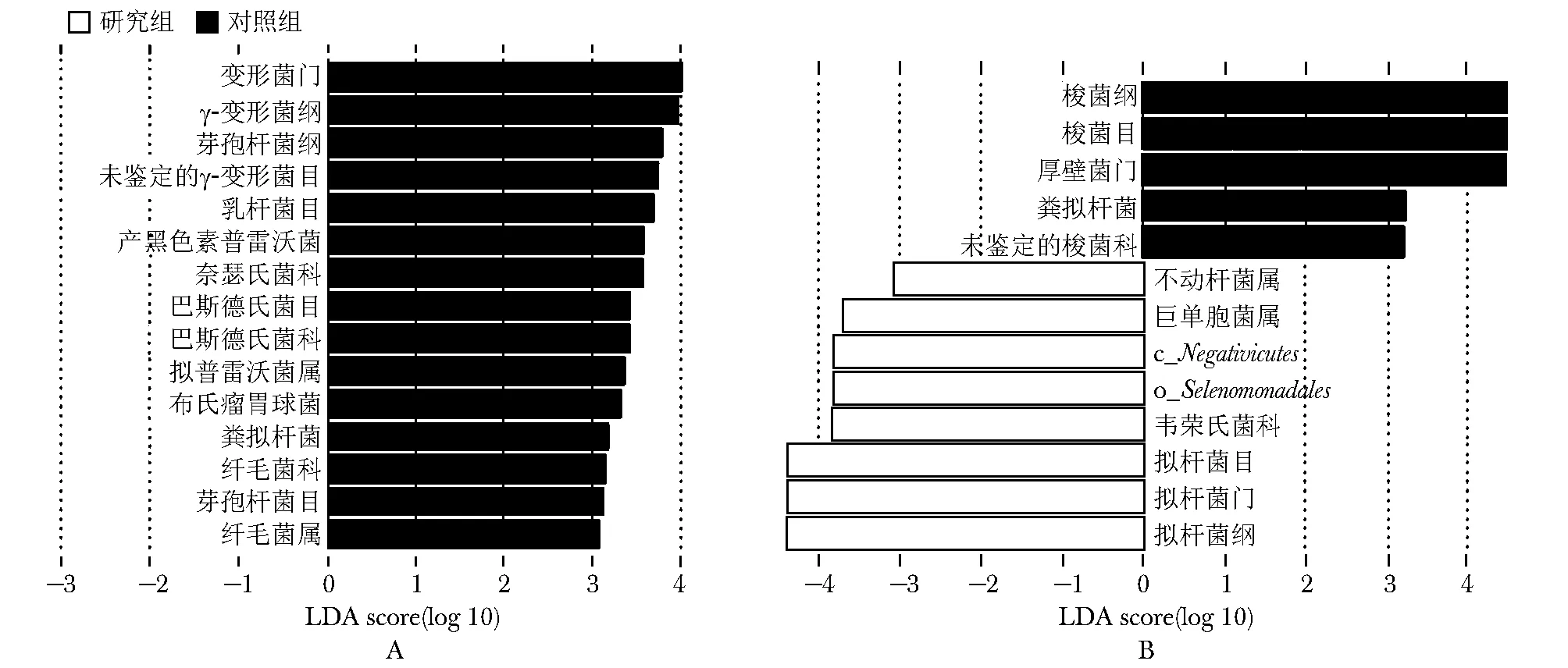
图1 两组肠道菌群物种差异的LEfSe分析
2.2.3 早孕期肠道菌群主要物种相对丰度与GDM的关系
由于LEfSe分析显示,研究组在早孕期肠道菌群多个类群的相对丰度明显低于对照组,为探索与中孕期发生GDM相关的早孕期肠道菌群特征菌属,采用ROC曲线下面积法计算早孕期肠道菌群主要物种(在属水平上相对丰度排名前35的物种)相对丰度的最优临界值。以中孕期是否合并GDM为因变量,早孕期肠道菌群主要物种为自变量进行Logistic回归分析,校正年龄、孕前BMI后,早孕期拟普雷沃菌属相对丰度≤0.004、毛螺菌属相对丰度(Lachnospira)≤0.0107是中孕期发生GDM的危险因素(P<0.05)(表3)。
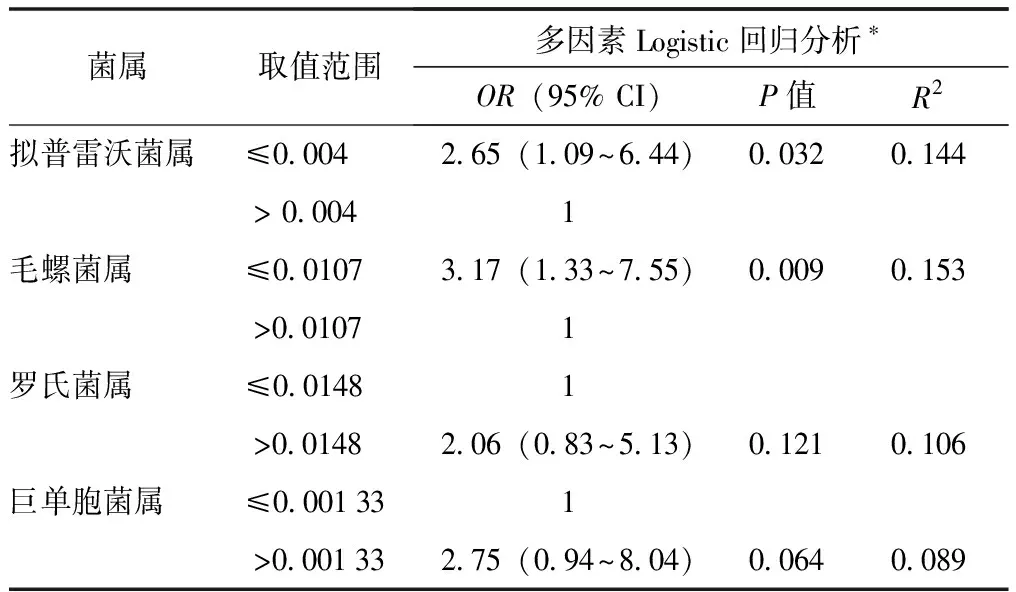
表3 早孕期肠道菌群主要物种与GDM关系的多因素Logistic回归分析结果
2.2.4 两组早/中孕期肠道菌群功能差异分析
两组早孕期肠道菌群功能通路相对丰度较少存在差异,仅脂多糖(lipopolysaccharide, LPS)合成和磷酸转移酶系统(phosphotransferase system, PTS)等通路在GDM组富集,而鞭毛装配和细菌趋化性通路在对照组富集。中孕期时,与能量代谢(氧化磷酸化)、糖代谢(三羧酸循环、PTS、半乳糖代谢、戊糖-葡萄糖醛酸转换)、细菌生物膜合成(LPS合成、甘油磷脂代谢)、氨基酸代谢和维生素及辅因子代谢(叶酸合成、烟酸及烟碱代谢、核黄素代谢、抗坏血酸代谢)相关的通路在研究组显著富集(图2)。

图2 两组肠道菌群功能通路相对丰度富集分析
3 讨论
本研究对早/中孕期妇女的肠道微生物群落组成和功能进行分析,发现GDM患者孕早期时的肠道菌群物种多样性Shannon指数和Simpson指数明显低于对照组(P<0.05),且早孕期Shannon指数≤6.51(OR=3.15,95% CI:1.32~7.52)、Simpson指数≤0.96(OR=2.54,95% CI:1.09~5.89)、拟普雷沃菌属相对丰度≤0.004(OR=2.65, 95% CI:1.09~6.44)、毛螺菌属相对丰度≤0.0107(OR=3.17, 95% CI:1.33~7.55)是中孕期发生GDM的危险因素。菌群功能预测及比较分析发现,GDM患者在中孕期时与糖代谢、能量代谢等相关的通路呈富集状态。
肠道丰富的菌群及其结构多样性有助于宿主维持物质和能量代谢等功能的稳定及有效抵御致病性微生物的入侵[18],肠道微生物多样性降低与肥胖、胰岛素抵抗和血脂异常相关[19]。Alpha多样性反映样本内群落的丰富度和多样性,其中Shannon指数和Simpson指数反映群落的物种多样性,Chao1指数反映群落的丰富度。本研究中GDM组早孕期肠道菌群的Shannon指数和Simpson指数均显著低于对照组,且多因素Logistic分析显示早孕期Shannon指数与Simpson指数降低是GDM发生的危险因素,提示早孕期肠道菌群物种多样性的降低可能与中孕期发生GDM存在一定关系,与Ma等[20]针对早孕期肠道菌群特征与GDM关系的前瞻性研究结果一致。本研究中两组组内和组间的比较中,Chao1指数均未显示出差异,提示孕妇肠道菌群的群落丰度可能较为稳定。
Beta多样性反映组间群落组成结构的差异。本研究仅在对照组的早/中孕期比较中Beta多样性存在显著差异,提示随着孕期改变,健康孕妇的肠道菌群群落结构会发生变化。Koren等[17]比较了91名孕妇早孕期和晚孕期的肠道菌群变化,发现其Beta多样性存在显著差异,且与是否患GDM无关。肠道菌群Beta多样性是否随孕期进展或GDM疾病状态变化而发生改变目前尚不明确,可能与肠道菌群易受饮食结构、人种、地域影响有关[21]。
孕期肠道微生物的群落组成保持相对稳定状态,均以拟杆菌门和厚壁菌门为主,辅以放线菌门和变形菌门[13,17]。本研究LEfSe分析显示,中孕期时GDM组拟杆菌门相对丰度高于健康孕妇,而厚壁菌门相对丰度低于健康孕妇,此种拟杆菌占比增高而梭菌占比减少的分布特点与T2DM患者肠道菌群的分布相似[19]。多项研究报道拟杆菌门/厚壁菌门的比值与血糖、胰岛素抵抗[22]呈正相关。GDM孕妇即使在分娩后,其肠道菌群的厚壁菌门相对丰度仍低于健康对照孕妇,这可能是GDM孕妇患T2DM风险增加的原因之一[23]。GDM组中孕期时巨单胞菌属及其亲本分类群的相对丰度明显高于对照组,与Kuang等[13]针对中孕期GDM患者肠道菌群进行的宏基因组分析结果一致。针对冠心病患者的研究发现,巨单胞菌属相对丰度与胆固醇水平呈正相关[24],提示巨单胞菌属可能与宿主的糖脂代谢异常存在一定相关性。
本研究多因素Logistic回归分析提示,早孕期拟普雷沃菌属和毛螺菌属的相对丰度降低可能是中孕期发生GDM的危险因素。既往有动物实验发现,高糖或高脂饮食均可使小鼠肠道中的拟普雷沃菌属丰度降低,而给予益生菌干预后其丰度可回升[25]。拟普雷沃菌属在心血管疾病高风险的人群肠道中相对丰度明显降低,表明拟普雷沃菌属丰度降低可能与糖脂代谢紊乱有关,进而引起GDM[26]。毛螺菌属能分泌短链脂肪酸(short chain fatty acids, SCFAs)[27],在糖尿病动物实验中被发现毛螺菌属的相对丰度与血糖呈负相关[28]。食物中不能被直接消化的碳水化合物在肠道会经特殊菌群发酵,生成包括乙酸、丙酸、丁酸在内的多种SCFAs,SCFAs减少可能与胰岛素抵抗加重有关[29]。此外,SCFAs参与维持肠道黏膜屏障的完整性,其分泌减少会增加肠壁渗透性,减弱肠黏膜屏障功能,使肠道内的条件致病菌、LPS等渗透进入血液循环,引发全身慢性炎症反应,加重胰岛素抵抗[30- 31]。本研究对肠道菌群功能的分析亦发现,与对照组相比,GDM患者早孕期时LPS合成相关通路明显富集。分泌SCFAs菌的减少以及LPS的增加可能共同加剧了孕妇糖代谢的异常。孕中期时GDM已经发生,表现为与能量、糖和氨基酸代谢等相关的多种菌群功能的富集,可能是在高糖环境下,肠道菌群作出的代偿性反应,即为适应宿主的高糖代谢状态,肠道菌群适应性地加强了自身对糖和能量代谢等的处理能力,此种菌群功能的特征性改变可作为GDM的干预靶点。
目前研究认为,肠道菌群紊乱导致的产丁酸菌的减少、LPS增多,是发生胰岛素抵抗和代谢综合征的原因之一[7,32]。因此,进行菌群干预可能对GDM的早期预防有一定效果。利用益生菌、益生元对GDM进行干预的临床研究已有报道。Callaway等[33]应用益生菌来对超重/肥胖女性进行干预,结果并未发现早孕期补充益生菌能够预防GDM的发生。一项纳入11项临床研究的Meta分析显示,补充益生菌似乎能改善GDM孕妇的血糖、血脂、炎症及氧化应激状态[34]。但目前通过肠道菌群干预来预防/缓解GDM的研究较少,尚无确切结论。
本研究尚有不足之处:(1)由于缺乏孕妇孕期饮食结构和能量摄入的相关数据,饮食结构的个体化差异可能影响GDM的发生。(2)本研究样本量较小,而肠道菌群的个体差异较大,结果可能存在偏倚。后续的研究可借助多种组学方法优化研究设计,根据饮食结构等影响因素作分层分析,在本研究的基础上进一步明确肠道菌群与GDM间的因果关系,强调肠道菌群的物种及其功能在GDM发生发展中的意义,以期发现可应用于临床的GDM预防与治疗靶点。
综上,与健康孕妇相比,中孕期GDM患者肠道菌群的功能特点为LPS合成、能量代谢、糖代谢和氨基酸代谢相关通路显著富集。早孕期肠道菌群物种多样性降低及某些菌属的丰度降低是发生GDM的危险因素。
作者贡献:王佩负责研究设计、实施、数据采集、统计分析、撰写论文;马良坤指导研究设计;刘俊涛参与研究设计和实施、论文修改、经费支持。
利益冲突:无
