年龄对水合氯醛诱导的小鼠可逆性晶状体混浊及Na+-K+-ATP酶表达的影响
2021-10-12张俊芳吴刘萍康丽华张国伟石海红管怀进
秦 柏,张俊芳,杨 梅,吴刘萍,康丽华,张国伟,石海红,管怀进
•KEYWORDS:lens opacity; chloral hydrate; age; Na+-K+-ATPase; mice
0引言
小鼠是眼科研究中最常用的实验动物之一,很多眼科检测需要将小鼠镇静麻醉后进行,但水合氯醛、戊巴比妥钠、七氟醚等常用镇静麻醉剂均可引起小鼠急性可逆性晶状体混浊,严重影响眼底照相、视觉电生理、光相干断层扫描(OCT)等检查的结果[1]。研究表明药物、麻醉剂、温度、供氧、钙、pH值和脱水等多种因素均可影响小鼠晶状体的透明度,但其具体机制尚不明确[2]。研究显示Na+-K+-ATP酶在维持晶状体的透明性中具有重要的作用,并参与糖皮质激素诱导的可逆性晶状体混浊和糖尿病白内障[3-4]。本研究应用青年小鼠及老年小鼠,探讨晶状体年龄相关性改变对水合氯醛引起的小鼠可逆性晶状体混浊的影响及可能机制。
1材料和方法
1.1材料
1.1.1实验动物与分组3月龄雄性C57BL/6小鼠12只,体质量25~30g,设为青年组;24月龄雄性C57BL/6小鼠12只,体质量29~35g,设为老年组;小鼠均购自南通大学实验动物中心。实验期间小鼠饲养温度23℃±2℃,相对湿度40%~70%,12h明暗交替照明,自由饮食饮水。本研究实验动物的使用严格遵循《实验动物管理条例》的规定。本研究通过南通大学实验动物伦理委员会批准(批准号:20190926-001)。
1.1.2试剂和仪器水合氯醛和多聚甲醛(上海生物工程有限公司);兔抗小鼠Na+-K+-ATP酶多克隆抗体(美国abcam公司,ab76020),免疫组化显色试剂盒(上海Gene Tech公司),裂隙灯显微镜(瑞士HAAG-STREIT BQ900)。
1.2方法
1.2.1水合氯醛诱导小鼠急性可逆性晶状体混浊水合氯醛注射前10min,复方托吡卡胺滴眼液散瞳,裂隙灯显微镜观察,排除眼前节和晶状体异常小鼠。4%水合氯醛溶液(400mg/kg)腹腔注射,在注射后10、20、30、45、60、90、120min用裂隙灯观察晶状体混浊程度,并拍摄照片。观察间隙,应用生理盐水点眼,保持角膜湿润,实验过程中室温保持23℃。
1.2.2晶状体混浊程度分级水合氯醛注射后晶状体的混浊程度评估参照Bermudez等[2]方法,并在其基础上增加了晶状体混浊消退评级。晶状体混浊程度分为4个等级:无混浊(0级);轻度混浊(1级),晶状体混浊仅限于晶状体前缝(anterior lens suture)附近;中度混浊(2级),晶状体混浊局限在前缝范围内;重度混浊(3级),晶状体前皮质全部混浊。晶状体混浊消退程度分为3个等级:轻度消退(-1级),晶状体中央及前缝混浊消退;中度消退(-2级),晶状体混浊消退范围局限在晶状体前缝范围内;完全消退(-3级),晶状体混浊消退区域超过晶状体前缝范围至完全透明,见图1。双眼晶状体混浊程度不一致时以混浊较为严重的眼记录等级。

图1 晶状体混浊程度及消退分级 A:无混浊(0级);B:轻度混浊(1级);C:中度混浊(2级);D:重度混浊(3级);E:轻度消退(-1级);F:中度消退(-2级);G:重度消退(-3级)。
1.2.3晶状体苏木素-伊红染色在水合氯醛注射前、注射后45min分别颈椎脱臼处死小鼠各2只,随后立即摘取眼球,用Davidson固定液固定2h后,再经4%多聚甲醛溶液固定过夜,常规梯度酒精脱水、浸蜡、包埋,4μm厚度连续切片,二甲苯脱蜡,梯度酒精水化,苏木素-伊红(HE)染色,光学显微镜拍照。
1.2.4晶状体Na+-K+-ATP酶免疫组织化学染色取水合氯醛注射前、注射后45min的小鼠眼球石蜡切片,经常规脱蜡、水化,柠檬酸盐缓冲液煮沸10min进行抗原修复,PBS缓冲液洗3次,每次5min;体积分数3% H2O2溶液37℃孵育10min,阻断内源性辣根过氧化物酶(HRP);PBS缓冲液洗3次,每次5min;滴加封闭液,37℃孵育2h;除去封闭液,滴加兔抗小鼠Na+-K+-ATP酶抗体(1∶100),4℃孵育过夜;室温复温2h,PBS缓冲液洗3次,每次5min;滴加HRP标记聚合物(二抗),37℃孵育30min;除去二抗,PBS缓冲液洗3次,每次5min;新鲜配置的DAB显色1min,充分水洗;苏木素复染,水洗;1%盐酸酒精分化,水洗;梯度酒精脱水,二甲苯透明,自然干燥后中性树胶封片。光学显微镜下观察Na+-K+-ATP酶在晶状体上皮细胞(lens epithelial cells, LECs)及纤维的表达并拍照。

2结果
2.1两组小鼠对水合氯醛注射镇静的反应两组小鼠水合氯醛腹腔注射后角膜反射消失,翻正反射消失,记录为起效时间。翻正反射出现,开始出现步态移动,记录为苏醒时间。老年组小鼠体质量显著高于青年组小鼠体质量,差异有统计学意义(t=9.6623,P<0.01),两组小鼠水合氯醛注射的起效时间(t=0.8514,P>0.05)和苏醒时间差异均无统计学差异意义(t=0.3933,P>0.05),见表1。
表1 两组小鼠体质量、水合氯醛注射的起效和苏醒时间
2.2两组小鼠水合氯醛注射后晶状体混浊和消退的进展两组小鼠水合氯醛注射后均出现不同程度的晶状体混浊。水合氯醛诱导的晶状体混浊是从晶状体前缝开始,逐渐向周围扩散,最终导致整个晶状体前皮质浅层混浊。晶状体混浊在注射后约10min开始出现,注射后约30~45min混浊达到高峰,注射后60~90min晶状体混浊开始消退,消退从中央部分开始,逐渐向周围扩散,直到注射后120~150min混浊全部消退,部分小鼠在苏醒前晶状体混浊全部消退,部分小鼠在苏醒后混浊部分消退。多数小鼠右眼晶状体混浊较左眼略严重。两组小鼠在水合氯醛注射后10、20、30、45、60、90、120和150min晶状体混浊程度分布见图2。青年组小鼠混浊出现早,持续时间长,混浊厚重,呈乳白色;老年组小鼠晶状体混浊出现略晚,持续时间短,混浊略轻,呈灰白色,薄雾状。注射后10min,青年组小鼠晶状体混浊程度0级2只,1级10只,老年组小鼠晶状体混浊程度0级9只,1级3只;注射后90min,青年组小鼠晶状体混浊程度轻度消退(-1级)5只,中度消退(-2级)6只,完全消退(-3级)1只,老年组小鼠晶状体混浊程度中度消退(-2级)5只,完全消退(-3级)7只。注射后10、90min两组晶状体混浊程度均有显著性差异(10min:Z=1.966,P=0.0493;90min:Z=-2.082,P=0.0373)。水合氯醛注射后45min晶状体3级混浊代表性图片见图3。
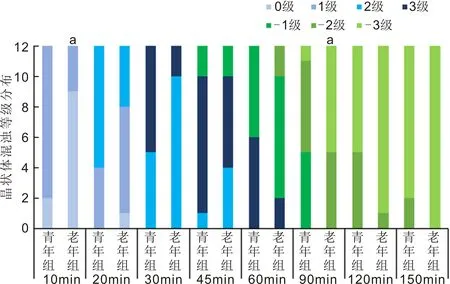
图2 两组小鼠水合氯醛注射后不同时间点晶状体混浊分布情况 aP<0.05 vs 青年组。

图3 青年小鼠及老年小鼠水合氯醛注射后45min眼前节照相 A:青年组小鼠晶状体混浊,混浊厚重,呈乳白色;B:老年组小鼠晶状体混浊,混浊轻薄,呈薄雾状。
2.3水合氯醛诱导小鼠晶状体的病理改变裂隙灯检查发现水合氯醛注射后青年组小鼠与老年组小鼠晶状体的混浊程度差异明显,为探究其机制我们将水合氯醛注射前和注射后45min晶状体混浊3级的两组小鼠眼球进行病理组织学检查。HE染色可见水合氯醛诱导的晶状体混浊主要病理改变在晶状体前皮质,但晶状体核及后皮质无明显改变。水合氯醛注射前,青年组小鼠晶状体纤维排列规则;注射后45min,青年组小鼠晶状体纤维排列欠规则,囊膜下浅皮质间出现大量水泡。水合氯醛注射前老年组小鼠晶状体纤维呈老年性改变,纤维肿胀变性;注射后45min,老年组小鼠晶状体纤维排列紊乱,前皮质下少量水泡聚集,但明显少于青年组小鼠,见图4。

图4 水合氯醛注射前后小鼠晶状体病理改变(HE染色) A:水合氯醛注射前青年组小鼠晶状体;B:水合氯醛注射前老年组小鼠晶状体;C:水合氯醛注射45min后青年组小鼠晶状体,混浊3级;D:水合氯醛注射45min后老年组小鼠晶状体,混浊3级。
2.4两组小鼠麻醉后LECs的Na+-K+-ATP酶表达HE染色发现水合氯醛注射后晶状体前皮质有大量水泡积聚,这可能是导致晶状体混浊的主要原因。LECs中Na+-K+-ATP酶主动转运Na+和K+,维持离子的平衡对于晶状体透明性的维持十分重要。为探讨Na+-K+-ATP酶是否参与水合氯醛诱导的急性可逆性晶状体混浊,我们进行了Na+-K+-ATP酶的免疫组织化学染色。结果显示,水合氯醛注射前,两组小鼠Na+-K+-ATP酶在LECs呈低表达;水合氯醛注射后45min,两组小鼠LECs的Na+-K+-ATP酶的表达显著增加,而且老年组小鼠LECs的Na+-K+-ATP酶的表达增加更为显著,见图5。

图5 免疫组织化学检测水合氯醛注射前后小鼠晶状体的Na+-K+-ATP酶的表达 A:水合氯醛注射前青年组小鼠晶状体Na+-K+-ATP酶低表达;B:水合氯醛注射前老年组小鼠晶状体Na+-K+-ATP酶低表达;C:水合氯醛注射后45min青年组小鼠晶状体混浊3级,Na+-K+-ATP酶表达增加;D:水合氯醛注射后45min老年组小鼠晶状体混浊3级,Na+-K+-ATP酶表达显著增加。
3讨论
啮齿类动物的急性可逆性晶状体混浊是个相对古老的问题,早在20世纪60年代就有研究者报道了这一现象。研究显示水合氯醛、戊巴比妥钠、七氟醚、氯胺酮-甲苯噻嗪等麻醉剂均可引起小鼠急性可逆性晶状体混浊[5-6],而且温度、氧供、脱水、pH值、小鼠品系等多种因素也可影响晶状体混浊的进展[7]。研究显示,不同麻醉镇静药物诱导的晶状体混浊进展过程相似,推测可能与麻醉剂导致的体温下降相关[8]。药物、气体[9]、脱水[10]等因素也会引起人晶状体出现可逆性混浊,但其具体分子机制尚不清楚。
水合氯醛是动物实验中的常用镇静药物,也是儿童眼科检查的常用镇静药物[11]。其镇静效果稳定,作用持续时间长,能降低新陈代谢,抑制体温中枢,使体温下降。水合氯醛注射后小鼠会出现眼睑闭合障碍、眼球突出,注射后10~20min开始出现晶状体混浊,注射后30min晶状体显著混浊,并持续至注射后约60min,注射后60~90min晶状体混浊开始消退,直至小鼠苏醒前后,晶状体混浊全部消退[5]。既往研究显示水合氯醛诱导的急性可逆性晶状体混浊可能与麻醉效应[5]、角膜脱水[12]和温度[2,13]等因素有关。研究显示应用低渗生理盐水[8]、透明质酸钠[14]、卡波姆[1]等滴眼液可以缓解麻醉剂诱导的晶状体混浊程度[1,14],应用角膜接触镜、眼睑缝合等方法也可以减缓或阻止晶状体混浊的形成[12]。有研究者推测是由于麻醉状态下小鼠无法瞬目,泪膜蒸发,角膜缺水而导致晶状体循环出现障碍,滴眼液、接触镜及闭合眼睑等方法可以抑制泪液的蒸发,减轻角膜脱水,进而延缓晶状体混浊的进展。环境温度下降显著增加晶状体混浊的程度和进展,环境温度升高显著降低晶状体混浊的程度和进展,室温达到37℃时,大部分小鼠不形成晶状体混浊[2,13]。本实验过程中保持室温23℃,用生理盐水点眼来保持角膜湿润,尽量减少晶状体混浊的影响因素。本研究发现水合氯醛注射后青年组小鼠和老年组小鼠晶状体混浊进展过程相似,但青年组小鼠晶状体混浊进展速度更快,混浊程度更高,提示晶状体年龄相关性改变对水合氯醛诱导的晶状体混浊具有一定的影响。
水合氯醛等镇静麻醉剂诱导的急性晶状体混浊的确切分子机制尚不明确。晶状体的液体稳态对晶状体透明性有重要影响,其中主要包括水循环和离子交换。水通道蛋白1(aquaporin 1, AQP1)、Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性对维持晶状体液体稳态具有重要的作用。Gu等[8]应用活体激光共聚焦显微镜和OCT发现水合氯醛诱导晶状体混浊主要改变晶状体前皮质,本研究的结果也显示水合氯醛诱导的混浊晶状体前皮质下大量水泡积聚,晶状体的水含量/离子浓度改变可能参与水合氯醛诱导晶状体混浊。既往研究显示AQP1主要表达在LECs,水通道蛋白0(aquaporin 0,AQP0)主要表达在晶状体纤维[15],水合氯醛诱导的可逆性晶状体混浊,LECs中AQP1表达减少,推测LECs的水和离子的转运可能参与可逆性晶状体混浊[16]。Na+-K+-ATP酶在LECs及纤维中均有表达,其活性在LECs中显著高于晶状体纤维[17],但其蛋白表达与酶的活性并不完全一致。Na+-K+-ATP酶是否参与水合氯醛诱导的晶状体混浊尚未见报道,本研究发现水合氯醛注射前青年组小鼠和老年组小鼠LECs中的Na+-K+-ATP酶均呈现低表达,水合氯醛注射45min后两组LECs中的Na+-K+-ATP酶的表达增加,而且老年组LECs的Na+-K+-ATP酶的表达增加更为显著,这可能与老年小鼠晶状体混浊较青年组较轻相关。
麻醉剂可影响神经元的Na+-K+-ATP酶的活性[18],麻醉后Na+-K+-ATP酶活性降低是否会导致其表达代偿性增加,目前尚不可知。Na+-K+-ATP酶的活性检测比表达检测更有意义,本研究的不足之处在于未进行Na+-K+-ATP酶的活性检测。但本研究提示Na+-K+-ATP酶参与了水合氯醛诱导的可逆性晶状体混浊的形成,晶状体年龄相关性改变对水合氯醛诱导的晶状体混浊形成具有一定影响。
