有氧运动对钝挫伤恢复期大鼠腓肠肌肌电变化影响的实验研究
2021-10-11郁建华孔纯纯张英祥潘卫东李可峰董贵俊
郁建华 孔纯纯 张英祥 潘卫东 李可峰 董贵俊
摘 要:对腓肠肌钝挫伤后大鼠恢复过程施加有氧运动进行恢复干预,通过分析肌电变化情况,探讨施加有氧运动对钝挫伤腓肠肌恢复的影响。60只雄性SD大鼠随机分为5组:正常对照组(A组)、自然恢复组(B组)、伤后48 h有氧运动组(C组)、伤后7 d恒定负荷有氧运动组(D组)、伤后7 d渐增负荷式有氧運动组(E组)。建模并于钝挫伤后2、5、7、10、14、21、28、30、35、56 d进行肌电图检测,观察大鼠钝挫伤腓肠肌恢复情况,记录静息电位、肌电异常自发活动出现的程度、复合肌肉动作电位(CMAP)的波幅和潜伏期的变化情况。结果显示:(1)自发电位结果:E组自发电位Daube积分分别在21、28、35 d显著低于C组,D组在28 d显著低于C组。(2)CMAP潜伏期比值:E组在14、28、35 d均显著低于B组,在14、21、28、35 d显著低于C组,在35 d显著低于D组。(3)CMAP波幅比值:D组在35、56 d显著高于B组,E组在10、14、28、35、56 d显著高于B组;D组和E组在10、14、21、28、35、56 d均显著高于C组;E组在10、56 d显著高于D组。结果表明:在腓肠肌钝挫伤恢复过程中,伤后48 h施加有氧运动,可加剧诱发大鼠自发电位异常,延长CMAP潜伏期,降低波幅恢复速度,不利于大鼠腓肠肌钝挫伤后的恢复及周围神经发生再支配;7 d后施加递增有氧运动和恒定负荷有氧运动可促进异常自发电位消失,缩短CMAP潜伏期,提高波幅恢复速度,有利于大鼠受损骨骼肌的修复及神经再支配。
关 键 词:运动医学;腓肠肌;钝挫伤;有氧运动;肌电
中图分类号:G804.5 文献标志码:A 文章编号:1006-7116(2021)05-0138-07
An experimental study on the effect of aerobic exercise on electromyographic changes of gastrocnemius muscle in rats during the recovery of contusion
YU Jian-hua1,KONG Chun-chun2,ZHANG Ying-xiang2,
PAN Wei-dong3,LI Ke-feng2,DONG Gui-jun2
(1.Department of Physical Education,Nanjing University of Aeronautics and Astronautics,Nanjing 210016,China;
2.College of Sports and Health,Shandong Sport University,Jinan 250102,China;
3.Department of Bio-electromagnetic Technology Research, Institute of Electrical Engineering of Chinese Academy of Sciences,Beijing 100190,China)
Abstract: Aerobic exercise was applied to recovery intervention in the rats after blunt contusion of gastrocnemius muscle during the recovery period, so as to explore the effect of the recovery of gastrocnemius muscle with blunt contusion by conducting aerobic exercise via analyses of electromyographic changes. 60 male SD rats were randomly divided into five groups: normal control group (group A), natural recovery group (group B), aerobic exercise group 48h after injury (Group C), constant load aerobic exercise group 7d after injury (Group D), gradually increasing load aerobic exercise group 7d after injury (Group E). The rats were sacrificed at 2d, 5d, 7d, 10d, 14d, 21d, 28d, 30d, 35d and 56d after blunt contusion, and were tested by electromyography. The recovery of gastrocnemius muscle was observed, the resting potential was recorded and the changes of CMAP were inducted during recovery. Results show that: (1) spontaneous potential: the Daube score of spontaneous potential in Group E was significantly lower than that in group C at 21d, 28d and 35d, and that in group D was significantly lower than that in group C on 28d. (2) CMAP latency ratio: the latency of group E was significantly lower than that of group B at 14d, 28d and 35d, significantly lower than that of group C at 14d, 21d, 28d and 35d, and significantly lower than that of group D at 35d. (3) CMAP amplitude ratio: the amplitude of group D was significantly higher than that of group B at 35d and 56d, and that of group E was significantly higher than that of group B at 10d, 14d, 28d, 35d and 56d; the amplitude of group D and E was significantly higher than that of group C at 10 d, 14 d, 21d, 28d, 35d and 56d; the amplitude of group E was significantly higher than that of group D at 10 d and 56d. The study indicates that: during the recovery process of gastrocnemius contusion, aerobic exercise 48 hours after injury can aggravate the abnormal spontaneous potential, prolong the latent period of CMAP, and reduce the recovery speed of amplitude, which is not conducive to the recovery of gastrocnemius contusion and reinnervation of peripheral nerve; after 7 days, incremental aerobic exercise and constant load aerobic exercise can promote the disappearance of abnormal spontaneous potential, shorten the latent period of CMAP, improve the recovery speed of amplitude, which is conducive to the repair and reinnervation of damaged skeletal muscle.
Keywords: sports medicine;gastrocnemius;blunt contusion;aerobic exercise;electromyograph
在运动损伤中,有90%运动损伤的患者伴有骨骼肌损伤[1],其中以钝挫伤最为常见[2]。钝挫伤多发生于对抗性项目或者重力性撞击意外事故,治疗不及时或者治疗不得当,易形成疤痕、肌肉纤维化,使肌肉修复不完整,而且弹性和收缩性降低,并容易引起反复性再损伤,影响伤者肌肉的运动功能,进而影响运动员的运动能力及运动寿命[3-4]。肌电检测记录肌肉收缩时所引起的不同肌电变化曲线和数值,是分析和判断肌肉状态的有效检测手段。研究证实,骨骼肌损伤后其相应的支配神经轴突产生损伤,导致部分失神经支配引起电位变化[3],进而通过损伤局部肌电信号的变化表现出来,具体表现为纤颤电位和正尖波逐渐减少等[2]。因此,在骨骼肌钝挫伤恢复过程中,钝挫伤后肌电信号可以有效反映损伤部位肌肉功能恢复状况,并可作为检测骨骼肌损伤愈合进程、修复质量的指标[5]。
运动康复是目前康复领域的新趋势,既致力于恢复机体功能,又聚焦于改善机体病理治疗效果,但是不合理的运动康复对钝挫伤早期愈合会起到副作用[6]。对于骨骼肌钝挫伤的运动康复介入治疗,其治疗的时间和强度选取,是临床运动康复的棘手问题。已有研究发现,有氧运动可减轻钝挫伤早期产生的炎证反应,促进卫星细胞对肌肉组织的再生和修复[7],但也可能会促进bFGF等修复因子过度表达在后期的修复中生成瘢痕[8]。因此,研究钝挫伤后运动康复干预时机、干预强度,对于钝挫伤的运动康复具有重要意义。本研究建立骨骼肌钝挫伤动物模型,并通过不同形式有氧运动对其进行恢复干预,检测损伤骨骼肌肌电变化,分析施加有氧运动对钝挫伤恢复的干预效果。
1 研究对象与方法
1.1 研究对象
60只雄性SD大鼠(8周龄)购自北京华阜康生物科技股份有限公司,体质量(260±8)g,于中国科学院电工研究所生物医学工程部动物房分笼饲养。室温保持在(21±3)℃,相对湿度30%~50%,光照时间为8:00—20:00,国家标准固体混合饲料喂养,自由饮食。
1.2 研究方法
1)动物分组及模型构建。
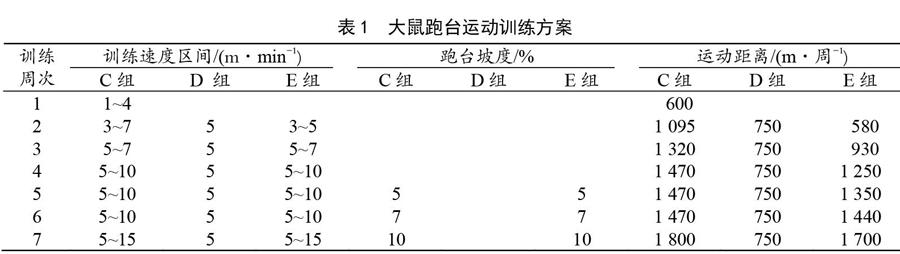
60只大鼠进行一周适应性饲养和运动后,随机分为5组,每组12只,每组10只进行实验测试,2只备用。实验中未出现实验动物死亡情况。具体分组情况如下:A组(正常对照组),笼内自然生长,正常饲养,不做任何处理和干预;B组(自然恢复组),钝挫伤后,笼内自然愈合,除钝挫伤急性期每天擦涂碘伏消毒外(以下3组同),不施加任何恢复干预措施;C组(伤后48 h递增负荷运动恢复组),在钝挫伤48 h后施加7周递增负荷有氧运动;D组(伤后7 d恒定负荷运动恢复组),在钝挫伤后7 d施加6周恒定负荷有氧运动;E组(伤后7 d递增负荷运动恢复组),在钝挫伤后7 d施加6周递增负荷有氧运动。
将实验大鼠经0.2%戊巴比妥钠溶液2 mL/kg腹腔注射麻醉后,固体木制圆柱体下落导致右小腿内侧面(其皮下为腓肠肌中段)一次打击伤[4, 9]。打击器为自制,打击面直径为1 cm,下落物体的长度为116 cm,质量为600 g,均从垂直40 cm 高处自由落下,计算后动能为2.56 J。经解剖证实,腓肠肌经打击后,100%导致钝挫伤成功。
2)实验动物跑台运动方案。
本实验除A组与B组不参与运动外,C、D和E组均介入运动干预。运动负荷在ZH-PT动物实验跑台(PT-96,中国)上进行。本实验动物运动干预方案的设置参照Bedford[10]理论进行。另外,C组从伤后48 h开始施加运动,运动干预为7周;D和E组从伤后1周开始施加运动,运动干预时间为6周。C、D和E组每周均运动5 d,每天3次,每次运动时长为10 min,每两次运动之间休息10 min。具体运动方案见表1。
3)大鼠体质量检测。
适应性喂养及实验期间,每天8:00测试大鼠体质量,监测大鼠体质量变化,检查大鼠伤后愈合情况,做好记录工作。
4)肌电检测。
肌电检测采用十六导生理记录仪MP150(Biopac,美国),并分别于大鼠钝挫伤后2、5、7、10、14、21、28、35、56 d进行,参照陈疾忤等[3]方法实施。每只大鼠同时检测左右下肢腓肠肌,以左侧腓肠肌作为健侧对照。大鼠麻醉后,切开皮肤,暴露右侧腓肠肌,并于腘窝处暴露坐骨神经的腓肠肌支。在腓肠肌受损处的远、近端插入记录电极,观察并记录大鼠安静状态下的静息电位及相关异常自发活动(纤颤电位和正尖波)等。保持电极于腓肠肌受损处,在腘窝处用刺激电极针以3 mA的脉冲电流刺激坐骨神经,记录复合肌肉动作电位(Compound muscle action potential,CMAP)。采样率为1000 Hz,EMG100C肌电放大器采集信号。同样方法应用于大鼠左侧腓肠肌。
1.3 数据处理与统计
本研究分析各组间肌电自发活动出现的程度、CMAP的波幅、潜伏期的差异。异常自发电位分级与记录采用Daube[11]标准(以下称为Daube积分),即:Ι度为异常自發电位至少在2个区域持续出现(Daube积分赋值为1);Ⅱ度为异常自发电位在3个或更多区域持续性出现(赋值为2);Ⅲ度为异常自发电位在所有区域大量持续性发放(赋值为3);Ⅳ度为异常自发电位呈弥漫性、广泛性、持续性发放,充满基线(赋值为4);无异常自发活动出现赋值为0。为排除动物个体差异和不同时间点造成的误差,以伤侧CMAP波幅、潜伏期与健侧的比值作为参数进行比较[2]。所有数据采用SPSS 19.0统计分析软件进行单因素方差分析(One-Way ANOVA),数据均以平均值±标准差(M±SD)表示。P<0.05,差异(或差别)有统计学意义;P<0.01,差异(或差别)有统计学非常显著意义。
2 结果与分析
2.1 钝挫伤后大鼠体质量变化情况
观察大鼠钝挫伤恢复期体,发现随着时间的增长和恢复的进程,体质量在逐步升高。A组大鼠,身体灵活,有活力,皮毛有光泽,饮食正常,体质量呈平稳逐渐上升趋势。B、C、D、E组大鼠,均在第2~5天体质量呈下降或者缓慢生长趋势,第7~14天为缓慢增长趋势。从第2周后期到整个第3周,甚至第4周会出现恢复期体质量快速增长的现象。
2.2 骨骼肌钝挫伤后大鼠腓肠肌肌电变化情况
1)钝挫伤大鼠腓肠肌自发电位变化结果。
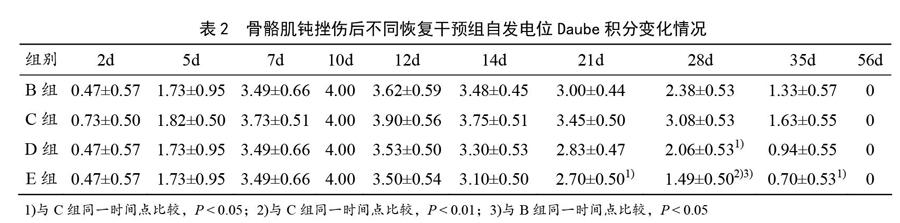
静息电位在大多数细胞中是一种稳定的直流电位,在细胞未受到外来刺激且保持正常的新陈代谢时稳定在某一相对恒定的水平,即表现为一条直线。纤颤电位和正锐波是异常自发电位的表现形式之一,可见于神经源性损害。本研究检测大鼠静息电位肌电图观察到,A、B、C、D、E组大鼠的左健侧腓肠肌静息电位是一条平稳的直线,在实验中未出现异常自发电活动,故在观测期内Daube积分均为0,因此具体数据不再在表2中显示。
表2显示,不同恢复干预组大鼠的异常自发电位均在骨骼肌钝挫伤后2~5 d少量出现(零星的纤颤电位及正尖波)。各组钝挫伤后7~10 d异常自发电位发生逐渐加剧,至第10天为最高峰,随着愈合时间及干预修复的进程,其出现的异常自发电位逐渐减少,表现为缓慢下降趋势,至第56天恢复为正常。值得注意的是,C组的异常自发电位在第10天达到高峰,之后继续维持高峰水平至第12天,而E组自第10天后,异常自发电位快速減少。
比较不同干预组同一时间点的自发电位发现,损伤后1~14 d,各恢复干预组之间,自发电位的恢复水平无统计学差异(P>0.05);至第21天,E组的Daube积分显著低于C组(P<0.05),表明E组的异常自发电位减少水平显著高于C组;至第28天,E组的Daube积分显著低于C组(P<0.01)和B组(P<0.05),D组的Daube积分显著低于B组(P<0.05);至第35天,E组的Daube积分显著低于C组(P<0.05)。
由此,钝挫伤后大鼠恢复过程后期各恢复干预组异常自发电位逐渐减少。C组在早期明显出现异常自发电位,并且将异常自发电位高峰拖至到第12天,较其他恢复组的异常自发电位减少程度缓慢。D、E组均比B组的异常自发电位减少速度稍快,E组在4组不同干预手段中,其异常自发电位减少程度最快。
2)不同恢复干预组大鼠腓肠肌钝挫伤后CMAP潜伏期变化。
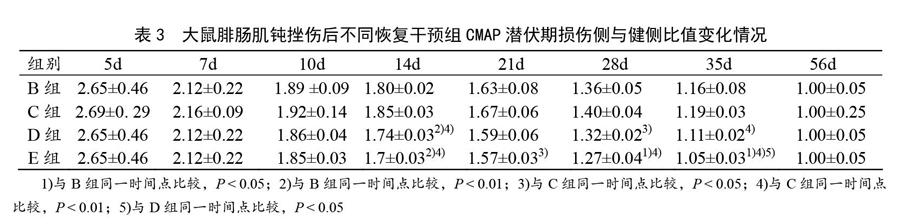
A组为未损伤组,在电刺激下会引出CMAP,而在其他各损伤组(B、C、D和E组)大鼠的右侧伤肢,在其受伤的4 d内不能引出CMAP,而在第5天后不同恢复组逐渐引出了不同形态的低波幅CMAP,其引出的CMAP潜伏期较长。表3显示,不同恢复干预组的大鼠腓肠肌CMAP潜伏期比值随着修复的进程逐渐缩短。对同一时间点的CMAP潜伏期比值变化进行分析,发现在损伤后10 d,各恢复干预组之间CMAP潜伏期的恢复水平差异没有统计学意义(P>0.05);至第14天,D、E组CMAP潜伏期比值分别显著低于B、C组(P<0.01);至第21天,E组CMAP潜伏期比值显著低于C组(P<0.05);至第28天,E组CMAP潜伏期比值显著低于B组(P<0.05),极显著低于C组(P<0.01),D组显著低于C组(P<0.05);至第35天,E组CMAP潜伏期比值显著低于B、D组(P<0.05),极显著低于C组(P<0.01);至第56天,各组CMAP潜伏期均恢复正常。结果显示,E组CMAP潜伏期在4组不同恢复干预组中最短,其次是D、B组,而C组在4组不同恢复干预组中CMAP潜伏期缩短是最缓慢的。
3)不同恢复干预组大鼠腓肠肌钝挫伤后CMAP波幅比值变化。
钝挫伤大鼠的伤侧腓肠肌CMAP波幅,随着时间的推移及愈合的好转,逐渐从离散状波形,恢复出正常波形;波幅逐渐接近健侧及对照组大鼠CMAP的波幅。表4数据显示,钝挫伤组大鼠的CMAP波幅比值均随着修复进程逐步升高,但表现出不同的规律。至第7天,B、C、D、E组间CMAP波幅比值均没有统计学差异(P>0.05);至第10天,E组CMAP波幅比值显著高于B、D组(P<0.05),极显著高于C组(P<0.01),D组极显著高于C组(P<0.01);至第14天,C组显著低于D组(P<0.05)和E组(P<0.01),E组显著高于B组(P<0.05);至第21天,E、D组的CMAP波幅比值均极显著高于C组(P<0.01);至第28天,E、D组的CMAP波幅比值均极显著高于C组(P<0.01),E组显著高于B组(P<0.05);至第35天,E、D组的CMAP波幅比值均极显著高于C组(P<0.01),E组极显著高于B组(P<0.01),D组显著高于B组(P<0.05);至第56天,E组CMAP波幅比值均极显著高于B、C、D组(P<0.01),D组极显著高于B、C组(P<0.01)。由以上结果所知,E组CMAP波幅的恢复是4组不同恢复干预组中最为快速,其次是D、B组,而C组在4组恢复干预中CMAP波幅恢复速度最为缓慢,所需恢复期更长(见图1)。
3 讨论
骨骼肌伤后恢复过程一般分为3个阶段:破坏期(第1周)、修复期(第2~6周)和重塑期(第7周后)[12]。肌肉炎症伴随着组织愈合的整个过程,这一过程的适当演变将确保最佳的肌肉再生,从而产生适当的肌肉功能。然而,炎症反应的加重可能损害肌肉再生,导致纤维化瘢痕或脂肪组织浸润,使肌肉功能难以恢复[13],因此一直是运动医学领域研究的难点和焦点。肌卫星细胞是骨骼肌成体干细胞,被激活后,可增殖分化生成新的肌细胞。研究显示,一定负荷或者负重运动可激活肌卫星细胞,并调控相关信号通路,参与新肌的产生[14]。如,Smith等[15]发现持续的肌肉负荷可以促进大鼠骨骼肌卫星细胞增殖和新肌核增生,从而有助于损伤后的肌纤维修复和再生。同样,Fry等[16]研究表明12周的有氧训练不但可引起肌纤维平均横截面积的增加,还可增加卫星细胞含量和每根纤维的肌核数。而且,骨骼肌急性损伤后介入运动干预,有助于加速肌卫星细胞的激活[17],从而促进损伤骨骼肌功能恢复。另外,不同的运动形式可激活不同类型肌卫星细胞的增殖与分化,其运动强度、负荷阈值和运动介入时机等均影响卫星细胞激活增殖与分化程度[18]。值得注意的是,骨骼肌钝挫伤后48 h处于急性炎症反应期,产生严重的氧化应激,而修复期一般在伤后1周开始[19],因此采取何种运动干预方式及何时介入值得探讨。本研究建立了3组不同运动修复时期的有氧运动干预恢复组,通过肌电图监测不同时期、不同负荷形式下肌电变化,以期对损伤骨骼肌运动神经元功能修复进行时程性监测与分析。
骨骼肌在运动神经元的支配下具有弹性、收缩功能等,钝力性挫伤容易造成肌肉收缩能力、弹性等下降,导致单个的神经元及其轴突受损及所支配的肌纤维受损发生肌肉病变[12]。因此,骨骼肌损伤后必然伴随肌纤维的失神经支配。损伤肌肉失神经支配会导致肌肉膜电位的变化,表现为肌肉膜静息电位的下降,而且会在无任何外界刺激下膜电位产生自发性振荡,发放异常自发电位,出现纤颤电位和正尖波等异常自发活动[5]。反之,当异常自发电位消失时,其肌纤维又重新获得神经支配[2]。Hurme等[5]研究了大鼠腓肠肌钝挫伤后的愈合过程,发现伤后第7天,损伤肌纤维的近端和远端均出现纤颤电位和正尖波,并分别于损伤第14天(近端)和第21天(远端)消失;第14天开始观察到运动动作电位的晚期成分;失神经支配主要是肌源性的,较小程度的去神经支配是神经源性的;另外,肌电图表现与形态学改变的相关性结果表明肌电监测可以用来评估骨骼肌伤后的康复状况,但是缺乏深入研究。以Hurme等研究为基础,陈疾忤等[2]通过肌电监测评估大鼠腓肠肌钝挫伤后的康复进度,结果显示:腓肠肌于伤后2~5 d出现肌电异常自发活动,即纤颤电位和正锐波,伤后7~10 d达到高峰,其后逐渐下降,至35 d后基本消失。本研究结果与陈疾忤等结果基本一致。在正常的静息电位时,肌电呈现为一条直线,而钝挫伤后会出现不同程度的异常自发电位,随着不同恢复干预组的恢复治疗其异常自发电位随着恢复的进程与时间推移而逐步減少。其中,骨骼肌钝挫伤后2~5 d,不同恢复干预组大鼠均开始出现异常自发电位,表现为零星的纤颤电位及正尖波等,而且C组早于其他组;钝挫伤7~10 d是各组恢复干预组大鼠异常自发电位的高峰期,而且C组异常自发电高峰持续到伤后第12天。值得注意的是,本研究结果中,C组早期出现异常自发电位明显较其他恢复干预组更早,随着恢复时间的推移其异常自发电位结束的最晚,说明在损伤后的炎症急性反应期介入运动干预会加重肌肉损伤并延缓肌肉损伤的修复速度。而D、E组均比B组的异常自发电位减少速度稍快,E组在4组不同干预手段中,其异常自发电位减少速度最快,说明在损伤后一周加入低强度渐增负荷式有氧运动干预可缩短病程,有益于肌肉的损伤恢复。
支配骨骼肌的神经在电刺激下会发生兴奋,导致支配的骨骼肌纤维产生动作电位。当神经在超大强度的电刺激下,会募集其支配的所有肌纤维参与产生动作电位,即产生CMAP[5],其波幅大小与去极化的肌纤维数量正相关,而如果周围神经所支配的肌纤维不能被有效激活则可能使其波幅降低。肌纤维的坏死瘢痕纤维化、失神经、肌细胞减少,都会记录到CMAP异常[20]。陈疾忤等[2]研究结果显示:腓肠肌损伤局部早期无法引出CMAP,至伤后5 d才出现多相的CMAP;伤后10 d CMAP潜伏期明显延长,损伤侧CMAP波幅降低,CMAP的潜伏期与健侧的比值,随着时间的延长而增高,并于伤后35~56 d恢复正常。本研究与上述结果基本一致:正常对照组在电刺激的传导下会引出CMAP,而受伤大鼠,在其受伤的4 d内不能引出CMAP,这与损伤肌纤维发生失神经支配,电刺激将难以募集神经支配的肌纤维有关;5 d后,对不同运动恢复干预组进行电刺激,逐渐引出了不同形态的(离散型)低波幅且潜伏期较长的CMAP,提示伤后5 d开始发生肌纤维的神经再支配过程。随着时间推移和修复进程,CMAP潜伏期也在逐渐缩短,波幅逐渐增大,波形趋于正常。运动干预研究结果表明,E组的CMAP潜伏期缩短在4组不同恢复干预组中最快,其次是D、B组,而C组最慢。骨骼肌钝挫伤大鼠腓肠肌CMAP波幅,逐渐从离散状波形恢复为正常波形,在恢复后期波幅逐渐接近未损伤大鼠CMAP的波幅。其中,E组CMAP波幅的恢复在4组不同恢复干预组中最快,其次是D、B组,而C组恢复进度最慢。上述结果提示损伤后48 h加入运动干预不利于骨骼肌的恢复与周围神经发生再支配,而损伤后1周加入低强度渐增负荷式有氧运动干预有利于受损骨骼肌的修复及神经再支配。
综上所述,骨骼肌伤后48 h施加有氧运动对于骨骼肌的功能恢复效果不佳,而在伤后1周的修复期介入运动有利于骨骼肌的损伤修复,特别是施加渐增负荷式有氧运动干预效果最佳。这可能是因为骨骼肌钝挫伤后48 h是严重的炎症反应期,在此期间介入运动可能加重炎症反应,促使损伤的骨骼肌组织内出现大量炎细胞浸润,引起更高浓度的细胞分解物及毒素等,损害未被修复成功的肌组织及正常肌组织[21]。已有研究表明骨骼肌钝挫伤后48 h是炎细胞的高发期,仅有少量卫星细胞出现,而骨骼肌钝挫伤1周后,肌卫星细胞才开始大幅度升高,并且产生分化[5],而此时引入运动干预,可进一步促使肌卫星细胞的增殖与分化,促进周围神经的再生与损伤肌纤维的神经再支配,从而加快受伤骨骼肌的修复进程与功能恢复。
因此,在钝挫伤早期,无论是进行运动,还是休息都存在炎症反应,而早期进行运动,可能会使炎症反应高于休息,不利于骨骼肌钝挫伤的恢复[22]。与此相对,钝挫伤7 d后施加渐增负荷有氧运动恢复效果在4组恢复干预中治疗效果较理想。钝挫伤7 d后施加恒定负荷有氧运动恢复效果仅次于钝挫伤7 d后施加渐增负荷有氧运动效果,可能是由于骨骼肌钝伤后7 d炎症细胞已经降至最佳数量,且血肿消失、细胞内渗透重新获得平衡[23],选择在这个时间施加低强度有氧运动可以有效激活卫星细胞[24],促进生长因子的生长,提高肌肉的代谢能力,进而有利于大鼠骨骼肌钝挫伤的恢复[25]。
大鼠腓肠肌钝挫伤早期48 h施加有氧运动,会导致大鼠异常自发电位出现更早、结束更晚,CMAP潜伏期延长,波幅恢复周期长,不利于大鼠钝挫伤后的腓肠肌肌电的正常恢复。大鼠腓肠肌钝挫伤修复过程中,7 d后施加渐增负荷有氧运动和7 d后施加恒定负荷有氧运动可使大鼠异常自发电位减少更快速,CMAP潜伏期缩短,有利于波幅增大,促进大鼠钝挫伤后的腓肠肌肌电的正常恢复。本研究表明大鼠腓肠肌钝挫伤后,施加有氧运动的时机及训练强度等干预策略影响骨骼肌钝挫伤恢复过程中肌纤维再生和损伤肌纤维的神经再支配进程,因此骨骼肌损伤后何时并采用何种运动方案需要进一步探讨。
参考文献:
[1] VIDONI A,GILLETT M,BOTCHU R,et al. Lower limb muscle injuries:The good,the bad and the ugly[J]. Eur J Radiol,2018,104:101-107.
[2] 陈疾忤,陈世益,李云霞,等. 骨骼肌钝挫伤后肌电检测的应用研究[J]. 中华物理医学与康复杂志,2005,27(1):23-24.
[3] 陈疾忤,陈世益,李云霞,等. 骨骼肌钝挫伤后愈合质量的肌电评价[J]. 中国运动医学杂志,2004,23(1):21-26.
[4] 董贵俊,李可峰,葛新发,等. 补充磷脂对大鼠腓肠肌钝挫伤收缩力、松弛特性及自由基清除的影响[J].武汉体育学院学报,2011,45(10):52-55.
[5] HURME T,LEHTO M,FALCK B,et al. Electromyography and morphology during regeneration of muscle injury in rats[J]. Acta Physiol Scand,1991,142(4):443-456.
[6] 徐明明,于晓华,吴耀义,等. 跑台运动对大鼠骨骼肌急性钝挫伤后TGF-β1和bFGF表达的影响[J].中国运动医学杂志,2013,32(4):327-331.
[7] 杨辉,常青,唐成林,等. 跑台运动训练与按摩联合作用对大鼠骨骼肌急性损伤修复过程中炎症的发展及肌卫星细胞增殖的影响[J]. 体育科学,2015,35(3):51-58.
[8] SMITH C,KRUGER M J,SMITH R M,et al. The inflammatory response to skeletal muscle injury[J]. Sports Med,2008,38(11):947-969.
[9] KAMI K,MASUHARA M,KASHIBA H,et al. Changes of vinculin and extracellular matrix components following blunt trauma to rat skeletal muscle[J]. Med Sci Sports Exerc,1993,25(7):832-840.
[10] BEDFORD T G,TIPTON C M,WILSON N C,et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[11] OAUBE J R. AAEM minimonograph#11:Needle examination in clinical electromyography[J]. Muscle Nerve,1991,14(8):685-700.
[12] J?RVINEN T A,J?RVINEN M,KALIMO H. Regeneration of injured skeletal muscle after the injury[J]. Muscles Ligaments Tendons J,2014,3(4):337-345.
[13] CHELLINI F,TANI A,ZECCHI-ORLANDINI S,et al. Influence of platelet-rich and platelet-poor plasma on endogenous mechanisms of skeletal muscle repair/ regeneration[J]. Int J Mol Sci,2019,20(3):683.
[14] PUGH J K,FAULKNER S H,TRUNER M C,et al. Satellite cell response to concurrent resistance exercise and high-intensity interval training in sedentary,overweight/obese,middle-aged individuals[J]. Eur J Appl Physiol,2018,118(2):225-238.
[15] SMITH H K,MAXWEL L L,RODGERS C D,et al. Exercise-enhanced satellite cell proliferation and new myonuclear accretion in rat skeletal muscle[J]. J Appl Physiol,2001,90(4):1407-1414.
[16] FRY C S,NOEHREN B,MULA J,et al. Fibre type-specific satellite cell response to aerobic training in sedentary adults[J]. J Physiol,2014,592(12):2625-2635.
[17] 賀舟,常青,唐成林,等. 大鼠骨骼肌急性损伤后早期运动训练和按摩对肌卫星细胞增殖相关因子的影响[J]. 中国康复理论与实践,2020,26(1):49-54.
[18] 王震,蔺海旗,何霏,等. 运动激活骨骼肌卫星细胞:增龄性肌衰减症及肌肉损伤修复的运动预防和治疗[J]. 中国组织工程研究,2021,25(23):3752-3759.
[19] LI K,HAN W,ZHAO Y,et al. Using complex II as an emerging therapeutic target for the treatment of muscle lesions[J]. Saudi J Biol Sci,2019,26(8):1943-1947.
[20] MCLOUGHLIN T J,MYLONA E,HORNBERGER T A,et al. Inflammatory cells in rat skeletal muscle are elevated after electrically stimulated contractions[J]. J Appl Physiol,2003,94(3):876-882.
[21] GHALY A,MARSH D R. Aging-associated oxidative stress modulates the acute inflammatory response in skeletal muscle after contusion injury[J]. Exp Gerontol,2010,45(5):381-388.
[22] 劉树坤,于晓华,吴耀义,等. SD大鼠骨骼肌钝挫伤早期的组织病理变化[J]. 中国组织工程研究,2012,16(24):4371-4375.
[23] MITCHELL C A,MCGEACHIE J K,GROUNDS M D. Cellular differences in the regeneration of murine skeletal muscle:A quantitative histological study in SJL/J and BALB/c mice[J]. Cell Tissue Res,1992,269(1):159-166.
[24] ORIMO S,HIYAMUTA E,ARAHATA K,et al. Analysis of inflammatory cells and complement C3 in bupivacaine-induced myonecrosis[J]. Muscle Nerve,1991,14:515-520.
[25] MENETREY J. Growth factors improve muscle healing in vivo[J]. J Bone Joint Surg Br,2000,82(1):
