高频即时磁刺激对神经兴奋性与 电压门控钠钾离子通道的影响
2021-10-11朱海军尹晓楠侯文涛徐桂芝
朱海军 尹晓楠 丁 冲 侯文涛 徐桂芝
(1. 省部共建电工装备可靠性与智能化国家重点实验室(河北工业大学) 天津 300130 2. 河北工业大学天津市生物电工与智能健康重点实验室 天津 300130)
0 引言
经颅磁刺激(Transcranial Magnetic Stimulation, TMS)是一种非侵入性的无创脑刺激技术[1-2],其利用法拉第电磁感应定律的原理,通过线圈产生快速变化的脉冲磁场,磁场无衰减地穿透颅骨,在大脑皮层诱导产生感应电流[3-4]。因此,经颅磁刺激可以引起皮层神经兴奋性的变化、重塑神经连接、诱导神经可塑性的改变等,实现神经调控的功能[5-6]。基于此,经颅磁刺激技术已经广泛地应用于脑与认知神经方面的科学研究与临床应用中,如阿尔兹海默症、帕金森症、抑郁症等[7-8]。
TMS的作用效果取决于参数,如刺激强度、频率、周期等[9-10]。一般研究规律表明,运动诱发电位的幅度随着刺激强度与频率的增加而增加[11-12],高频(大于5Hz)TMS对大脑兴奋起到促进作用,而低频(小于或等于1Hz)则产生抑制作用[13]。临床研究表明,90%阈值强度的长期高频重复TMS可以提高轻至中度阿尔兹海默病患者的皮层兴奋性,改善认知功能障碍[14]。长期高频重复TMS可以增强健康成年个体皮层-海马网络区域的功能性连接,改善联想记忆功能和认知过程[15]。动物实验研究揭示,长期高频TMS可有力激活神经可塑性关键分子通路,且在一定范围内具有强度依赖性[16]。2.2T的长期高频TMS可诱导或调节突触可塑性[17]。1.26T的长期高频TMS可以提高认知并调节海马锥体神经元的兴奋性[18]。尽管临床应用与科学研究从不同方面对磁刺激的作用效果做了深入探究,但其激活或者抑制大脑兴奋、调控神经的潜在机制尚不明确。
研究表明,钠通道与钾通道在调控神经兴奋的过程中起着重要的作用,其中,电压门控钠通道(Voltage-Gated Sodium Channels, VGSCs)主要介导膜电位的去极化过程[19],电压门控钾通道(voltage- gated potassium channels, Kv)参与调控静息电位[20]。本课题组前期的研究揭示了0.3T的长期高频TMS可以显著改善大脑老化过程中海马齿状回(Dentate Gyrus, DG)颗粒神经元兴奋性的衰退[21],但缺乏对相关离子通道的潜在调控作用的研究。临床报道经TMS作用后脑电波信号EEG发生即时性的跟随改变,暗示TMS可以对神经活动进行瞬态调节[22]。同时也有动物实验研究报道,神经元在即时磁刺激后神经活动发生改变。例如,急性大鼠脑切片在经过高频磁刺激作用后,其皮层锥体神经元神经放电频率增加,神经活动增强[23]。研究人员利用电压敏感染料光学成像技术,记录到即时高频磁刺激改变了皮层神经元兴奋与抑制的平衡状态,且增加了皮层兴奋性[24],离体坐骨神经元在磁刺激作用后,其神经放电幅值与兴奋性增加[25],这些研究同样暗示磁刺激具有即时效应。尽管如此,关于磁刺激即时效应的研究还很少,且对即时效应机制的探究并不充分[26]。结合前期的研究基础、磁刺激对神经活动可能的瞬态调节作用以及其机制的不明确性,本文继续采用高频刺激,探究不同强度TMS在即时刺激的模式下,对急性小鼠脑切片DG颗粒神经元兴奋性的影响,以及对电压门控钠钾通道的潜在调控作用。探索TMS调控神经兴奋的内在介导机制,并验证TMS的调控作用是否具有强度依赖性。
1 材料与方法
1.1 急性脑切片的制备
所有动物实验均获得河北工业大学伦理委员会批准,且符合实验动物使用规范。KM购自北京华阜康生物科技有限公司,动物饲养的环境温度维持在(25±1)℃,湿度维持在50%~60%,食物与水供应充足,12h光照与黑暗交替循环。将小鼠用异氟烷深度麻醉后迅速断头取脑,将取出的大脑组织浸入氧饱和的低温切片液中,冰浴2min后取出,用502胶水固定在切片槽中,使用德国徕卡VT1200S型号的振动切片机切成厚度为300μm的冠状脑片。将脑片移入氧饱和的人工脑脊液中进行孵育,孵育温度维持在30℃,时间为1h左右。切片液(mmol/L):KCl 2.5、CaCl21、MgCl26、NaH2PO21.625、NaHCO326、glucose 11、sucrose 220,NaOH调节pH至7.4。人工脑脊液(mmol/L):NaCl 124、KCl 3、CaCl22、MgCl22、NaH2PO41.625、NaHCO326、glucose 11、HEPES 5,NaOH调节pH至7.4。
1.2 脑片分组及磁刺激
实验使用中国武汉依瑞德CCY-I型号的经颅磁刺激仪,线圈为Y064型号圆形动物刺激线圈,外径56mm,内径14mm。将脑片移置充满氧饱外液的记录槽(培养皿)中心,将线圈平行且紧贴记录槽上方,线圈中心对准培养皿中心。每只小鼠的脑片依据有无刺激及刺激强度的不同分为对照组、0.3T刺激组、0.5T刺激组。施加的即时磁刺激频率为20Hz,一个序列刺激的持续时间为5s,序列间隔为3s,序列个数5个,总刺激脉冲数500个。刺激完毕后立即对脑片进行膜片钳实验检测,刺激方式如图1所示。
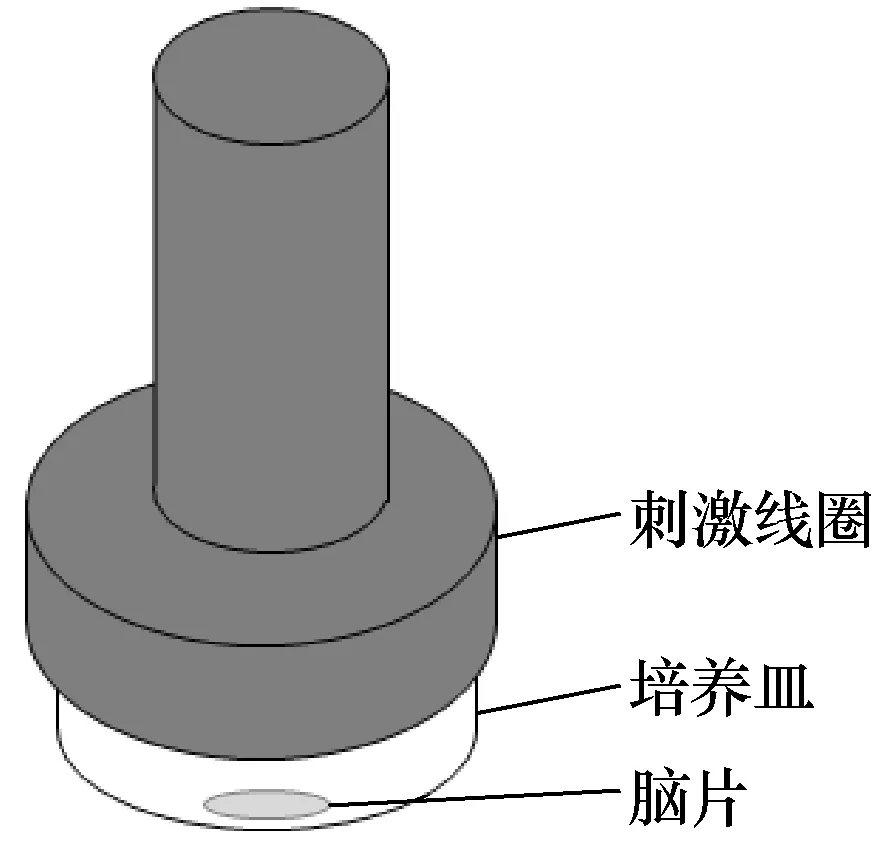
图1 脑片刺激示意图 Fig.1 Schematic illustration of brain slice stimulation
1.3 膜片钳电生理记录
选取DG颗粒细胞作为目的神经元。采用全细胞电压钳模式,记录激活、失活、恢复等不同过程下的电压门控钠电流INa(voltage-gated sodium current)、瞬时外向钾电流IA(transient outward potassium current)、延迟整流钾电流IK(delayed rectifier potassium current)。采用全细胞电流钳模式,记录静息膜电位(Resting Membrane Potential, RMP)、80pA去极化电流下的单个诱发动作电位(Action Potential, AP)及500ms内AP长时程放电。
INa记录外液(mmol/L):NaCl 130、KCl 3、CaCl22、MgCl22、glucose 10、HEPES 10、TEA-Cl 25、4-AP 3、CdCl20.2,KOH调节pH至7.4。INa记录电极内液(mmol/L):CsCl 140、MgCl22、EGTA 10、HEPES 10、Mg-ATP 2,CsOH调节pH至7.2。钾电流记录外液(mmol/L):NaCl 130、KCl 5、CaCl22、MgCl21、glucose 10、HEPES 10、TTX 0.001、CdCl20.2,记录IA时加入终浓度为25的TEA-Cl,记录IK时加入终浓度为3的4-AP,NaOH调节pH至7.4。IA与IK记录电极内液(mmol/L):KCl 140、MgCl22、EGTA 10、HEPES 10、Mg-ATP 2,KOH调节pH至7.2。AP记录外液为人工脑脊液。AP记录内液(mmol/L):K-gluconate 125、NaCl 15、MgCl22、CaCl21、EGTA 11、HEPES 10、Na-ATP 3、Na-GTP 0.3,KOH调节pH至7.2。
1.4 通道电流I-V、激活、失活及恢复曲线的绘制
I-V曲线:以不同电压下的峰电流为纵坐标,以膜电位为横坐标,绘制I-V曲线。激活曲线:首先利用式(1)将电流值转化为电导值,以归一化电导值(G/Gmax)为纵坐标,膜电位为横坐标绘制激活散点图;其次用式(2)Boltzmann方程对散点图进行拟合,失活曲线:以归一化的测试脉冲电流峰值(I/Imax)为纵坐标,膜电位为横坐标绘制失活散点图;然后用式(3)Boltzmann方程对散点图进行拟合。恢复曲线:以测试脉冲记录的峰电流与条件脉冲记录的峰电流比值为纵坐标,以间隔时程为横坐标绘制散点图,所得散点图用式(4)单指数方程进行拟合。

式中,G为电导;Vm为膜电位;Vr为反转电位。
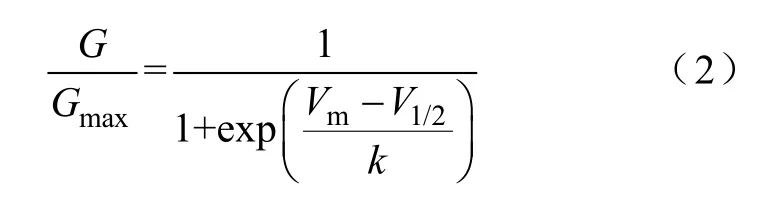
式中,V1/2为半数激活电压;k为斜率因子。

式中,I为每条测试脉冲下的电流峰值;Imax为所有电流峰值中的最大值。
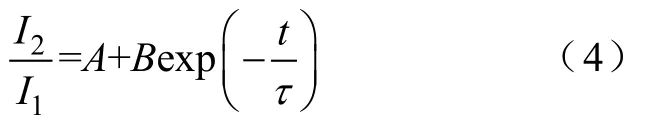
式中,I2为测试脉冲峰电流;I1为条件脉冲峰电流;A、B为常数;t为时间间隔;τ为恢复时间常数。
1.5 数据分析方法
数据分析采用单因素方差(one-way Analysis of Variance, one-way ANOVA)分析方法,强度为主因素。事后分析即组别之间的多重比较采用Turkey- test矫正下的成对t检验分析方法。数据分析软件采用Origin 2017及GraphPad Prism 6。统计结果以mean±SEM呈现,检验水准为0.05。
2 数据分析结果
2.1 磁刺激对电压门控钠通道的影响
2.1.1 磁刺激对INa幅值的影响
不同强度磁刺激对INa幅值的影响如图2所示。如图2a所示,电压钳制在−70mV,给予细胞−80~+70mV的阶梯去极化脉冲刺激,步阶为10mV,波宽20ms,记录到快速激活与快速失活的内向电流。绘制INa的I-V曲线如图2b所示。统计分析结果表明,0.3T与0.5T强度的磁刺激均显著增加了INa幅值,且0.5T磁刺激对INa的激活程度显著高于0.3T。同时,从INa的I-V曲线中可以看出,相较于对照与0.3T的磁刺激,0.5T磁刺激改变了引出INa最大峰值的电压,从−30mV变为−20mV,暗示不同强度磁刺激影响了电压门控钠通道激活状态。
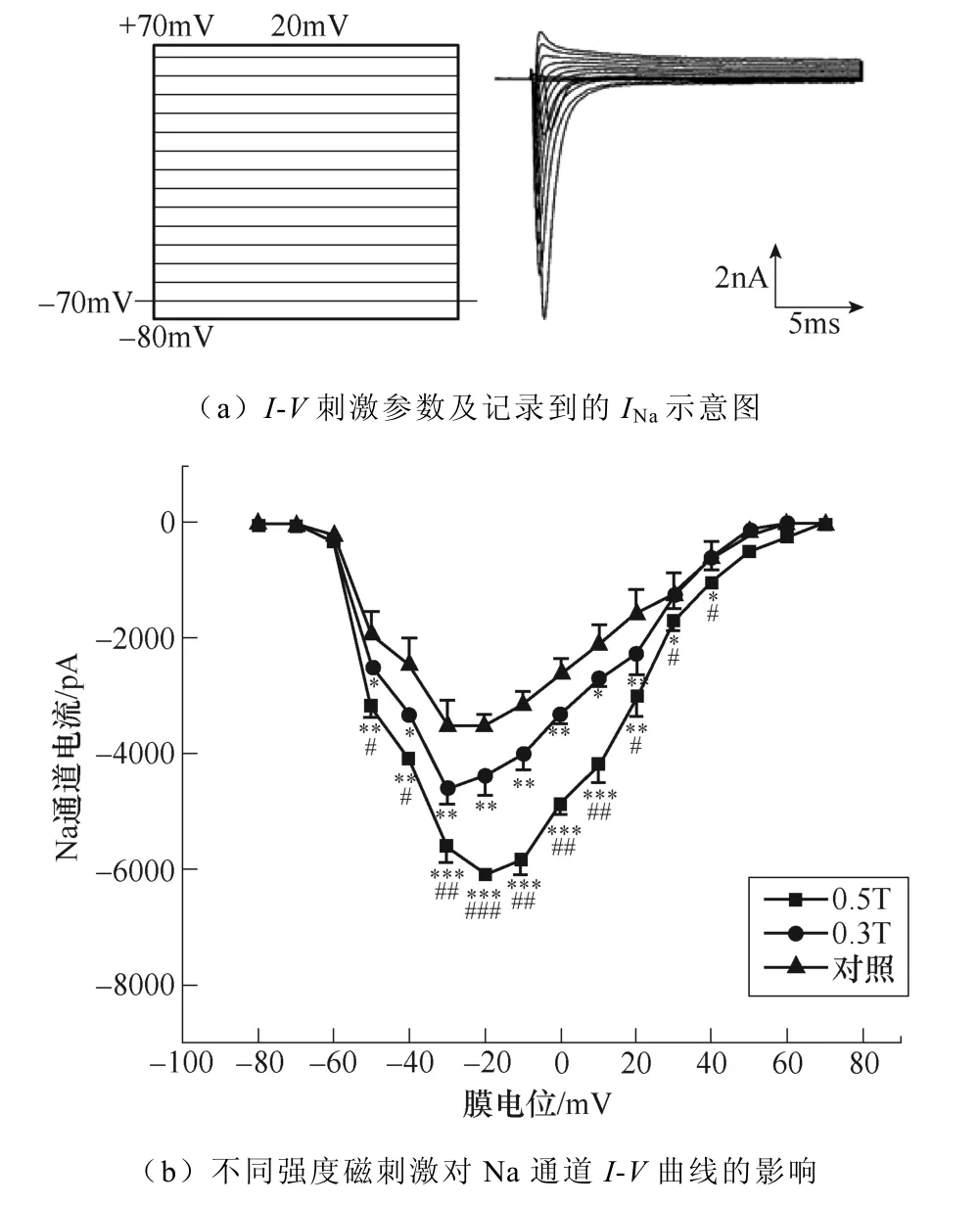
图2 不同强度磁刺激对INa幅值的影响 (*P<0.05,**P<0.01,***P<0.001 vs对照;#P<0.05,##P<0.01,###P<0.001 vs 0.3T) Fig.2 The effect of different intensity magnetic stimulation on the amplitude of INa(*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05,##P<0.01, ###P<0.001 vs 0.3T)
2.1.2 磁刺激对INa激活动力学的影响
不同强度磁刺激对INa激活过程的影响如图3所示。如图3a所示,电压钳制在−70mV,先施加−120mV波宽60ms的条件脉冲,随后给予细胞−90~+10mV的阶梯去极化测试脉冲刺激,步阶为10mV波宽20ms,通过双脉冲刺激记录得到INa的稳态激活过程。绘制INa激活曲线如图3b所示,随着磁刺激强度的增加,INa激活曲线逐渐向左移动,同时V1/2发生了相应的改变,对照组为(−34.08± 0.39)mV,0.3T刺激组为(−36.64±0.57)mV,0.5T刺激组为(−43.39±0.60)mV(**P<0.01 vs对照;#P<0.05 vs 0.3T)。k值变化无显著性差异。INa激活曲线详细参数见表1。
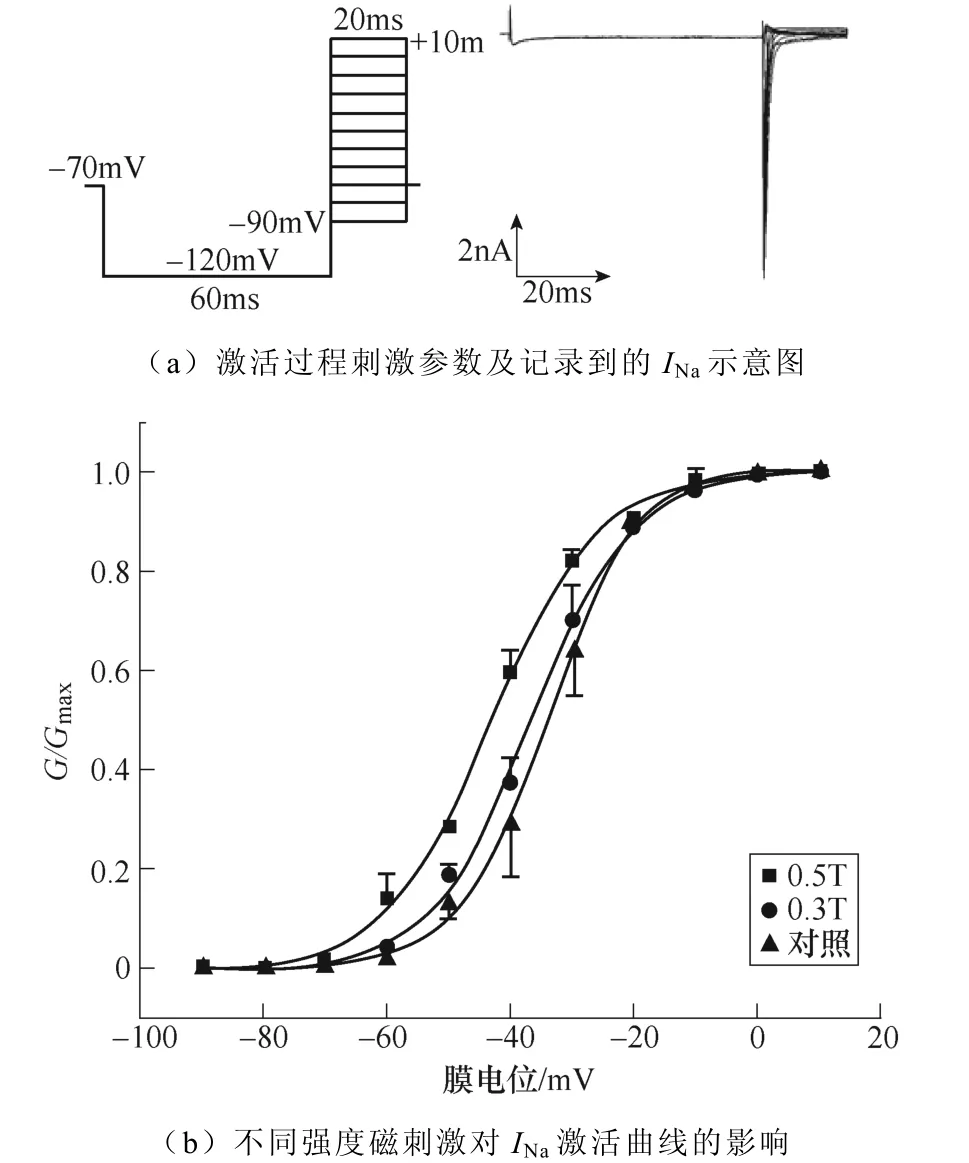
图3 不同强度磁刺激对INa激活过程的影响 Fig.3 The effect of different intensity magnetic stimulation on the activation process of INa

表1 不同强度磁刺激对INa激活曲线参数的影响 (*P<0.05,**P<0.01 vs对照) Tab.1 The effect of different intensity magnetic stimulation on the activation parameters of INa(*P<0.05, **P<0.01 vs control)
2.1.3 磁刺激对INa失活动力学的影响
不同强度磁刺激对INa失活过程的影响如图4所示。如图4a所示,电压钳制在−70mV,先给予细胞−100~+10mV的阶梯去极化条件脉冲,步阶为10mV波宽100ms,随后施加−30mV波宽20ms的测试脉冲,通过双脉冲刺激记录得到INa的稳态失活过程。绘制INa失活曲线如图4b所示,INa失活曲线发生了磁刺激强度依赖性右移,同时V1/2发生了相应的改变,对照组为(−52.42±1.15)mV,0.3T刺激组为(−48.52±0.75)mV(*P<0.05 vs对照),0.5T刺激组为(−44.95±0.72)mV(**P<0.01 vs对照;#P<0.05 vs 0.3T)。0.5T刺激组的k值与对照组相比显著降低(*P<0.05),k值降低表明,0.5T刺激组失活曲线的斜率增大,通道失活更快。INa失活曲线详细参数见表2。

图4 不同强度磁刺激对INa失活过程的影响 Fig.4 The effect of different intensity magnetic stimulation on the inactivation process of INa

表2 不同强度磁刺激对INa失活及恢复曲线参数的影响(*P<0.05,**P<0.01 vs对照;#P<0.05 vs 0.3T) Tab.2 The effect of different intensity magnetic stimulation on the inactivation and recovery parameters of INa (*P<0.05, **P<0.01 vs control; #P<0.05 vs 0.3T)
2.1.4 磁刺激对INa恢复动力学的影响
不同强度磁刺激对INa恢复过程的影响如图5所示。如图5a所示,电压钳制在−70mV,给予细胞−30mV波宽25ms的两个相同的条件脉冲与测试脉冲。条件脉冲与测试脉冲两个刺激间隔保持钳制电位−70mV,间隔时程2~26ms,每2ms递增,记录得到INa失活后再恢复的过程。绘制INa恢复曲线如图5b所示,INa恢复曲线发生了磁刺激强度依赖性左移,对曲线τ值的统计学分析表明,0.3T刺激组(**P<0.01)与0.5T刺激组(**P<0.01)的恢复时间相比对照组显著缩短。INa恢复曲线详细参数见表2。
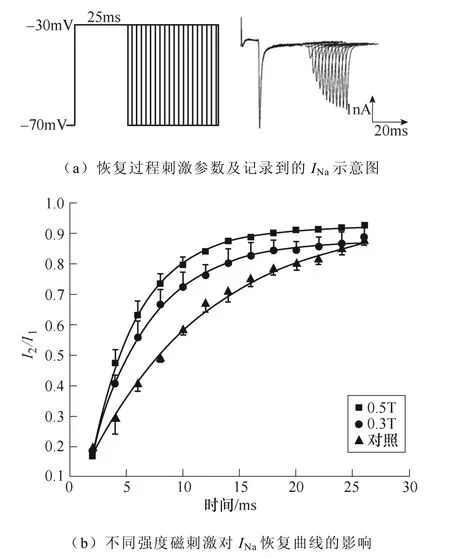
图5 不同强度磁刺激对INa恢复过程的影响 Fig.5 The effect of different intensity magnetic stimulation on the recovery process of INa
2.2 磁刺激对瞬时外向钾通道的影响
2.2.1 磁刺激对IA幅值的影响
不同强度磁刺激对IA幅值的影响如图6所示。如图6a所示,电压钳制在−100mV,给予细胞−50~+90mV的阶梯去极化脉冲刺激,步阶为10mV,波宽200ms,记录到外向电流。绘制IA的I-V曲线如图6b所示,磁刺激强度依赖性地抑制了IA的峰电流。
2.2.2 磁刺激对IA激活动力学的影响
不同强度磁刺激对IA激活过程的影响如图7所示。如图7a所示,电压钳制在−100mV,先施加−110mV波宽400ms的条件脉冲,随后给予细胞−50~+90mV的阶梯去极化测试脉冲刺激,步阶为 10mV波宽150ms,通过双脉冲刺激记录得到IA的稳态激活过程。绘制IA激活曲线如图7b所示,激活曲线没有发生偏移,对IA激活曲线参数的统计学分析表明,V1/2与k没有显著性差异。IA激活曲线详细参数见表3。

图6 不同强度磁刺激对IA幅值的影响 (*P<0.05,**P<0.01,***P<0.001 vs对照;#P<0.05,##P<0.01 vs 0.3T) Fig.6 The effect of different intensity magnetic stimulation on the amplitude of IA (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05, ##P<0.01 vs 0.3T)
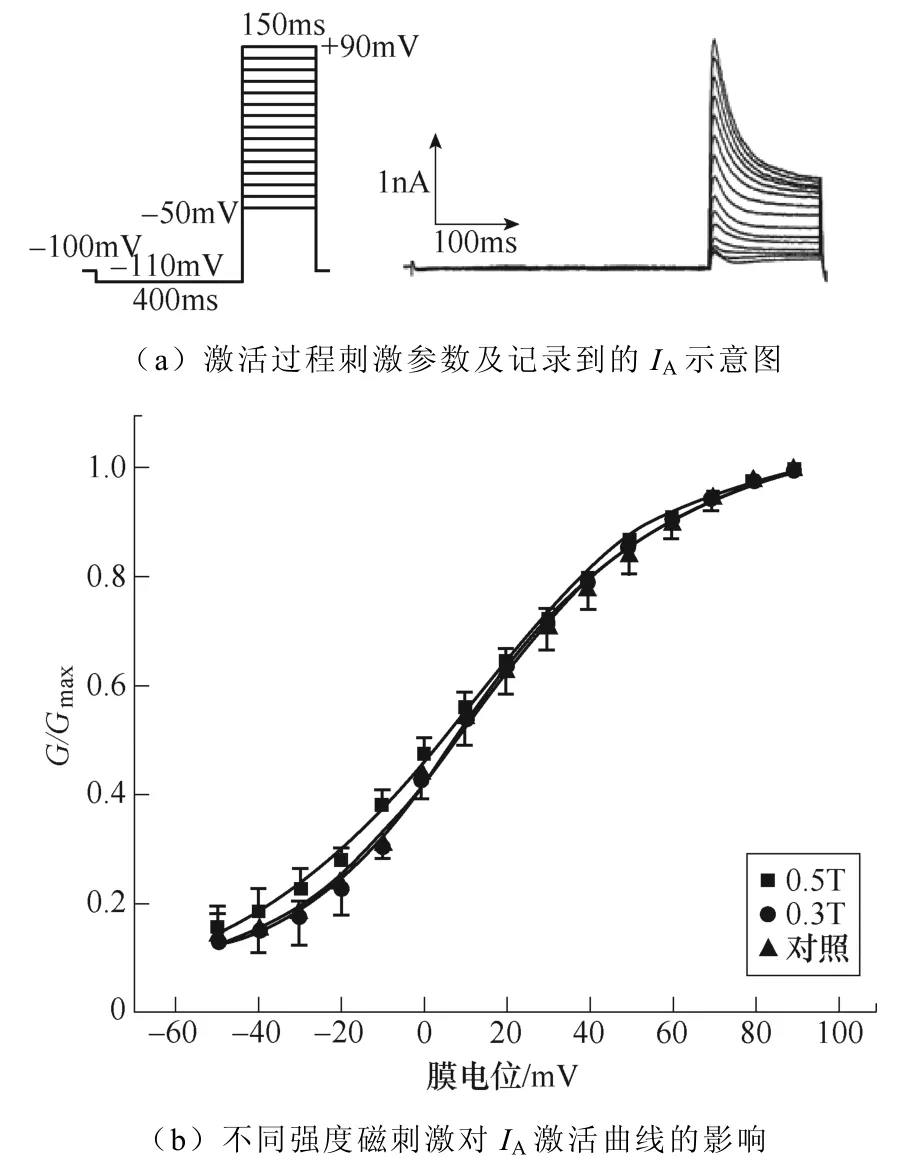
图7 不同强度磁刺激对IA激活过程的影响 Fig.7 The effect of different intensity magnetic stimulation on the activation process of IA

表3 不同强度磁刺激对IA激活曲线参数的影响 Tab.3 The effect of different intensity magnetic stimulation on the activation parameters of IA
2.2.3 磁刺激对IA失活动力学的影响
不同强度磁刺激对IA失活过程的影响如图8所示。如图8a所示,电压钳制在−100mV,先给予细胞−110~+10mV的阶梯去极化条件脉冲,步阶为10mV波宽80ms,随后施加+50mV波宽80ms的测试脉冲,通过双脉冲刺激记录得到IA的稳态失活过程。绘制IA失活曲线如图8b所示,失活曲线发生了磁刺激强度依赖性左移,同时V1/2发生了相应的改变,对照组为(−44.44±0.47)mV,0.3T刺激组为(−49.41±0.33)mV(*P<0.05 vs对照),0.5T刺激组为(−55.66±0.34)mV(***P<0.001 vs对照;#P<0.05 vs 0.3T)。k值变化无显著性差异。IA失活曲线详细参数见表4。
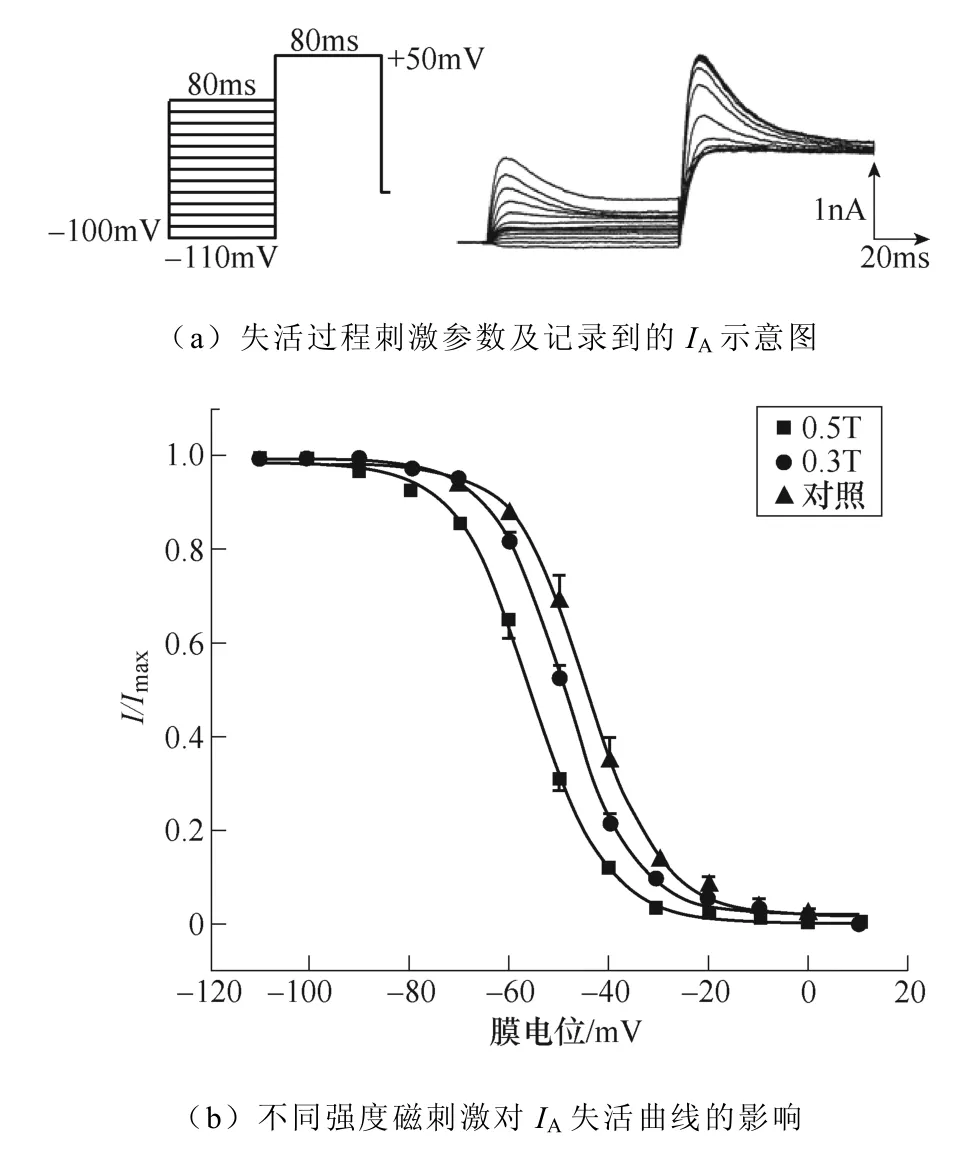
图8 不同强度磁刺激对IA失活过程的影响 Fig.8 The effect of different intensity magnetic stimulation on the inactivation process of IA

表4 不同强度磁刺激对IA失活及恢复曲线参数的影响(*P<0.05,**P<0.01,**P<0.001 vs对照; #P<0.05 vs 0.3T) Tab.4 The effect of different intensity magnetic stimulation on the inactivation and recovery parameters of IA (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05 vs 0.3T)
2.2.4 磁刺激对IA恢复动力学的影响
不同强度磁刺激对IA恢复过程的影响如图9所示。如图9a所示,电压钳制在−100mV,给予细胞+50mV波宽80ms的两个相同的条件脉冲与测试脉冲。条件脉冲与测试脉冲两个刺激间隔保持钳制电位−100mV,间隔时程1~256ms,记录得到IA失活后再恢复的过程。绘制IA恢复曲线如图9b所示,0.5T刺激组恢复曲线显著右移,对曲线τ值的统计学分析表明,0.5T刺激组(**P<0.01 vs对照;#P<0.05 vs 0.3T)的恢复时间相比对照组和0.3T刺激组显著延长。IA恢复曲线详细参数见表4。
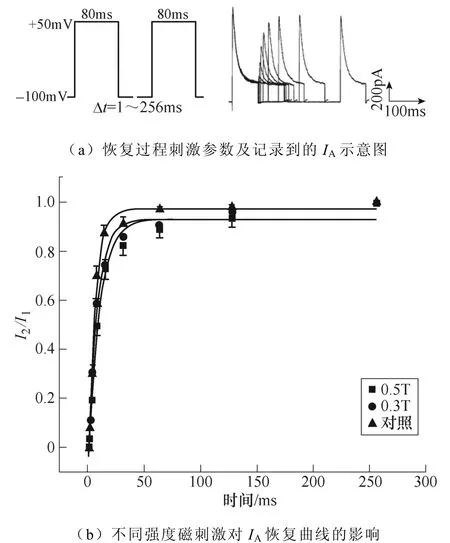
图9 不同强度磁刺激对IA恢复过程的影响 Fig.9 The effect of different intensity magnetic stimulation on the recovery process of IA
2.3 磁刺激对延迟整流钾通道的影响
2.3.1 磁刺激对IK幅值的影响
不同强度磁刺激对IK幅值的影响如图10所示。如图10a所示,电压钳制在−50mV,给予细胞−50~+90mV的阶梯去极化脉冲刺激,步阶为10mV,波宽300ms,记录到外向电流。绘制IK的I-V曲线如图10b所示,磁刺激强度依赖性地抑制了IK的峰电流。
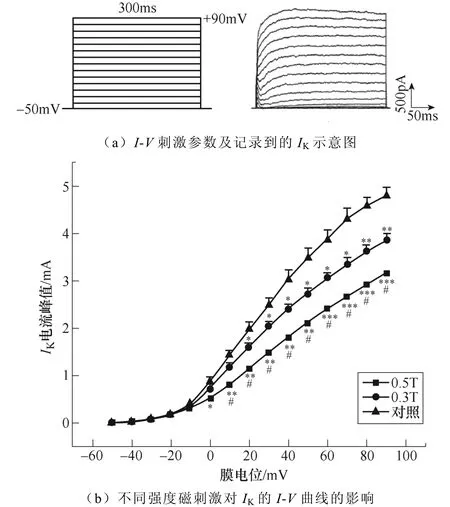
图10 不同强度磁刺激对IK幅值的影响(*P<0.05, **P<0.01,***P<0.001 vs对照;#P<0.05 vs 0.3T) Fig.10 The effect of different intensity magnetic stimulation on the amplitude of IK (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05 vs 0.3T)
2.3.2 磁刺激对IK激活动力学的影响
不同强度磁刺激对IK激活过程的影响如图11所示。如图11a所示,电压钳制在−50mV,先施加−110mV波宽400ms的条件脉冲,随后给予细胞−50~+90mV的阶梯去极化测试脉冲刺激,步阶为10mV波宽150ms,通过双脉冲刺激记录得到IK的稳态激活过程。绘制IK激活曲线如图11b所示,0.5T刺激组激活曲线明显左移,V1/2也发生了相应变化,对照组为(7.07±0.58)mV,0.3T刺激组为(5.12±0.59)mV,0.5T刺激组为(2.58±0.66)mV(*P<0.05 vs对照)。k值变化无显著性差异。IK激活曲线详细参数见表5。
2.4 磁刺激对DG颗粒细胞神经兴奋性的影响
在全细胞电流钳模式下,记录了DG颗粒细胞的静息膜电位、长时程放电、单个诱发AP,并对AP 相关特征指标进行分析,如AP发放阈值、峰值、达峰时间、上升支最大斜率、半波宽、后超极化幅度。

图11 不同强度磁刺激对IK激活过程的影响 Fig.11 The effect of different intensity magnetic stimulation on the activation process of IK

表5 不同强度磁刺激对IK激活曲线参数的影响 (*P<0.05 vs对照) Tab.5 The effect of different intensity magnetic stimulation on the activation parameters of IK(*P<0.05 vs control)
不同强度磁刺激对膜电位及动作电位的影响如图12所示。如图12a所示,0.3T(**P<0.01)与0.5T(***P<0.001)刺激组静息膜电位显著高于对照组,0.5T刺激组显著高于0.3T刺激组(*P<0.05)。如图12b所示,对神经元500ms内长时程放电的分析表明,0.3T(**P<0.01)与0.5T(***P<0.001)刺激组放电个数显著高于对照组,0.5T刺激组显著高于0.3T刺激组(*P<0.05)。如图12c所示,与对照组相比,0.3T(**P<0.01)与0.5T(***P<0.001)磁刺激显著降低了AP发放的阈值电位,且0.5T刺激组的阈值电位比0.3T刺激组更低(*P<0.05)。如图12d所示,0.3T(**P<0.01)刺激组与0.5T(***P<0.001)刺激组的AP峰值显著高于对照组,且0.5T刺激组显著高于0.3T刺激组(**P<0.01)。如图12e所示,与对照组相比,0.3T(**P<0.01)与0.5T(***P<0.001)磁刺激显著缩短了AP达峰时间。如图12f所示,与对照组相比,0.3T(*P<0.05)与0.5T(***P<0.001)磁刺激显著增加了AP最大上升斜率。如图12g所示,0.3T(**P<0.01)与0.5T(***P<0.001)刺激组的半波宽与对照组相比显著缩短,且0.5T刺激组比0.3T刺激组更短(***P<0.001)。如图12h所示,与对照组相比,0.3T(***P<0.001)与0.5T(***P<0.001)磁刺激显著降低了AP的后超极化幅度。

图12 不同强度磁刺激对膜电位及动作电位的影响 (*P<0.05,**P<0.01,***P<0.001) Fig.12 The effect of different intensity magnetic stimulation on the membrane potential and action potential (*P<0.05, **P<0.01, ***P<0.01)
3 讨论
本研究采用即时刺激的方式将不同强度的高频磁刺激施加于小鼠急性大脑切片,分析了VGSCs与Kv通道激活、失活、恢复不同过程下的通道电流与DG颗粒细胞神经兴奋性的变化。
诸多证据表明,VGSCs介导AP的去极化相位与神经兴奋性,Kv参与设置静息膜电位及调控细胞兴奋性[19-20,27-33]。实验结果显示,在TMS对VGSCs影响的分析中,INa的半数激活电压V1/2由大变小,激活曲线明显左移,即VGSCs的激活可以发生在膜电位更低处。INa半数失活电压V1/2在TMS作用下由小变大,失活曲线明显右移,VGSCs失活向着膜电位去极化的方向移动,整个激活过程更持久。同时,INa的恢复曲线明显左移,恢复时间常数τ显著缩短。VGSCs通道动力学特征的这些变化加速了Na+内流激活了INa,且TMS对VGSCs的调控作用随着刺激强度的增强而增强。在TMS对Kv影响的分析中,结果显示IK的半数激活电压V1/2在TMS作用下由大变小,激活曲线明显左移。IA激活曲线无显著变化,IA半数失活电压V1/2在TMS作用下由大变小,失活曲线明显左移。Kv通道较早且快速的失活说明TMS阻止了膜电位向着超极化方向移动,提升了膜电位静息态水平。同时,IA的恢复曲线明显右移,恢复时间常数τ显著延长。Kv通道动力学特征的这些变化阻止了K+外流,抑制了IA与IK,且TMS对Kv的调控作用随着刺激强度的增强而增强。INa的激活、IA与IK的抑制共同促进了神经兴奋性的增强。同样,有研究发现TMS可以提高CA1椎体神经元兴奋性,同时激活了INa抑制了IA[34]。皮层神经元在高频TMS的即时刺激下,可瞬时打开VGSCs并增加INa幅值[23]。这些研究与本课题组的结果都揭示了TMS可通过调控VGSCs与Kv介导神经兴奋性的变化。
神经兴奋性是神经元受到刺激后产生动作电位的能力,是神经元在放电状态和静息状态之间转换的基本和重要的动力学机制[35]。AP是哺乳动物中枢神经系统中可兴奋细胞的基本特征,它遵循VGSCs与Kv的开启与关闭[36]。在对静息电位及AP相关特征的分析中,实验结果显示:在TMS作用下,颗粒细胞的静息膜电位显著升高;长时程放电频数显著增加;诱发AP的阈值电位显著降低;AP的峰值电位及上升支最大斜率均显著增加;AP达峰时间、半波宽、后超极化幅度显著减小。这些 特征的变化揭示了TMS的调控作用使得神经元的静息状态向着去极化方向移动,在同样的刺激脉冲下更容易达到其放电阈值,达峰时间、半波宽的缩短与最大上升斜率的增加印证了INa激活曲线的右移及膜电位更快的去极化速度,后超极化幅度的降低揭示了TMS对K+外流的抑制。这些变化都说明了神经兴奋性的显著增强,同时这种增强效应随着刺激强度的增加而增加,即高频即时TMS对颗粒细胞神经兴奋性的提升表现出了强度依赖性。已有文献报道高频TMS可以提高CA1锥体神经元的静息电位水平和神经放电频率、降低后超极化电位幅度,增强神经兴奋性[18]。高频TMS对脑片进行即时刺激后,皮层神经元的活动增强,增加神经放电频率[23]。这些研究与本课题组当前及先前[21,37]的结果相似。
本课题组的研究结果证明了TMS对神经元具有瞬态调节作用,展示了TMS对神经兴奋性、VGSCs和Kv通道强度依赖性的即时调节潜力。引言中提及的部分研究也报道了相似的结果,例如急性大鼠脑切片在高频磁刺激作用下增强神经元反应的同时,其VGSCs通道被瞬间打开并增加了稳态钠电流[23],除此之外,该研究也表明,在神经活动增强这一过程中伴随神经胞内钙离子聚集的现象,这提示在今后的研究中对电压门控钙离子通道的检测同样重要。磁刺激增强离体坐骨神经节神经元的兴奋性,这种即时的调控作用与钠通道密切相关[25]。因此,这些研究或可揭示磁刺激对于神经活动的调控作用,至少部分上是通过与电压门控相关离子通道的相互作用介导的。
研究表明,内在神经兴奋性的可塑性促进了学习与记忆,这一过程的异常调节与相关神经退行性疾病认知障碍等症状的发展有关,如老化、阿尔兹海默症、抑郁等[38]。TMS可通过调节神经兴奋性改善认知功能障碍[18,21]。研究表明,离子通道作为主要病因或中介参与了多种疾病的发生,因此,离子通道成为众多疾病诊断和治疗的理想靶点[39]。有关VGSCs及Kv通道的功能及区域表达的研究表明,它们是包括心血管和神经疾病、癌症与免疫性疾病在内的多种疾病的靶点。例如,VGSCs的异常表达与内在神经元兴奋性的改变有关,是包括癫痫和偏头痛在内的几种神经系统疾病的神经紊乱的基础[40]。免疫系统可以利用VGSCs通道来选择强大的T细胞,当身体制造T细胞时,它依赖神经和心肌中常见的VGSCs通道确保强大的T细胞具备攻击性,同时也会消除过度活跃能够攻击自身导致自身免疫疾病的T细胞[41]。Kv4.2通道的下调与慢性癫痫和其他以神经元过度兴奋为表型的中枢神经系统疾病有关[42]。Kv1.3通道位于人类免疫细胞中主要的Kv通道之下,其通道活性在人类T淋巴细胞中表现得最为明显,它在免疫和炎症事件期间的增殖和分泌反应中发挥重要作用[43]。CCR7效应记忆T淋巴细胞参与T细胞介导的自身免疫性疾病的发病机理中,而Kv1.3通道电流是控制CCR7效应记忆T淋巴细胞膜电位的主要钾电流[44]。因此,TMS在调控神经兴奋性进而改善神经退行性疾病的认知障碍,在调控相关离子通道进而调节神经及免疫性应答等方面有巨大的研究空间和应用前景,是今后TMS科学研究与临床应用的一个重要方向。本课题组的研究亦提供了相关的理论基础,但仍需在后续工作中进一步深入探索。
4 结论
TMS强度依赖性地左移了INa激活曲线,右移了INa失活曲线,加速了INa失活后再复活的速度,激活了INa电流峰值;TMS强度依赖性地左移了IA失活曲线与IK激活曲线,延缓了IA失活后再复活的速度,抑制了IA与IK电流峰值;TMS强度依赖性地提高了DG颗粒细胞神经兴奋性。因此,TMS改变了VGSCs与Kv部分通道动力学特性、激活INa抑制IA与IK,是TMS提高海马DG颗粒细胞神经兴奋性潜在的内在介导机制之一,且TMS的神经调控作用具有强度依赖性。
