传染性单核细胞增多症患儿调节性T细胞与EB病毒DNA浓度的相关性研究
2021-10-11李海霞陶永明赵秋霞王立和高晓鹏
李海霞, 陶永明, 赵秋霞, 王立和, 高晓鹏
(山西省运城市中心医院 儿内科, 山西 运城, 044000)
传染性单核细胞增多症(IM)是一种由EB病毒感染引起的急性或亚急性全身性疾病,临床特征多为不规则发热、肝脾及淋巴结肿大、咽峡炎、周围血象出现异常淋巴细胞,临床结合实验室检查可确诊[1]。IM好发于小儿时期,且一年四季都可发病,应用抗生素治疗无效,而使用抗病毒药物治疗有效。IM可引起消化、呼吸、神经、血液、泌尿等多系统损害,严重者还可能引发肿瘤,再加上其临床症状多样,早期较易发生漏诊、误诊[2]。人体中存在辅助性T细胞1(Th1)、辅助性T细胞2(Th2)、辅助性T细胞17(Th17)和调节性T细胞(Treg)4类T细胞亚群,其中Treg是具有抑制性作用的负调控功能细胞,其在人体中发挥维持自身免疫稳定、预防自身免疫性疾病等重要作用。报道[3]显示,这类T细胞除与免疫性疾病有关,还与移植、感染等密切相关。本研究探讨IM患儿的Treg水平变化及其与EB病毒DNA(CEBV-DAN)浓度的相关性,现报告如下。
1 资料与方法
1.1 一般资料
选取本院在2018年8月—2020年8月收治的42例IM患儿作为观察组。纳入标准: 符合IM的诊断标准[4]者; 初次发病者; 未应用过糖皮质激素类药物、细胞毒性药物或免疫调节剂者; 患儿家属对本研究知情同意,并签署知情同意书。排除标准: 非首次发病者; 合并其他病毒感染者; 近期应用过免疫抑制剂或糖皮质激素类药物者。其中男23例,女19例,年龄3~12岁,平均(5.3±2.1)岁。另选取同期进行健康体检的30例健康儿童作为对照组,对照组儿童无任何过敏性疾病史或感染史,其中男19例,女11例,年龄2~11岁,平均(4.8±1.7)岁。2组儿童的性别构成比、年龄比较,差异无统计学意义(P>0.05)。
1.2 方法
标本采集: 2组受检儿童均在清晨空腹状态下采血。2组使用真空采集管采集1 mL外周静脉血,使用EDTA抗凝管保存,快速送至流式细胞室进行T细胞检测。观察组患儿还需采集2 mL外周静脉血,以EDTA抗凝管保存,送至PCR室进行EBV-DNA检测。观察组患儿在急性期进行T细胞亚群与EBV-DNA浓度检测,在恢复期进行1次EBV-DNA浓度检测。
主要仪器: 美国BD公司生产的FACSCantoⅡ型流式细胞仪; 科大创新股份有限公司生产的KD640型低速离心机; 姜堰新康医疗器械有限公司生产的XK96-B快速混匀器、微量移液器; 北京鑫诺美迪公司生产的ABI-7300实时荧光定量聚合酶链反应(FQ-PCR)仪。检测试剂包括PerCP(多甲藻红素-叶绿素)标记的CD45单克隆抗体, FITC(异硫氰酸荧光素)标记的CD4单克隆抗体, PE(藻红蛋白)标记的CD127、CD8单克隆抗体, APC(别藻蓝蛋白)标记的CD3、CD25单克隆抗体,溶血素,均由美国BD公司提供。EB病毒核酸扩增荧光定量检测试剂盒由中山大学达安基因股份公司提供。
检验方法: (1) T细胞亚群。检测前先确认标本是否凝血,凝血标本需重新采血、处理。对标本进行编号,放入试管架。在试管中分别加入单克隆抗体A: CD4-FITC/CD8-FE/CD45-PerCP/CD3-APC, B: CD4-FITC/CD127-PE/CD45-PerCP/CD25-APC, 各10 μL。每支试管中加入20 μL抗凝全血,混合后避光孵育20 min。在每支试管中加入90 μL红细胞裂解液,孵育15 min, 使红细胞充分裂解。加入0.5 mL生理盐水,离心5 min(转速1 000 r/min), 摒弃上清液。剩余液体加入适量生理盐水,用流式细胞仪进行检测,测定CD3+、CD4+、CD8+、CD4+CD25+、CD4+CD25+CD127-比例。(2) EBV-DNA: ① 阴性质控品处理。以8 000 r/min的速度离心5 s, 吸取50 μL液体加入灭菌离心管(0.5 mL)中,加入DNA提取液混合均匀, 100 ℃恒温处理10 min, 离心备用。② 标本处理。取1 mL全血标本加入1 mL生理盐水混合。另取试管加淋巴细胞分离液,将稀释后的全血移至加有淋巴细胞分离液的试管中,离心后吸取白细胞层,离心保留沉淀物,加入DNA提取液,恒温处理,再次离心备用。③ 临界阳性质控品与强阳性质控品处理。方法均与阴性质控品处理方法相同。④ 聚合酶链反应(PCR)扩增。取若干PCR反应管,各加入2 μL处理后的标本、阴性质控品、临界阳性质控品、强阳性质控品或阳性定量参考品,离心后放入仪器样品槽中进行检测,记录检测结果。以5×102copies/μL为检测极限值,若检测数值超过该极限值则判定为阳性。
1.3 统计学方法
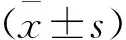
2 结 果
2.1 T细胞亚群
观察组患儿的CD3+、CD8+水平均高于对照组, CD4+、CD4+/CD8+、CD4+CD25+、CD4+CD25+CD127-水平均低于对照组,差异有统计学意义(P<0.05)。见表1。
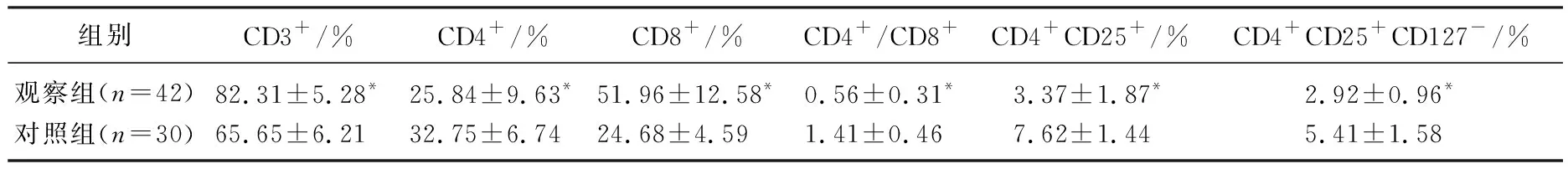
表1 2组T细胞亚群检测结果对比
流式细胞散点图显示, IM患儿CD3+CD4+T淋巴细胞占CD3+T淋巴细胞的百分比为25.3%(图1), 正常儿童CD3+CD4+T淋巴细胞占CD3+T淋巴细胞的百分比为36.7%(图2)。
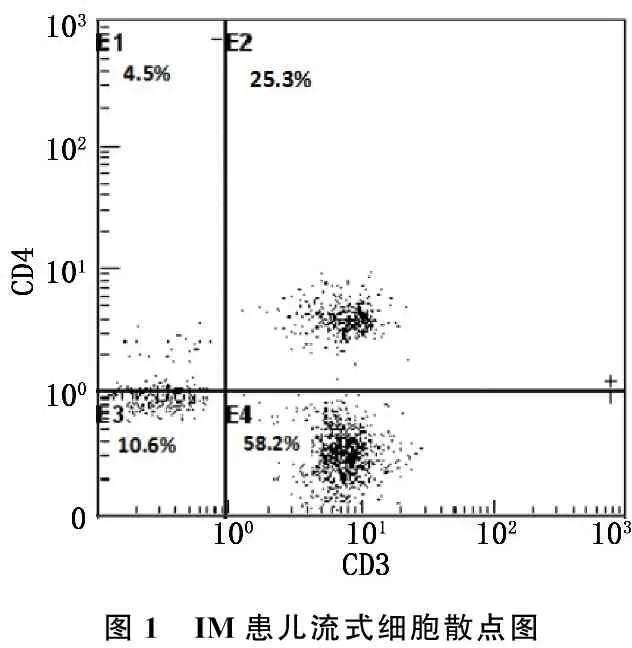
图1 IM患儿流式细胞散点图
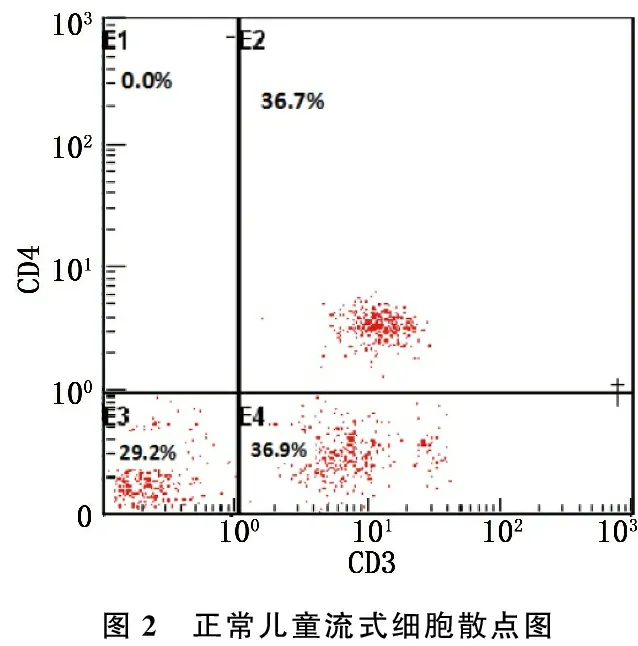
图2 正常儿童流式细胞散点图
2.2 EBV-DNA检测结果
观察组患儿的EBV-DNA阳性检出率为85.71%, 高于对照组的3.33%, 差异有统计学意义(P<0.05)。见表2。

表2 2组EBV-DNA阳性检出情况[n(%)]
观察组患儿急性期的EBV-DNA含量为(76.62±5.10)×103copies/mL, 恢复期的EBV-DNA含量为(0.68±2.30)×103copies/mL。观察组患儿急性期的EBV-DNA含量高于恢复期,差异有统计学意义(P<0.05)。
2.3 相关性分析
IM患儿急性期的EBV-DNA浓度与CD3+、CD8+水平均呈正相关关系,与CD4+、CD4+/CD8+、CD4+CD25+、CD4+CD25+CD127-水平均呈负相关关系。见表3。
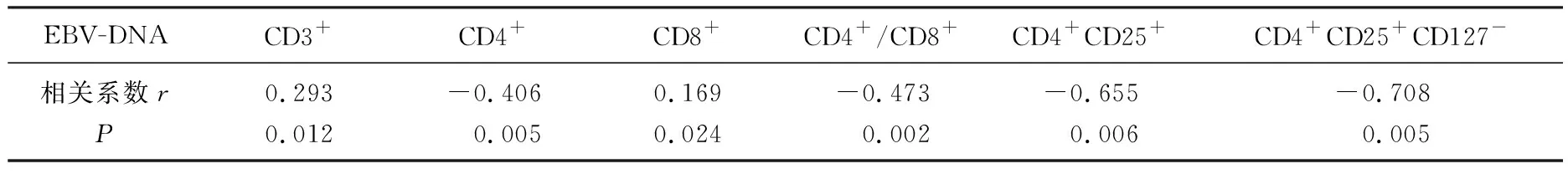
表3 IM患儿急性期EBV-DNA浓度与T细胞亚群的相关性分析
3 讨 论
EB病毒为疱疹病毒属,为嗜淋巴细胞DNA病毒,具有明显的转化与潜伏特性。儿科多种疾病特别是发热性疾病的发生都与EB病毒感染有关。多数儿童在感染EB病毒后会表现为IM, 一些患儿还会因病情控制不当导致病情迁延不愈,或继发霍奇金淋巴瘤、鼻咽癌、Burkitt淋巴瘤等恶性疾病[5]。
IM的临床症状多样,且出现时间不确定,临床主要通过实验室检查和临床症状进行诊断,但是传统的外周血淋巴细胞检查、嗜异性凝集反应有一定的假阳性与假阴性率。BV病毒特异性抗体检测有较高的灵敏度与特异性,但对一些免疫力低下或使用过免疫抑制剂的患儿难以获得准确的诊断结果。在分子生物学技术的持续发展下, PCR技术在血清、血浆EB病毒DNA含量检测中的应用也越来越多[6]。本研究结果显示,观察组患儿的EBV-DNA阳性检出率显著高于对照组,达到了85.71%, 说明EBV-DNA检测对IM有较高的灵敏度,是早期诊断IM的可靠方法。结果还显示,观察组患儿恢复期的EBV-DNA含量明显低于急性期,这可能是因为IM是一种自限性疾病,感染BV病毒的B淋巴细胞在不断增殖的过程中,也会释放病毒颗粒而引发一系列免疫反应,免疫反应可在4~6周后使BV病毒细胞明显减少,从而使疾病自愈。
CD3+是T细胞共同的表面标志,标记了所有T淋巴细胞。自然Treg主要为CD4+细胞,其在外周血CD4+T淋巴细胞总数中占5%~10%, 发挥免疫调节作用, CD4+CD25+是Treg细胞的主要表型, CD4+CD25+CD127-则是近期被发现的新型Treg标志物。除CD4+Treg外, CD8+Treg在免疫调节中也发挥着重要作用,其能通过多种途径调控免疫应答,抑制自身免疫性疾病的发生,诱导移植耐受,并能发挥肿瘤免疫调节等作用。研究[7]显示, IM的发病过程中存在着明显的细胞免疫异常情况,这可能是因为人体感染EB病毒后,病毒在细胞内复制,细胞溶解后病毒被释放到血液中。因人体内B细胞中存在着EB病毒受体,所以血液中的EB病毒会最先感染B细胞,之后T细胞、NK细胞相继受累,从而释放出大量的细胞因子。活化B细胞会刺激CD8+细胞增殖,同时B细胞还会与CD8+细胞结合而出现凋亡,使淋巴细胞呈现出自限性增殖特点。由此可见,对于EB病毒感染引起的B细胞增殖, CD8+细胞发挥着重要的抑制作用,而CD4+细胞则能促进多种免疫细胞增殖,从而清除EB病毒。据此认为在EBV感染中,细胞免疫起着决定性作用, CD4+/CD8+比值是临床用于反映人体免疫状态的重要指标, CD4+/CD8+比值降低通常预示着机体发生了免疫系统损伤。本研究结果显示,相比健康儿童, IM患儿急性期的CD3+、CD8+水平明显更高,而CD4+、CD4+/CD8+水平明显更低。这一结果说明EB病毒感染使机体发生了强烈的T细胞反应,受EB病毒感染者的细胞免疫功能明显下降,这与相关文献[8]报道结论相符。学者[9]指出, IM患儿普遍存在免疫调节功能紊乱,从而削弱了机体的抗病毒能力,这也是导致IM患儿病情加重的主要原因。在人体免疫细胞中,调节性T细胞是一群具有免疫抑制作用的免疫细胞,能对效应T细胞的过度活化发挥抑制作用,从而起到维持机体免疫稳定、避免自身免疫发生的作用。CD4+CD25+CD127-在多种疾病的发病机制中都扮演着十分重要的角色,但是目前关于CD4+CD25+CD127-与EB病毒感染相关性的报道还较少。本研究对CD4+CD25+CD127-与EB病毒感染的关系进行探究,结果显示IM患儿外周血中的CD4+CD25+CD127-比例明显低于正常儿童,这提示在IM发病过程中可能有CD4+CD25+CD127-调节T细胞的参与。本研究还发现, CD4+CD25+CD127-与EBV-DNA浓度有负相关关系。有文献[10]报道, IM患儿的CD4+CD25+CD127-调节T细胞水平与CD19+CD23+水平呈正相关, CD4+CD25+CD127-可能会抑制EB病毒转化为永生细胞。EB病毒在感染B细胞后,可诱发CD23持续表达,并促使其成为永生细胞, EB浓度越高,永生细胞越多,由此也间接反映CD4+CD25+CD127-能够对EB病毒发挥一定的抑制作用。
综上所述, IM患儿的调节性T细胞水平与EBV-DNA浓度呈负相关,提示IM患儿在急性期普遍存在免疫调节功能紊乱,且免疫功能紊乱程度与EB病毒感染量密切相关。
