土壤团聚体氧化亚氮排放及其微生物学机制研究进展*
2021-10-11李文娟蔡延江朱同彬
李文娟,蔡延江,朱同彬,黄 平
(1. 中国科学院重庆绿色智能技术研究院,重庆 400714;2. 中国科学院大学,北京 100049;3. 亚热带森林培育国家重点实验室,浙江农林大学,杭州 311300;4. 自然资源部/广西壮族自治区岩溶动力学重点实验室,中国地质科学院岩溶地质所,广西桂林 541004)
氧化亚氮(Nitrous oxide,N2O)是大气中重要的温室气体,其单位质量的增温潜势是二氧化碳(CO2)的265倍[1],同时N2O还能在平流层中发生化学反应,引起臭氧层的破坏,导致地面紫外辐射增强,威胁人类的健康与生存[2]。N2O的来源有土壤、海洋和淡水湖泊,以及化石燃料燃烧等,而土壤是N2O主要排放源,约占总排放量的60%[3]。土壤N2O排放主要受其产生和还原双重作用的影响[4]。据估计,至2030年,随着农田面积的扩大和化肥使用量的增加,N2O排放量将增加35%~60%[3]。
土壤团聚体由原生颗粒(砂、粉、黏粒)、胶结物质和孔隙组成[5],是土壤结构的基本单元和微生物的重要栖息地[6]。不同粒径的土壤团聚体具有独特的物理化学特性,大团聚体孔隙连接度高、通气性好、周转率快、有机质丰富[7];微团聚体持水能力强、稳定性碳含量高,且受其保护的微生物不易被捕食[8]。因而,不同粒径团聚体形成了分化的微生物生态位[9],进而影响N2O产生和还原的功能微生物分布[10]。本文梳理了不同粒径团聚体N2O排放量的研究,整合分析其结果存在明显分歧;通过阐述土壤N2O产生和还原的微生物学过程和分析不同粒径土壤团聚体微生物的初始分布与环境扰动下的再分布过程,解释分歧存在的原因;进一步探讨氮循环功能基因在土壤团聚体中分布,评估不同粒径团聚体N2O产生和还原热区的可行性。
1 不同粒径土壤团聚体的N2O排放
土壤团聚体是矿物颗粒在植物根系和土壤有机质、菌丝、土壤氧化物等有机和无机胶结物质作用下结合形成的二次颗粒。根据分级团聚理论,将土壤团聚体分成大团聚体(Large macroaggregates,>2 mm)、小团聚体(Small macroaggregates,2~ 0.25 mm)、微团聚体(Microaggregates,0.25~ 0.053 mm)和粉-黏颗粒(Silt-plus Clay-size Particles,<0.053 mm)[11]。不同粒径土壤团聚体具有不同的几何形状和孔隙结构,微团聚体的平均孔径较大团聚体小。这种差异影响通气条件、营养物质和溶解性有机碳的扩散。相对于微团聚体,大团聚体的通气条件较好,含有更多的不稳定性碳,其周转率和碳氮比(C/N)也较高[7],有利于增强好氧菌的活性。但是大团聚体内细菌更容易被捕食;特殊水分状态(如短时间内快速对流水和长时间缺水)会限制微生物运动和微生物酶运输,不利于细菌生长[12]。相反,微团聚体能够承受强大的机械和物理化学外力;能够在土壤中保持良好的稳定性;同时具有较低的养分有效性以及较低气体扩散率(图1)[8]。因此,具有特殊独立化学条件的不同粒径土壤团聚体,可以被视为微生物产生和还原N2O的生物化学反应器[13-14]。目前在不同粒径土壤团聚体中N2O排放的结果存在较大差异(表1),在不同的培养实验条件下,大团聚体、小团聚体和微团聚体的排放速率阈值分别为0.044~5 607 μg·kg–1·h–1、0.016~7 637 μg·kg–1·h–1、0.009~4.03 μg·kg–1·h–1。
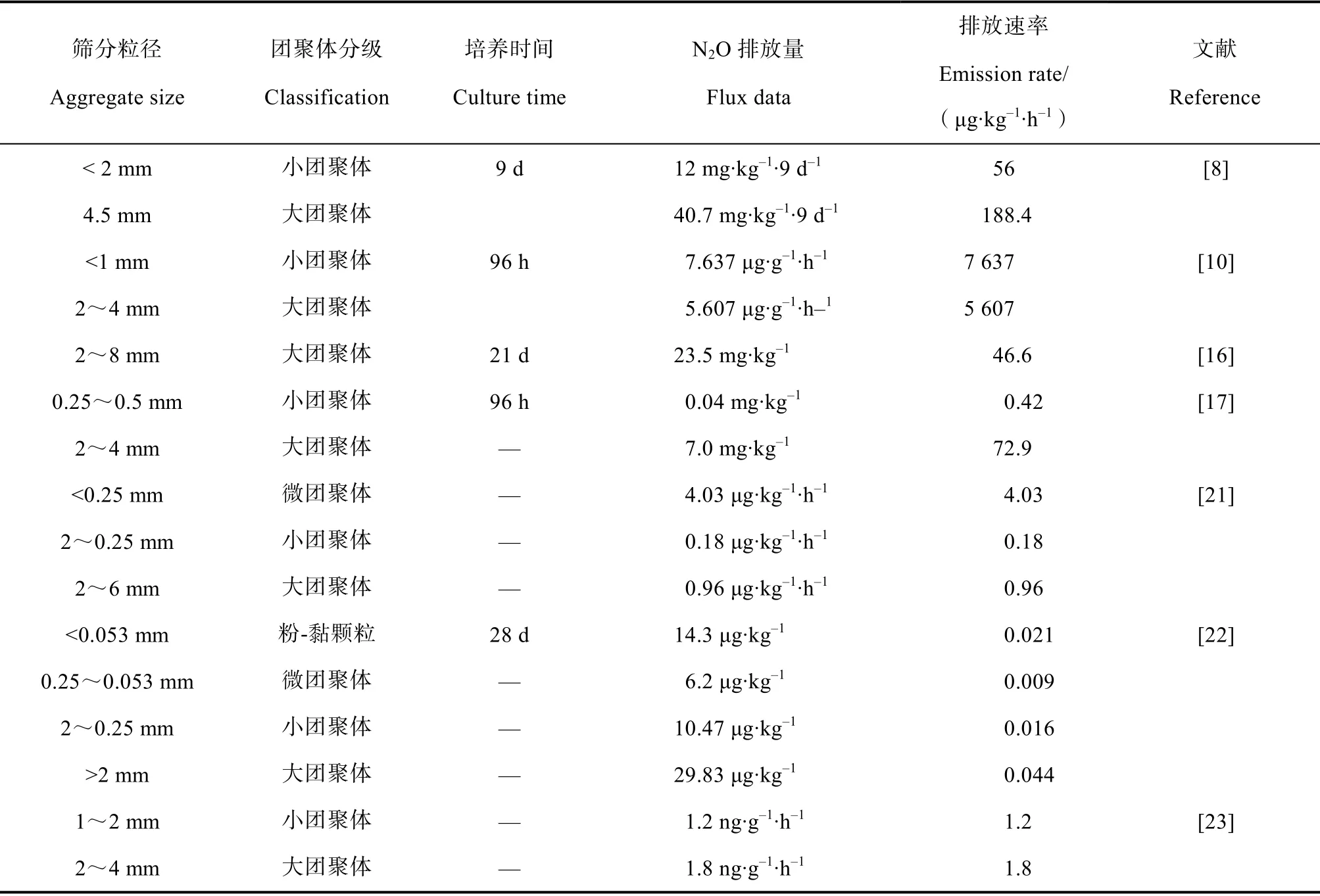
表1 不同粒径土壤团聚体N2O排放速率 Table 1 N2O emission rate in different sizes of soil aggregates
大量研究发现大团聚体较微团聚体具有更高的N2O排放能力[14]。Khalil等[15]发现较大团聚体中的N2O排放高于小团聚体,认为这是由于团聚体内的氧气浓度较低造成的。Diba等[8]研究发现火山灰土施用肥料时,大团聚体(4.5 mm)较小团聚体(<2 mm)排放更多的N2O。Kimura等[16]采用培养实验研究两种土地利用类型下不同粒径团聚体中N2O排放,发现热带油棕和林地均以大团聚体N2O排放最多。Drury等[17]通过培养实验,发现N2O在大团聚体中排放速率(2~4 mm、4~8 mm)为7.0 mg·kg–1,而在小团聚体和微团聚体(0.25~0.5 mm、<0.25 mm)中排放速率为0.04 mg·kg–1。同时,也有研究表明较小团聚体中的反硝化速率和N2O排放高于大团聚体[10]。Muñoz等[18]发现在施用肥料后,随着团聚体粒径的增大,N2O的排放量减少。Uchida[19]和Robinson[20]等发现,施用尿肥后, 土壤中小团聚体较大团聚体N2O排放量更多。Sey[21]和周汉昌[10]等的研究结果也表明土壤团聚体最小粒径下N2O排放速率更高。由此可以看出,不同粒径土壤团聚体对N2O排放的贡献存在不一致性,而存在这种分歧的主要原因是产生和还原N2O的微生物在土壤中分布不同[21]。
2 土壤团聚体N2O排放的微生物学过程
土壤团聚体N2O排放主要与N2O产生和还原有关。土壤N2O主要通过微生物的硝化作用(Nitrification)、反硝化作用(Denitrification)以及硝酸盐异化还原成铵(Dissimilatory nitrate reduction to ammonium,DNRA)、硝化-反硝化耦合作用(Nitrification-Coupled denitrification)、共反硝化作用(Co-denitrification)和非生物分解等过程产生[24]。而完全反硝化和非反硝化微生物携带的氧化亚氮还原酶(Nitrous oxide reductase,N2OR)是目前唯一明确的N2O微生物还原途径[25]。本文重点讨论微生物对N2O产生和还原的影响(图2)。
2.1 N2O产生的微生物学机制
微生物硝化作用主要是将NH3氧化为 2NO-,再最终生成 3NO-的过程[26]。其主要微生物包括,氨氧化细菌(Ammonia oxidizing bacteria,AOB)、氨氧化古菌(Ammonia oxidizing archaea,AOA)、亚硝酸氧化菌(Nitrite oxidizing bacteria,NOB)和完全氨氧化细菌(Complete ammonia oxidizers,comammox)[4]。AOA和AOB携带amoA基因,该基因编码氨单加氧酶(Ammonia monooxygenase,AMO),将NH3氧化生成羟胺(NH2OH),细胞色素P460以NO为中间体将NH2OH转化为N2O,或NH2OH经化学分解生成N2O[27]。未被转化的NH2OH则经过羟胺氧化还原酶(Hydroxylamine oxidoreductase,HAO)氧化为 2NO-。氨氧化细菌(AOB)还可以利用 2NO-作为电子受体,进行硝化细菌反硝化作用(Nitrifier denitrification)[28]。目前研究较多的硝化细菌反硝化作用菌N. europaea含有某种亚硝酸还原酶和一氧化氮还原酶(Nitric o xide reductase,NOR),将 NO-2还原为N2O[27-28]。亚硝酸氧化菌(Nitrite oxidizing bacteria,NOB)携带亚硝酸盐氧化还原酶(Nitrite oxidoreductase,NXR)将 NO-2氧化为 NO3-,nxrB是NXR的编码基因[29]。完全氨氧化细菌含有AMO、HAO和NXR,可一步完成硝化作用将NH3氧化 NO-3[30]。目前对完全氨氧化细菌N.inopinata进行单独培养研究发现,由于该菌体内缺乏将NO转化为N2O的一氧化氮还原酶,进而通过非生物NH2OH转化产生N2O。但还需要进一步判断是否其他完全氨氧化微生物含有一氧化氮还原酶[31]。
反硝化作用是微生物将 NO-3依次还原为 NO-2、NO、N2O,最后还原成N2的过程[4]。反硝化细菌产生N2O过程中,关键作用酶有硝酸还原酶(Nitrate reductase,NAR)、亚硝酸还原酶(Nitrite reductase,NIR)、一氧化氮还原酶[26]。NAR是将 NO-3还原为NO-2,分为膜结合硝酸还原酶(NAR)和周质硝酸还原酶(NAP),对应的功能基因分别为:narG和napA,NAR仅在厌氧环境下发挥作用[26]。NIR是将NO-2还原为NO,该酶分为含铜亚硝酸盐还原酶(Cu-NiR)和细胞色素 cd1亚硝酸盐还原酶(cd1-NiR),分别由nirK和nirS编码。2002年首次发现同时含有这两种基因的菌株以前,学术界公认这两种基因在同一微生物体内不能共存[32-33]。含铜亚硝酸盐还原酶的微生物一般生存在低氧环境。NOR将NO还原为N2O,在细菌和古菌中发现三类NOR,第一种(cNOR),是双亚基酶,两个亚基分别是NorB和NorC,该酶仅在反硝化细菌中存在,且使用可溶性蛋白质作为电子供体,如细胞色素c[34];第二类为quinol-dependent NOR(qNOR),是一种单亚基酶,它缺乏细胞色素c,采用醌作为电子供体,在非硝化致病菌、反硝化菌和古菌中均有发现[35];第三类是qCuANOR,从NO还原菌Bacillusazotoformans中分离获取,其亲水域具有双铜位点,对于该酶的研究目前甚少[36]。
土壤N2O的产生还存在其他微生物过程,如:硝酸盐异化还原成铵、硝化-反硝化耦合作用和共反硝化等[24]。DNRA将 NO-3转化为 NH+4,与 NO-3反硝化作用具有底物竞争关系[37]。DNRA的关键酶是细胞色素c亚硝酸盐还原酶(Cytochrome c nitrite reductase,NrfA),它能够催化 NO-2还原为 NH+4[38];由于将 NO-3还原为 NH+4所需自由能较反硝化作用将 NO-3还原为N2O和N2所需自由能更高,因而大多数情况下,DNRA很难发生[39]。但是相对于反硝化作用,在高 C∶ N O3-比条件下,DNRA更容易发生,此过程中可以产生N2O,但是数量少,贡献率低[40]。硝化-反硝化耦合作用是有氧环境中硝化作用产生 NO-3和 NO-2,然后作为底物直接被存在于厌氧或低氧环境,被反硝化微生物所利用,从而导致好氧-厌氧界面N2O排放[28]。共反硝化则是在反硝化条件下,尖孢镰刀菌(Fusarium oxysporum)将非硝酸或非亚硝酸盐氮化物(氨基酸、苯胺、叠氮化物、水杨酸和氨等)转化为N2O或N2的过程[41]。在同一土壤团聚体中存在哪些N2O产生途径,以及这些途径的区分与相对贡献的量化还需深入研究。
2.2 土壤N2O还原微生物学机制
土壤N2O可以通过多个微生物途径产生,但N2O还原目前已知的过程仅为nosZ基因编码的氧化亚氮还原酶(Nitrous oxide reductase,N2OR)将N2O还原为N2[42-43]。nosZ基因存在于细菌和古菌中,而真菌缺乏该酶,并且在放线菌或酸杆菌门基因组中也明显缺乏[25]。因此,真菌不能进行完全反硝化作用将N2O还原N2[44]。nosZ基因存在nosZI和nosZII两种基因类型[25]。相对于前者,后者编码的酶对N2O亲和力更高;同时,前者信号肽采用Sec分泌途径,酶的运输状态未折叠,后者则是Tat途径,酶的运输状态折叠[45]。通常情况下,土壤中nosZII较nosZI分布更广,并发现nosZII在非反硝化N2O还原过程中也能发挥作用[43]。nosZ基因与nirS基因出现频率明显高于nirK,nosZ和nirS有更大程度的共同进化史。这说明在良好的环境条件下,nirS型反硝化微生物更有可能发生完全反硝化作用,因此对N2O排放的贡献可能小于nirK型反硝化细菌[25]。
3 土壤团聚体对N2O排放的影响机制
土壤团聚体形成与周转过程中,微生物可以通过代谢物黏结周围土壤颗粒,形成对其有利的生境[46]。同时,随着外界环境因子改变,微生物也面临栖息地再选择[47]。一种情形是,适应环境的微生物快速繁殖产生更多的衍生产物,而处于环境胁迫下的微生物会因为自我保护作用处于休眠状态,直到再次出现适合生存条件被激活或者极端环境导致死亡[48];另外一种情形是,土壤大团聚体发生崩解,微生物从团聚体内部重新释放到外部环境,选择适合生存的栖息地,或重新构造新的团聚体,进而导致微生物群落结构在不同微生境的演变[49]。上述过程均可能导致土壤N2O产生与还原的功能微生物群落在不同粒径团聚体中分异与演化,进而影响N2O排放。
3.1 土壤团聚体与微生物相互影响机制
Tisdall和Oades[50]提出的团聚体形成模型为0.000 2 mm→0.000 2~0.002 mm→0.002~0.02 mm→ 0.02~0.250 mm→2 mm,微团聚体由有机分子胶结粉-黏颗粒和多价阳离子形成复合粒子,微团聚体再相互结合形成大团聚体(如图1)。土壤微生物的活性在团聚体的形成和稳定过程中起着至关重要的作用[51-52]。细菌对大团聚体和微团聚体的形成具有较大的贡献;而真菌在大团聚体形成中发挥着重要作用,真菌释放的菌丝和糖蛋白能有效地黏着土壤颗粒[53-54]。硝化细菌(如Nitrospirae)由于硝化和反硝化过程减少土壤50%可利用的氮,减少大团聚体形成,而土壤腐生真菌粪壳菌目(Sordariales)则是大团聚体形成和稳定的关键微生物[55]。真菌的菌丝通过形成大团聚体可间接促进N2O的排放[56]。微生物通过分泌胞外多糖黏结土壤颗粒,增加颗粒间的凝聚力;同时由于胞外多糖的疏水性也有助于增加大团聚体的稳定性[54]。而微团聚体则可以通过有机键保持稳定[57]。当发生外界环境扰动(水淹、耕作、土壤动物活动和根系穿插等)时,土壤团聚体内部相对稳定的结构可能发生崩解[49];或者随着时间的推移,微生物直接消耗土壤团聚体中的胶结剂,导致大团聚体崩解并释放微团聚体和基本颗粒,进而为新团聚体的形成提供基础构件[6,58]。
微生物群落和结构受土壤团聚体粒径的影响,细菌和真菌群落在不同粒径团聚体中存在明显结构差异。细菌和古菌更倾向存活于微团聚体,一方面能躲避土壤动物的捕食;另一方面作为原核生物的细菌和古菌较真核生物的真菌小,更易于在微小生境栖息[59]。Mummey等[60]发现 α-变形杆菌纲(Alphaproteobacteria)、放线菌亚纲(Actinobacteria)、红色杆菌纲(Rubrobacteriaceae)和芽单孢菌纲(Gemmatimonadetes)等在微团聚体中具有较高的丰度,而酸杆菌门(Acidobacteria)在大团聚体中的丰度相对较高。Yang等[61]发现细菌在微团聚体中主要以芽胞杆菌科(Bacillaceae)和梭菌科(Clostridiaceaea)为主,而草酸杆菌科(Oxalobacteraceae)、鞘脂单胞菌科(Sphingomonadaceae)、噬纤维细菌科(Cytophagaceae)和芽单胞菌科(Gemmatimonadaceae)的相对丰度则在大团聚体中占主导地位。真菌主要分布在土壤大团聚体和团聚体表面[62],其中以毛球壳科(Lasiosphaeriaceae)和新科盾叶科(Rhizophlyctidaceae)为主[59-60]。Liao等[63]研究指出黑土中真菌子囊菌纲(Sordariomycetes)随团聚体粒径的减少而显著降低。子囊菌产生N2O 占真菌的90%,其次为担子菌门(Basidiomycota)和合子菌门(Zygomycota),分别占7%和3%[64]。还有研究证实土壤微团聚体(<0.02 mm)微生物多样性和活性高,为微生物提供了良好的栖息地[65]。Bach等[66]通过田间实验也发现细菌和真菌在微团聚体中具有更丰富的多样性。
土壤氮素循环功能微生物在不同粒径团聚体的分布情况如表1所示。研究发现固氮螺菌属(Azospirillum)在粉-黏团聚体(<0.002 mm)中丰度最高[67]。硝化作用能在不同粒径的团聚体中发生,主要取决于活性硝化细菌的群落结构和丰度[68]。添加氮磷钾肥的情况下,AOA在大团聚体中的丰度显著高于微团聚体[69-70];而未添加肥料时,AOB和AOA丰度在微团聚体(<0.25 mm)中高于其他粒径团聚体(0.25~2 mm、>2 mm)[70]。在不同粒径团聚体上硝化细菌和反硝化细菌很少发生完全分离,但是氨氧化细菌在大团聚体(>0.25 mm)中的丰度最高,反硝化细菌群落在微团聚体(<0.25 mm)中占主导地位[21]。周汉昌等[10]研究发现在<1 mm的团聚体中,反硝化细菌群落数量显著高于粒径2~4 mm的团聚体。也有研究发现反硝化细菌在<0.002 mm的团聚体中生物量最大[71]。Kong等[72]开展了不同氮素管理条件对土壤硝化微生物、反硝化微生物和氮循环微生物的影响研究,发现微团聚体(0.053~0.25 mm)中硝化细菌、反硝化细菌以及总微生物群落明显大于大团聚体(>0.25 mm)和粉-黏团聚体(<0.053 mm)[72]。
3.2 环境因素对团聚体中功能微生物丰度以及N2O排放的影响
环境变化影响土壤团聚体功能微生物群落重新分布,进而影响N2O排放[73]。底物浓度、土壤含水量、通气状况和土地利用方式等诸多环境因素与土壤N2O排放通量密切相关。(1)土壤底物浓度(如碳、氮含量等)影响N2O排放。土壤大团聚体中有机碳和总氮的浓度显著高于微团聚体,且易于分解[74-75]。研究表明,土壤有机碳和总氮含量与细菌和古菌的amoA基因丰度以及硝化速率密切相关[70];有机碳和 NO3-浓度是反硝化细菌活性和N2O排放的关键影响因素[76]。活性有机碳能够加快微生物繁殖,形成厌氧环境促进反硝化作用发生[77]。有机碳的增加导致反硝化作用最终产物为N2[78]。葡萄糖有机碳的添加,显著的提高N2/N2O比例[79]。 NO3-是硝化作用的产物,其浓度升高可能抑制硝化和亚硝化微生 物活性,从而弱化硝化反应[80]。土壤微团聚体 NO-3含量高,导致微团聚体硝化反应速率较小团聚体更慢[70]。非厌氧环境条件下,高的 NO-3抑制N2O还原为N2[81]。(2)土壤含水量决定了液体和气体扩散速率,影响微生物碳、氮供给过程[82]。土壤孔隙充水度(Water-filled pore space,WFPS)介于35%~60%时,硝化作用是N2O产生的主导过程;WFPS超过70%时,N2O主要由反硝化作用产生;WFPS>90%则较多的N2O还原为N2[83-84]。值得注意的是,不同粒径团聚体中主导N2O产生的硝化和反硝化过程的土壤含水量阈值有所差异。大团聚体在80%WFPS仍处于好氧条件;而当土壤含水量超过60%WFPS,微团聚体中反硝化过程产生更多的N2O[21]。这也证实60% WFPS是硝化细菌作用的临界阈值,大团聚体虽然处于好氧状态,但是土壤水分条件已不再适宜硝化作用发生。相比于大团聚体,土壤微团聚体持水作用强,长期处于厌氧状态,在N2O产生过程中反硝化作用占优势[21,74]。(3)土壤通气性:微生物产生的N2O在传输过程中受土壤通气性的显著影响。与黏壤土相比,砂壤土中N2O通量较大,说明土壤孔隙结构对气体排放具有控制作用[23]。大团聚体中相对较高的孔隙度利于氧气扩散,提高基质分解速率,降低底物浓度,从而减少细菌的多样性[74]。随着土壤团聚体粒径减少,透气性显著减弱(微团聚体<小团聚体<大团聚体),微团聚体中氧气扩散受抑制,可能释放更多的N2O[20]。在0.5%和3%(体积比)的氧浓度下,氨氧化菌(AOB)反硝化作用对N2O的产生占其主导作用,而在完全厌氧的环境中,N2O完全由异养反硝化作用产生[85-86]。厌氧低浓度 NO-3条件下,土壤N2O排放速率高于非厌氧高浓度 NO-3条件[15],说明土壤通气性改变了硝态氮对N2O排放的影响效果。此外,其他环境条件(如土地利用方式、外源氮素的增加等)主要通过影响微生物所需的营养底物、水分和通气条件间接影响土壤团聚体N2O产生和还原能力。(4)土地利用方式:An等[87]对林地和草地土壤团聚体稳定性及有机碳和氮含量研究表明,不同土地利用方式下土壤团聚体的稳定性表现为:林地>耕地>牧草地,在所有土地利用类型中大团聚体有机碳含量较微团聚体高,而微团聚体碳氮比较大团聚体低,说明土壤有机碳在微团聚体中较大团聚体更稳定。Zhu等[88]也发现相似的结果,草地的有机碳含量和土壤团聚体稳定性均显著低于农田。林地与草地和农田相比,土壤团聚体含水量最高,草地大团聚体(>0.5 mm)的硝态氮含量明显低于其他土地利用类型[9]。不同土地利用方式下,土壤团聚体稳定性、底物含量、土壤含水量等存在差异,进而影响N2O排放。Vilain等[89]研究指出,N2O排放量最多的是农田,其次为草地,林地排放量最少。石洪艾等[90]也发现由于底物和水分含量影响,相较于草地和撂荒地,在农田N2O的排放量最多。(5)外源氮素的增加:氮添加能够通过改变土壤团聚体稳定性和碳、氮含量而影响N2O排放。氮添加能够提高土壤大团聚体(>0.25 mm)有机碳和全氮含量,尤以0.25~2 mm粒径团聚体最为显著[91]。氮添加可以增加大团聚体中产生N2O的真菌数量[92],同时增加微团聚体中反硝化细菌以及大团聚体中硝化细菌的丰度[46]。由此可见,外界环境的变化可以影响土壤团聚体内微生物的群落结构和分布,进而影响土壤N2O的排放。
4 不同粒径土壤团聚体N2O排放功能基因分布
氮循环功能基因可作为一项指标来衡量N2O排放。目前已有研究表明,土壤N2O产生潜力能用amoA、narG基因表征,N2O还原强度可通过nosZ基因丰度反映[93-94]。Rasche等[95]发现古细菌amoA、nirS和nosZ基因丰度与土壤N2O排放呈正相关。反硝化功能基因napA、narG、nirK、nirS、nosZ基因能评估N2O排放潜力;产生N2O功能基因(nirS/nirK)及其还原功能基因(nosZ)之间的差异也可预测N2O排放[96]。因此,通过提高nosZ反硝化基因丰度,降低土壤(nirK+nirS)/nosZ比值,可使N2O还原大于产生,从而减少N2O排放[76,97]。
不同粒径土壤团聚体中微生物群落分布不同,携带的功能基因也存在一定差异(表2),导致其N2O产生和还原热区也不一致。Xin等[98]在长期耕种的水稻生态系统中发现AOA和AOB的amoA基因主要分布在小团聚体内(0.25~2 mm);Blaud等[9]研究发现,林地和草地中nifH、amoA bacteria、narG、nirS和nosZ在小团聚体中(0.25~0.5 mm)分布最多,而这些功能基因在农田土壤中主要分布于<0.25 mm的微团聚体。Kong等[72]研究表明amoA和nosZ基因在微团聚体(0.053~0.25 mm)中分布最多,同时在>0.25 mm的大团聚体中,amoA基因丰度较nosZ低。周汉昌等[10]采用室内培养试验研究了氮循环关键功能基因在不同粒径土壤团聚体中的分布,发现<1 mm的土壤团聚体中narG和nosZ基因丰度均高于4~8 mm团聚体,且随着团聚体粒径增加而减少,narG和nosZ基因丰度与N2O排放呈正相关关系。大量研究结果表明,氮循环关键功能基因分布热区在微团聚体(0.053~0.25 mm)和小团聚体(0.25~2.0 mm),且N2O产生和还原的功能基因nirS和nosZ分布趋势一致。由此可以看出,微团聚体和小团聚体可能是N2O产生和还原的热区,而N2O产生和还原的相对贡献目前无法量化,因而尚不能通过nirS和nosZ丰度准确预测不同粒径团聚体N2O排放速率。微团聚体功能基因丰度高,可能是因为微团聚体相比大团聚体更加稳定,利于硝化/反硝化微生物的栖息与被保护。值得注意的是,如果微团聚体中养分亏缺、竞争激烈,微生物可能会选择更大的团聚体作为栖息地。不同土地利用方式、土壤含水量以及底物浓度也会影响N2O产生和还原的功能基因在土壤团聚体中的分布。

表2 不同粒径团聚体N2O排放速率及功能基因分布 Table 2 Distribution of functional genes and N2O emission rate in different sizes of soil aggregates
但是Liu等[99]研究表明:在长期的重复火灾作用下,环境因素而非反硝化基因丰度控制N2O排放。可能由于上述工作仅分析了反硝化相关功能基因丰度,并未涉及其他N2O产生排放过程[100]。因此,通过功能基因丰度直接量化N2O排放趋势还存在一定的不确定性,需充分考虑土壤基本性质和环境因素。
5 总结与展望
土壤团聚体是微生物进行硝化/反硝化作用的生化反应器。不同粒径土壤团聚体中孔隙特征、通气条件、底物浓度以及水分含量等性状分异能改变微生物群落结构和活性,从而导致不同粒径团聚体中N2O排放差异较大。目前功能微生物对N2O排放的研究重心逐渐从全土尺度转移到团聚体尺度,聚焦于微生物群落结构和多样性以及功能微生物与团聚体的生物物理关联机制下N2O排放研究。
今后的研究主要加强以下几个方面:
1)土壤团聚体N2O产生和还原热区探究。土壤团聚体内部和周围孔隙是微生物存活的生境,有机质、氧气浓度、水分条件和底物成分等差异可能是导致微生物群落差异的主要驱动因素。土壤大团聚体通气条件好,可利用有机碳含量高,但是容易被外界环境因素扰动,而微团聚体内部可能是微生物相对稳定和隐蔽的栖息地。微团聚体具有长期稳定的碳库,能够持续为硝化/反硝化微生物提供生长环境,并且可能为微生物提供物理保护。近年来大量研究表明微团聚体内存在较高的微生物丰度,氮循环功能基因也在微团聚体中大量分布。但是目前对土壤团聚体中氮循环功能基因分布特征研究较少,尚不能明确功能微生物对土壤微团聚体粒径的偏好。今后还需要结合室内控制试验和环境因子梯度,明确N2O产生和还原的潜在热区,进一步探究微团聚体和大团聚体对N2O排放的贡献。
2)环境因子阈值范围确定。大团聚体和微团聚体均可能为硝化/反硝化微生物提供有利的生境,不同粒径土壤团聚体N2O排放潜势存在差异,可能是由底物浓度、通气条件以及水分含量等异质性引起。一旦外界环境压力超出阈值范围,则对参与硝化/反硝化过程的微生物生存产生胁迫,从而改变硝化/反硝化过程中N2O排放。通过研究确定环境因子的临界范围,可进一步明晰不同粒径土壤团聚体N2O产生和还原所占的比例,可初步判断N2O排放情况,有利于更好地分析硝化/反硝化对N2O的贡献率以及微生物驱动机制。
3)对系列功能基因(酶)开展整体性研究,而不仅是单个主要基因(酶)。硝化/反硝化过程能够在微生物体内发生,并排放N2O,是一系列功能基因和酶的运转,而非某一个功能基因和酶发挥作用。例如:目前用nosZ/(nirS+nirK)或者(nirS+nirK)/nosZ来衡量N2O排放,仅关注了反硝化在N2O排放中的关键作用,而忽略了其他作用的功能基因对N2O排放的贡献。虽然针对个别主要的功能基因能够突出研究重点,但是也可能造成氮循环功能基因认识的盲区,甚至是误区。因此,结合其他过程的功能基因(酶)展开研究,探究不同途径(如硝化作用、硝酸盐异化还原成铵、共反硝化作用等)对N2O排放的相对贡献。发掘这些功能基因是否能够和N2O排放建立相互关系以及这些基因(酶)之间互相的调控机制。功能基因和酶的活性相结合可能会成为衡量N2O排放潜势的新途径。功能基因不能够完全用来量化N2O排放潜势,N2O产生不仅由微生物活性决定,硝化/反硝化过程中酶的活性也是N2O产生的决定性因素。为此,将功能基因和酶结合研究,可能是量化N2O排放潜势的有效途径。
