颌骨放射性骨坏死的影像学表现
2021-10-09周锐志李彦磊高炜刘圆圆陈海松郝大鹏
周锐志 李彦磊 高炜 刘圆圆 陈海松 郝大鹏
[摘要] 目的 总结颌骨放射性骨坏死(ORNJ)的影像学表现。方法 将2009年5月—2019年5月就诊于我院并经临床病理检查证实为ORNJ的33例病人纳入研究。ORNJ按照临床表现分3期,Ⅰ期12例,Ⅱ期10例,Ⅲ期11例。回顾性分析ORNJ各期的影像学表现。结果 X线表现:Ⅰ期示骨质多发透亮影伴骨小梁增粗、骨纹理模糊;Ⅱ期示骨质密度不均匀并明显降低;Ⅲ期示较大范围骨密度降低伴有游离死骨。CT表现:Ⅰ期示颌骨多发骨质密度减低区,脂肪间隙模糊,颈部多发小淋巴结;Ⅱ期示片状骨质破坏区、边缘不清,面肌间隙结构紊乱、软组织肿胀,乳突腔内软组织影,颈部多发小淋巴结;Ⅲ期示大范围溶骨性骨质破坏伴骨质硬化边及碎骨片影,软组织肿胀,颈部多发淋巴结大。结论 ORNJ的Ⅰ期表现为多发斑片状的骨质破坏区,边界清;Ⅱ期的骨质破坏区范围扩大、边界不清,CT上呈现“虫洞状”改变;Ⅲ期出现死骨、病理性骨折及明显的溶骨性骨质破坏。总结其影像学表现,有助于本病诊断。
[關键词] 放射性骨坏死;颌;放射摄影术;体层摄影术,X线计算机;病理学,临床
[中图分类号] R445.3
[文献标志码] A
[文章编号] 2096-5532(2021)04-0507-05
颌骨放射性骨坏死(ORNJ)是指在无肿瘤残留或复发的前提下,经暴露照射的骨质不愈合的时间超过3个月[1]。有研究结果显示,ORNJ的发生率为5%~20%,约占全部放射性骨坏死的40%[2-3]。ORNJ是头颈部癌尤其是口腔牙龈癌的严重并发症,影像学检查在协助临床诊断该病的同时,能够明确病变范围、排除转移和复发等[4]。本文对2009年5月—2019年5月就诊于本院的33例ORNJ病人的X线及CT表现进行分析总结,以加强对该病的认识,为其临床诊断、预防和治疗提供帮助。
1 资料与方法
1.1 一般资料
将2009年5月—2019年5月就诊于我院并经活组织病理检查证实为ORNJ的33例病人纳入研究。其中男性19例,女性14例;年龄38~73岁,平均51.3岁。放疗时间2~6个月,平均3.2个月;放射治疗量60~90 Gy,平均72 Gy。放射性骨坏死发生时间为放疗后2个月~8年。放射性骨坏死发生部位:下颌骨19例(左侧9例,右侧7例,双侧3例),上颌骨14例(左侧7例,右侧5例,双侧2例)。诱发因素:拔牙17例,无明显诱因16例。原发肿瘤:牙龈癌11例,鼻咽癌10例,口腔黏膜鳞癌8例,舌癌2例,舌下腺腺样囊性癌1例,腮腺癌1例。按姚小武等[5]的临床分期标准分期,Ⅰ期12例,Ⅱ期10例,Ⅲ期11例。
1.2 影像学检查
本文33例病人均行X线和CT检查。X线检查采用口腔曲面体层X线摄影机、Kodak增感屏。将下颌颏部置于口腔曲面体层X线摄影机颏托正中,使听眦线与听鼻线的分角线与地面平行,矢状面与地面垂直,X 线中心线向头侧倾斜7°,摄片。CT检查采用GE Twin Speed/Phillip Brilliance 64 CT扫描仪,螺旋容积扫描,采集螺距1.25 mm,重建方法采用骨算法及软组织算法,重建厚度1 mm,无间隔重建,视野(FOV)为15~18 cm,窗技术4 000/700 Hu、350/50 Hu。
1.3 病理检查
本文33例ORNJ病人均取其病变组织,用石蜡包埋,常规切片、苏木精-伊红(HE)染色,进行组织学观察。
2 结 果
2.1 影像学表现
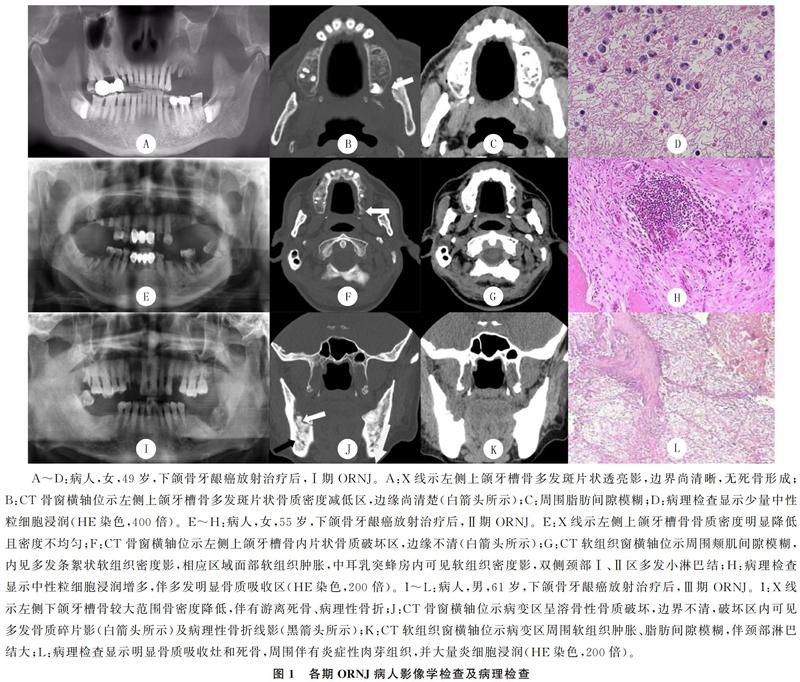
Ⅰ期ORNJ:X线示局部骨质多发斑片状透亮影,边界尚清晰,无死骨形成(图1A);CT示牙槽骨内多发斑片状骨质密度减低区(图1B),边缘尚规整,周围脂肪间隙模糊,双侧颈部Ⅰ、Ⅱ区多发小淋巴结(图1B、C)。
Ⅱ期ORNJ:X线示骨质密度明显降低且密度不均匀,但无游离死骨(图1E);CT示颌骨牙槽骨多发斑片状骨质破坏区,边缘尚清楚,周围颊肌间隙模糊,内见多发条絮状软组织密度影,相应区域面部软组织肿胀,中耳乳突蜂房内可见软组织密度影,双侧颈部Ⅰ、Ⅱ区多发小淋巴结(图1F、G)。
Ⅲ期ORNJ:X线示较大范围骨质破坏伴有游离死骨、病理性骨折(图1I);CT示病变区呈溶骨性骨质破坏,边界不清,骨质破坏区周围见骨质硬化边,骨质破坏区内可见多发碎骨片影(图1J),并可见病理性骨折线影(图1J),病变区周围软组织肿胀、脂肪间隙模糊伴颈部淋巴结大(图1J、K)。
2.2 病理学表现
本文12例表现为少量中性粒细胞浸润,无死骨形成(图1D);10例表现为中性粒细胞浸润增多伴多发明显骨质吸收区(图1H);11例表现为明显骨质吸收灶和死骨,死骨以骨细胞消失、骨陷窝空虚表现为主,死骨周围伴有炎症性肉芽组织,死骨与周围组织分离形成瘘管,并伴有大量中性粒细胞、淋巴细胞和巨噬细胞浸润(图1L)。
3 讨 论
3.1 ORNJ的发病机制与临床表现
ORNJ是一种由于恶性肿瘤放射治疗而引起的严重并发症。1983年,MARX[6]指出,放射治疗所致的细胞和血管减少以及低氧是放射性骨坏死发生发展的主导因素。STORE等[7]用DNA-DNA杂交的方法在ORNJ标本的骨髓内找到以厌氧菌为主的多种细菌,认为菌体的形成原因是在照射区域的下颌骨丧失了对细菌的抵抗能力而受到感染后,触发了髓内的炎性反应,扩散后导致放射性骨髓炎的发生。近年来,有新的理论认为,除成骨的成纤维细胞萎缩外,射线还可以通过激活异常的成纤维细胞系统取代正常肌成纤维细胞,从而导致ORNJ[8]。YANG等[9]认为,ORNJ发生的原因主要是射线对成骨细胞和破骨细胞的直接损伤,而不仅仅是由于局部血循坏障碍引起的并发症。放射治疗引起的细胞损伤,尤其是破骨细胞的损伤破坏了正常骨组织内成骨细胞和破骨细胞维持的骨代谢的动态平衡,最终引发了ORNJ,而在细胞损伤之后的血管损伤则加重了放射性骨坏死的程度和加快了放射性骨坏死的速度[10-12]。
放射性骨坏死的临床危险因素包括辐射剂量(>50 Gy)、拔牙及手术创伤、口腔卫生不良、感染、免疫缺乏疾病和药物因素、不良习惯等[13-15]。一般认为,拔除病变牙齿是ORNJ发生的主要危险因素。尽管放疗后拔牙会加大ORNJ发生的风险,但很少有研究显示放疗前拔牙会增加ORNJ的发生率[16-17]。THORN等[18]研究结果显示,ORNJ病人中约89%有过往吸烟习惯。
ORNJ的体征和症状包括患区疼痛、外耳道流脓、皮肤或黏膜瘘口、张口困难、错畸形、面部肿胀和食物嵌塞等[19-24]。EPSTEIN等[25]的分类法根据放射性骨坏死的活动期和静止期来进行分类,但界限欠明确,难以反映病人的临床表现。本研究根据临床表现进行分期,方法简单可靠,以此为基础探讨各期ORNJ的影像学表现更具实用意义。
3.2 ORNJ的影像学特点
本文12例Ⅰ期ORNJ病人,X线显示颌骨骨质多發斑片状透亮影,边界尚清晰;CT显示颌骨骨质多发密度减低区,边缘清,周围脂肪间隙模糊伴面部软组织肿胀。在Ⅰ期的临床表现中,患区软组织疼痛、肿胀及张口受限与影像学的骨质密度减低、面部软组织增厚、咀嚼肌间隙紊乱并弥漫性水肿等征象相对应。作者认为,Ⅰ期病人影像及临床表现的病理基础为轻度炎症反应,炎细胞浸润较少,尚无死骨形成。10例Ⅱ期ORNJ病人,X线显示骨质密度减低区明显较Ⅰ期范围扩大、数量增多,且密度不均、边界不清;CT显示“虫洞状”骨质破坏区,边缘不规整,伴有中耳乳突腔内软组织密度影及颈部Ⅰ、Ⅱ区多发小淋巴结。在Ⅱ期的临床表现中,患区的骨质暴露、骨面粗糙与影像征象中的多发骨质破坏及不均匀的骨质密度减低有关,外耳道流脓与中耳乳突蜂房软组织密度影相关联。作者认为,Ⅱ期ORNJ临床、影像特点的形成与病理显示的炎细胞浸润增多及明显骨质吸收有关。11例Ⅲ期ORNJ病人,X线显示与正常骨质界限不清、大小不一的死骨形成,并可出现病理性骨折;CT显示溶骨性骨质破坏,病变区内散在骨质碎片影,并可见骨质连续性中断,周围脂肪间隙结构紊乱、软组织肿胀、密度不均,中耳乳突炎及颈部多发淋巴结大。以上Ⅲ期影像学征象与瘘管形成、大面积骨质暴露及多量脓性分泌物的临床表现相对应,亦可在病理表现中找到原因,即明显的死骨形成、骨细胞消失、骨陷窝空虚等,死骨周围有炎症性肉芽组织,使死骨与周围组织分离形成瘘管,伴有大量炎细胞浸润[26-29]。
本研究中发生于下颌骨的ORNJ(19例)较发生于上颌骨的ORNJ(14例)多,有关文献也提到下颌骨ORNJ的发生率高于上颌骨,其原因可能是下颌骨的血供更加丰富以及下颌骨接受了更为频繁的照射治疗[30-32]。
3.3 ORNJ的鉴别诊断
ORNJ主要需与牙源性颌骨骨髓炎及颌骨硬化性骨髓炎进行鉴别。①牙源性颌骨骨髓炎:在病因上,牙源性颌骨骨髓炎与ORNJ有着根本的不同,前者为化脓菌感染所致牙体及牙周组织炎性病变扩散所引起,而后者为颌骨恶性肿瘤放射治疗所引起的严重并发症。牙源性颌骨骨髓炎的影像学表现为:以病源牙为中心向病牙根尖及根尖周围的骨质破坏,依次累及骨小梁及骨膜;其影像学表现也随病理演变的时期而变化,弥散破坏期表现为骨小梁模糊、斑片状骨质破坏区及骨膜反应,病变局限期表现为破坏区边界变清及死骨形成,新骨形成期表现为破坏区周围新骨形成;有时因致病菌的原因还可见到破坏区内气体影。ORNJ在某个时期可能会与牙源性颌骨骨髓炎的影像表现相近,难以鉴别。但作者认为,ORNJ受放射线治疗覆盖区的影响,其发病中心多不局限于病源牙及其根尖周;由于骨膜对放射线极为敏感,成骨细胞层往往受到较大的破坏,丧失了沉积新骨的能力,ORNJ难以像牙源性颌骨骨髓炎那样表现出破坏区周围多发的新骨形成;且ORNJ多无骨膜反应及气体密度影,这与牙源性颌骨骨髓炎也有一定的区别[33-35]。②弥漫性硬化性颌骨骨髓炎:多为牙源性轻度感染所致;病程较长,某些病例可反反复复持续数年;病变初期影像学表现为颌骨骨质密度减低区和骨质密度增高区相伴存在,进而骨质密度减低区范围逐渐缩小,取而代之的是骨硬化的发生;在病变区内,骨质密度增高常表现为弥散性,范围较大,而骨质密度减低区则较为分散。这些特征均是与ORNJ的不同之处[36-38]。
[参考文献]
[1]EPSTEIN J B, WONG F L W, STEVENSON-MOORE P. Osteoradionecrosis: clinical experience and a proposal for classification[J]. Journal of Oral and Maxillofacial Surgery, 1987,45(2):104-110.
[2]REUTHER T, SCHUSTER T, MENDE U, et al. Osteoradionecrosis of the jaws as a side effect of radiotherapy of head and neck tumour patients—a report of a thirty year retrospective review[J]. International Journal of Oral and Maxillofacial Surgery, 2003,32(3):289-295.
[3]BRASS J, DE JONGE H K, VALL MERKESTEYN J P. Osteora-dionecrosis of mandibular: pathogenesis[J]. American Journal of Otolaryngology, 1990,11(2):244-250.
[4]TENG M S, FUTRAN N D. Osteoradionecrosis of the mandible[J]. Current Opinion in Otolaryngology & Head and Neck Surgery, 2005,13(4):217-221.
[5]姚小武,李锐球. 颌骨放射性骨坏死的临床分期和治疗程序[J]. 耳鼻咽喉头颈外科, 2000,7(3):152-154.
[6]MARX R E. Osteoradionecrosis: a new concept of its pathophysiology[J]. Journal of Oral and Maxillofacial Surgery, 1983,41(5):283-288.
[7]STRE G, ERIBE E R, OLSEN I. DNA-DNA hybridization demonstrates multiple bacteria in osteoradionecrosis[J]. International Journal of Oral and Maxillofacial Surgery, 2005,34(2):193-196.
[8]DELANIAN S, LEFAIX J L. The radiation-induced fibroatrophic process: therapeutic perspective via the antioxidant pathway[J]. Radiotherapy and Oncology, 2004,73(2):119-131.
[9]YANG D Y, ZHOU F, FU X Y, et al. Symptom distress and interference among cancer patients with osteoradionecrosis of jaw: a cross-sectional study[J]. International Journal of Nur-sing Sciences, 2019,6(3):278-282.
[10]贺捷,何悦. 颌骨放射性骨坏死研究进展[J]. 上海口腔医学, 2008,17(6):659-661.
[11]BARTON M B, JACOB S, SHAFIQ J, et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012[J]. Radiotherapy and Oncology, 2014,112(1):140-144.
[12]NADELLA K R, KODALI R M, GUTTIKONDA L K, et al. Osteoradionecrosis of the jaws: clinico-therapeutic management: a literature review and update[J]. Journal of Maxillofacial and Oral Surgery, 2015,14(4):891-901.
[13]GOLDWASER B R, CHUANG S K, KABAN L B, et al. Risk factor assessment for the development of osteoradionecrosis[J]. Journal of Oral and Maxillofacial Surgery, 2007,65(11):2311-2316.
[14]SATHASIVAM H P, DAVIES G R, BOYD N M, 等. 頜骨放射性骨坏死的预测因素:回顾性研究[J]. 中国口腔颌面外科杂志, 2018,16(2):187.
[15]LI J, YIN P, CHEN X Y, et al. Effect of α2-macroglobulin in the early stage of jaw osteoradionecrosis[J]. International Journal of Oncology, 2020,57(1):213-222.
[16]LAMBADE P N, LAMBADE D, GOEL M. Osteoradionecrosis of the mandible: a review[J]. Oral and Maxillofacial Surgery, 2013,17(4):243-249.
[17]OGURA I, MINAMI Y, ONO J, et al. CBCT imaging and histopathological characteristics of osteoradionecrosis and medi-cation-related osteonecrosis of the jaw[J]. Imaging Science in Dentistry, 2021,51(1):73-80.
[18]THORN J J, HANSEN H S, SPECHT L, et al. Osteoradionecrosis of the jaws: clinical characteristics and relation to the field of irradiation[J]. Journal of Oral and Maxillofacial Surgery, 2000,58(10):1088-1093.
[19]CHRCANOVIC B R, REHER P, SOUSA A A, et al. Osteoradionecrosis of the jaws—a current overview—part 1: physiopathology and risk and predisposing factors[J]. Oral and Ma-xillofacial Surgery, 2010,14(1):3-16.
[20]MARX R E, TURSUN R. Suppurative osteomyelitis, bisphosphonate induced osteonecrosis, osteoradionecrosis: a blinded histopathologic comparison and its implications for the mechanism of each disease[J]. International Journal of Oral and Maxillofacial Surgery, 2012,41(3):283-289.
[21]SABERIAN F, GHATE A, KIM M. Optimal fractionation in radiotherapy with multiple normal tissues[J]. Mathematical Medicine and Biology: a Journal of the IMA, 2016,33(2):211-252.
[22]HABIB A, HANASONO M M, DEMONTE F, et al. Surgical management of skull base osteoradionecrosis in the cancer po-pulation-treatment outcomes and predictors of recurrence: a case series[J]. Operative Neurosurgery (Hagerstown, Md), 2020,19(4):364-374.
[23]EL-RABBANY M, DUCHNAY M, RAZIEE H R, et al. Interventions for preventing osteoradionecrosis of the jaws in adults receiving head and neck radiotherapy[J]. The Cochrane Database of Systematic Reviews, 2019,2019(11):CD011559. doi:10.1002/14651858.CD011559.pub2.
[24]OWOSHO A A, TSAI C J, LEE R S, et al. The prevalence and risk factors associated with osteoradionecrosis of the jaw in oral and oropharyngeal cancer patients treated with intensity-modulated radiation therapy (IMRT): The Memorial Sloan Kettering Cancer Center experience[J]. Oral Oncology, 2017,64:44-51.
[25]EPSTEIN J B, WONG F L, STEVENSON-MOORE P. Osteo—radionecrosis: clinical experience and a proposal for classmcation[J]. Oral and Maxillofacial Surgery, 1987,45(2):104-110.
[26]李儒煌,蔡志剛,毛驰,等. 颌骨放射性骨坏死93例治疗分析[J]. 中华耳鼻咽喉头颈外科杂志, 2012,47(6):458-461.
[27]赵熠,邹海啸,吴丽芬,等. 颌骨放射性骨坏死的影像学特点[J]. 口腔医学研究, 2017,33(10):1068-1070.
[28]OGURA I, SASAKI Y, SUE M, et al. Tc-99m hydroxyme-thylene diphosphonate scintigraphy, computed tomography, and magnetic resonance imaging of osteonecrosis in the mandible: osteoradionecrosis versus medication-related osteonecrosis of the jaw[J]. Imaging Science in Dentistry, 2019,49(1):53-58.
[29]CAMOLESI G C, ORTEGA K L, MEDINA J B, et al. The-rapeutic alternatives in the management of osteoradionecrosis of the jaws. Systematic review[J]. Medicina Oral, Patologia Oraly Cirugia Bucal, 2021,26(2):e195-e207.
[30]RAGUSE J D, HOSSAMO J, TINHOFER I, et al. Patient and treatment-related risk factors for osteoradionecrosis of the jaw in patients with head and neck cancer[J]. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 2016,121(3):215-221.
[31]ZHANG W C, ZHANG X D, YANG P, et al. Intensity-mo-dulated proton therapy and osteoradionecrosis in oropharyngeal cancer[J]. Radiotherapy and Oncology, 2017,123(3):401-405.
[32]SCHUURHUIS J M, STOKMAN M A, ROODENBURG J L, et al. Efficacy of routine pre-radiation dental screening and dental follow-up in head and neck oncology patients on intermediate and late radiation effects. A retrospective evaluation[J]. Radiotherapy and Oncology: Journal of the European Society for Therapeutic Radiology and Oncology, 2011,101(3):403-409.
[33]邵文龙,冯浩,邵菁. 牙源性中央性颌骨骨髓炎2例CBCT影像学分析[J]. 口腔医学, 2013,33(4):277-278.
[34]OGURA I, KOBAYASHI E, NAKAHARA K, et al. Quantitative SPECT/CT imaging for medication-related osteonecrosis of the jaw: a preliminary study using volume-based parameters, comparison with chronic osteomyelitis[J]. Annals of Nuclear Medicine, 2019,33(10):776-782.
[35]鲍东昱,鲁勇. 放射性颌骨骨髓炎研究进展[J]. 中国实用口腔科杂志, 2016,9(6):379-382.
[36]许向亮,张益,高岩. 下颌骨弥漫性硬化性骨髓炎:病例报告与文献复习[J]. 实用口腔医学杂志, 2008,24(2):219-222.
[37]王琰,王靖虓,郭倩倩,等. 上頜骨弥漫性骨髓炎的临床诊疗及影像学分析[J]. 中华全科医学, 2021,19(2):232-235.
[38]陈佩雯,王乐诗,王月红,等. Gardner综合征合并慢性颌骨骨髓炎1例[J]. 华西口腔医学杂志, 2018,36(4):457-460.
(本文编辑 马伟平)