卡瑞利珠单抗致急性间质性肾炎的病例报道及文献分析
2021-10-09章斌焦秀秀沈波李艳上海交通大学医学院附属第九人民医院药剂科上海000上海交通大学医学院附属第九人民医院肾内科上海000
章斌,焦秀秀,沈波,李艳*(.上海交通大学医学院附属第九人民医院药剂科,上海 000;.上海交通大学医学院附属第九人民医院肾内科,上海 000)
肿瘤治疗进入了免疫治疗新时代,目前已有多种程序性细胞死亡受体-1(PD-1)免疫检查点抑制剂被批准用于恶性肿瘤的治疗。接受免疫疗法的患者中超过60%最终会产生免疫相关不良事件(irAEs)[1-2],最常见的是皮肤和胃肠道,其次是肺、内分泌系统、肌肉骨骼、肾、神经、血液和心血管。既往认为肾脏不良反应虽相对罕见,但仍可能存在严重的伤害[3]。本文通过1 例PD-1抗体所致的急性间质性肾炎的案例进行分析,以期为临床安全合理用药提供参考。
1 病例资料
患者,男,62 岁,体质量80 kg,2019年12月25日全麻下行右颈部淋巴结活检术,诊断为上皮性恶性肿瘤,2020年3月起行放化疗治疗,化疗药物为注射用卡瑞利珠单抗(艾瑞卡)200 mg/次,静脉输注,每2 周1 次,已行8 次化疗。患者化疗前及化疗后肌酐均在65~78 μmol·L-1;但在化疗8 次后随访发现,肌酐升高至187 μmol·L-1↑;eGFR(EPI)32 mL/(min·1.73 m2)↓;同时查尿常规示:尿蛋白(++);尿红细胞(+++)。患者病程中无明显泡沫尿,无明显双下肢、眼睑浮肿,无明显尿量减少,无畏寒乏力,无咳嗽咳痰,无恶心呕吐,无尿路刺激征,无发热、光过敏、口腔溃疡、关节酸痛等不适,为进一步治疗,于2020年7月8日收入本院肾内科。入院当日查血清肌酐274 μmol·L-1↑,eGFR(EPI)26 mL/(min·1.73 m2)↓;尿微量白蛋白与肌酐比值(UACR)316.8 μg·mg-1↑,抗核抗体(ANA)+,临床诊断为急性间质性肾炎,考虑为PD-1 单抗所致的急性肾损伤。给予甲基强的松龙40 mg·d-1,连续3 d;后减量至甲强龙20 mg·d-1,连续3 d。7月22日,复查肾功能恢复正常,血清肌酐60 μmol·L-1,eGFR(EPI)102 mL/(min·1.73 m2);UACR 58.6 μg·mg-1。住院期间7月9日查尿微量蛋白,结果显示尿微量白蛋白186 mg·L-1,尿β2微球蛋白0.274 mg·L-1,尿转铁蛋白8.99 mg·L-1,均高于正常值,其他的主要检查指标见表1。之后改为口服醋酸泼尼松片(强的松)25 mg·d-1维持治疗,出院后逐渐减量至停药。2 个月后复查肾功能正常,血清肌酐61 μmol·L-1。

表1 主要检查指标
2 分析与探讨
2.1 不良反应相关性判断
免疫检查点抑制剂(ICIs)所致免疫相关性肾损伤的治疗较为特殊,不同于常规的药物性肾损伤,所以确诊时需谨慎,应排除其他可能造成肾损伤的原因。当监测出现血肌酐异常时,应开始肾功能异常的鉴别诊断,以区分肾前性、肾性及肾后性因素。详细询问病史,包括液体出入量、有无腹泻及感染、其他药物使用史如非甾体抗炎药(NSAIDs)、质子泵抑制剂(PPIs)及氨基糖苷类抗菌药物等。完善尿常规及沉渣、肾功能及尿蛋白定量、尿相差显微镜、影像学等辅助检查。筛查尿常规如提示白细胞或红细胞升高,伴蛋白尿,且尿培养阴性,患者亦无尿频尿急尿痛等尿路刺激征的表现,提示为急性间质性肾炎(AIN)所致的急性肾损伤。确诊AIN 需行肾活检,但在明确患者是在使用某种致病药物后出现的急性肾损伤(AKI)时,一般认为没有必要行肾活检。
根据国家药品不良反应评价中心制订的不良反应关联性评价标准,该患者符合:
① 化疗8 次后出现肾功能不全症状,免疫性肾损伤与卡瑞利珠单抗的使用存在合理的时间关系。② 说明书中有介绍该药致免疫性肾损伤的不良反应,中重度肾功能不全患者不推荐使用;轻度肾功能不全患者应在医师指导下慎用,如确需使用,无需调整剂量。③ 化疗8 次后出现肌酐升高等肾功能不全症状,给予激素治疗后,肾功能恢复正常,病情稳定。④ 未再次使用卡瑞利珠单抗。⑤ 完善各项检查后,临床诊断为AIN,考虑是药物引起的AKI,无其他药物用药史。因此,判断患者免疫相关性肾损伤的原因很可能是卡瑞利珠单抗所致。
2.2 免疫相关性肾损伤的发生机制
免疫相关性肾损伤的发生机制还未明确,主要为免疫系统非特异性激活(TCR-MHC 作用),非特异性刺激T 细胞持续活化,活化的T 细胞不能区分肿瘤组织与正常组织,导致对自身组织包括肾脏的损伤;T 细胞多样化(PD-1 被ICIs 阻断的T 细胞)。免疫治疗相关的AIN 可能是由于PD-1 信号通路的阻断改变了T 细胞对肾脏固有抗原(自身免疫相关)或伴随药物(药物诱导的)的免疫耐受[4]。PD-1 信号在维持外周T 细胞免疫耐受中起重要作用。在肾小管细胞上表达L1 保护这些细胞免受T 细胞介导的自身免疫。也有研究表明,体内存在一些自身反应性T 细胞,它们通常通过几种机制保持休眠,以防止自身免疫[5]。
2.3 病理表现和临床特点
肾脏疾病的发生发展与免疫系统关系密切,PD-1 抗体亦有导致肾脏损伤发生的风险。免疫相关性肾损害的发生率约为2.2%[6]。AKI 是ICIs 免疫治疗的罕见并发症。有病例系列研究显示,最常见的是AIN,但也有免疫复合物性肾小球肾炎和血栓性微血管病。但目前尚无卡瑞利珠单抗致免疫相关性肾损伤的个案报道。随着肿瘤免疫治疗的不断推广,PD-1 抗体导致的肾损伤将不断攀升,成为药物性肾损伤的重要组成部分。
PD-1 抗体致免疫相关性肾损伤一般在开始治疗后3~10 个月出现[7],中位时间大约4.5 个月[8],在停止免疫治疗后仍有可能发生。该患者不良反应出现在用药后4 个月,与既往研究数据相符。最新的统计研究显示,PD-1 抗体致免疫相关性肾损伤的中位发生时间为48 d,个别发生在首次给药后[9]。因此,应严密监测肾功能,尤其是在ICIs 给药后的前几个月内。
2.4 危险因素及注意事项
免疫相关性肾损伤的危险因素包括基线eGFR、联用PPIs、联合免疫治疗(PD-1 抑制剂/PD-L1 抑制剂与CTLA-4 抑制剂联用)[5,10]。再次接受免疫治疗是否会激发免疫相关性肾毒性仍存在争议。出现免疫相关性肾损伤的患者在病情缓解后,建议继续每周监测血清肌酐水平至少1~3 个月。
2.5 分级和治疗
目前血清肌酐虽不够敏感,但仍是最为经济有效的筛查方式。如出现病情明显变化或影响重要药物使用的决策,肾活检是确诊肾脏损伤的金标准。建议在使用ICIs 之前进行基线尿液分析,并定量蛋白尿或微量白蛋白尿,从而更好地了解患者的基线肾脏特征,便于医师在治疗过程中进行数据比较。此外,可以关注C 反应蛋白(CRP)。最新研究发现,在irAEs 的发展过程中,CRP 通常会在临床症状出现之前升高。因此,CRP 可能是使用ICIs 患者发生irAEs 的预测指标,可作为肾脏irAEs 的诊断和后续免疫应答治疗反应的辅助生物标志物[11]。irAEs 管理主要参考美国食品药品监督管理局、中国临床肿瘤学会、美国临床肿瘤学会、欧洲肿瘤内科学会等管理指南,汇总如下(见表2)[10]。该患者Scr >3 ULN,根据肾损伤分级标准为3 级,停用卡瑞利珠单抗,给予激素治疗后肾功能恢复正常。
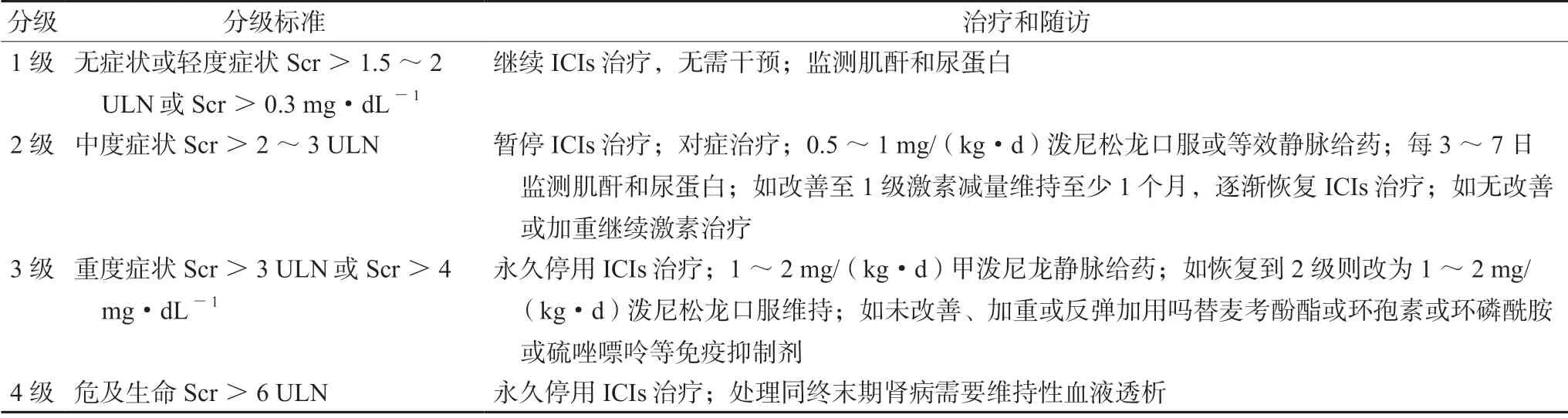
表2 免疫相关性肾损伤的管理
2.6 预后
糖皮质激素对于ICIs 所致AIN 有较好的效果。大多数诊断明确的患者如及时干预,肾功能多数可部分甚至完全恢复,同时病情复发的情况少见[3]。如肾脏病理提示明确的肉芽肿病变形成,可能提示对激素的反应及肾功能恢复均不佳。此外,其他特殊类型的肾小球疾病十分罕见,预后方面仍需进一步统计。该患者经过激素积极治疗后,肾功能逐渐恢复正常,病情稳定未再复发。该患者在最后一次化疗方案后发生的AIN,故不存在再次接受同一治疗方案再次发生AKI 的风险。若还要继续化疗,应警惕PD-l 抗体导致AKI的不良预后和复发风险,重在预防。在ICIs 治疗前,评估肾功能,停用其他肾毒性药物;治疗中,减少PPIs、NSAIDs 等联合用药,降低药物肾损伤的叠加风险;对于已经发生的AKI,可暂停相关药物,待肾功能恢复后,在条件允许下可更换抗体种类,并严格监测尿量与肾功能,警惕AKI复发[12]。
3 总结
免疫相关性肾损伤等irAEs 可对全身各器官和组织造成损害,并具有独特的作用机制,随着ICIs 在肿瘤治疗的应用愈来愈广泛,T 细胞过度活化带来的免疫不良事件须引起警惕。应根据irAEs 发生的器官系统和组织部位的不同特点进行针对性的处理,治疗药物以糖皮质激素和免疫抑制剂为基础;应对irAEs 进行全程化管理,包括预防、评估、检查、治疗、监测等闭环式管理,根据具体情况制订个体化诊疗方案,往往需要肿瘤、肾脏内科甚至泌尿外科等多学科合作,以有效保障患者的用药安全。
