降水量与氮添加对荒漠草原生态系统碳交换的影响
2021-10-09朱湾湾许艺馨余海龙黄菊莹
朱湾湾, 许艺馨,余海龙,王 攀,黄菊莹
1 宁夏大学 生态环境学院, 银川 750021 2 宁夏大学 地理科学与规划学院, 银川 750021
降水和氮是干旱半干旱区植物生长和微生物活动的主要限制因子。全球变暖加速了水循环, 导致降水量在全球范围内呈增加趋势, 同时表现出时空分配不均以及极端事件频发等特点[1]。例如研究发现, 我国西北地区的西部生态区降水量呈增加趋势, 而其东部生态区降水量有所降低[2]。另一方面, 由于人类活动产生了大量含氮化合物, 导致大气氮沉降增加。近年来, 随着大气污染物控制措施的实施和社会经济结构的转型, 氮沉降速率在欧美国家有所减缓[3- 4]。在我国, 虽然自2010年以来氮沉降速率在许多发达省市有所下降, 但在宁夏等欠发达地区呈增加趋势[5]。降水通过改变土壤水分和养分的可利用性, 调控着植物光合作用及微生物呼吸, 因此其格局的改变直接影响着陆地生态系统碳循环和收支平衡[6]。氮添加使土壤中有效氮含量增多[7], 可以缓解植物氮限制, 从而促进植物光合作用[8]、提高植被生产力和碳储存[9]。在干旱半干旱区开展降水量变化及氮添加下生态系统碳交换的研究, 对于科学评估全球变化背景下脆弱生态系统碳收支平衡具有重要的现实意义。
碳交换过程对生态系统碳汇功能具有重要影响。碳交换组分包括净生态系统碳交换(Net ecosystem carbon exchange, NEE)、生态系统呼吸(Ecosystem respiration, ER)以及总生态系统生产力(Gross ecosystem productivity, GEP)等[10]。NEE是评估碳收支平衡的重要指标, 由GEP和ER两个过程共同决定[11]。降水量和氮沉降通过调控土壤资源的可利用性, 改变植物生长和微生物活动以及其他生态过程, 直接影响着植被—土壤系统碳交换过程。目前, 已有大量国内学者针对草原研究了降水量、氮添加及其交互作用对生态系统碳交换的影响[12- 15], 发现降水量和氮添加均会不同程度地改变生态系统碳交换能力。由于生态系统所处的气候条件、土壤养分状况及植物群落结构均会影响到碳交换的响应格局。因此, 有必要针对多种类型草原生态系统开展降水量、氮添加及其交互作用的野外模拟试验。然而, 通过梳理近年来国内针对草原生态系统碳交换的研究成果, 发现相关研究主要集中在典型草原和草甸草原, 尚缺乏针对荒漠草原的研究, 尤其缺乏极端降水变化及其与氮添加交互作用的相关探讨。
1 材料与方法
1.1 研究区概况
试验样地位于海拔为1367 m的宁夏回族自治区盐池县柳杨堡乡杨寨子村围栏草地内(37.80°N, 107.45°E)。该围栏草地自1998年开始围封, 是黄土高原向鄂尔多斯台地的过渡地带, 具有典型的温带大陆性气候: 年均降水量为289.4 mm。降水量季节分配不均, 且超过全年降水的75%集中在生长季的4—9月; 年均蒸发量为2131.8 mm; 年均气温为7.7 ℃, 1月平均气温为-8.9 ℃, 7月平均气温为22.5 ℃。土壤质地多为砂壤土, 保水保肥能力弱, 且pH偏高(表1)。试验样地植物群落结构简单, 物种组成以一年和多年生草本为主, 如牛枝子(Lespedezapotaninii)、草木樨状黄芪(Astragalusmelilotoides)、白草(Pennisetumcentrasiaticum)、地稍瓜(Cynanchumthesiodes)、糙隐子草(Cleistogenessquarrosa)、苦豆子(Sophoraalopecuroides)、乳浆大戟(EuphorbiaEsula)、针茅(Stipacapillata)和阿尔泰狗娃花(Heteropappusaltaicus)等。

表1 降水和氮添加处理前试验样地0—20 cm土壤理化性质
1.2 试验设计
2017年9月, 在围栏草地内选择地势平坦且植被均匀的地段作为降水量和氮添加处理的试验样地。增减降水量处理主要依据近几十年来我国西北地区西部生态区降水量增加而东部生态区减少的趋势进行设置, 同时参考了国内同类研究方法[17]。采用添加氮肥模拟氮沉降[11, 13]。氮肥施用量主要依据2011年设立的氮添加原位试验的观察结果[18], 同时参考了区域氮沉降水平[19]。采用随机区组的裂区试验设计: 主区为降水量处理, 副区为氮添加处理(表2和图1)。设置了5个降水量处理(减少50%, W1; 减少30%, W2; 自然降水量, W3; 增加30%, W4; 增加50%, W5)和两个氮添加处理(0 g m-2a-1, N0; 5 g m-2a-1, N5)。每个处理设置3次重复, 共计30个小区。每个主区面积为8 m×8 m, 各主区之间设置1.5 m的缓冲带。各主区的两个副区(均为8 m×4 m)以四周垂直下埋1 m深的塑料薄膜隔开。
降水量减少处理采用减雨架实现。减雨架上端离地约1.8 m, 用5 cm宽的瓦面状高透光性聚氯乙烯板搭建分别相当于50%和30%小区面积的遮雨面。由于该区域降水量分配不均, 主要集中于5—8月, 故喷水时间为每年5—8月的月初和月中。降水量增加处理采用流量控制的喷灌装置实现。氮添加处理通过施用硝酸铵实现。施用时, 将每个小区每次需要施加的硝酸铵溶解于少量水中, 于5—8月每月月初均匀喷施到小区内。对照小区喷洒相同量的水, 以避免因喷水量不同造成的试验误差。具体的试验处理方法见朱湾湾等[20]。

表2 试验处理及其在文中的简写
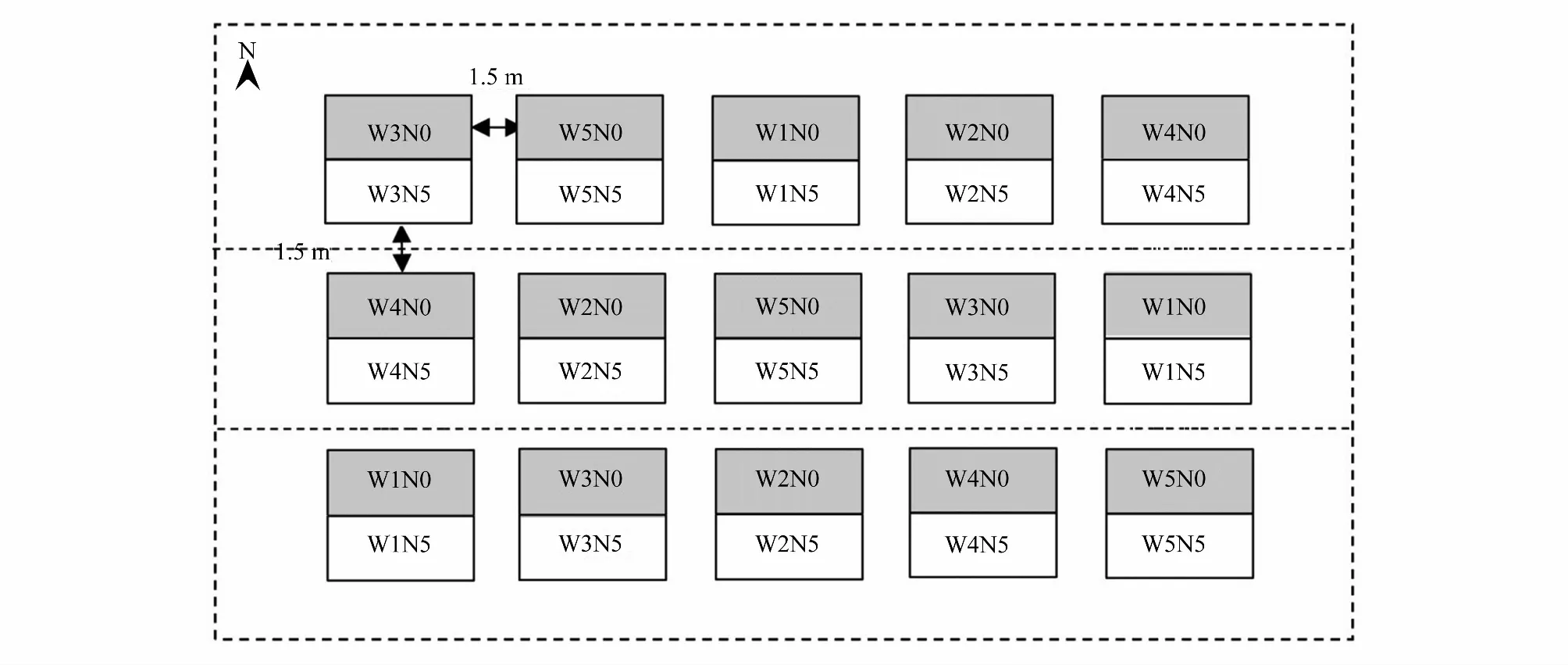
图1 试验设计Fig.1 Experimental design5个降水量处理(减少50%, W1; 减少30%, W2; 自然降水量, W3; 增加30%, W4; 增加50%, W5)和两个氮添加处理(0 g m-2 a-1, N0; 5 g m-2 a-1, N5)
1.3 样品收集与测定
1.3.1生态系统碳交换的测定与计算
生态系统碳交换包括输入与输出两个过程。碳输入指植物光合作用吸收大气中的CO2合成有机物质, 而碳输出指通过植物自养呼吸和微生物异养呼吸所释放的碳[21], 包括3个组分, 即NEE、ER和GEP。采用LI- 6400便携式光合作用测定仪(LI- 6400, LI-COR, Lincoln, USA)结合箱式法, 对不同处理下生态系统CO2及H2O的交换量进行测定。于2019年4月, 将底面直径为60 cm、高为10 cm的圆柱形亚克力透明底座垂直嵌入各小区中, 以备日后的定点测定。于生长季5—10月, 选择晴朗无云的早晨(7:00—9:30)进行月动态的监测。选取生长季7—8月(旺盛期)进行日动态(7:00—9:30、9:30—12:00、12:00—14:30、14:30—17:00、17:00—19:30)的测定。测定间隔参考国内同类研究方法[12- 14], 每10 d 测定1次, 每月测定3次。若遇阴天或雨天, 测定时间适当提前或延后。测定时将底面直径为60 cm、高为40 cm的圆柱形透明有机玻璃箱放在底座上, 以保证构成密闭气体采样室。同时, 在透明箱侧边和顶部各安装一个散热风扇以混匀箱内气体。待气体达到稳定状态时, 连续测定90 s (测定间隔为10 s), 记录箱体内CO2和H2O浓度, 据此计算NEE。其中, NEE为正, 表示净生态系统碳释放(即碳源); NEE为负, 则表示净生态系统碳吸收(即碳汇)[11]。测定结束后, 将透明箱抬起, 待箱内CO2和H2O浓度接近外界值时将透明箱重新放在底座上, 并覆盖遮光布(内黑外白), 重复上述测定。由于第二次测定采用了遮光布, 排除了光合作用, 计算的值即为ER[12]。各指标的计算公式如下:
GEP=ER-NEE
式中,Fc为CO2的通量, 代表NEE和ER (μmol m-2s-1);V为透明箱的体积(m3);Pav为平均气压(kPa);Wav为H2O的平均摩尔百分比(mmol/mol);Tav为测量期间的平均温度(℃);R为理想气体常数(8.314 J mol-1K-1);S为透明箱底座面积(m2); dc/dt为CO2浓度随时间变化线性关系的斜率。-NEE可表征净生态系统碳吸收量[15]。为便于分析, 文中分析NEE与植物群落组成以及土壤性质的关系时, 采用了-NEE。
1.3.2植物与土壤样品的采集
于2019年7月下旬, 在每个小区内尽可能选取植被代表性强的区域进行植被调查(样方面积为1 m×1 m)和样品收集[11]。植被调查结束后, 用剪刀将每个样方内全部植物齐平地面剪下, 将其中的枯落物挑出, 并将剩余部分分物种装入牛皮纸袋带回实验室烘干称重(65 ℃, 48 h)。群落生物量为所有物种地上生物量之和。物种多样性以Patrick丰富度指数、Shannon-Wiener多样性指数、Simpson优势度指数和Pielou均匀度指数衡量, 具体计算方法见张金屯[22]。
我们一下子还没明白过来这句话的意思,大家似笑非笑地看着林孟,看看萍萍,萍萍就又补充了一句,她说:“当他需要我的时候。”
同期, 采用内径为5 cm的土钻收集每个小区0—20 cm土壤样品, 以测定与生态系统碳交换密切相关的土壤性质。每个小区内随机取3钻, 取适量装入铝盒中, 采用称重法进行含水量的测定。剩余部分过2 mm标准筛后再分装为两部分: 一部分自然风干后, 用于有机碳、全氮、全磷、蔗糖酶活性、脲酶活性和磷酸酶活性的测定; 另一部分置于冰箱中4 ℃下冷藏保存, 用于pH、电导率、铵态氮、硝态氮、速效磷和微生物量的测定。
室内分析时, 分别采用重铬酸钾容量法—外加热法、凯氏定氮法、钼锑抗比色法、3, 5二硝基水杨酸比色法、苯酚钠—次氯酸钠比色法和对硝基苯磷酸盐法测定有机碳、全氮、全磷、蔗糖酶活性、脲酶活性和磷酸酶活性; 分别采用酸度计法、便携式电导率仪、连续流动分析仪(Auto Analyzer 3, SEAL Analytical GmbH, Hanau, Germany)和0.5 mol/LNaHCO3法测定pH、电导率、铵态氮、硝态氮和速效磷; 分别采用氯仿熏蒸-K2SO4浸提-碳分析仪器法、氯仿熏蒸-K2SO4提取-流动注射氮分析仪器法和氯仿熏蒸-K2SO4提取-Pi测定-外加Pi矫正法测定微生物量碳、氮和磷。
1.4 数据分析
采用SPSS 19.0进行数据统计分析: 采用K-S检验进行正态分布检验; 采用裂区设计方差分析和Duncan检验比较降水量、氮添加及其交互作用对生态系统碳交换各指标的影响; 采用单因素方差分析(One-way ANOVA), 分别对相同氮添加下各指标在不同降水量处理间以及相同降水量下各指标在不同氮处理间的差异性分析。若方差为齐性, 选用最小显著性差异法(LSD), 否则选用Games-Howell法; 采用线性回归方程进行生态系统碳交换与植物生物量以及物种多样性之间关系的拟合; 采用Sigmaplot 12.0进行图的绘制。采用Canoco 5.0进行生态系统碳交换与土壤性质对应关系的冗余分析(RDA)。分析前, 先对数据进行Log转换, 以减少数据间差异。以全部土壤性质为解释变量, 以生态系统碳交换为响应变量, 依据解释变量前项选择, 剔除影响力较小的解释变量后进行RDA。文中, 按照各土壤性质的贡献率和显著性进行了排序。
2 结果与分析
2.1 降水量及氮添加对生态系统碳交换的影响
降水量和氮添加对生态系统碳交换月动态和日动态变化趋势的影响较小, 但改变了NEE、ER和GEP的峰值(图2和图3): 0和5 g m-2a-1氮添加下, NEE、ER和GEP月动态均呈现先增强后减弱, 在8月底或9月初达到峰值; NEE、ER和GEP日动态亦整体上均呈现先增强后减弱, NEE和GEP在9:30左右最强, ER在12:00左右达到峰值。
裂区设计方差分析中(表3): 降水量和氮添加对NEE、ER和GEP均有极显著影响(P<0.01); 降水量和氮添加对NEE具有极显著交互作用(P<0.01), 对GEP具有显著交互作用(P<0.05)。单因素方差分析中(图4): NEE在整个生长季表现为负值, 即生态系统表现为碳吸收。0 g m-2a-1氮水平下, 与自然降水量相比, 减少降水量显著降低了NEE、ER和GEP(P<0.05), 增加降水量显著提高了NEE、ER和GEP(P<0.05)。5 g m-2a-1氮水平下, 与自然降水量相比, 减少降水量显著降低了NEE、ER和GEP(P<0.05), 增加30%和50%降水量显著提高了NEE(P<0.05)、增加30%降水量显著提高了ER和GEP(P<0.05)。相同降水量条件下, 氮添加增强了NEE、ER和GEP, 且其效应在自然降水量和增加50%降水量时达到显著水平, 而其他增减降水量条件下未达到显著水平, 表明降水量和氮添加的交互作用存在一定时滞性, 需长期进行原位试验进行探讨。
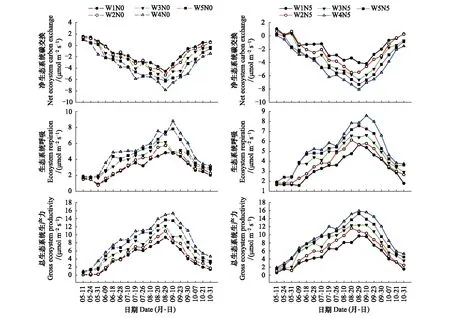
图2 降水量和氮添加下生态系统碳交换的时间动态Fig.2 Temporal dynamics of ecosystem carbon exchange under changing precipitation and nitrogen addition
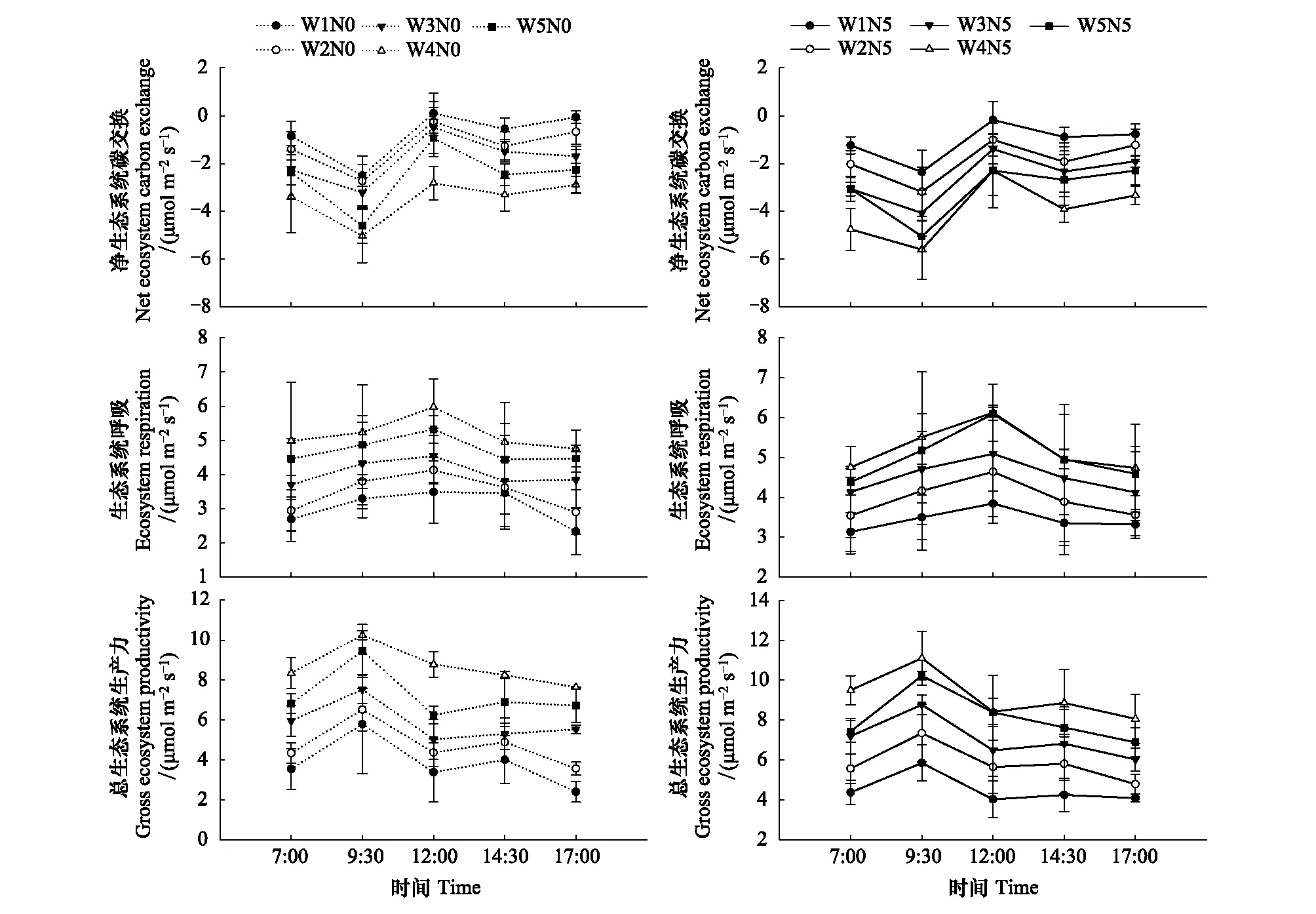
图3 降水量和氮添加下生态系统碳交换的日动态Fig.3 Daily dynamics of ecosystem carbon exchange under changing precipitation and nitrogen addition

表3 降水量、氮添加及其交互作用对生态系统碳交换的影响

图4 不同N添加处理下降水量对生态系统碳交换的影响Fig.4 Effects of precipitation on ecosystem carbon exchange under different N addition不同小写字母表示相同氮添加下降水量处理间各指标存在显著性差异(P<0.05);*表示相同降水量下氮添加处理间各指标存在显著性差异(P<0.05)
2.2 降水量变化及氮添加下生态系统碳交换与植物生物量和物种多样性的关系
-NEE和GEP均与牛枝子和草木樨状黄芪种群生物量以及群落生物量存在显著正的线性关系(图5,P<0.05)。ER与牛枝子、草木樨状黄芪、针茅、糙隐子草种群生物量以及群落生物量存在显著正的线性关系(P<0.05)。
-NEE、ER和GEP均与Patrick丰富度指数以及Shannon-Wiener多样性指数存在较强的线性关系(图6,P<0.01), 即三者随着Patrick丰富度指数以及Shannon-Wiener多样性指数的增加而增加。

图5 生态系统碳交换与植物生物量的关系 Fig.5 Relationships between ecosystem carbon exchange and plant biomass*、**和***分别代表显著性水平小于0.05、0.01和0.001
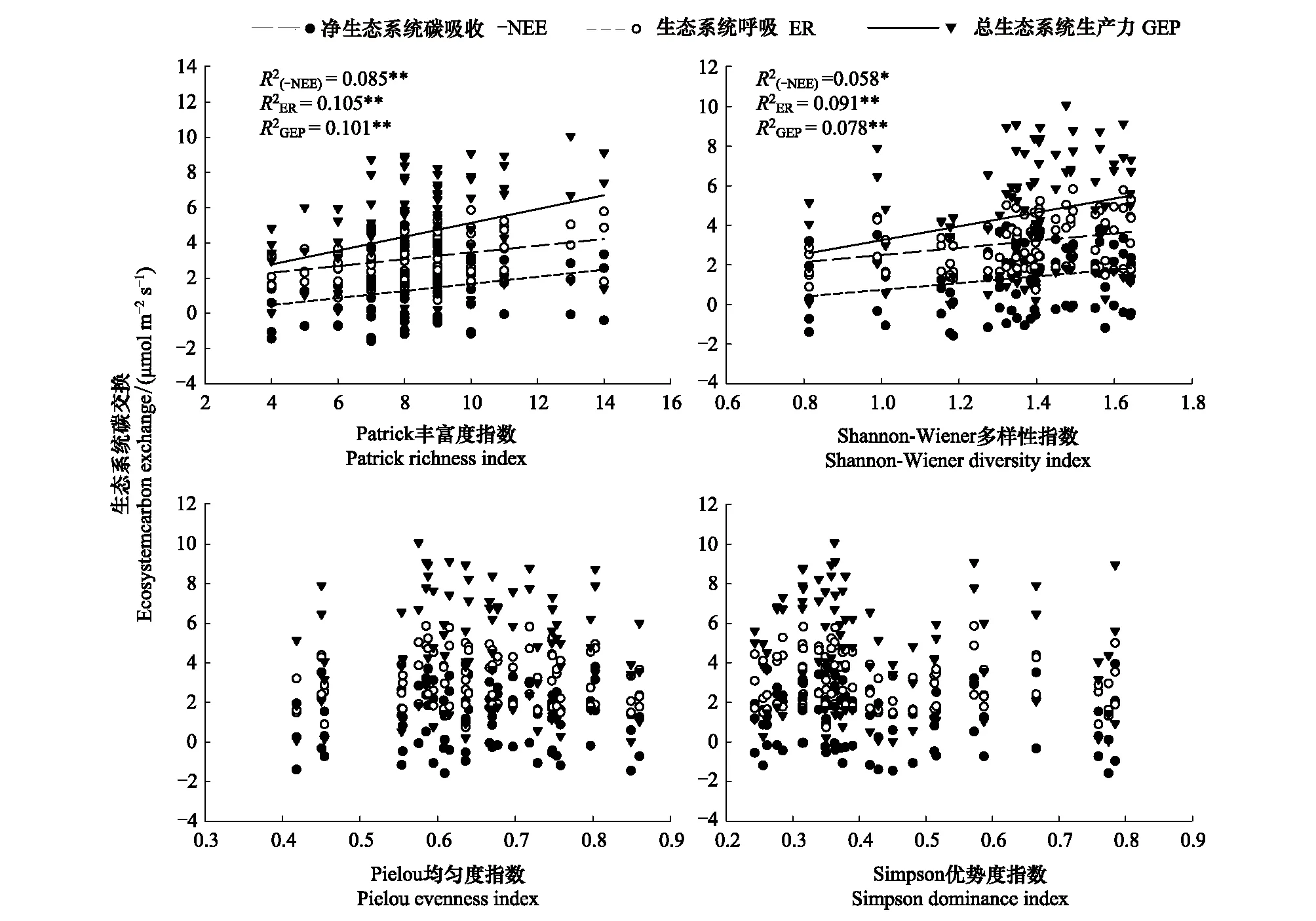
图6 生态系统碳交换与植物多样性的关系 Fig.6 Relationships between ecosystem carbon exchange and plant diversity
2.3 降水量变化及氮添加下生态系统碳交换与土壤性质的冗余分析
对生态系统碳交换影响显著的土壤性质分别是含水量、磷酸酶活性、C∶N、电导率、全氮、C∶P、全磷、微生物量磷、蔗糖酶活性和有机碳 (表4和图7)。其中, -NEE与土壤含水量、磷酸酶活性、C∶N、电导率、C∶P、蔗糖酶活性和有机碳呈较强的正相关, 与土壤全氮、全磷和微生物量磷呈较强的负相关; ER与之相反; GEP与除土壤磷酸酶活性及全磷之外的其他土壤性质呈负相关关系。

表4 生态系统碳交换与土壤性质冗余分析中各土壤性质的显著性检验

图7 生态系统碳交换与土壤性质的RDAFig.7 RDA of ecosystem carbon exchange and soil properties RDA: 冗余分析;NEE: 净生态系统碳交换; ER: 生态系统呼吸; GEP: 总生态系统生产力 SOC:土壤有机碳; TN∶ 土壤全氮; TP: 土壤全磷; MBP: 微生物量磷; EC: 土壤电导率; SWC: 土壤含水量; SA: 土壤蔗糖酶活性y; PA: 土壤磷酸酶活性
3 讨论
3.1 生态系统碳交换对降水量及氮添加的响应
降水量和氮添加及其交互作用对生态系统碳交换的影响取决于土壤本底条件[13]。作为驱动生态过程的关键影响因子, 降水量的改变和氮添加能够影响生态系统碳源汇功能[21, 23]。降水量和氮添加下生态系统碳交换月动态的结果显示(图2), 在生长季期间荒漠草原由碳源转为碳汇, NEE、ER和GEP呈先增大后减小的趋势, 与针对黄土高原典型草原的研究结果类似[21]。这可能是由于随着生长季推移, 植物生长加快, 叶片光合作用增强, 从而植被碳吸收能力提高[24]; 同时, GEP的增加幅度大于ER[11], 故生态系统逐渐转变为碳汇。降水量和氮添加下生态系统碳交换日动态的结果显示(图3), -NEE在中午前后明显降低, 出现“午休”现象。这可能是由于夏季高温、强辐射和低空气湿度等因素使叶片气孔导度下降或者关闭, 植物呼吸速率变大, 导致光合作用受到一定程度的抑制[25]。
本研究中, 与减少降水量相比, 增加降水量不同程度地提高了NEE、ER和GEP, 与针对内蒙古典型草原的研究结果一致[12]。可能是由于研究区长期处于干旱环境, NEE等碳循环过程对增加降水量的响应敏感性高于减少降水量[26]; 另一方面, 降水量通过影响土壤含水量间接影响生态系统碳交换过程(呼吸作用和植被生产力)[27], 即降水量增加使得土壤湿度和养分有效性增加, 一定程度上促进了土壤呼吸作用[26]; 此外, 在增加50%降水量条件下, 氮添加显著增强了NEE和GEP。一方面, 氮添加能够促进叶片氮摄取, 从而增强光合速率[28]、提高CO2吸收能力[29]。另一方面, 氮添加效应受到降水量的影响, 即一定量的土壤水分能够更好地激发氮肥肥效的释放, 进而提高植被生产力、增强植物光合固定作用。同时, 降水量和氮添加的交互作用具有一定的时滞性[30- 31], 因而减少(30%和50%)、自然和增加30%降水量条件下, 短期氮添加对NEE的正效应未达到显著水平(图4)。
3.2 生态系统碳交换与植物生物量及物种多样性的关系
植物生物量的累积可以作为评价植物生长状况和碳储量的重要依据[32- 33]。本研究发现, -NEE、ER和GEP均随着群落生物量的增加而增强, 这与在其他草原生态系统的研究结果一致[34]。首先, 在生长季期间, 随着植物生长加快, 其叶片光合作用增强、碳固定与储存增加, 同时地上部分呼吸作用增强[24]。其次, 随着植物地下部分生长, 其呼吸作用相应增强[35]。同时, 随着土壤温度升高、水分和养分有效性增多, 微生物活动的底物增加, 其呼吸作用随之提高[36- 37]。三者共同导致生态系统呼吸作用增强。由于植被生产力的增加程度高于土壤呼吸作用, 故生态系统表现为碳吸收。此外, 适度降水量增加及氮添加提高了土壤水分和养分有效性, 使得研究区由水、氮限制转变为其他资源限制(如光和磷), 牛枝子以及草木樨状黄芪等生态位较宽的植物竞争优势相应增加[38]。因而, 随着二者种群生物量的增加, 植物群落固碳能力增强。
不同植物种对土壤水分和养分的利用能力以及对环境变化的适应性不同, 造成群落优势物种组成间的差异, 加剧了环境变化对生态系统碳交换影响的不确定性[39- 40]。图6中, -NEE、ER和GEP均与Patrick丰富度指数以及Shannon-Wiener多样性指数存在正相关关系。首先, 降水量和氮添加下, 随着植物种数增多[20], 植物的光合固定作用增强[41], 植被生产力增加, 植物地下部分以及土壤微生物呼吸作用的底物随之增多, 直接导致生态系统呼吸作用增强[42]。其次, 本文测定的均为植物群落的光合作用以及生态系统呼吸作用, 植物群落的光合速率与群落物种类型和数目密切相关[31, 43]。另一方面, 植被群落结构会影响草地生产力以及植物光合作用产物, 从而调控着土壤物质积累状况[44], 进而直接影响到生态系统呼吸作用。以上结果进一步证实生态系统碳交换与植被群落组成之间存在密切的联系。
3.3 生态系统碳交换与土壤性质的关系
影响生态系统碳交换的因素包括生物因素和非生物因素[36]。本研究发现, 与其他因子相比, 土壤C∶N∶P生态化学计量特征对生态系统碳交换的影响较大。土壤C∶N∶P平衡特征可以反映土壤有机碳水平和养分供给状况[45]。土壤元素含量及其平衡关系受到降水量和氮添加的影响, 影响植物群落组成[20], 进而改变植物固碳能力。RDA结果显示(图7), -NEE与土壤C∶N、C∶P以及有机碳呈正相关, 与土壤全氮以及全磷呈负相关。这可能是由于降水量和氮添加下, 短期内土壤氮限制缓解, 刺激了植物和土壤微生物对氮、磷的利用以及竞争[46], 土壤可利用氮和磷含量降低。同时, 植物生长加快, 且通过光合作用吸收碳的能力增强。ER与土壤全氮以及全磷正相关, 与C∶N、C∶P以及有机碳负相关。这可能是由于土壤氮和磷是土壤微生物活动的底物, 适宜范围内其含量越高越有利于土壤微生物呼吸。相反, 生长季返还于土壤的枯落物(有机碳的主要来源)在短期内造成的遮蔽效应, 抑制了土壤呼吸[47]。
此外, 对生态系统碳交换影响显著的土壤性质还包括含水量、磷酸酶活性、微生物量磷和蔗糖酶活性。由于研究区长期处于干旱状态, 水分是其主要的限制因子, 因此对降水量的响应较为敏感[26]。土壤含水量调控着土壤微生物的生理过程、底物以及O2的扩散, 进而影响着土壤微生物呼吸作用[47]。然而, 在荒漠草原土壤含水量长期过低或短暂性增高均会一定程度上抑制呼吸作用[6], 故ER与土壤含水量负相关。土壤酶活性影响着土壤养分有效性以及植物养分利用策略, 间接调控着生态系统固碳能力和植被生产力[48]。本研究中, -NEE与蔗糖酶以及磷酸酶活性正相关。这可能是由于适度增加降水量与氮添加使微生物胞外酶从氮限制转变为碳、磷限制, 从而刺激了参与碳、磷转化的蔗糖酶和磷酸酶活性[48]、调节了微生物与植物间的元素竞争关系, 进而促进了植物生长和生态系统碳吸收。此外, RDA结果显示蔗糖酶、磷酸酶和含水量均与微生物量磷负相关(图7)。而这些土壤性质间的相互关系势必影响着土壤性质的单独影响效应, 有待在今后的研究中予以充分的考虑。
4 结论
降水量和氮添加对生态系统碳交换时间动态变化趋势的影响较小, 但改变了NEE、ER和GEP的峰值。NEE在生长季的月均值为负值, 即表现为碳吸收。与自然降水量相比, 减少降水量显著降低了NEE、ER和GEP (P<0.05), 增加降水量不同程度地提高了三者。氮添加亦有助于促进生态系统碳交换, 且其效应在增加50%降水量时较为明显。-NEE、ER和GEP与牛枝子、草木樨状黄芪种群生物量以及群落生物量正相关。同时, 三者亦随Patrick丰富度指数和Shannon-Wiener多样性指数的增加而增加。结合RDA结果, 本文研究表明减少降水量降低了生态系统碳交换, 增加降水量则可能通过提高土壤含水量、调控土壤C∶N∶P平衡特征和刺激土壤酶活性等, 促进了植物生长和物种多样性, 进而提高了荒漠草原生态系统碳汇功能; 氮添加促进了生态系统碳交换, 尤其是增加50%降水量条件下。考虑到二者交互作用的时滞性以及土壤性质间的相互作用, 今后还需通过长期的野外观测, 深入探讨降水格局改变和氮沉降增加对干旱半干旱区敏感生态系统碳收支平衡的影响机制。
