宁夏燃煤电厂周边土壤、植物和微生物生态化学计量特征及其影响因素
2021-10-09余海龙许艺馨李春环黄菊莹
王 攀,余海龙,许艺馨,李春环,黄菊莹
1 宁夏大学生态环境学院, 银川 750021 2 西北土地退化与生态恢复国家重点实验室培育基地, 银川 750021 3 西北退化生态系统恢复与重建教育部重点实验室, 银川 750021 4 宁夏大学地理科学与规划学院, 银川 750021
工业革命以来, 人类活动产生了大量二氧化硫(SO2)和氮氧化物(NOx), 导致大气酸沉降增加。长期酸沉降增加不但会引起土壤酸化, 而且可能造成碳(C):氮(N):磷(P)失衡和P限制增加, 导致生物多样性降低和生态系统退化[1]。近年来, 随着大气污染物控制措施的逐步推进和经济结构的全面转型, 酸沉降在欧美等发达国家呈降低趋势, 但在亚洲等发展中国家仍逐年增加[2]。研究发现, 自1990年以来全国硫(S)沉降下降, N沉降普遍上升[3]; 然而, 随着煤炭等行业的快速发展, 西北地区S、N沉降均加快, 且致酸物质由以S为主转变为以N为主[4-5]。相关研究表明, 尽管估测的宁夏N沉降量低于华南、西南、华北等高N沉降区域, 但较低的N沉降临界负荷[6]以及N沉降与S沉降的促进/拮抗作用[7], 使得区域S、N沉降状况同样值得重视。燃煤电厂是SO2、NOx等酸前体物的主要工业排放源。因此, 在宁夏燃煤电厂周边研究S、N沉降效应, 可为科学评估区域大气污染物限排措施的实施效果提供数据支撑。
植被-土壤系统C∶N∶P生态化学计量特征可指示系统C积累动态以及N、P限制格局[8], 调控着植物生长发育、微生物活动和凋落物分解等关键过程。因此, 研究土壤、植物和微生物C∶N∶P平衡关系可为阐明全球变化的生态效应提供新思路。通常认为有机体C、N、P之间的比值相对稳定, 在维持生态系统功能方面发挥着重要作用。例如, 在一定的外界条件下, 土壤中C和N的积累与消耗过程是相互耦合的, 二者比值的时空变异性较小[9]; 植物通过细胞成分或体内环境的自主调控, 以保持元素组成相对稳定[10]; 微生物则通过分泌胞外酶或调整生存策略等途径来适应底物养分条件的变化, 从而维持自身恒定的元素比[11]。然而, 近年来随着酸沉降量的持续增加, 土壤和植物C∶N∶P平衡关系趋于解耦[12-13], 并通过对植被群落组成的影响改变微生物元素平衡关系[14], 导致生态系统服务功能降低。目前, 国内已有较多研究探讨了酸沉降增加下土壤、植物和微生物C∶N∶P平衡特征, 但相关研究多为模拟N沉降试验, 且多集中在酸性、中性和轻度碱性土壤, 尚缺乏针对工业排放源周边S、N复合沉降下的研究, 尤其是土壤呈中重度碱性的区域。
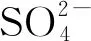
1 研究地区与研究方法
1.1 研究区概况
宁东基地是国家大型的煤炭生产基地, 位于宁夏中东部, 地处毛乌素沙地西南缘, 具有降水少(<300 mm)、蒸发强以及沙尘天气多等气候特征。土壤类型以灰钙土、风沙土及少量盐碱土为主, 具有pH高、有机质含量低、可溶性盐浓度高等特点。天然植被稀疏, 多为草本、半灌木和灌木, 且呈斑块状聚集[16, 18]。
在宁东基地选择宁夏发电集团有限责任公司马莲台电厂(38.17° N, 106.57° E, 海拔1258 m)、国网能源宁夏煤电有限公司鸳鸯湖电厂(38.06° N, 106.70° E, 海拔1279.6 m)和华电宁夏灵武发电有限公司灵武电厂(38.17° N, 106.35° E, 海拔1272.5 m)为监测点。其中, 马莲台电厂机组规模为2×330 MW, 是宁东基地第一个开工建设投产的重大工程和大型企业。鸳鸯湖电厂一期机组规模为2×660 MW, 二期机组规模为2×1100 MW, 是西部地区和国神集团最大的电厂。灵武电厂一期机组规模为2×600 MW, 二期机组规模为2×1000 MW, 是宁夏“十一五”重点建设项目。灵武电厂地势低洼, 相较马莲台和鸳鸯湖电厂具有较高的土壤含水量和电导率(表1)。

表1 电厂周围月平均S、N沉降量以及土壤性质
1.2 野外取样方法
依据前期调研结果, 本研究将取样点统一设在3个电厂围墙外东南方向(下风向)远离农田、牧场和道路等无人为活动的扇形区域内, 按照不同取样距离收集样品。每个取样距离上随机选取3个植被分布较为均匀的区域作为采样点, 每个采样点面积约10 m×10 m[16,18]。
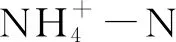
此外, 参照邢建伟等[19]和《环境空气降尘标准》(GB/T 15265—1994)[20], 采用手动采样器结合替代面法收集了1—6月(受采样周期和技术手段限制, 未能完整采集到全年沉降样品)每个采样点的降水降尘混合样品, 具体收集方法见项目组前期研究[16,18]。

表2 三个电厂取样距离和所选植物种
1.3 室内测试分析

1.4 统计方法
内稳性指数依据生态化学计量内稳性模型进行计算[21]:
y=Cx1/H
其中,y为叶片/微生物生物量N、P、N∶P; 考虑到植物和微生物对土壤养分不同的吸收利用方式, 在计算叶片内稳性时x分别对应土壤无机N、速效P和二者比值, 在计算微生物内稳性时x分别对应土壤全N、全P和N∶P[22-23]; C和H分别为拟合常数和内稳性指数。在P<0.05的条件下,H>4,y为稳态; 2
在Excel 2007中计算土壤、植物叶片和微生物生物量C∶N∶P生态化学计量特征的变异系数(CV, 标准差与平均值之比)。使用Sigmaplot 12.5进行图的绘制。采用R 3.4.3中的vegen程序包分别对叶片和微生物生物量C∶N∶P生态化学计量特征与环境因子之间的关系进行冗余分析(RDA): 先通过Log或Hellinger转换使所有数据符合正态分布, 再以叶片和微生物生物量C∶N∶P生态化学计量特征为响应变量、以全部环境因子为解释变量(影响较小的环境因子通过解释变量前项选择剔除)进行RDA。同时, 求得每个环境因子的条件效应。
2 结果与分析
2.1 电厂周围土壤、叶片和微生物生物量C、N、P及其比值的变化范围
土壤和微生物各指标相较植物叶片有较大变异系数(图1和图2): 土壤有机C、全N、全P、C∶N、C∶P和N∶P的变化范围分别为1.14—11.88 g/kg、0.10—1.19 g/kg、0.39—0.80 g/kg、5.25—14.55、4.25—18.96和0.37—1.66; 微生物各指标的变化范围分别为28.95—129.57 mg/kg、3.09—31.60 mg/kg、0.64—5.24 mg/kg、1.92—10.99、8.43—63.89和2.71—8.64; 叶片各指标的变化范围分别为279.90—521.54 mg/g、11.40—51.10 mg/g、1.07—2.97 mg/g、8.53—40.36、100.02—438.66和6.30—27.42。总体而言, 土壤—叶片—微生物系统元素间比值的变异系数小于各元素含量的变异系数。

图1 电厂周围土壤C∶N∶P生态化学计量特征Fig.1 Soil C∶N∶P ecological stoichiometry around the studied power plantsCV: 变异系数 Coefficient of variation
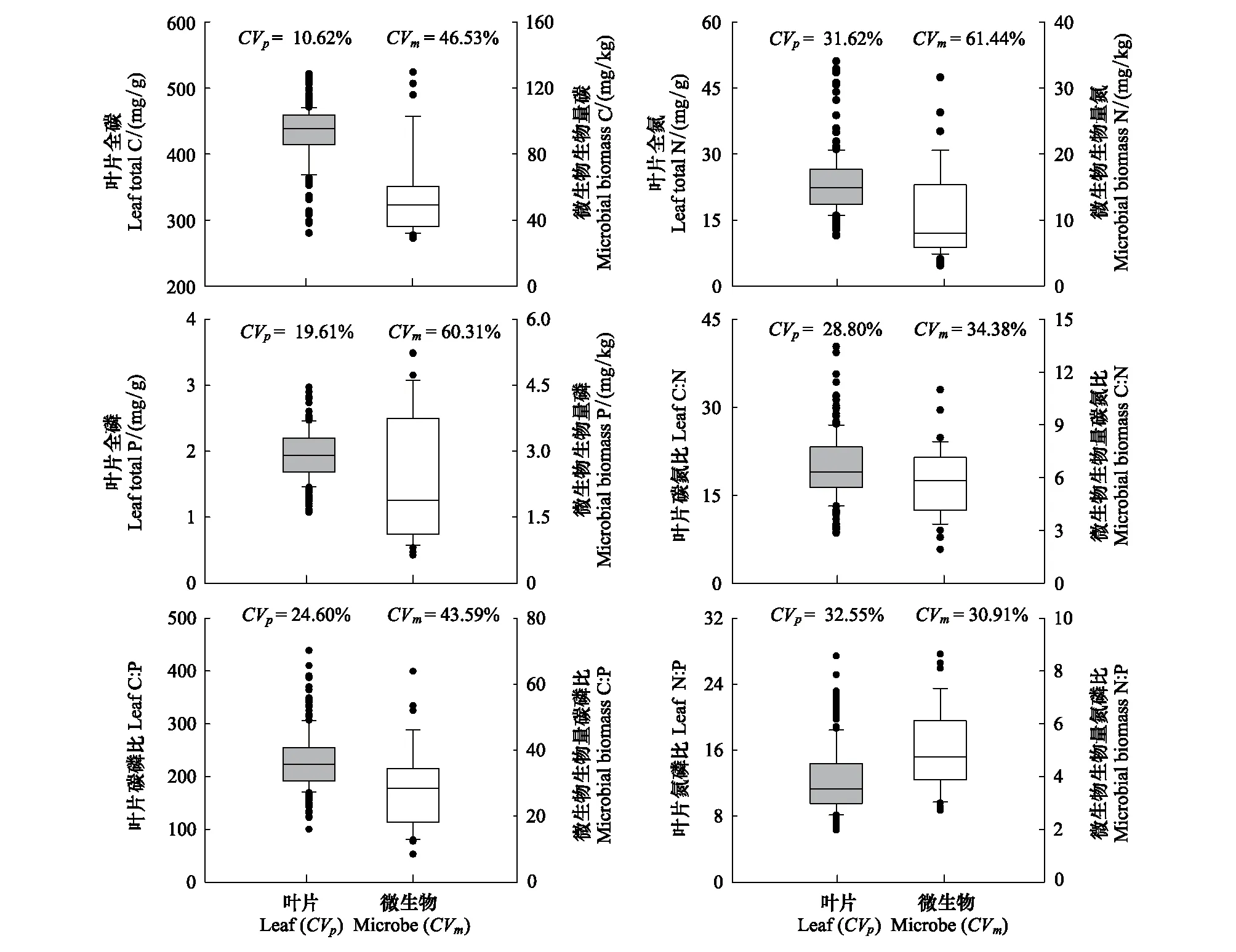
图2 电厂周围叶片和微生物生物量C∶N∶P生态化学计量特征Fig.2 The C∶N∶P ecological stoichiometry in leaves and microbes around the studied power plants
2.2 电厂周围土壤、叶片和微生物C、N、P拟合关系
图3中, 叶片全N和全P均与全C无显著的线性关系(P>0.05), 全N和全P存在显著的线性关系(P<0.001); 土壤和微生物3个元素间均存在极显著的线性关系(P<0.001)。
2.3 电厂周围叶片和微生物生物量N、P、N∶P内稳性
依据Persson等提出的内稳性判定阈值[24], 叶片全N和微生物生物量N∶P为绝对稳态; 叶片全P和N∶P为稳态; 微生物生物量P为弱稳态; 微生物生物量N为弱敏感态(图4)。
2.4 叶片和微生物生物量C∶N∶P生态化学计量特征与环境因子的关系

表3 叶片C∶N∶P生态化学计量特征与环境因子RDA中各因子的条件效应

图3 电厂周围叶片、微生物和土壤C、N、P拟合关系Fig.3 The relationships among C, N, P in leaves, microbes, and soils around the studied power plants
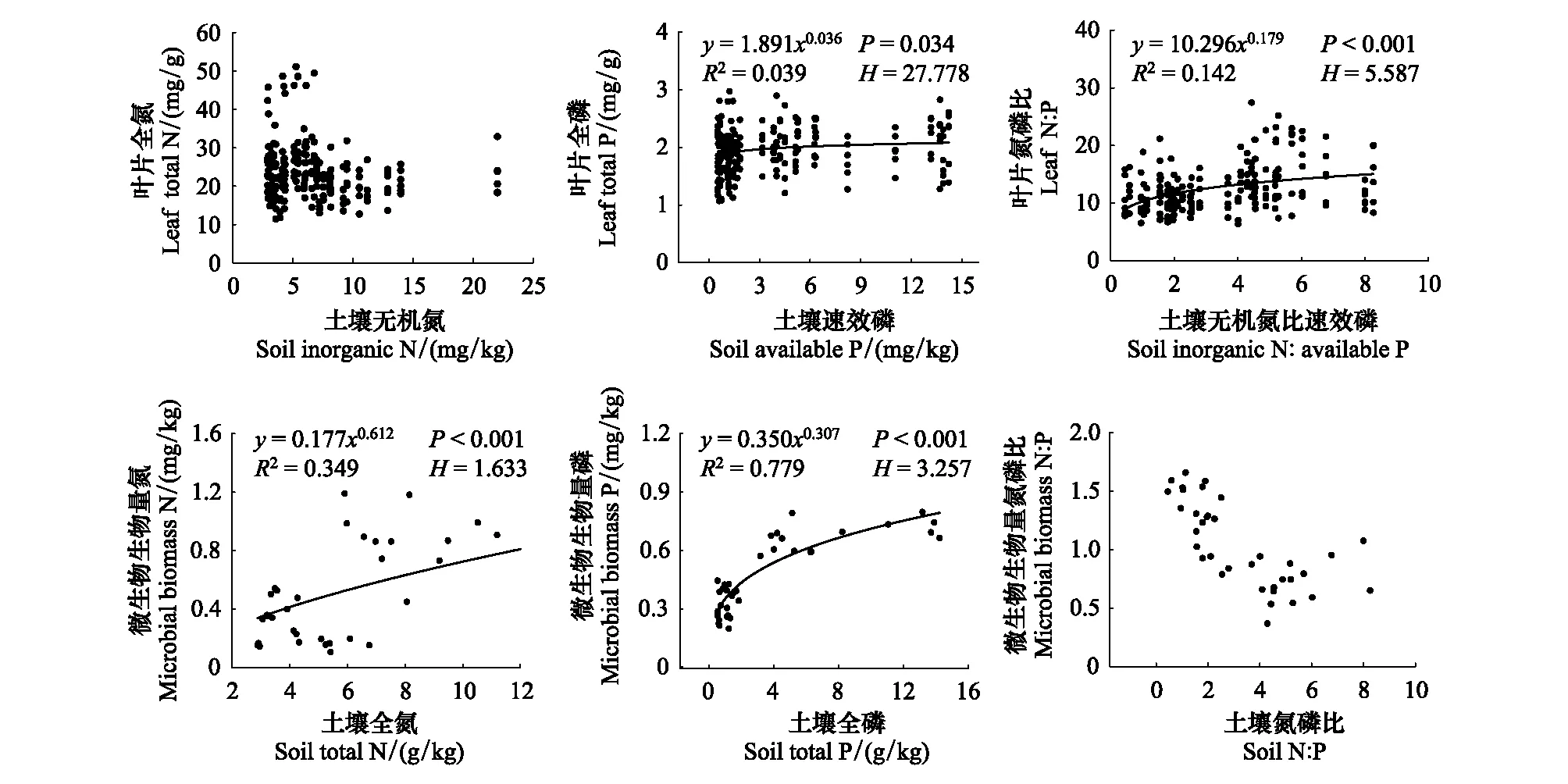
图4 电厂周围叶片和微生物生物量N、P、N∶P内稳性Fig.4 The homeostasis of N, P, and N∶P in leaves and microbes around the studied power plants

图5 叶片C∶N∶P生态化学计量特征与环境因子关系的RDAFig.5 RDA of C∶N∶P ecological stoichiometry in leaves explained by environmental factorsCp: 叶片全C Leaf total C; Np: 叶片全N Leaf total N; Pp: 叶片全P Leaf total P; C∶Np: 叶片C∶N Leaf C∶N; C∶Pp: 叶片C∶P Leaf C∶P; N∶Pp: 叶片N∶P Leaf N∶P; 月沉降量 Monthly deposition of 土壤 土壤 SIN∶ 土壤无机N Soil inorganic N; AP: 土壤速效P Soil available P; pH: 土壤pH Soil pH; BD: 土壤容重 Soil bulk density; EC∶ 土壤电导率 Soil electric conductivity; K+: 土壤K+Soil K+; Na+: 土壤Na+ Soil Na+; Mg2+: 土壤Mg2+ Soil Mg2+; UA: 土壤脲酶活性 Soil urease activity; PA: 土壤磷酸酶活性 Soil phosphatase activity

表4 微生物生物量C∶N∶P生态化学计量特征与环境因子RDA中各因子的条件效应

图6 微生物生物量C∶N∶P生态化学计量特征与环境因子关系的RDAFig.6 RDA of C∶N∶P ecological stoichiometry in microbes explained by environmental factorsMBC: 微生物生物量C Soil microbial biomass C; MBN: 微生物生物量N Soil microbial biomass N; MBP: 微生物生物量P Soil microbial biomass P; C∶Nm: 微生物生物量C∶N Soil microbial biomass C∶N; C∶Pm: 微生物生物量C∶P Soil microbial biomass C∶P; N∶Pm: 微生物生物量N∶P Soil microbial biomass N∶P
3 讨论
3.1 电厂周围植被-土壤系统C∶N∶P生态化学计量特征的变化范围及受限性
研究表明, 我国表层土壤平均有机C为2047 mmol/kg、全N为134 mmol/kg、全P为25 mmol/kg[25]。本研究对各指标进行了摩尔浓度转化, 转化后的有机C为844.65 mmol/kg、全N为93.44 mmol/kg、全P为18.92 mmol/kg, 低于全国平均值, 但高于其他受人为干扰较少的同气候类型区的观测值[26-27]。此外, 全国尺度上土壤C∶N为14.4 (摩尔比, 下同)、C∶P为13.6、N∶P为9.3[25]。本研究中, 转换后的各指标分别为11.16、29.37和2.63, C∶N和N∶P低于全国平均值。土壤C∶N和C∶P可指示底物质量, N∶P可指示N饱和状况[8]。结合有机C、全N和全P的供给状况, 以上结果意味着与自然条件下同类型区相比, 研究区土壤有较高的有机C水平和N、P供给能力; 且即使研究区具有较高的N沉降量[16], 其土壤N供给依然相对于P匮乏。此外, 较高的C∶N也意味着微生物分解有机N的速度较快, 可为植物提供较多的无机N。
本研究中, 叶片平均全N和全P分别为23.41 mg/g和1.95 mg/g, 高于全球尺度和全国水平草本植物的观测值[28-29], 但与内蒙古科尔沁沙地[30]等同类型地区的观测值相近, 反映了干旱半干旱环境下植物较强的N吸收能力[31]和较高的土壤P供给能力[32]。考虑到叶片对环境变化的敏感性, 较高的叶片N、P也间接地反映了研究区较高的N沉降量[18]以及植物对P的协同吸收[33]。叶片C∶N∶P生态化学计量比可以反映植物生长过程中的N、P受限状况。Koerselman和Meuleman认为植物N∶P<14时, 其生长主要受N限制; N∶P > 16时, 主要为P限制[34]。Güsewell则认为该判断阈值分别为N∶P<10和N∶P > 20[35]。本研究中, 平均叶片C∶N为19.86、C∶P为230.46、N∶P为12.33, 低于全球平均值[28,36], 但接近沙地植物的观测结果[30]。结合全N和全P的变化特点, 较低的叶片C∶N∶P意味着研究区植物可能主要受N的限制。
研究区微生物生物量C的变化范围为28.95—129.57 mg/kg、生物量N为3.09—31.60 mg/kg、生物量P为0.64—5.24 mg/kg, 低于土壤肥力条件较好的我国草原区的报道值[37-38]。土壤有机质是微生物生长的底物, 因此通常认为其与微生物生物量正相关。干旱区由于降水和温度的限制, 植物生物量积累较低, 导致输入到土壤中的有机质较少; 此外, 与其他类型土壤相比, 研究区广泛分布的风沙土较弱的保水保肥能力, 可能进一步阻碍了微生物生物量的积累[18]。全球尺度上, 微生物生物量C∶N的变化范围为3—24(摩尔比, 下同)、N∶P为1—55, 平均C∶P为59.5[11]。本研究中, 转化后的C∶N为6.69、C∶P为73.21、N∶P为11.07, 接近全球尺度的平均水平, 但高于我国草原区的报道值[37-38]。结合微生物生物量C、N、P的变化特点, 较高的微生物生物量C∶N∶P生态化学计量比证实了P可能是研究区微生物的主要限制因子[18]。
3.2 电厂周围叶片和微生物元素内稳性
本研究中, 与微生物相比叶片各指标的变异系数较小, 尤其全C (图2); 微生物生物量C与N、C与N以及N与P间均极显著相关, 而植物叶片三种元素间未呈现出明显的相关性(图3); 此外, 叶片全N、全P和N∶P内稳性较高, 微生物元素内稳性较低(图4)。这可能意味着, 当土壤环境发生改变时, 研究区植物可以保持相对稳定的叶片元素生态化学计量关系, 与科尔沁沙地植物的反应相似[39]。但其元素间耦合关系较弱, 反映了植物群落中不同物种对贫瘠养分环境的适应策略的差异性; 微生物元素内稳性较弱, 且N∶P内稳性> P内稳性> N内稳性。这可能是因为高浓度外源N输入会引起微生物功能改变和活性降低[40], 进而导致其元素内稳性下降。此时, 微生物可以通过提高磷酸酶活性来削弱P限制(图6), 以维持P和N的协同固持[41]。这不仅反映了微生物养分获取对土壤基质养分状况的依赖, 而且其生态化学计量关系对土壤环境变化敏感, 可作为表征土壤肥力状况的生物学指标[42]。
3.3 电厂周围叶片和微生物生态化学计量特征的影响因素
此外, 土壤酶活性和含水量也显著影响着叶片和微生物生态化学计量特征(表3和表4):蔗糖酶、脲酶和磷酸酶活性均与微生物生物量(C、N、P)正相关, 而与C∶N∶P生态化学计量比负相关。研究发现, 土壤酶活性与微生物代谢活动间存在着耦合关系[48]。本研究中随着三种酶活性的增加, 微生物固持有机物的能力增强, 进而导致其C∶N和C∶P降低[18]; 反过来, 随着微生物活性的增强, 其会分泌更多的酶以矿化有机物[49-50]。就植物而言, 3种酶活性与叶片C∶N正相关, 与全N和N∶P负相关, 与黄土丘陵区撂荒草地略有不同[51]。土壤水分在植物和微生物生理过程中扮演着重要角色, 其不仅可以调节植物根系对养分的吸收、也决定着微生物可用底物和细胞水化基质的扩散速率[52]。本研究发现, 土壤含水量与叶片全N呈负的相关性。这可能是因为当土壤含水量较高时, 沙质土壤N损失风险增加(如淋溶), 导致土壤N受限性升高, 从而阻碍根系对N的吸收[18]。此外, 有研究发现土壤电导率亦调控着植物C∶N∶P生态化学计量特征[53]。本研究中, 虽然土壤电导率在3个电厂间存在较大差异(表1), 但其对叶片和微生物生态化学计量特征的影响均不显著, 有待深入研究。
4 结论
鉴于酸沉降效应的时间累积性、元素受限类型判定标准的复杂性、研究区土壤偏碱性以及3个电厂在土壤含水量和盐渍化程度等方面存在的较大差异, 今后还需结合多个电厂的观测值(酸沉降、土壤性质和植物状况等), 通过长期的定位观测深入探讨植物-微生物-土壤元素生态化学计量特征及其驱动因子, 为科学评估工业排放源周边酸沉降的累积效应提供有力的数据支撑。
