基于网络药理学的青黛治疗溃疡性结肠炎作用机制研究△
2021-10-09王依史瑞李军祥刘豫玥袁亚利万雯
王依,史瑞,李军祥*,刘豫玥,袁亚利,万雯
1.北京中医药大学,北京 100029;2.北京中医药大学 东方医院,北京 100078
溃疡性结肠炎(UC)是以结肠和直肠黏膜连续性、弥漫性炎症改变为特点的慢性非特异性肠道炎症性疾病,以腹痛、腹泻、黏液脓血便、里急后重为主要临床表现[1]。在我国UC 发病高峰年龄为20~49岁,性别差异不明显[2]。近20年来我国UC的发病率呈现快速上升趋势[3],因此UC 治疗策略的制定受到越来越多的关注。目前,UC的常规治疗多以氨基水杨酸类制剂、糖皮质激素、免疫抑制剂、生物制剂为主[4],但这些药物存在疗效不稳定、停药后易复发、价格昂贵等问题。中医药在改善UC 患者临床症状、缓解疾病、防止疾病复发、减少不良反应等方面具有优势[5-7]。因此,可预防和治疗UC 的中药具有重要的临床应用价值。
青黛具有清热解毒、凉血消斑、泻火定惊之效。现代药理研究表明,青黛具有抗炎、调节免疫力、抗菌、抗病毒、抗肿瘤、镇痛等作用,可下调白细胞介素-6(IL-6)等炎症因子水平,故能有效预防和治疗UC[8]。青黛及其复方治疗UC 具有较好的临床疗效,且能有效修复肠道黏膜[9-12]。青黛与化学药联用治疗UC 时疗效优于化学药单用,且临床不良反应小[13]。尽管青黛治疗UC的临床研究较多,但其作用机制及物质基础尚未完全明确。因此,本研究采用网络药理学方法,挖掘青黛治疗UC 的靶点和通路,以期为青黛的进一步深入研究提供参考。
1 材料与方法
1.1 青黛活性成分筛选及靶点预测
利用中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/)检索青黛所有化学成分,并设置口服生物利用度(OB)≥30%、类药性(DL)≥0.18 为阈值,对所有检测到的化学成分进行筛选,得到青黛潜在的有效成分,并找出每个成分对应的靶点。将成分对应的靶点导入UniProt数据库(https://www.uniprot.org/),检索各靶点对应的人类基因简称。
1.2 疾病靶点及药物作用于疾病有效靶点预测
通过GeneCard 数据库(https://www.genecards.org)、OMIM 数据库(https://www.omim.org/),以“ulcerative colitis”为关键词查找得到与UC 相关的靶点。利用R软件将查找到的青黛作用靶点与UC疾病靶点取交集,得到青黛治疗UC 的预测靶点,并绘制韦恩图。
1.3 药物-成分-靶点-疾病相互作用网络的构建
利用Cytoscape 3.7.0 软件将青黛、成分、靶点及疾病之间的相互关系构建成相互作用网络。并以接近中心度(closeness)、度(degree)、介度中心度(betweenness)为主要分析指标,收集每个点的拓扑参数值,将相互作用网络进行可视化分析,得到核心化学成分及核心基因。
1.4 生物通路分析
运用基因注释工具Metascape(https://metascape.org/)及R软件对上述核心靶点进行生物功能及通路富集分析,预测青黛参与治疗UC 的主要生物功能及生物通路,分析相关作用机制。
2 结果
2.1 青黛活性成分及靶点筛选
利用TCMSP 数据库,共搜索到青黛化学成分29 个,设置阈值(OB≥30%和DL≥0.18)后,得到符合要求的化学成分9 个(表1),对应96 个靶点,排除重复值后得到68个靶点。将靶点输入到UniProt网站检索与人类有关的靶点蛋白简称,将无法检测到与人类相关的靶点排除,最终获得29个靶点。

表1 青黛有效成分
2.2 UC疾病靶点及青黛作用于UC的有效靶点
通过GeneCard、OMIM 网站共获得与UC 相关的靶点4356 个。将上述青黛的29 个潜在靶点通过R软件与UC 靶点取交集,最终得到青黛作用于UC 有效靶点18 个(图1),通过18 个靶点找到相对应的化合物7 个(图2),分别为10H-吲哚并[3,2-b]喹啉、异靛蓝、靛蓝、6-(3-氧代吲哚-2-亚甲基)吲哚并[2,1-b]喹唑啉-12-酮、靛玉红、β-谷甾醇、异维他汀。
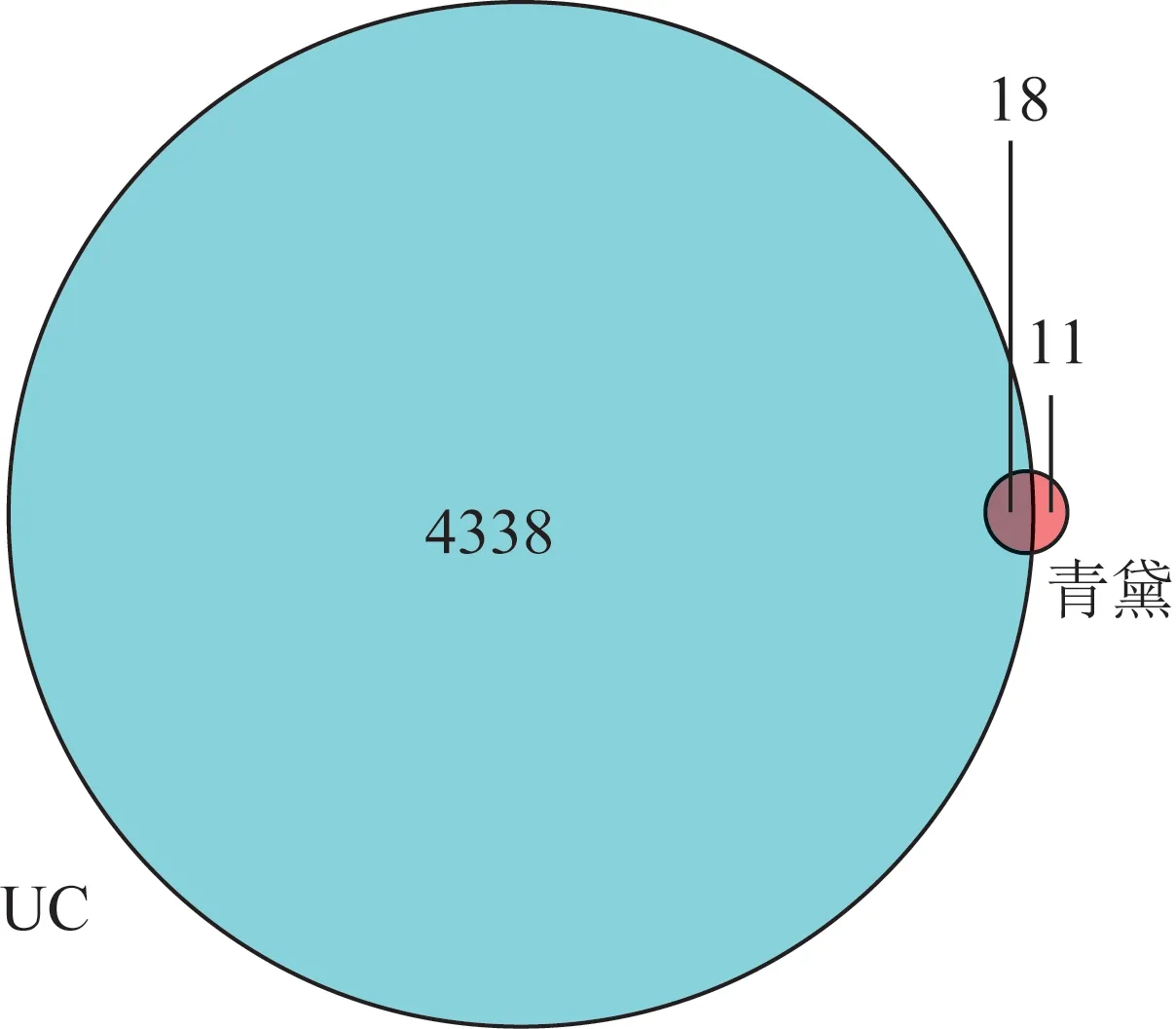
图1 青黛与UC交集靶点韦恩图

图2 青黛成分-靶点网络
2.3 药物-化学成分-靶点-疾病相互作用网络
将青黛7 个有效成分、18 个有效靶点及对应的UC 靶点输入到Cytoscape 3.7.0 软件中,绘制出各节点之间的相互作用网络图(图3)。从相互作用网络图中各节点与边的多种联系可知,青黛治疗UC具有多靶点、多环节调节的特点。在Cytoscape 3.7.0 中计算网络拓扑结构值,使用CytoHubba App调节节点参数值,以接近中心度、度、介度中心度为主要分析指标,设定Top25 nodes为筛选条件,收集每个点的拓扑参数值,将相互作用网络进行可视化分析,得到以靛玉红、β-谷甾醇为核心的化学成分及包括环加氧酶1(PTGS1)、雌激素受体1(ESR1)、雄激素受体(AR)、丝氨酸蛋白酶1(PRSS1)、转录因子p65(RELA)、半胱氨酸蛋白酶-3(CASP3)、CASP8、CASP9 在内的核心靶点,结果见表2~3。
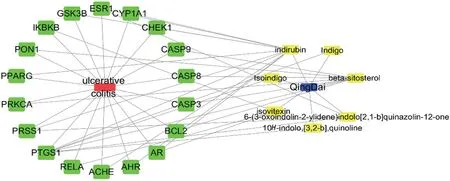
图3 青黛治疗UC的药物-活性成分-靶点-疾病网络
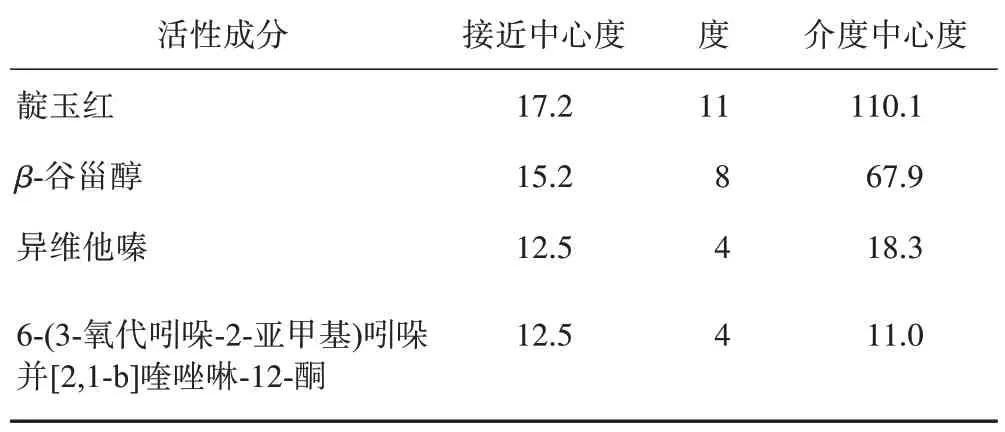
表2 青黛治疗UC的核心活性成分

表3 青黛治疗UC的前10位核心靶点
2.4 生物功能及通路富集分析
将药物-化学成分-靶点-疾病相互作用网络中得到的前10 位核心靶点进行以生物功能为主的基因本体(GO)分析及京都基因与基因组百科全书(KEGG)通路分析。运用基因注释工具Metascape进行GO 生物功能分析时设定物种为“H Sapiens”、P≤0.01,富集结果显示前20条(图4),颜色越深表示生物作用越强。GO分析主要包括细胞组分、分子功能及生物过程,其中以生物过程最为关键。分析结果显示,青黛可能参与的生物过程有131 条,主要包括对外源性凋亡信号通路的调节、对类固醇激素的反应、对外源性凋亡信号通路的负调控、对雌二醇的反应、对模式识别受体信号通路的调节、参与分化的细胞形态改变、对IL-1 的反应等过程。使用R 软件clusterProfiler 包对前10 位核心靶点进行KEGG通路信号富集分析,得到主要生物通路(图5),P值越小,对应的信号通路富集结果越好,图5中所示与UC 密切相关的通路主要包括细胞凋亡、p53 信号通路、IL-17信号通路等。

图4 青黛治疗UC核心靶点的GO分析

图5 青黛治疗UC核心靶点的KEGG通路分析
3 讨论
本研究筛选出青黛7 个活性成分,主要包括靛玉红、β-谷甾醇、异维他嗪、6-(3-氧代吲哚-2-亚甲基)吲哚并[2,1-b]喹唑啉-12-酮等,这些成分即青黛治疗UC 时发挥药效的物质基础。在得到的核心药效成分中,靛玉红和β-谷甾醇的研究最为广泛。靛玉红具有抑制细胞增殖、抗炎、抗肿瘤和抗病毒等生物学效应[14]。有动物实验研究表明,靛玉红具有抗UC 作用,且能促进UC 大鼠紧密连接肠黏膜蛋白的表达[15]。李楠等[16]研究发现,靛玉红能有效地缓解2,4,6-三硝基苯磺酸(TNBS)/乙醇诱导的UC模型大鼠的症状,其机制可能是通过下调转化生长因子-β1(TGF-β1)、髓过氧化物酶(MPO)的表达水平,提高成纤维细胞生长因子(bFGF)、ITF mRNA 表达水平,激活相关信号通路,进而起到抗肠道细胞凋亡、抑制肠道炎症、促进UC 肠道受损黏膜修复的作用。β-谷甾醇对由TNBS 诱导的动物结肠炎也具有一定的抑制作用[17]。冯思敏等[l8]研究发现,β-谷甾醇能显著抑制葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠结肠组织中IL-6 和环氧化酶-2(COX-2)的表达,降低结肠炎病理学评分。表明筛选出的青黛活性成分具有良好的抗UC作用。
药物-化学成分-靶点-疾病网络显示,各节点之间相互作用,存在多种联系。节点连线越多,连接度越大,则表明其在治疗UC 时发挥的作用可能越大。将网络图通过拓扑参数可视化后发现,青黛主要通过调控PTGS1、ESR1、AR、PRSS1、RELA、CASP3、CASP8、CASP9 等靶点发挥作用。而在诸多的核心靶点中,现代医学对PTGS1、CASP3、ESR1、RELA 研究较多。根据GeneCard 数据库显示,PTGS1 亦称为COX-1,普遍认为COX-1 为要素酶或管家酶,其产生的前列腺素参与机体正常生理过程和保护功能,与炎症产生无关。但有文献指出,COX-1 不仅是要素酶,也是诱导酶。其参与炎症反应,并具有加重炎症的作用[19]。然而,Peng 等[20]发现,无论是在UC 患者还是UC 小鼠的损伤阶段,COX-1 含量均显著降低,表明COX-1 也可能是UC的重要保护因素。基于以上研究及其他文献研究结论可知,COX-1 与UC 的关系尚不明确[21-22],因此后续可通过基因靶向敲除实验进一步探究COX-1 与UC 的关系。UC 的发生与细胞凋亡密切相关[23],肠黏膜细胞凋亡可造成肠黏膜通透性增加,肠道屏障功能降低,导致肠黏膜屏障破坏、受损或丧失,最终导致UC 的发生[24]。而CASP3、CASP8、CASP9均属于Caspase蛋白家族成员,是细胞凋亡的关键执行者,当细胞接受凋亡刺激时,这些蛋白被系列反应激活,进而诱导细胞发生凋亡[25-26]。有多项研究表明,无论是UC 模型大鼠还是小鼠,其肠黏膜中CASP3 含量均显著升高,且经有效药物处理后,CASP3 表达水平下调,结肠细胞凋亡率明显下降[27-28],表明CASP3、CASP8、CASP9 均与UC 发生相关,其中CASP3 作用最为关键。ESR1 是众多雌激素受体中的一员,与雌激素结合后发挥作用。雌激素可能与炎症性肠病的发生相关,因此激素受体也可与炎症有关。李文欣等[29]利用TNBS/乙醇诱导制备大鼠炎症性肠病(IBD)模型,结果表明,与对照组比较,经雌激素干预后IBD大鼠体质量降低、疾病活动指数(DAI)评分增加、结直肠长度缩短、肠道炎症加重,实验最终结果显示,雌激素可能通过与ESR1 结合促进TNBS 诱导的IBD 的发生与发展,且ESR1 的激活能加重大鼠IBD 症状。RELA 是核转录因子-κB(NF-κB)家族重要的成员,前期已有大量研究表明,NF-κB 与UC 发病关系十分密切[30],而RELA 经翻译后修饰可精准调控NF-κB 的转录活性,在调节炎症、肿瘤、代谢及免疫应答等重要的生命活动及相关疾病的发生发展过程中起重要作用;同时,亦有研究表明,RELA 对NF-κB 进行调控后可增加机体免疫能力[31]。因此,可推测青黛可能通过增强RELA 的表达,调控NF-κB 的活性及生物学功能,增强机体免疫功能进而起到抗UC作用。
生物功能分析结果显示,青黛可能主要通过干扰外源性凋亡信号通路、调节细胞形态及参与对类固醇激素、雌二醇、IL-1 等反应过程,最终通过调节细胞凋亡通路、p53 信号通路、凋亡-多物种信号通路、IL-17 等信号通路发挥抗UC 作用。对于信号通路而言,前20 条通路中与UC 相关的通路主要有凋亡、p53 信号通路、IL-17 信号通路。其中凋亡通路可能与CASP3、CASP8、CASP9 相关。此外,已有实验表明,IL-17信号通路的主要因子IL-17在UC的发生发展中占有重要地位[32],IL-17 表达水平下降提示病情缓解[33];而p53 蛋白具有抑制细胞增殖功能,可使DNA 损伤的细胞生长停止于G1/G0期,然而UC 相关结直肠癌中p53基因突变率很高[34]。因此,推测青黛可能通过抑制细胞凋亡及IL-17信号通路起到抗UC 作用,并能同时通过抑制p53信号通路减少UC病变部位发生癌变的风险。
综上所述,网络药理学研究结果表明,青黛主要从调节炎症因子、细胞凋亡及防止癌变等方面发挥治疗UC 的作用。其作用机制是多种生物学过程共同参与而成,体现了中药多靶点、多环节、多途径、多通路调节的作用特点,为临床利用青黛治疗UC提供一定理论依据。然而,本研究主要依靠网络药理学方法,研究所得核心成分与青黛入血实际发挥作用的成分是否一致尚未得到有效验证,因此,后续可从青黛入血成分等方面深入研究,以更好地阐述青黛治疗UC的作用机制。
