青杨不同种群叶片表型性状的遗传变异*
2021-10-09曹德美张亚红成星奇项晓冬胡建军
曹德美 张亚红 成星奇 项晓冬 张 磊 胡建军,2
(1.林木遗传育种国家重点实验室 国家林业和草原局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091;2.南方现代林业协同创新中心 南京林业大学 南京 210037)
青杨(Populuscathayana)是青杨派(PopulusSect.Tacamahaca)树种的重要成员,是我国特有种,其天然资源广泛分布于我国东北、华北、西北和西南地区,生长迅速且适应性强,具有重要的生态经济价值(徐纬英, 1988)。青杨天然种群在野外经过长期的自然选择,拥有丰富的种内变异(何承忠等, 2005),SSR标记表明青杨的遗传多样性在杨属树种中居于中等偏高水平(张亚红, 2019)。尽管如此,由于天然的青杨种群收集困难,青杨的相关研究多停留在系统发育学研究、基于少数群体的多样性研究及青杨杂交育种研究(卫尊征等, 2010; 徐红等, 2002; 李金花等, 2002),天然青杨不同种群的遗传多样性研究则鲜有报道。
遗传多样性是物种内个体遗传变异的综合(陈日红等, 2018),其不仅可以反映物种内基因的丰富程度,也体现物种应对环境变化的潜力,是物种多样性的基础(张腾驹等, 2019)。表型多样性是遗传多样性和环境异质性的综合表现(尚帅斌等, 2015),植物经过长期自然选择,性状逐渐稳定,形成新表型,因此表型变异在植物适应性进化中具有重要意义(Lietal., 2018; Gonzlez-Martínezetal., 2006)。表型性状的差异还经常作为遗传变异的表征被广泛地用于农作物、经济植物、林木及园艺植物表型多样性、种质资源鉴定和育种材料选择等研究,把握表型变异规律和内在机制,可为遗传改良和引种驯化奠定基础(Wangetal., 2011)。在林木中,天然种群由于对特殊生境的适应而拥有更加丰富的表型和基因变异,是进行遗传多样性分析的理想材料。
叶片是植物进行光合、呼吸和蒸腾作用的主要器官,能直接影响植物的光能、水分利用和物质积累(杨艳等, 2015),其大小、叶柄长度和颜色等表型是植物长期适应环境的结果,多样性极为丰富,常作为植物分类的依据。同时,叶的可塑性大,在不同选择压力下形成适应性特征,并且有研究发现叶片性状也受到较强的遗传控制,其表型变异能反映遗传基础上的变异,可利用叶片表型多样性获得植物生存、适应和进化的信息(王长海等, 2020; Ostria-Gallaetal., 2015)。此外,叶片形态和结构特征还与植物的生长密切相关,可作为农作物或林木良种选育的早期指标(Romanetal., 2016; Duetal., 2014)。天然种群内叶片性状具有丰富的多样性,研究不同种群叶片的形态变化有助于解析物种的生态适应性机制(李春明等, 2016; Monclusetal., 2009; Evansetal., 2014)。
本研究从全国青杨天然分布34个地点收集456份天然种质,对其10个叶片表型性状和4个复合性状进行测定和调查统计,了解青杨不同种群叶片表型多样性和变异程度,探明叶表型与种源地地理气候因子的相关关系,为解析青杨适应性的生态遗传机制和叶片性状的分子遗传机制奠定基础。
1 材料和方法
1.1 试验材料
2016年12月至2017年3月在中国青杨天然分布区内收集34个青杨种群。每种群从成熟林木中选取6~20株个体,为最大限度地避免种群内的无性繁殖植株,株间距大于100 m,采集树冠中部的1~2年生健壮枝条,将枝条剪成粗1~2 cm、长15~20 cm的插穗。对所采集个体利用GPS定位标记记录,并从中国气象数据网(1981—2010年)查询记录各种群种源地地理气候因子信息(表1)。2017年4月扦插于中国林业科学研究院温室,5月移植玉泉山苗圃,每个无性系10~20株,统一水肥管理, 2018年春季平茬幼化。

表1 青杨种群的地理信息Tab.1 Geographic information of Populus cathayana populations
1.2 性状测定
2018年7月,每个无性系选取长势正常、无病虫害的3株苗木,每株取新生第7、8、9片叶(茎尖以下第1片完全展开叶为第1片叶,下同)进行测量,取平均值作为每株苗木的观测值。首先用手持叶绿素SPAD测定仪测定叶绿素相对含量即叶绿素SPAD值(SPAD),然后统计叶片侧脉数(number of lateral veins,LVN),最后取下叶片用扫描仪扫描成像(图1A),利用Digimizer图像处理软件测量叶片的叶长(leaf length,LL)、叶宽(leaf width,LW)、叶面积(leaf area,LA)、叶周长(leaf perimeter,LP)、叶柄长(petiole length,PL)、叶基角(leaf base angle,LBA)和侧脉夹角(lateral vein angle,LVA)7个叶形性状度量指标及1个间接计算指标叶最宽处到叶尖距离(distance from the widest leaf to the tip,WTD)。根据成星奇等(2019)的方法计算4个叶形性状复合指标: 叶形指数(叶长宽比)=叶长/叶宽; 最大叶宽位置=叶最宽处距叶尖距离/叶长; 叶柄相对长=叶柄长/叶长; 叶缘因子=4×叶面积/叶周长。2019年5月,对每个无性系植株新生第1~5片叶进行叶色分级。对所有植株新生叶片叶色进行观测对比,确定分级标准,每级赋值并拍照,对照分级标准照片对每个无性系植株进行分级(分级标准见图1B)。

图1 青杨叶片表型Fig. 1 Leaf phenotype of Populus cathayanaA: 青杨叶形对比; B: 青杨叶色对比(1: 深绿色; 2: 黄绿色; 3: 暗红色; 4: 紫红色)。A: Comparison of leaf morphology; B: Comparison of leaf color (1: Deep green; 2: Yellow-green; 3: Dark red; 4: Purple-red).
1.3 数据处理与统计分析


在R3.4.3 软件中完成聚类分析和类群性状差异分析,其中聚类分析采用非加权配对算术平均法(UPGMA)。在General mapping tool 5.4.5软件中完成叶片表型分布图制作。
2 结果与分析
2.1 青杨叶片表型性状变异分析
对青杨34个种群的叶片表型性状进行统计分析,结果(表2)表明叶片各表型性状在种群间变异较大,而种群内变异较小,种群间变异系数在10.816%~38.006%之间,平均为20.562%,其中变异系数最大的为叶柄相对长,达到38.006%,最小的是SPAD值,为10.816%,说明34个种群间遗传分化明显,种群的选择潜力较大。方差分析结果(表3)与上述结果基本一致,14个叶片表型性状在种群间和种群内变异均达极显著水平(P<0.01),青杨叶片表型性状在种群间和种群内遗传变异丰富; 种群表型分化系数在43.14%~84.25%之间,平均为55.77%,说明青杨叶片表型在种群间和种群内均存在一定程度的变异,但种群间的遗传分化大于种群内,即青杨叶片表型变异更多地来自种群间。

表2 青杨叶片表型性状变异Tab.2 Variation of leaf phenotypic traits in P. cathayana
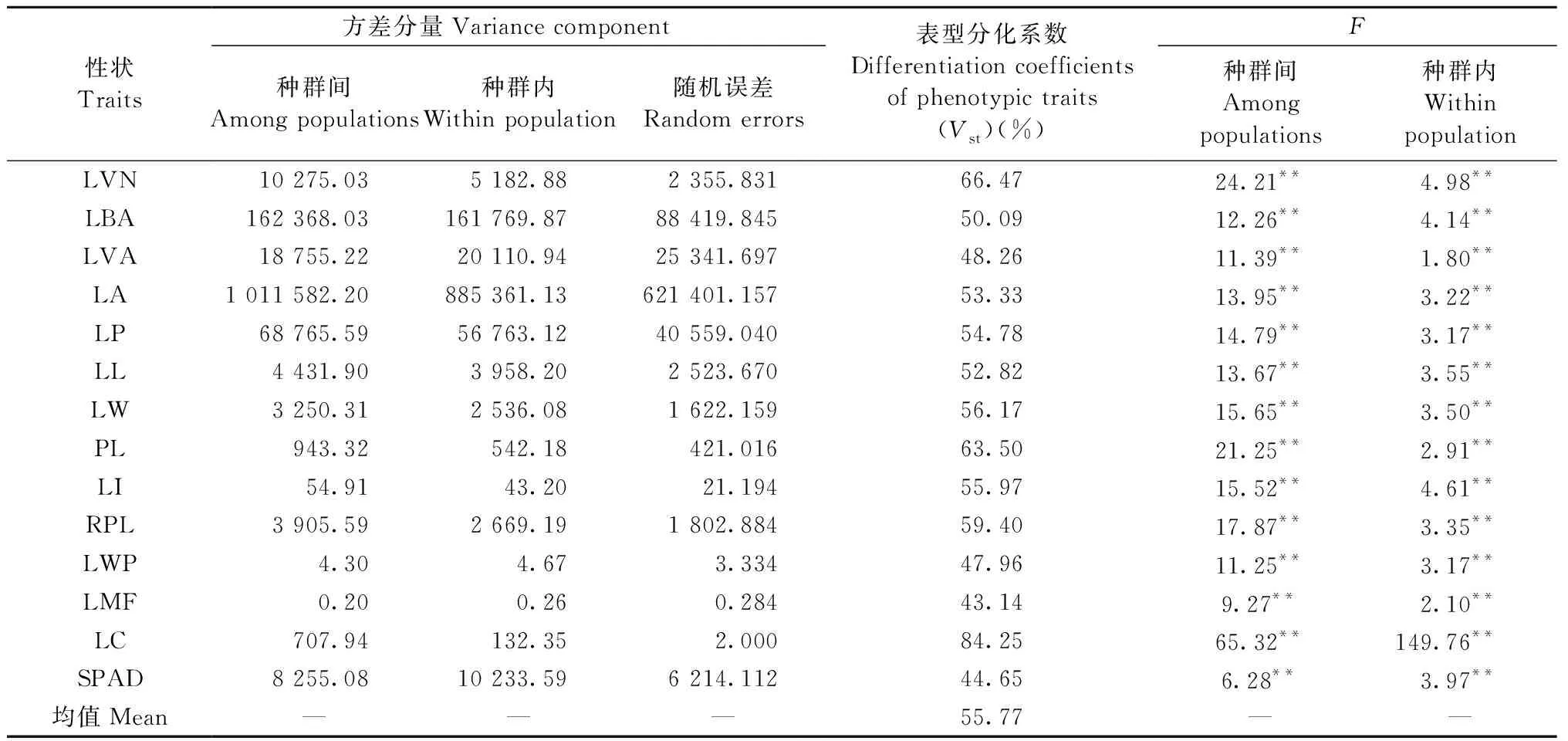
表3 青杨叶片表型性状的方差分析Tab.3 Analysis of variance of leaf phenotypic traits in P. cathayana
青杨叶片表型性状的多样性指数H介于1.054~2.093之间,平均为1.968。叶基角、叶柄相对长和叶色的多样性指数较小,低于平均值。其他性状多样性指数相差不大,均处于较高水平,其中叶柄长的多样性指数最高,为2.093。
重复力分析(表2)表明,除叶缘因子(0.892)和SPAD值(0.841)外,其余各性状重复力均高于0.9,说明青杨叶片表型性状受较强的遗传因素控制。其中侧脉夹角和最大叶宽位置的变异系数小于15%,表明这2个叶片性状更稳定,受遗传因素的控制更强; 叶面积、叶柄长、叶柄相对长和叶色的变异系数大于30%,这4个性状变异大、重复力高,更有助于优良种群的选择。
2.2 青杨种群内表型变异特征和表型多样性
由表4可知,34个青杨种群叶片表型性状的平均变异系数(CV)在6.002%~25.150%之间,均值为12.852%。8个种群的平均变异系数超过15%,其中17、30和31号种群的变异系数超过20%,叶片表型变异丰富; 9个种群平均变异系数低于10%,叶片表型变异水平较低,其中11号种群的变异系数最小,为6.002%; 其他种群变异系数介于10%~15%之间,变异相对丰富。青杨叶片表型性状在种群水平上变异不等,种群选择潜力大。
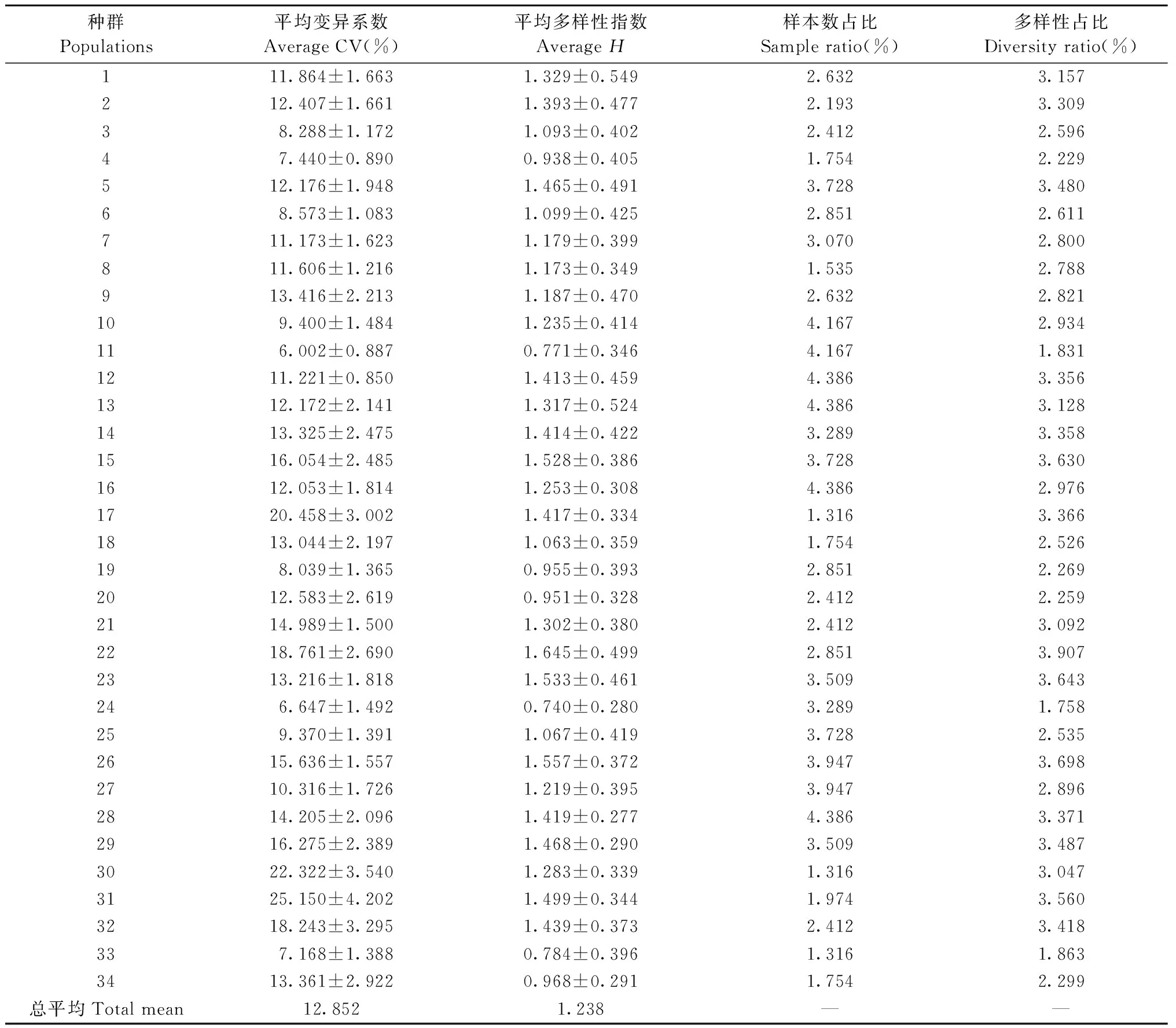
表4 青杨叶片表型性状平均变异系数和Shannon-Wiener指数Tab.4 Average coefficient of variation and Shannon-Wiener indexes of leaf phenotypic traits in P. cathayana
34个种群叶片性状的平均多样性指数在0.740(24号种群)~1.645(22号种群)之间,均值为1.238。各种群多样性指数相差较大,22、23、26号等18个种群的多样性指数超过均值,说明这些种群叶片表型多样性较为丰富,其他种群多样性指数低于均值,说明这些种群的叶片表型比较稳定。比较各个种群的多样性占比和样本数占比,发现17、30、31号种群的多样性占比显著高于其样本数占比,而11号种群多样性占比明显低于其样本数占比,说明17、30和31号种群叶片变异更为丰富,11号种群叶片变异最小,表型稳定性最高。
2.3 青杨叶片表型性状间及其与种源地地理-气候因子间的相关性
利用Pearson相关系数展示14个叶片表型性状间的相关关系(图2A),发现在91对相互关系中,有多达64对表现为极显著相关(P<0.01),还有4对表现为显著相关(P<0.05),其中叶基角、叶面积、叶周长、叶长、叶宽、叶柄长和最大叶宽位置7个性状间均呈极显著的正相关关系,说明这7个叶片形态特征之间是相互促进、共同变异的关系,即叶片越大,叶基角、叶面积、叶周长等越大。其余7个性状中相关性最强的是叶柄长和叶柄相对长,相关系数为-0.84,而叶长与叶柄相对长的相关性极低,相关系数仅为0.08,说明叶柄相对长主要取决于叶柄长。侧脉夹角、叶柄相对长和最大叶宽位置反映了叶的侧向生长情况,侧脉夹角和最大叶宽位置之间达极显著正相关,相关系数为0.46,而这2个性状与叶柄相对长之间未发现显著相关关系,表明侧脉夹角和最大叶宽位置协同影响叶片的侧向生长。叶缘因子是描述叶缘相对生长情况的重要性状指标,它与叶周长的相关系数为-0.50,而与叶面积相关系数为0.25,说明叶周长对叶缘生长的影响更大。叶色与其他叶片性状均不存在显著相关性,说明叶色遗传相对独立。SPAD值除与叶缘因子呈极显著正相关外,与其他叶片表型性状均呈极显著负相关或者无显著相关性,说明SPAD值可能参与植物的逆境适应。
青杨不同种群叶片表型性状与种源地地理气候因子的相关关系(图2B)表明,青杨叶片表型性状与地理生态因子的相关性较强。侧脉数与经纬度呈极显著正相关,与海拔呈极显著负相关。叶面积、叶周长、叶长、叶宽和最大叶宽位置均与海拔呈极显著负相关,与年均温和年降水量呈极显著正相关,表明高温、多雨、低海拔有利于青杨叶片生长。SPAD值则相反,其与纬度和海拔呈极显著正相关,与年均温、年降水量和年相对湿度呈极显著负相关。
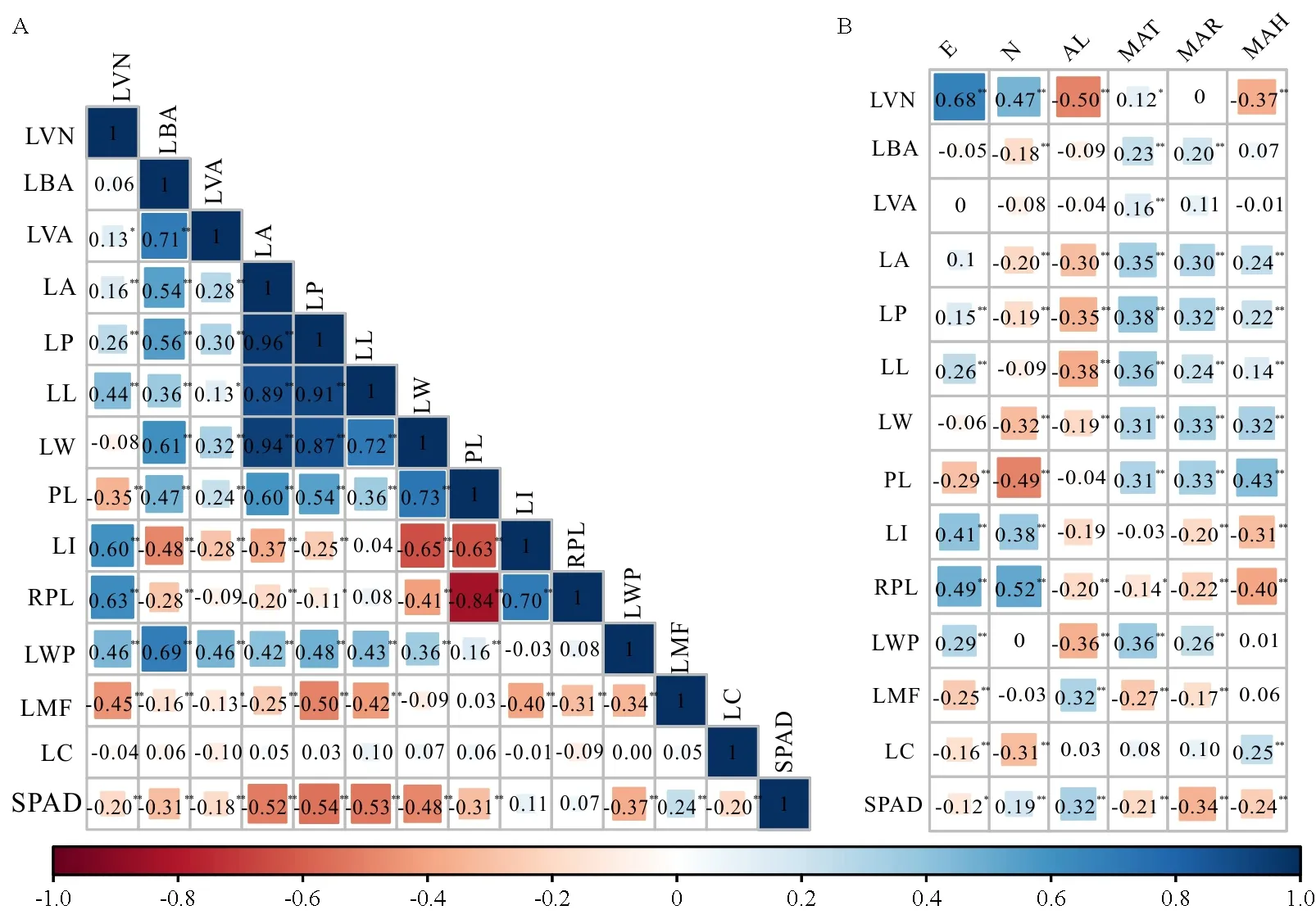
图2 青杨叶片表型性状的相关性分析Fig. 2 Correlation analysis of leaf phenotypic traits in P. cathayanaA: 叶表型性状间相关系数; B: 叶表型性状与地理-气候因子的相关系数。*表示0.05的显著水平;**表示0.01显著水平。性状及地理气候因子名称为缩写,全称分别见表2和表1。A: Correlation coefficients among leaf phenotypic traits; B: Correlation coefficients between leaf phenotypic traits and geographical meteorological factors. * indicates P<0.05; ** indicates P<0.01. The name of traits and geographical meteorological factors are abbreviations, full names are shown in Tab.2 and Tab.1, respectively.
2.4 青杨天然种群聚类分析
以欧氏距离为衡量单位,根据青杨不同种群14个叶片表型性状的相似性,34个种群在欧式距离为7处聚为4个类群(图3A),第Ⅰ类群种群数量最少,仅包括1、6、7号种群,第Ⅱ类群种群数量最多,包括14个种群,第Ⅲ和第Ⅳ类群分别包括9个和8个种群。
图3B展示了同一性状在4个类群间的标准化值差异,叶基角、侧脉夹角、叶面积、叶周长、叶长、叶宽、叶柄长和最大叶宽位置8个性状的均值在第Ⅰ类群中最大,第Ⅱ类群次之,但第Ⅰ类群的叶形指数、叶柄相对长、叶缘因子和SPAD的均值最小,可知第Ⅰ类群叶片生长旺盛,属长叶柄大叶类群; 第Ⅱ类群叶形较大,且该类群叶色值最大,有叶色鲜艳的特点,属中等叶类群; 第Ⅲ类群的侧脉数、叶形指数、叶柄相对长均值最大,叶宽和叶柄长均值最小,此类群属短叶柄窄长叶类群; 第Ⅳ类群的叶缘因子和SPAD均值最大,其余性状均值都较小,属小叶类群。4个类群叶形对比见图1A。

图3 青杨叶片表型多样性分类Fig. 3 Classification of leaf phenotypic diversity in P. cathayanaA: 不同种群青杨叶片表型性状聚类图; B: 不同类群青杨叶片表型性状差异; C: 青杨种质资源叶片表型分布。A: UPGMA cluster of leaf phenotypic traits in P. cathayana of different populations; B: The difference of leaf phenotypic traits of different groups; C: Leaf phenotype distribution of P. cathayana germplasm resources.
根据青杨不同类群的地理分布(图3C)可看出,短叶柄窄长叶类群(第Ⅲ类群)和小叶类群(第Ⅳ类群)分布比较集中,分别位于我国东部低海拔地区和西部高海拔地区; 中等叶类群(第Ⅱ类群)分布比较松散,由西南部青藏高原边缘至东部华北平原均有分布,说明中等叶类群可能为过渡类群,类群内特征不明显; 长叶柄大叶类群(第Ⅰ类群)分布在相隔较远但温度、降水等环境条件相似的2个地区。青杨叶片性状4个类群的种源地分布有重叠但同一类群的分布地有一定的相似性,这说明种群除具有特定的表型特征外,还具有特定的生态幅度与分布范围。种群是在一定的气候、地理位置、生物等因素综合作用下经过长期发展形成,是自然生态系统中的一部分。分布区的划分除了考虑具有代表性的叶片性状外,还要考虑生态及地理特征。因此,结合类群分布和中国地形特点,将青杨不同种群划分为三大分布区: 第1个分布区为太行山东侧地区,其地势较低,属华北平原北缘地区,土壤肥厚,包括14个青杨种群,占最大比重的为短叶柄窄叶类群(57.14%),其次是中等叶类群(35.71%); 第2个分布区为太行山以西和秦岭-六盘山之间地区,属黄土高原,海拔较高,包括12个种群,以中等叶类群为主(66.67%); 第3个分布区为六盘山以西青藏高原周边地区,包括8个种群,小叶类群占62.5%,多位于超过2 500 m的高海拔地区,大叶类占25%,位于海拔1 800 m以下的温暖湿润地区,其余1个种群(12.5%)为中等叶类群。
3 讨论
3.1 青杨不同种群叶片表型多样性及变异规律
在木本植物中,尤其是在广布种中,复杂的环境条件、长期的地理隔离和自然选择容易引起种内表型变异,表型性状的变异同时受到遗传和环境因素影响(赵阳等, 2019)。青杨广泛分布于我国大部分地区,青海最为集中,垂直分布跨度大,多见于海拔800~3 000 m的沟谷、河岸等(彭幼红, 2011)。多变的自然条件和强烈的地域差异使得青杨某些性状在不同种群间产生了遗传分化。表型变异是生物遗传变异最直接的表现,也是遗传多样性研究的重要内容之一(陈日红等, 2018; Jiangetal., 2015),选用叶片进行表型性状多样性的研究,可在一定程度上反映不同种群的变异大小和遗传多样性水平。
本研究中青杨叶片表型变异相当丰富,青杨叶片表型性状在种群间和种群内均差异极显著,与其他木本植物如大别山山核桃(Caryadabieshanensis)(张深梅等, 2020)、珙桐(Davidiainvolucrata)(张腾驹等, 2019)等研究结果基本一致,具有很好的选择潜力,为后期的遗传改良奠定基础。青杨种群平均表型分化系数为55.77%,远高于海南岛青梅(Vaticamangachapoi)(18.31%)(尚帅斌等, 2015),与白花树(Styraxtonkinensis)(59.08%)(柳新红等, 2011)相近。种群间的变异反映了地理、生殖隔离上的差异,是种内多样性的重要体现(Satyendraetal., 2013),青杨表型变异主要来源于种群间,说明青杨种群分化程度较高,对环境的适应能力较强。从各性状的变异系数来看,最大的是叶柄相对长38.006%,其次是叶色36.175%,叶绿素SPAD最小10.816%,说明叶柄相对长和叶色变异大,叶绿素SPAD最稳定。从各种群的变异系数看,叶片表型性状平均变异系数在6.002%~25.150%之间,均值为12.852%,各种群变异水平差异显著,其中变异系数最大的是17号(河北蓝旗卡伦)种群,最小的为11号(河北龙泉)种群,这可能与种群地理位置有关; 2个种群虽都位于河北省,但地形却差别很大,蓝旗卡伦地处山地,地势起伏较大,气候复杂多变,更容易产生遗传变异,而龙泉处于华北平原,气候条件单一,各性状比较稳定。Shannon-Wiener指数分析肯定了上述结果。青杨叶片表型多样性指数(H)均值为1.968,与滇楸(Catalpafargesiif.duclouxii)(1.918)(肖遥等, 2018)和格木(Erythrophleumfordii)(2.027 8)(李洪果等, 2019)相近,低于四川省的珙桐(2.360)(张腾驹等, 2019),而高于白栎(Quercusfabri)(1.839)(熊仕发等, 2020)。地处复杂环境中的种群,如位于太行山的22号(山西广灵)、26号(山西七里峪)种群和位于燕山的17号(河北蓝旗卡伦)种群多样性指数高,可能是由于种源地海拔落差大以及土壤和光照等环境因子差异大促进了性状变异;而位于单一环境中的种群,如青藏高原高海拔地区的18号(青海湟源)、19号(青海湟中)等青海种群和位于低海拔平坦地区的4号(陕西长安)、11号(河北龙泉)种群等多样性指数低,表型性状稳定。通常来说,样本数量对种群的表型多样性也有很大影响,样本量大的种群可能具有更高的多样性(李洪果等, 2019),比较各个种群的多样性占比和样本数占比,发现 11号(河北龙泉)种群多样性占比明显低于其样本数占比,因此11号(河北龙泉)种群是叶片性状最稳定的种群。综合变异系数和多样性指数分析可看出17号(河北蓝旗卡伦)、30号(内蒙古半截塔)和31号(内蒙古坝底)种群的变异系数和多样性指数均较高,是多样性保护和种质资源保存的重点种群。
3.2 青杨叶片表型变异与地理气候因子相关性
不同物种由于对所处环境的适应性和敏感度有差异而形成不同的地理变异模式(Zengetal., 2018),如西伯利亚杏(Armeniacasibirica)呈现出以经度为主的变异模式(尹明宇, 2017),影响苦楝(Meliaazedarach)果核长度和种子宽度的主要因素是纬度(陈丽君等, 2014)。本研究中叶片性状与各地理气候因子之间相关性均较强。地理气候因子中的海拔、年均温和降水量主要影响叶形大小,如叶面积、叶长、叶宽等,低海拔、高温和多雨有助于青杨叶片生长; 叶绿素SPAD值则相反,高纬度、高海拔、低温和低湿的恶劣环境下叶片小但SPAD值大。整体上看,青杨呈现以海拔变化为主的地理变异模式。
青杨不同种群叶片表型聚类的特征和种源地分布特征也在一定程度上体现了青杨以海拔变化为主的地理变异规律。聚类分析将34个青杨种群分为4类,其并没有完全根据地理位置的远近而聚类,说明地理距离在青杨的群体表型分化中并不是起关键作用(Duetal., 2014)。经度、纬度和海拔等作为综合因子主要通过气温、降水和紫外线等影响植物的性状(张凯等, 2017),4个类群性状差异明显,结合对种源地划分发现,来源于低海拔、地势平坦地区如华北平原和四川盆地的种群叶形偏大,而来源于高海拔地区如青藏高原的种群叶形偏小。不同种群的叶片表型可能是因为不同种质中控制叶形的等位基因对环境的敏感度不同,而不同基因型主要是在特定环境下长期进化的结果(Fuetal., 2017)。本研究试验材料原始插穗条采集于不同年龄的青杨,可能会存在成熟效应引起的非遗传变异(张世红等, 2010),成熟效应的影响时间和影响大小无法预测,平茬、连续扦插、组织培养等可达到一定的幼化或复壮效果,但可能不足以消除成熟效应影响(洪汉辉等, 2018; 孙琳等, 2016),因此,如何估计青杨成熟效应的影响及探究消除成熟效应后青杨不同种群表型性状遗传变异规律,有待进一步研究。此外,有研究表明林木早期生长与叶片大小成正相关(Justineetal., 2015),而平原地区人口较多,人为因素更偏向于保存生长更好、经济效益更高的大叶片青杨资源,而高海拔地区人烟稀少,人为影响较小,因此本研究中叶片表型地理分布特点,尤其是低海拔地区叶形特点究竟是自然选择还是人为选择,仍需进一步探索。
4 结论
青杨不同种群叶片表型变异丰富,种群间变异大于种群内,其中河北蓝旗卡伦(17号)、内蒙古半截塔(30号)和内蒙古坝底(31号)种群的叶片表型多样性最丰富,是多样性保护和种质资源保存的重点种群。聚类分析将34个青杨种群分为4大类群,结合类群特征和种源地分布发现,青杨叶片呈现以海拔变化为主的地理变异模式,低海拔平坦地区主要为大叶形,高海拔山地主要为小叶形。本研究通过对天然青杨不同种群叶片表型性状的遗传变异分析,丰富了林木天然种群叶表型研究,保存了大量青杨种质资源,为解析青杨适应性的生态遗传机制和青杨叶片性状的分子遗传机制奠定基础。
