不同双膦酸盐类药物抑制破骨细胞特征曲线的意义
2021-10-08李鹏飞周林何玉秀贾楠梁军伟王金星
李鹏飞 周林 何玉秀* 贾楠 梁军伟 王金星
1. 河北师范大学体育学博士后流动站,河北 石家庄 050024 2. 河北医科大学附属哈励逊国际和平医院脊柱骨科,河北 衡水 053000
骨质疏松症为常见慢性疾病,主要影响骨骼运动系统[1]。双膦酸盐类药物可明确抑制骨吸收[2]。其中,唑来膦酸、伊班膦酸、帕米膦酸均为静脉应用[3]。但是目前尚无针对三者进行综合比较的基础研究。同时对于如何选择合适剂量的双膦酸盐类药物预防与治疗骨质疏松症亦存在分歧[4]。针对上述问题,本研究拟通过基础实验明确三者对破骨细胞分化、形成、粘附及迁移作用的抑制特点,绘制浓度与抑制作用曲线,找到药物最低有效浓度及50 %有效浓度。对于指导临床选择合适种类和剂量的双膦酸盐类药物,具有一定的研究意义和价值。
1 材料与方法
1.1 材料
唑来膦酸(瑞士诺华制药,注册证号H20090259,5 mg);伊班膦酸(河北医科大学生物制药中心,国药准字H20163325,1 mg);帕米膦酸(天吉生物制药,国药准字H20067706,15 mg)。C57小鼠(河北医科大学实验动物中心)。集落刺激因子-1(Abcam, CSF-1)、NF-κB受体活化因子(Abcam, RANKL)。胎牛血清(Sigma Aldrich,FBS)、抗酒石酸酸性磷酸酶(Sigma Aldrich,TRAP)。0.5 %四硼酸钠、1 %甲苯胺蓝;培养基(α-MEM,GIBCO BRL)、预湿牙本质片(Windham)。纤维蛋白降解产物、磷酸盐缓冲液。10 %甲醛、乙醇丙酮混合液;8 μm孔径滤网(Transwell系统,24孔板);光学显微镜(奥林巴斯)。QCapture-Pro(QImaging)、Imaging-Pro图像处理(Media Cybernetics)、SPSS19.0统计软件(IBM)等。
1.2 方法
1.2.1实验用破骨细胞的制备:本研究依照动物伦理学要求,自小鼠四肢长骨骨干髓腔内提取分离出骨髓单核细胞。采用α-MEM将培养3 d后,分化获得破骨细胞(osteoclasts, OCLs)。之后将OCLs分为唑来膦酸组、伊班膦酸组、帕米膦酸组、对照组。于唑来膦酸组加入阶梯浓度为10-3、10-2、10-1、1、10、102、103μmol/L唑来膦酸溶液[5]。同时,伊班膦酸组、帕米膦酸组分别加入相同阶梯浓度的伊班膦酸和帕米膦酸溶液,对照组则加入磷酸盐缓冲液。
1.2.2分化形成检测:将OCLs继续培育5 d后进行TRAP染色,倒置显微镜下观察并拍摄;应用Imaging-Pro软件计算TRAP阳性细胞数量。
1.2.3迁移性检测:应用8 μm孔径Transwell系统分析并测量OCLs活动性。三组分别加入相同阶梯浓度的相对应的实验药物(同1.2.1),对照组加入同等量磷酸盐缓冲液;仔细分出相同量OCLs,加于Transwell系统滤网,观察通过滤网的细胞数量,并进行拍摄记录。
1.2.4附着性检测:离心沉淀骨髓单核细胞接种于96孔培养板。三组分别加入相同阶梯浓度的相对应的实验药物(同1.2.1),对照组加入同等量磷酸盐缓冲液。培育40 min后应用磷酸盐缓冲液冲洗去掉游离OCLs。通过倒置显微镜观察记录附壁OCLs并计算数量。
1.2.5骨吸收性检测:将骨髓单核细胞接种于培养板并放置骨片。三组分别加入相同阶梯浓度的相对应的实验药物(同1.2.1),对照组加入同等量磷酸盐缓冲液。培育5 d后用磷酸盐缓冲液冲洗去掉骨板上破骨细胞。用四硼酸钠与甲苯胺蓝染色后观察记录OCLs骨吸收陷窝形态,并计算骨陷窝数量及分布面积。
1.3 统计学处理
各组实验数据以均数±标准误(Mean ± SEM)表示,采用SPSS 19.0统计软件进行数据分析。分布采用多样本t检验、重复测量方差分析,Tukey Kramer方法进行组间统计分析。P<0.05被认为差异具有统计学意义。
2 结果
2.1 阶梯浓度唑来膦酸抑制特征分析
与对照组相比,唑来膦酸在1 μmol/L浓度下,抑制破骨细胞分化、形成、活动、附着以及骨破坏功能明显。此浓度下每高倍视野(HPF)分化形成破骨细胞平均数量明显减少至(6.1±3.9)个,1 μmol/L为唑来膦酸最低有效抑制浓度(P<0.05, 见表1)。以对照组为基数,将数据综合换算为百分比(Y轴),制作阶梯浓度对数表(X轴),绘制阶梯浓度抑制曲线图。观察曲线形态发现:10-1μmol/L ~ 1 μmol/L浓度抑制曲线走形陡峭,1 μmol/L为“扳机”浓度。随着梯度浓度增加,在10、102、103μmol/L并未出现抑制作用明显增强(P>0.05,见表1和图1)。通过计算得出50 %有效浓度为0.66 μmol/L。
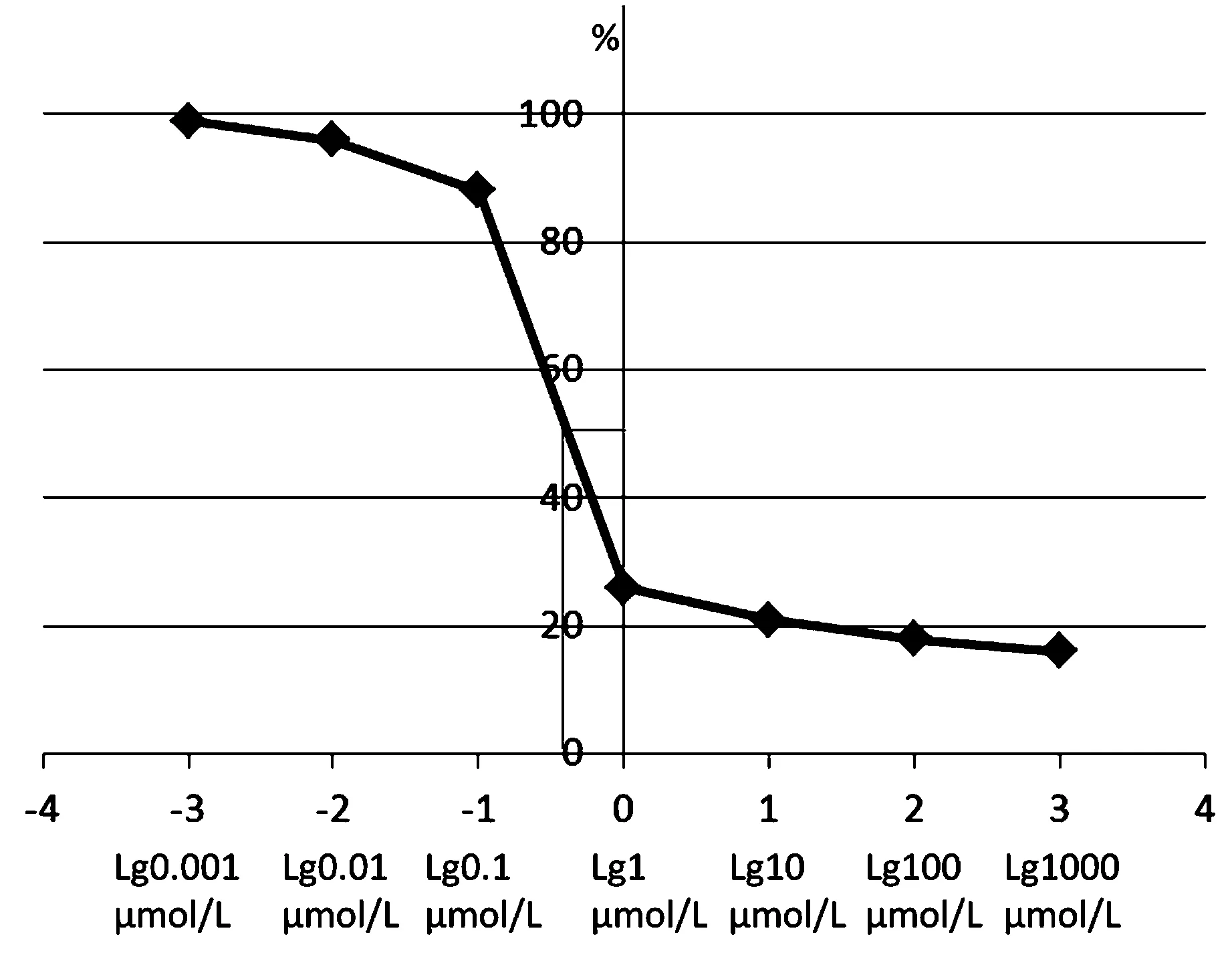
图1 阶梯浓度唑来膦酸对于体外培养OCLs抑制曲线图Fig.1 Characteristic curve of different concentrations of zoledronate suppress osteoclasts in vitro

表1 阶梯浓度唑来膦酸对体外培育OCLs抑制作用比较(Mean ± SEM)Table 1 Comparison of suppressed effects of different concentrations of zoledronate on osteoclasts(Mean ± SEM)
2.2 阶梯浓度伊班膦酸抑制特征分析
伊班膦酸最低有效抑制浓度为10 μmol/L(P<0.05)。但是,各浓度伊班膦酸对破骨细胞附着性影响无明显统计学意义(P>0.05,见表2)。绘制出阶梯浓度伊班膦酸抑制曲线可见:1 μmol/L ~ 10 μmol/L浓度抑制曲线陡降,10 μmol/L为伊班膦酸抑制破骨细胞的“扳机”浓度。但是,随着伊班膦酸浓度梯度进一步增加,对破骨细胞分化形成抑制曲线坡度逐渐减缓,抑制作用仅稍加强(P>0.05,见表2和图2)。50 %有效浓度为5.58 μmol/L。
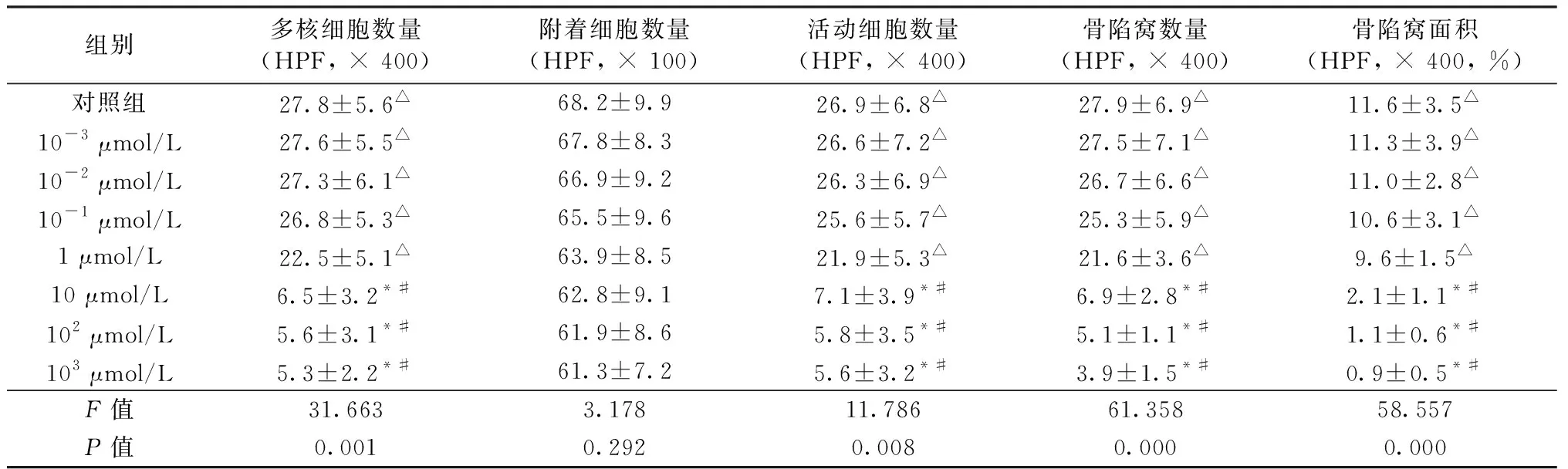
表2 阶梯浓度伊班膦酸对体外培育OCLs抑制作用比较(Mean ± SEM)Table 2 Comparison of suppressed effects of different concentrations of ibandronate on osteoclasts(Mean ± SEM)
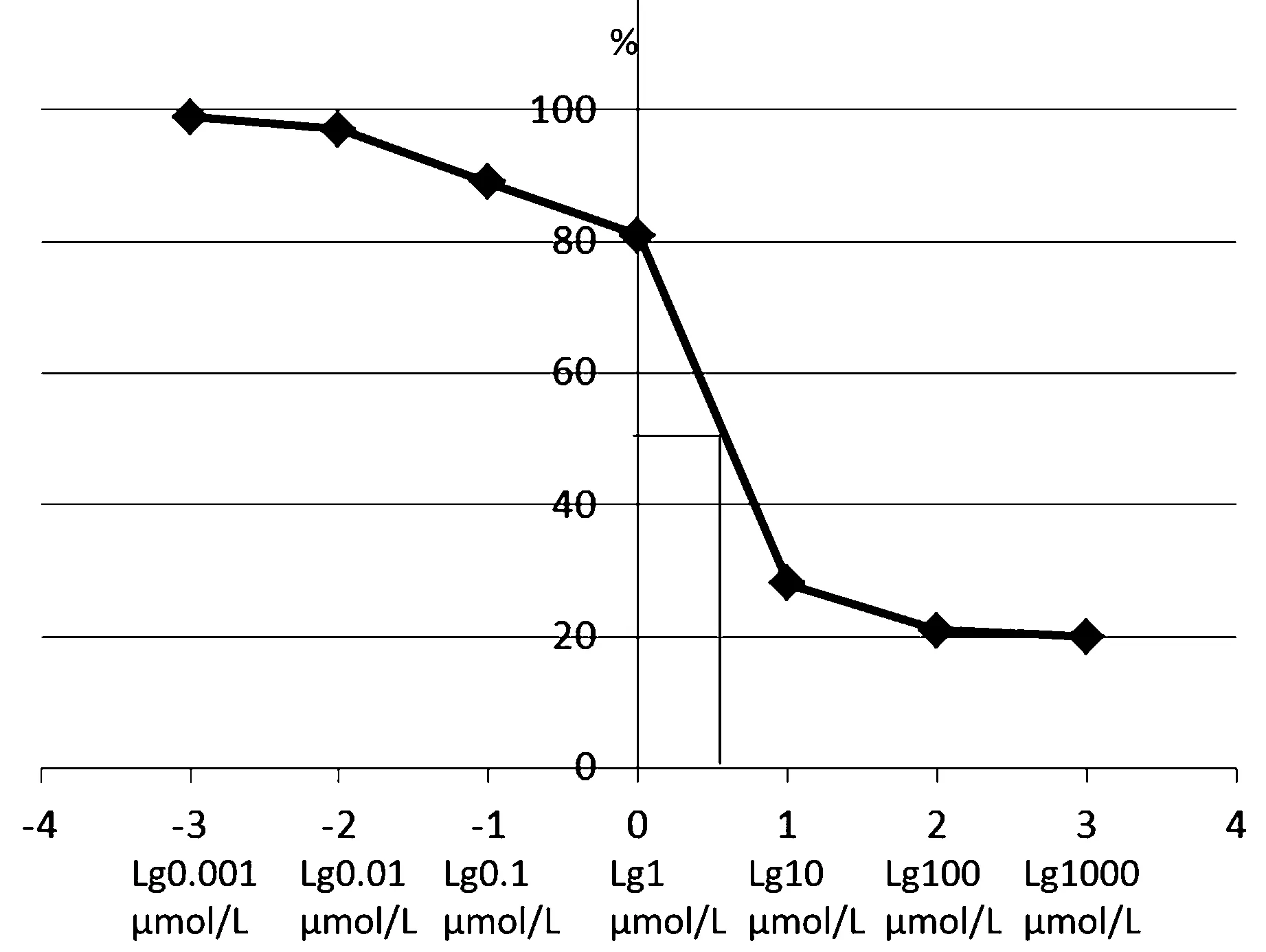
图2 阶梯浓度伊班膦酸对于体外培养OCLs抑制曲线图Fig.2 Characteristic curve of different concentrations of ibandronate suppress osteoclasts in vitro
2.3 阶梯浓度帕米膦酸抑制特征分析
帕米膦酸最低有效抑制浓度为102μmol/L(P<0.05)。但是,与对照组相比,各浓度帕米膦酸对破骨细胞附着性影响无明显统计学意义(P>0.05,见表3)。绘制出阶梯浓度帕米膦酸抑制曲线提示:10 μmol/L ~ 102μmol/L浓度抑制曲线陡降,102μmol/L为帕米膦酸抑制破骨细胞的“扳机”浓度。但是,随着帕米膦酸浓度梯度进一步增加,103μmol/L高浓度下,抑制作用没有出现明显增强(P>0.05,见表3和图3)。其50 %有效浓度为51.9 μmol/L。
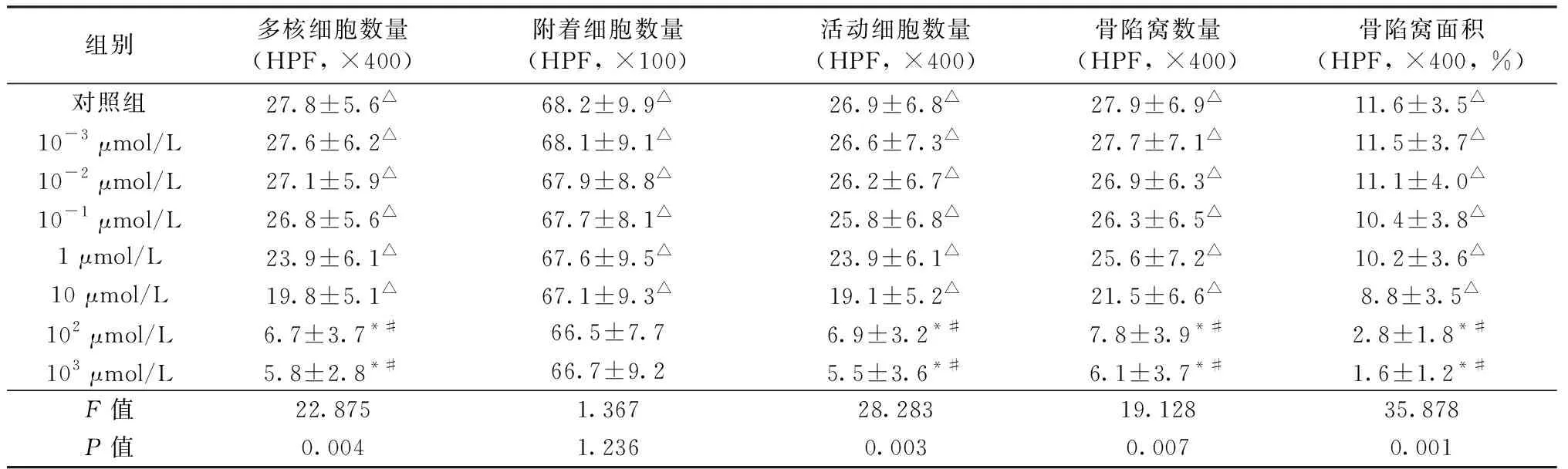
表3 阶梯浓度帕米膦酸对体外培育OCLs抑制作用比较(Mean ± SEM)Table 3 Comparison of suppressed effects of different concentrations of pamidronate on osteoclasts(Mean ± SEM)
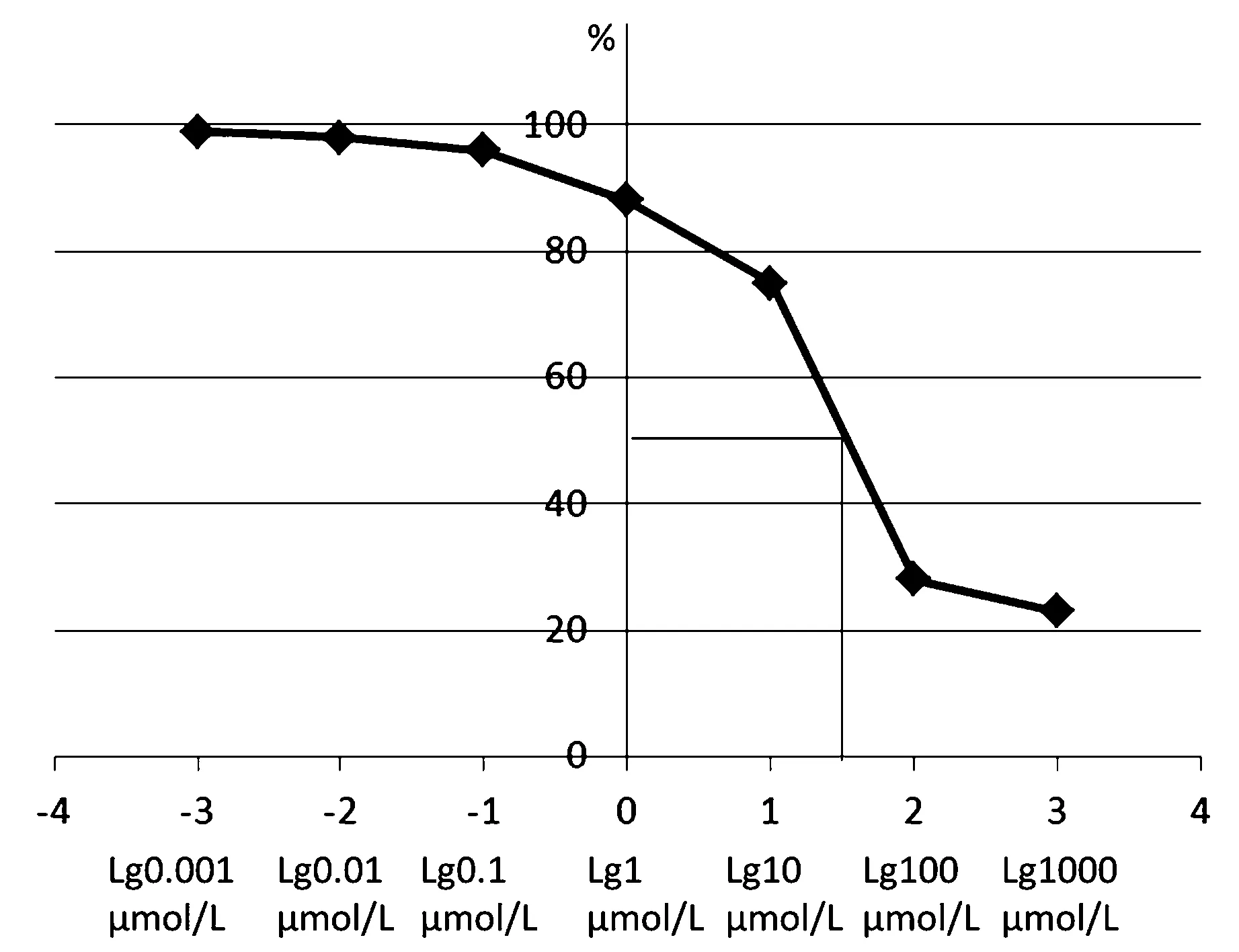
图3 阶梯浓度帕米膦酸对于体外培养OCLs抑制曲线图Fig.3 Characteristic curve of different concentrations of pamidronate suppress osteoclasts in vitro
2.4 唑来膦酸、伊班膦酸与帕米膦酸抑制作用组间比较
基于上述数据,首先针对破骨细胞活性、迁移性以及骨破坏性方面进行组间比较。在10-3、10-2、10-1μmol/L浓度下,三者抑制作用没有明显统计学意义(P>0.05)。对1 μmol/L浓度抑制作用进行组间比较,有显著统计学意义(P<0.05)。唑来膦酸抑制破骨细胞作用明显强于伊班膦酸与帕米膦酸(P<0.05,见图4)。达到10 μmol/L浓度时,唑来膦酸与伊班膦酸比较无统计学意义(P>0.05);而伊班膦酸抑制作用优于帕米膦酸(P<0.05)。在102、103μmol/L高浓度下,三者抑制作用比较没有明显统计学意义(P>0.05)。三种药物“扳机”浓度下进行组间比较没有统计学意义(P>0.05)。其次,在粘附性抑制方面组间比较,各浓度伊班膦酸与帕米膦酸之间均无统计学意义(P>0.05);但是1、10、102、103μmol/L唑来膦酸抑制粘附性作用均明显强于相同浓度伊班膦酸与帕米膦酸(P<0.05)。

图4 1 μmol/L浓度唑来膦酸、伊班膦酸与帕米膦酸对OCLs抑制作用比较Fig.4 Comparison of inhibitory effects of 1 μmol/L zoledronate, ibandronate and pamidronate on OCLs
3 讨论
骨质疏松症是高发性老年疾病,多表现为骨痛。目前老年人胸腰椎骨质疏松性压缩骨折、转子间骨折逐渐多见[6]。因此,需要积极预防及治疗骨质疏松症[7]。双膦酸盐类药物在预防及治疗骨质疏松症的临床方面应用普遍[8]。值得注意的是,双膦酸盐类药物是一把双刃剑,使用过程中存在发热、下颌骨坏死、肾功能损伤等不良反应[9]。如何发挥其最大药效,同时降低不良反应发生率具有重要研究意义[10]。因此,本研究对三种药物预防及治疗骨质疏松症的方法、疗程、用量及其对于破骨细胞抑制作用特点进行详细分析并阐述。
高浓度伊班膦酸可有效抑制破骨细胞,阻止骨质破坏[11]。这种作用亦随着双膦酸盐类药物使用剂量的增大而增加[12]。但是,应用同样高浓度的双膦酸盐类药物-唑来膦酸治疗,不会进一步提高疗效,反而引起严重药物不良反应[13]。课题组深入分析发现,唑来膦酸、伊班膦酸、帕米膦酸抑制破骨细胞的作用特征明显不同。首先,实验发现1 μmol/L为唑来膦酸最低有效抑制浓度,随着梯度浓度进一步增加,在10、102、103μmol/L并未出现抑制作用明显增强。证明大剂量应用唑来膦酸后,未能再进一步提高临床疗效。而血浆高浓度唑来膦酸却可能引起明显不良反应,产生发热、关节疼痛以及肾功能损伤等症状及临床表现。提示临床用药量需要结合临床实际,针对不同疾病、病情及患者肝肾功能等实际情况,合理用药。
2018年,FDA与加拿大卫生部公布在唑来膦酸治疗中出现下颌骨坏死症状以及具有导致肾功能衰竭的风险。因此,关于如何避免双膦酸盐类药物不良反应的研究被提上日程[14-16]。本研究发现唑来膦酸临床应用剂量已经超过其最低有效剂量。同时,国外学者[17]提示临床应用4 mg、5 mg甚至8 mg唑来膦酸可能引起下颌骨坏死及肾功能衰竭等严重并发症。为避免唑来膦酸带来的严重不良反应,建议临床应用尽量不超过4 mg。大剂量使用将导致体内药物浓度增加,增加肾脏清除负担,影响正常骨骼代谢。必须通过改变唑来膦酸的使用方法、调整单次应用剂量、适当延长间隔时间来降低及避免其不良反应的发生。同时,关于伊班膦酸及帕米膦酸应用的研究被再次提上日程[18-19]。伊班膦酸的肾损害风险、颌骨坏死风险及流感样症状发生率均远低于唑来膦酸[20-21]。与唑来膦酸及伊班膦酸比较,帕米膦酸抑制破骨细胞能力较弱,其优点是不良反应较轻且短暂,可以应用于肝功能轻度损伤患者,但是对于肾功能损害患者则需要酌情减少使用剂量。
综上所述,随着唑来膦酸应用剂量的增大,其药效并不能够明显增强。适当减少使用剂量,不良反应可以降低,而对治疗效果的影响却不明显。在某种程度上,伊班膦酸、帕米膦酸可以替代唑来膦酸,达到有效治疗骨质疏松症的作用。临床工作中可以依据三者抑制特征以及患者身体情况,制定个性化的抗骨质疏松症治疗方案。
