lncRNA ANCR调节骨质疏松大鼠脂肪源性干细胞分化成骨细胞及对Wnt信号通路的作用机制
2021-10-08史正亮张华范志勇宋永周李身泰李秋童马维
史正亮 张华 范志勇 宋永周 李身泰 李秋童 马维
河北医科大学第二医院,河北 石家庄 050000
骨质疏松症(osteoporosis, OP)是中老年群体常见的疾病。对于老年性骨质疏松症,主要是由于老年群体随着年龄的增长,骨骼中单位体积的骨量减少,质量改变,使得骨密度下降[1-2]。脂肪源性干细胞(ADSCs)是一种间充质干细胞,能够从脂肪组织中分离得到。近代研究[3-4]发现,ADSCs与骨髓间充质干细胞(BMSCs)的形态、作用均较为相近,且ADSCs的提取较为简单。因此,临床研究人员欲将ADSCs作为治疗疾病的细胞来源,用作分化成骨细胞、脂肪细胞等多种细胞,从而应用于临床治疗。LncRNA可以调节染色体结构、基因表达,并在人类疾病的发展过程中占有关键地位,目前它们被定位为多种疾病的潜在生物标志物[4]。分化拮抗非蛋白质编码RNA(ANCR)是一种与众多疾病相关的lncRNA[5]。研究[6]发现,ANCR在多种疾病中异常表达,且发现ANCR在人骨髓间充质干细胞成骨分化过程中发挥着核心调节作用,但有关LncRNA ANCR对ADSCs向成骨分化的影响作用研究较少。Wnt信号通路在动物间存在遗传学上的高度保守性,不同的物种间很相似,但又不相同[7],Wnt通路是Wnt基因调控的重要信号之一,Wnt基因在多种疾病及细胞中均有明显表达,但Wnt信号通路在LncRNA ANCR调控ADSCs成骨分化的作用效果还未可知[8]。因此,本研究将对lncRNA ANCR调节骨质疏松大鼠脂肪源性干细胞分化成骨细胞及对Wnt信号通路的作用机制展开探讨。
1 材料和方法
1.1 试验材料
选取河北省动物实验中心的雄性SD大鼠,常规饲养,每日给予大鼠70 mg/kg维甲酸灌胃处理,连续灌胃2周,采用X射线骨密度仪检测大鼠前股骨骨密度,根据骨密度值以确定大鼠模型建立成功[9],剔除造模失败的大鼠。维甲酸购自广州阿达拉生物科技公司;苏木精购自宝鸡市辰光生物公司;胎牛血清购自上海传秋;兔抗人BMP-2抗体购自上海北诺。
1.2 方法
1.2.1脂肪源性干细胞原代培养:无菌条件下切取OP大鼠双侧腹股沟的脂肪垫,剪碎至糊状,常规培养。接种在细胞培养瓶中,将原代干细胞在DMEM培育液中培养,保存于-80 ℃环境中。
1.2.2细胞转染及分组:将lncRNA ANCR siRNA 慢病毒载体及空载体慢病毒各30 pmol制备成复合物,按说明书操作与浓度为2×105/mL的细胞转染24 h,更换培养基,培养48 h。共分为三组,siRNA组、空载体组和干细胞组。采用RT-PCR法检测LncRNA ANCR是否转染成功。
1.2.3RT-PCR法:把保存在- 80 ℃环境中脂肪源性干细胞取出,研磨细胞,提取总RNA,进行逆转录。所有反应严格按照反应的条件进行扩增,内参采用GAPDH,95 ℃预变性3 min ,95 ℃变性5 s,60 ℃退火1 min,共进行40次。取得平均值后得到Ct值,计算方法用2-△△Ct法进行分析。

表1 引物序列Table 1 Primer sequence
1.2.4碱性磷酸酶染色法:将细胞平铺至6孔板中诱导培养至第7天,制备碱性磷酸酶染色液进行染色。去除多余培养基,PBS液冲洗3次,每次1 min。加入1 mL碱性磷酸酶染色工作液,摇匀并确保充分覆盖。常温下避光孵育60 min。除去染色液,PBS液冲洗2次,最后置于显微镜下观察成骨染色效果,并拍摄记录。
1.2.5茜素红染色实验:将细胞诱导培养至第21天,制备茜素红进行染色。步骤与1.2.4相同,每孔加入2 mL 4 %多聚甲醛溶液,固定30 min。冲洗后加入2 mL茜素红染液染5 min。除去染液,PBS冲洗3次,显微镜下观察成骨染色效果,并拍摄记录。
1.2.6免疫组化法:细胞常规脱蜡、水化,加阻断过氧化物酶,PBS 漂洗。加一抗Wnt(1∶400)、β-catenin(1∶600),孵育,漂洗,加二抗,重复以上步骤。甩干后滴加 DBA显色剂、苏木精,脱水、透明、封片,5 min内测量OD值;绘制标准曲线,计算阳性的表达量。
1.2.7Western blot法:将脂肪源性干细胞进行裂解并提取核蛋白,并对核蛋白的浓度进行测量,分装后,保存在- 20 ℃的环境中。将提取出的蛋白溶液和缓冲溶液按照4∶1的比例进行混均,然后将蛋白溶液全部进行煮沸处置,使其变性。蛋白加脱脂奶粉放PVDF膜上,加入1抗(Wnt,1∶400;β-catenin,1∶600;内参为GAPDH),TTBS漂洗3次,加2抗,封闭1 h。TTBS漂洗,DAB显色,拍照。
1.3 统计学处理
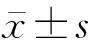
2 结果
2.1 原代培养细胞
原代培养的脂肪干细胞24 h即可见细胞贴壁,多数贴壁细胞呈小圆形,其中散在少量的梭形细胞或多角细胞。见图1。

图1 原代细胞观察(三代,400×,20 μm)Fig.1 Observation of primary cells
2.2 RT-PCR法检测LncRNA ANCR表达量
结果显示,siRNA组、空载体组、干细胞组细胞LncRNA ANCR表达量分别为0.38±0.07、0.79±0.10、0.80±0.11,siRNA组细胞内的LncRNA ANCR表达量最低。与空载体组、干细胞组相比较,siRNA组细胞LncRNA ANCR表达量显著下降(P均<0.05);空载体组、干细胞组相比较,两组细胞中LncRNA ANCR表达量相近,无显著差异(P>0.05),说明LncRNA ANCR转染成功。见图2。

注:与siRNA组比较,aP<0.05。图2 各组细胞中LncRNA ANCR表达量Fig.2 LncRNA ANCR expression in each group of cells
2.3 碱性磷酸酶染色观察ALP 染色效果
由图3可知,siRNA组细胞中ALP 染色最深,siRNA组与空载体组、干细胞组相比较,siRNA组细胞中ALP 染色显著加深(P均<0.05);空载体组、干细胞组相比较,两组细胞中ALP 表达水平相近(P>0.05)。
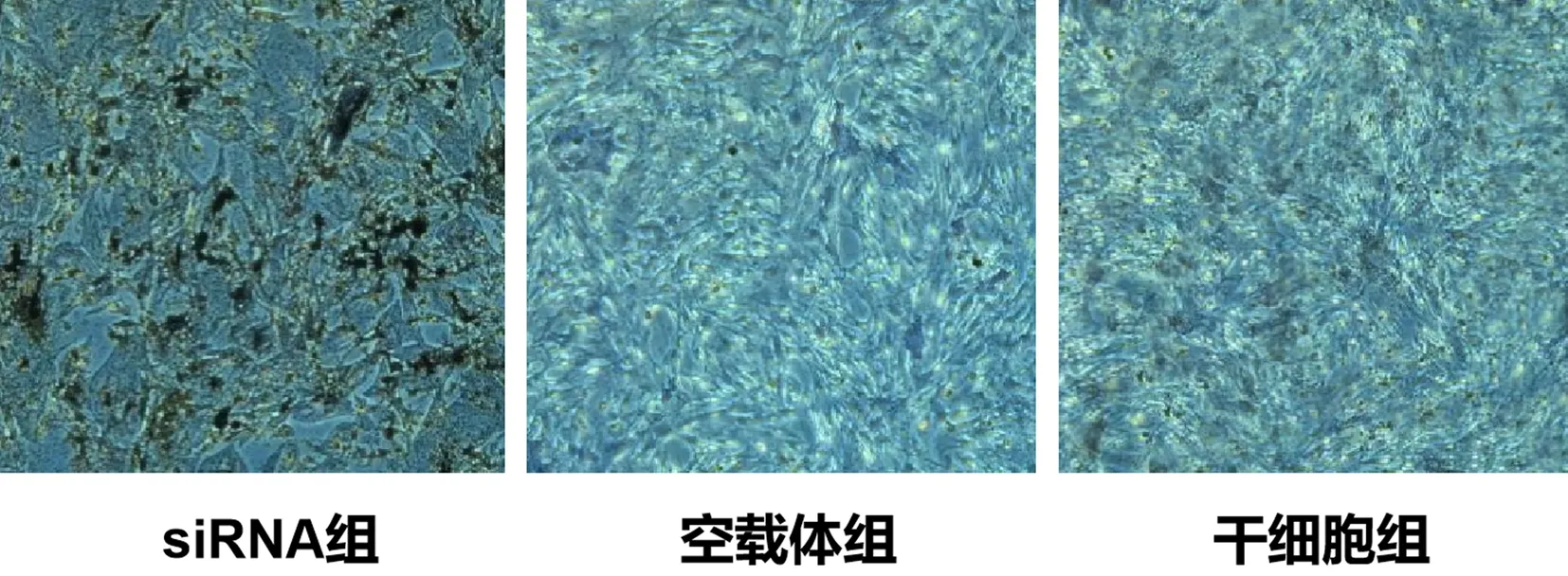
图3 各组细胞ALP 染色情况(400×,20 μm)Fig.3 ALP staining of cells in each group
2.4 茜素红染色实验检测成骨染色效果
siRNA组细胞中深红色最重,siRNA组与空载体组、干细胞组相比较,siRNA组细胞中深红色显著加深(P均<0.05);空载体组、干细胞组相比较,两组细胞中颜色相近(P>0.05)。见图4。
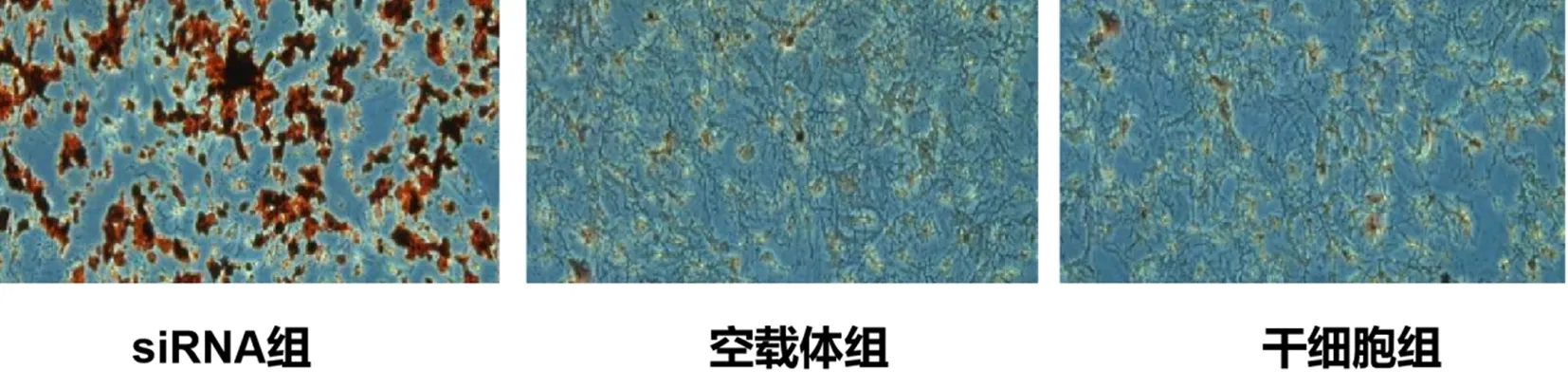
图4 各组细胞骨染色效果(400×,20 μm)Fig.4 Bone staining effect of each group of cells
2.5 Western blot法检测Wnt/β-catenin及其磷酸化蛋白水平
检测结果显示,siRNA组、空载体组、干细胞组细胞中Wnt蛋白水平分别为0.88±0.12、0.47±0.09、0.48±0.10,p-β-catenin蛋白水平分别为0.75±0.11、0.35±0.08、0.34±0.09,siRNA组细胞中Wnt/β-catenin及其磷酸化蛋白表达最高。与空载体组、干细胞组相比较,siRNA组细胞Wnt/β-catenin及其磷酸化蛋白表达显著上升(P均<0.05);空载体组、干细胞组相比较,细胞中蛋白水平相近(P>0.05)。见图5。
注:A:各组细胞中Wnt/β-catenin蛋白水平;B:各组细胞中Wnt/β-catenin蛋白表达比值;C:各组细胞中phospho-β-catenin蛋白表达比值;与siRNA组比较,aP<0.05。图5 各组细胞中Wnt/β-catenin蛋白水平Fig.5 Wnt/β-catenin protein levels in cells of each group
2.6 免疫组化法检测Wnt/β-catenin信号阳性表达
siRNA组细胞中Wnt/β-catenin阳性数最高,与空载体组、干细胞组相比较,siRNA组细胞Wnt/β-catenin阳性数显著升高(P均<0.05);空载体组、干细胞组相比较,两组细胞中Wnt/β-catenin阳性数相近,无显著差异(P>0.05)。见图6、图7。

图6 Wnt/β-catenin蛋白阳性表达(400×)Fig.6 Positive expression of Wnt/β-catenin protein (400×)
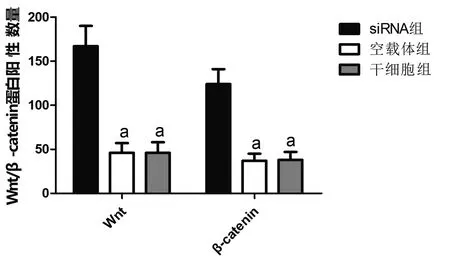
注:与siRNA组比较,aP<0.05。图7 Wnt/β-catenin蛋白阳性数量Fig.7 Number of Wnt/β-catenin protein positive
3 讨论
ADSCs在细胞的形态、表型及其多向分化潜能等方面与BMMSCs功能十分相似,但是ADSCs有其更为显著的优点,具体为取材相对方便、给患者带来的创伤小、来源相对充足等,因此ADSCs成为了现在一个非常重要的研究热点[10-11]。对细胞进行研究发现,传数代后衰老和死亡的细胞占有相对较小的比例。ADSCs可以被用来修复或者是重建很多种组织细胞,例如软骨组织、肺、脑及肝脏[12]。分化拮抗非蛋白质编码RNA(ANCR)在人体多种疾病中异常表达,但在一些终末分化细胞中的表达水平却显著降低,例如角质、成骨、脂肪等细胞。这一现象表明,lncRNA ANCR在终末分化细胞的分化、形成过程中占有重要地位[13]。研究显示,lncRNA ANCR在BMSCs、hFOBl19等细胞中的表达升高也证明了lncRNA ANCR高表达对终末分化细胞具有拮抗作用,但在滑膜组织干细胞的生成过程中lncRNA ANCR却产生促进作用,说明lncRNA ANCR在干细胞的分化中发挥不同的调控作用[14-15]。但lncRNA ANCR在ADSC向成骨细胞分化中的作用还未见报道。因此,本研究采用ANCR干预骨质疏松大鼠的脂肪源性干细胞向成骨分化,开展进一步的探讨。
已有研究报道,lncRNA ANCR在不同组织来源的干细胞分化过程中发挥重要的作用。lncRNA ANCR的敲减可以同时促进DPSCs、aSCAPs、PDLSCs等细胞的定向分化[16]。Xie等[17]发现,lncRNA ANCR在人hBMSC成骨分化过程中发挥重要作用。本研究结果显示,siRNA组与空载体组、干细胞组相比较,siRNA组细胞中ALP 染色显著加深、深红色显著加深;空载体组、干细胞组相比较,ALP 表达水平无显著差异。表明lncRNA ANCR的表达水平能够对ADSCs的分化起明显干预作用,lncRNA ANCR表达升高会显著抑制ADSCs向成骨分化的速度,其具体作用原理可能与细胞中Wnt/β-catenin的水平有关。研究显示[18],在lncRNA ANCR参与ADSCs成骨分化过程中,lncRNA ANCR可根据其细胞核内外不同的定位发挥不同的功能,主要包括海绵作用(lncRNA ANCR作用于miRNA后,减弱miRNA对靶基因mRNA表达的抑制作用)、靶向衔接作用(lncRNA ANCR可使相关转录信号因子的表达减少),进而发挥不同或者相反的生物学作用。张传志等[19]指出lncRNA ANCR过表达能够抑制骨髓间充质干细胞的成骨分化。前期临床研究表明[20],ADSCs可以逐步分化为成骨细胞,预防卵巢切除诱导的骨流失与骨质疏松疾病。ADSCs成骨分化条件及外在影响方面主要影响了成骨细胞活性和骨形成,并且还与骨吸收有关。lncRNA ANCR空载体内不含有siRNA,当空载体转染至其他细胞中时,siRNA不进行复制繁殖,因此,lncRNA ANCR空载体对细胞分裂及分化无任何影响。研究表明[21],脂肪源干细胞向成骨细胞分化的过程共分为三个阶段,其中,基质成熟期和矿化形成期是较为重要的阶段。在基质成熟期细胞中能够提升BMP2和ALP的表达,对ALP进行染色检测后表明,ALP表达水平与成骨细胞分化的速率存在正相关关系,即ALP表达水平越高,成骨细胞分化率越高。在成骨诱导过程中,敲减lncRNA ANCR后,ADSCs成骨分化会发生明显的钙化,其中钙结节的沉积显著增加,间接促进成骨细胞的生成[22]。
本研究发现,与空载体组、干细胞组相比较,siRNA组细胞Wnt/β-catenin阳性数及其蛋白表达显著升高,空载体组、干细胞组相比较无显著差异,说明抑制lncRNA ANCR的表达可提高Wnt/β-catenin的活性。Wnt信号最早发现于乳腺癌小鼠细胞内,是一种起始糖蛋白。作为一条高度保守的信号通路,其异常激活能够调节多种细胞的生物活性,对成骨细胞的分化有正向促进作用。Wnt信号作用的发挥主要通过其下游的调节蛋白β-catenin累积游离至细胞核中,与转录因子结合,对核内mRNA表达进行调节、启动实现。研究表明[23],lncRNA影响干细胞分化的作用方式有很多,可以通过转录因子激活或抑制靶基因的表达,例如:lncRNA-MEG3可以通过与Wnt/β-catenin的相互作用来促进BMP-2的转录,从而促进脂肪源性干细胞的成骨分化。Li等[24]的研究显示,ADSCs成骨分化后,其细胞中Wnt/β-catenin的水平出现显著变化,表明Wnt/β-catenin信号在ADSCs成骨分化过程中占有关键地位。王维等[25]的试验结果表明,lncRNA ANCR可以调控经典的Wnt/β-catenin通路,从而调节与成骨分化相关的转录调控因子,最终影响脂肪间充质干细胞成骨分化[22]。
综上所述,lncRNA ANCR的表达水平与骨质疏松大鼠体内脂肪源性干细胞的分化存在显著相关性,lncRNA ANCR能够促进脂肪源性干细胞向成骨细胞分化,lncRNA ANCR作用于脂肪源性干细胞向成骨细胞分化可能与调控Wnt/β-catenin的表达有关。
