不同溶解氧水平对青海湖裸鲤肝组织结构及抗氧化酶活性的影响
2021-10-08陈付菊多杰当智付生云赵宇田
陈付菊,多杰当智,付生云,马 敏,赵宇田,常 兰
(1.青海大学农牧学院,西宁 810016;2.青海省裸鲤救助中心,西宁 81003)
水体中溶解氧(DO)作为水生动物有氧代谢的重要限制因子,影响水生动物的生长、发育、代谢和行为、抗氧化等生命活动[1-3]。然而水体的DO含量由于物理、化学或生物等因素的影响而呈现出一定的波动性(4.0~7.4 mg/L)[4]。鱼类暴露在低氧环境后,因活性氧自由基(reactive oxygen species,ROS)过量产生,会造成缺氧应激损伤。为此,鱼类在漫长的进化过程中形成了独特的适应策略来应对不同的溶解氧水环境。
线粒体是细胞利用氧并产生三磷酸腺苷(ATP)的主要场所,也是细胞内产生ROS的重要细胞器[5]。在生理状态下,因生物体内存在完整的抗氧化系统如超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)和过氧化氢酶(catalase,CAT)等,这些酶在清除过量ROS的过程中发挥重要的作用[6]。当线粒体受到损伤时,线粒体呼吸链电子传递功能异常,进而使线粒体产生过量的ROS[7],从而影响抗氧化系统与生物膜的脂质过氧化,进而诱导机体组织氧化应激损伤[8]。
青海湖裸鲤(Gymnocyprisprzewalskii)俗称“湟鱼”,属鲤形目鲤科裂腹鱼亚科,是青海湖中唯一的经济鱼类,属国家二类保护珍贵鱼类。作为青藏高原上代表性的土著鱼类,长期生活在高海拔的低氧环境中(海拔3 200 m)。正如其他裂腹鱼亚科鱼类一样,青海湖裸鲤对水体环境DO波动(3.0~8.5 mg/L)表现出极强的习服特性。以往对青海湖裸鲤的研究多集中于繁殖特性[9-10]、盐度适应特性[11-12]及生物学特性[13]等方面,仅见低氧胁迫对青海湖裸鲤鳃[14]和体肾组织结构的影响。肝作为鱼体内最大的腺体,在能量代谢、解毒、凝血等方面起着非常重要的作用[15]。肝脏受损往往会影响机体内代谢、解毒、排泄等生命活动的正常进行[16]。陈世喜等[17]和杨明等[18]发现,低氧胁迫使卵形鲳鲹(Trachinotusovatus)和日本沼虾(Macrobrachiumnipponense)肝组织结构损伤,提示肝组织对低氧敏感,但低氧对青海湖裸鲤肝组织结构和抗氧化酶活性影响未见有报道。因此,本研究以青海湖裸鲤肝组织为研究对象,分析不同DO水平对青海湖裸鲤肝组织结构、线粒体超微结构及抗氧化酶活性的影响,以期探讨青海湖裸鲤的低氧适应能力,为青海湖裸鲤的资源保护提供参考依据。
1 材料与方法
1.1 试验动物
青海湖裸鲤120尾取自青海湖黑马河,体长(24.11±0.12) cm,体重(97.68±0.12) g,正式实验前在实验室暂养1周。
1.2 主要试剂与仪器
丙二醛(MDA)测定试剂盒(A003-1)、过氧化氢(H2O2)测定试剂盒(A064-1)、超氧化物歧化酶(SOD)测定试剂盒(A001-3)、谷胱甘肽过氧化物(GPX)测定试剂盒(A005-1)和总蛋白测定试剂盒(A045-2)均购自南京建成生物工程研究所;组织线粒体分离试剂盒(C3606)、JC-1线粒体膜电位检测试剂盒(C2006)、Bradford蛋白浓度试剂盒(P0006C)、苏木精-伊红染色试剂盒(C0105M)、二甲苯、乙醇均购自中国碧云天生物公司;詹纳斯绿B(J8020)购自北京索莱宝科技有限公司。
石蜡组织切片机(型号为LEICA RM2235)、生物组织包埋机和冷冻台(型号为BMJ-1B)、展片机(型号为ZPJ-1A)、烤片机(型号为KPJ-1A),均购自天津天利航空机电有限公司;电子天平(型号为BSA 1245 sartorius),购自金坛市富华仪器有限公司;显微镜(型号为NIKON H600 L),购于北京瑞科中仪科技有限公司;多功能酶标仪(SpectraMax M5),购自美谷分子仪器(上海)有限公司。
1.3 实验设计
暂养时将120尾青海湖裸鲤随机分配在3个500 L的塑料桶中,每日投喂人工配合饵料1次(青海湖裸鲤救助中心提供),每日9:00和17:00分别使用DO为(8.4±0.1) mg/L曝气自来水换水一次,每次换水量约为养殖水体的1/4。暂养期间采用空气泵连续增氧,使水体DO维持在(8.4±0.1) mg/L,即常氧组,水温为(14.5±0.7) ℃,正式实验前1天停止进食。
实验设重度低氧组、中度低氧组和常氧组,每组设置3个平行,将暂养的实验鱼随机分至装有120 L曝气自来水的顶部覆盖塑料膜的9个自制水族箱中,每个低氧组水族箱中15尾实验鱼,每个常氧组水族箱中10尾实验鱼。随后往低氧组水族箱中注入氮气,重度低氧组在1 h内将水体DO降至(0.7±0.1) mg/L;中度低氧组在1 h内将水体DO降至(3.0±0.1) mg/L。维持低氧处理24 h,并分别在8 h和24 h时采集样本。低氧胁迫期间水温为(14.5±0.7) ℃,调节氮气和空气的注入流量来控制水中的DO水平,并利用AZ8402溶解氧测定仪定期监控水体DO浓度。
1.4 样品采集
在低氧胁迫8 h时将裸鲤用MS-222溶液麻醉,迅速解剖后取肝脏,用生理盐水冲洗,提取线粒体并检测膜电位(8 尾/组);4%多聚甲醛缓冲液(pH=7.4)固定用于肝组织显微结构的观察(4 尾/组);2.5%戊二醛固定用于肝组织超微结构的观察(4 尾/组);液氮储存用于肝组织酶活性的检测(8 尾/组)。
1.5 肝组织显微结构的观察
将4%多聚甲醛固定液固定24 h后的肝组织,经50%、75%、85%、95%、100%的梯度酒精逐级脱水2 h后,二甲苯透明30 min,浸蜡、包埋,用切片机连续切片(厚度6 μm),展片机展片,烤片机烤片,二甲苯脱蜡,梯度酒精复水,苏木精-伊红(H·E)染色,盐酸酒精分色,自来水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察并拍照。
1.6 肝组织线粒体超微结构的观察
将2.5%戊二醛固定的肝组织,用0.1 mol/L磷酸缓冲液(pH=7.4)洗涤3次,每次5 min;1%四氧化锇固定1 h,30%、50%、70%、80%、95%、100%梯度酒精脱水15 min,100%环氧丙烷包埋3 次,每次5 min; 环氧丙烷:包埋液(2∶1)室温2 h,环氧丙烷:包埋液(1∶2)室温3 h, 纯包埋液室温过夜。然后用牙签挑出样品,于包埋板上包埋; 包埋板放于60 ℃烘箱 48 h,待树脂完全聚合后,取出包埋块备用; 树脂块于超薄切片机半薄切片定位,根据定位情况进行修块后,对所需位置进行超薄切片,切片厚度70 nm,铜网捞片;3%醋酸铀饱和酒精溶液染色8 min;70%酒精清洗3次,超纯水清洗3次;2.7%枸橼酸铅溶液染色8 min;超纯水清洗3次,滤纸稍吸干后透射电子显微镜下观察并拍照。
1.7 肝组织抗氧化酶活性的测定
将-80 ℃保存的肝组织在冰上解冻,称取适量的样品,按照质量∶体积=1∶9向样品中加入预冷的生理盐水,在冰上进行匀浆。随后将匀浆液用冷冻离心机在4 ℃条件下离心10 min(2 500 r/min),取上清液,检测样品总蛋白浓度,-80 ℃暂存待用。
样品总蛋白浓度、SOD、T-AOC、GPX活性及MDA、H2O2含量的测定均按试剂盒说明书进行操作。
1.8 肝组织线粒体分离和线粒体膜电位的检测
取新鲜的肝组织约90 mg,放入预冷的离心管中,并用预冷的小剪刀剪碎,随后向离心管内加入900 μL预冷的分离液A,用预冷的玻璃匀浆器手动上下匀浆10次,用冷冻离心机在4 ℃条件下离心5 min(600 r/min),取上清液,用冷冻离心机在4 ℃条件下离心10 min(11 000 r/min),小心弃去上清液,加入预冷的线粒体储存液,混匀后用詹纳斯绿B检测线粒体活性,并测定蛋白浓度。线粒体膜电位的检测按试剂盒说明书进行操作。
1.9 统计分析
结果均采用平均值±标准误(mean±SE)表示,采用SPSS 17.0软件对实验数据进行单因素方差分析,同一时间点不同DO浓度组间及同一DO浓度组不同时间点间的数据用Duncan检验多重比较,以P<0.05表示差异显著。
2 结果
2.1 不同DO水平对青海湖裸鲤肝组织显微结构的影响
光学显微镜下青海湖裸鲤常氧组肝细胞胞质均匀,细胞核清晰,位于肝细胞中央,肝血窦狭窄,内有红细胞,肝细胞内可见大小不一的脂肪滴。常氧8 h和24 h间肝组织显微结构无明显差异(图1-A,1-D)。中度低氧胁迫8 h和24 h时肝血窦扩张,血窦内红细胞数量增多(图1-B,1-E)。重度低氧胁迫8 h时肝血窦扩张明显,血窦内红细胞数量增多,肝细胞出现空泡(图1-C);重度低氧胁迫24 h时肝血窦扩张,血窦内红细胞数量增多,肝细胞空泡变性加剧(图1-F)。
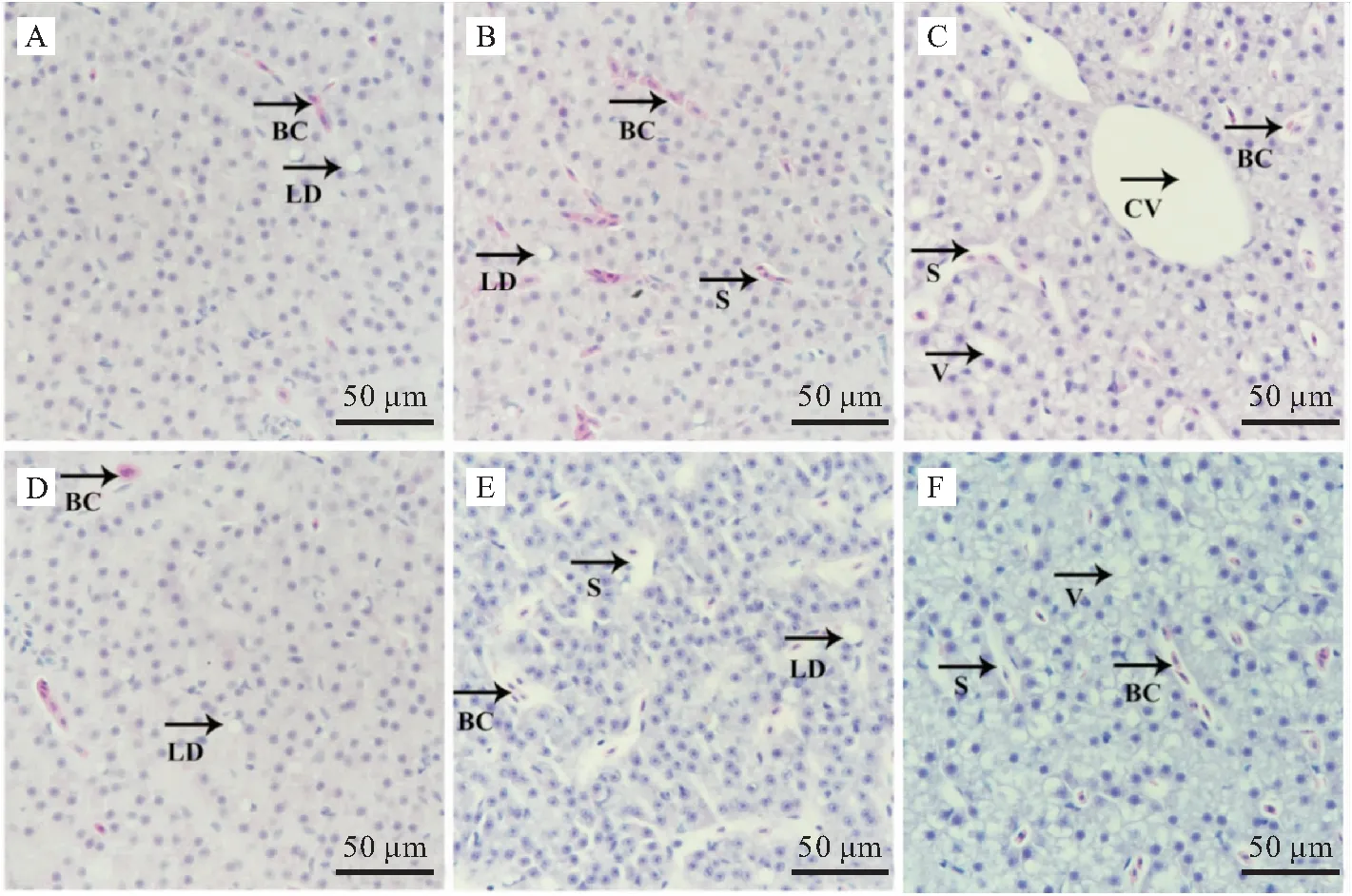
图1 低氧胁迫后青海湖裸鲤肝组织的显微结构(苏木精-伊红染色)
2.2 不同DO水平对青海湖裸鲤肝线粒体超微结构的影响
透射电镜下青海湖裸鲤常氧组肝线粒体多呈圆形,有的则近椭圆状,数量多,内有嵴,线粒体膜完整,电子密度高。常氧8 h和24 h间肝线粒体超微结构无差异(图2-A,2-D)。中度低氧胁迫8 h时线粒体多呈圆形和椭圆形,线粒体形态正常,线粒体膜完整(图2-B);中度低氧胁迫24 h时除圆形线粒体外,观察到杆状线粒体,线粒体膜完整,线粒体间出现少量空泡(图2-E)。重度低氧胁迫8 h时线粒体以椭圆形和杆状居多,线粒体膜完整,线粒体间空泡明显(图2-C);重度低氧胁迫24 h时线粒体多呈圆形、椭圆形,偶见杆状线粒体,线粒体数量减少,部分线粒体出现空泡化,线粒体间空泡化严重(图2-F)。
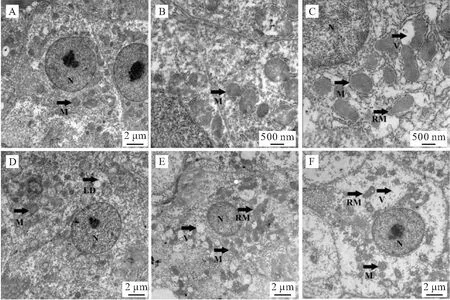
图2 低氧胁迫后青海湖裸鲤肝组织超微结构(透射电镜)
2.3 不同DO水平对青海湖裸鲤肝组织线粒体膜电位的影响
如图3所示,中度低氧胁迫8 h和24 h时肝组织线粒体绿色荧光与红色荧光强度比值降低,但中度低氧8 h和中度低氧24 h间差异不显著。重度低氧8 h和24 h时肝组织线粒体绿色荧光与红色荧光强度比值增加,但重度低氧8 h和重度低氧24 h间差异不显著,表明中度低氧胁迫使肝组织线粒体膜电位升高,重度低氧胁迫使肝组织线粒体膜电位降低。
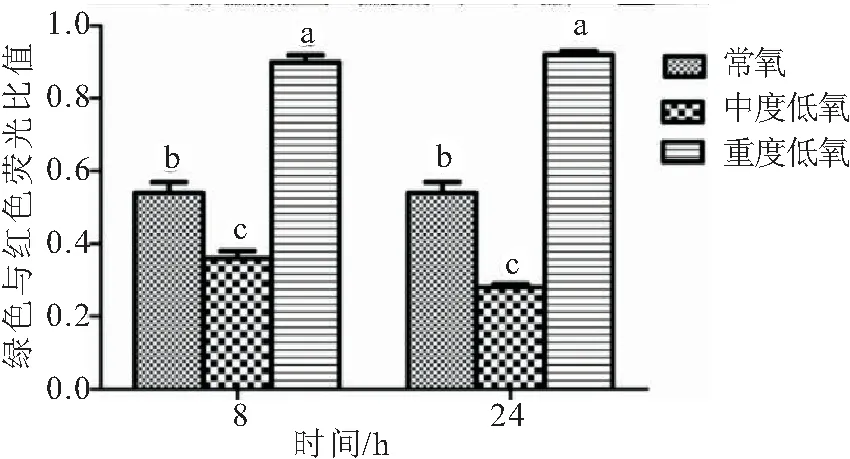
图3 不同DO水平下青海湖裸鲤肝线粒体膜电位的变化
2.4 不同DO水平对青海湖裸鲤肝组织氧化和抗氧化指标的影响
青海湖裸鲤肝组织氧化和抗氧化酶活性结果见图4。中度和重度低氧胁迫使青海湖裸鲤肝组织H2O2含量持续增加,但中度低氧8 h时H2O2含量与常氧组间差异不显著,且中度低氧8 h和中度低氧24 h间及重度低氧8 h和重度低氧24 h间H2O2含量差异不显著。中度低氧使肝组织MDA含量呈先增加后降低的趋势,但与常氧组差异不显著;重度低氧胁迫使肝组织MDA含量持续增加,但重度低氧8 h和重度低氧24 h间差异不显著。

图4 不同DO水平下青海湖裸鲤肝组织H2O2(A)、MDA(B)、GPX(C)、SOD(D)和T-AOC(E)活性的变化
中度和重度低氧使肝组织GPX活性持续增加,但中度低氧8 h和中度低氧24 h间及重度低氧8 h和重度低氧24 h间GPX差异不显著。中度和重度低氧使肝组织SOD活性呈增加趋势,但与常氧组间差异不显著。中度低氧使肝组织T-AOC持续增加,但中度低氧8 h和中度低氧24 h间差异不显著,重度低氧使肝组织T-AOC呈先增加后降低趋势,但均高于常氧组。
3 讨论
3.1 不同DO水平对青海湖裸鲤肝组织显微结构的影响
陈世喜等[19]研究发现,急性和慢性低氧(1.55±0.20 mg/L)使卵形鲳鲹(Trachinotusovatus)肝细胞出现空泡、局部坏死、肝线粒体数量减少等变化。马毅等[20]对大鼠(Rattusnorvegicus)无心跳供体热缺血损伤后肝组织超微结构的研究发现,肝细胞的空泡变性与线粒体肿胀、内质网扩张和糖原的吸收有关。杨明等[18]研究显示,急性低氧(2.0±0.2) mg/L胁迫使日本沼虾(Macrobrachiumnipponense)肝组织结构损伤。本研究中,中度低氧对肝组织显微结构影响不明显。重度低氧使肝细胞出现空泡化,且随低氧胁迫时间的延长空泡化加剧,表明重度低氧造成肝组织结构损伤。区又君等[21]研究发现,急性低氧胁迫使肝空泡体积增大与肝糖原的分解有关,且生境中低氧会造成鱼体组织的缺氧,影响鱼体正常的能量代谢。齐明等[22]研究显示,低氧胁迫使青田田鱼(Cyprinuscarpiovarqingtianensis)肝胰脏能量代谢方式发生改变。推测重度低氧胁迫后青海湖裸鲤肝组织空泡化可能与其能量代谢发生变化有关。
陈德举等[23]研究发现,慢性低氧(1.55±0.20) mg/L胁迫下吉富罗非鱼(Oreochromisniloticus)血液红细胞数量显著增加。陈世喜等[17]研究发现,低氧(1.55±0.10) mg/L胁迫下卵形鲳鲹鳃小片中红细胞数量增加。本研究结果与之一致,低氧胁迫后肝血窦中红细胞数量也增加,这可能与肝组织在面对低氧环境时需要通过增加红细胞数量来获得更强的摄氧能力,从而缓解外界水体环境低氧造成裸鲤肝组织的缺氧有关。
3.2 不同DO水平对青海湖裸鲤肝线粒体超微结构和膜电位的影响
线粒体是对低氧反应最为敏感的细胞器,而线粒体膜电位对维持线粒体正常功能起着关键作用,线粒体膜电位降低是细胞凋亡发生的最早事件[24]。薄海等[25]研究显示,慢性低氧抑制大鼠线粒体的合成,导致线粒体数量减少。魏琳等[26]研究发现,低氧导致凡纳滨对虾(Litopenaeusvannamei)线粒体结构肿胀变性、外膜扭曲肿胀、内嵴溶解,空泡化。刘静等[27]研究发现,急性低氧暴露使大鼠脑海马线粒体膜电位和ATP合成活力降低,而常氧环境运动预适应使线粒体膜电位和ATP合成活力显著升高,表明低氧胁迫后机体线粒体结构和功能发生适应性变化。
本研究中,中度低氧对线粒体结构影响不明显,但中度低氧使线粒体膜电位升高,这与刘静等[27]的研究结果相一致。推测中度低氧胁迫后青海湖裸鲤肝线粒体可能通过增强线粒体呼吸功能来提高肝组织对低氧胁迫的抵抗力,重度低氧24 h时青海湖裸鲤肝线粒体数量下降,部分线粒体空泡化,且膜电位降低,表明随低氧胁迫程度的加重和低氧时间的延长,肝线粒体氧化应激损伤,从而使线粒体空泡化,最终导致线粒体膜完整性及其功能损伤。
3.3 不同DO水平对青海湖裸鲤肝组织氧化应激的影响
氧化应激导致细胞内ROS含量增加,但因细胞内ROS寿命短暂,故通常通过检测H2O2含量来间接反映细胞发生脂质过氧化的程度。本研究发现,低氧胁迫使青海湖裸鲤肝组织H2O2含量显著增加,这一结果与低氧胁迫后日本沼虾肌肉和鳃组织中H2O2含量显著升高的结果相一致[18],表明低氧胁迫使青海湖裸鲤肝组织产生大量的ROS。
MDA是ROS攻击生物膜发生脂质过氧化的产物,其含量能够间接地反映机体脂质过氧化的程度。常志成等[28]研究发现,低氧(1.56±0.24) mg/L胁迫降低花鲈(Lateolabraxmaculatus)幼鱼肝组织MDA含量;陈世喜等[19]研究发现,急性和慢性低氧(1.55±0.20) mg/L胁迫使卵形鲳鲹(Trachinotusovatus)幼鱼肝脏组织MDA含量增加。本研究中,中度低氧胁迫对青海湖裸鲤肝组织MDA含量没有影响,表明在中度低氧胁迫后,肝组织内虽产生大量的ROS,但体内的抗氧化系统能够及时清除ROS,从而对肝组织未造成氧化损伤,这与中度低氧并未造成青海湖裸鲤肝组织结构损伤的结果相吻合。重度低氧使青海湖裸鲤肝组织MDA含量增加,表明在重度低氧胁迫后,肝组织内产生的ROS超出了抗氧化酶的清除能力,导致过量的ROS未能及时被清除,从而使肝组织处于脂质过氧化状态,产生大量MDA,随着低氧胁迫时间的延长,造成肝组织氧化应激损伤,这也间接证实重度低氧导致肝组织结构损伤。
3.4 不同DO水平对青海湖裸鲤肝脏组织抗氧化能力的影响
ROS累积易造成氧化应激损伤,但鱼体内存在SOD、GPX等能够清除过量ROS的抗氧化酶,从而保护细胞免受ROS损伤。张倩等[29]研究发现,低氧胁迫使鲫鱼(Carassiusauratus)血清、肌肉和鳃组织GPX和T-AOC显著增加。本研究中,肝组织T-AOC和GSH在低氧胁迫后显著增加,表明低氧胁迫使青海湖裸鲤肝组织始终处于氧化应激状态,T-AOC和GSH持续清除肝组织内因低氧胁迫而产生的过量ROS,保护机体免受ROS自由基损伤。本研究中,低氧胁迫后肝组织中SOD活性与常氧组差异不显著。陈世喜等[19]研究发现,卵形鲳鲹幼鱼肝组织SOD活性在急性低氧胁迫中持续增加,3 h时最大,后逐渐降低,8 h和24 h时降至正常水平,14 d时又显著高于对照组,可能SOD主要参与慢性低氧胁迫中机体的抗氧化水平。
综上所述,不同溶氧水平对青海湖裸鲤肝组织结构、线粒体超微结构和抗氧化酶活性产生不同的影响。中度低氧(3.0±0.1) mg/L对肝组织结构和线粒体未造成损伤,随着氧浓度的下降,重度低氧(0.7±0.1) mg/L对肝组织结构和线粒体损伤较为严重,且低氧胁迫后肝组织通过调整相关抗氧化酶活性来适应急性溶氧变化。本试验结果为鱼类低氧胁迫研究提供基础资料,也为青海湖裸鲤人工增殖放流及运输提供理论依据。
