miR-196-5p靶向HOXA5激活JAK/STAT通路促进皮肤鳞状细胞癌的增殖、侵袭及EMT
2021-10-08张永红代雪莲李存涛张玉红
张永红, 代雪莲, 李存涛, 张玉红
郑州大学附属郑州中心医院皮肤科,河南 郑州 450007
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是一种源自表皮角质形成细胞的皮肤肿瘤,是人类第二大常见癌症[1],在过去几十年,CSCC发病率一直在不断增加。最主要的危险因素是太阳辐射和免疫抑制[2]。虽然大多数散发性鳞状细胞癌可以通过手术和/或放疗治愈,但对于转移性患者,长期预后非常差,疾病特异性1年生存率为44%~56%。因此,迫切需要更有效的治疗策略。MicroRNAs (miRNAs)是一组内源性的、非编码的短RNA分子,由19~24个核苷酸组成[3]。miRNAs通过直接结合成熟mRNA在序列特异性位点的3′-非翻译区(3′-UTRs)负调控其靶基因的表达,从而导致mRNA失稳和蛋白下调[4]。一个单独的miRNA可能同时调控多个靶基因的表达,因此,miRNAs在许多生理和病理过程中发挥重要作用,包括细胞增殖、细胞周期进展、凋亡、代谢、转移、血管生成、上皮间充质转化和分化[5-6]。miRNA在各种类型的恶性肿瘤中表达异常,如宫颈癌、胶质瘤、肺癌、肾细胞癌[7]。根据其靶基因的不同,miRNAs在肿瘤发生和发展中可能是抑癌基因或癌基因[8]。因此,miRNAs可能成为癌症治疗的研究靶点。miR-196-5p已被报道在几种人类癌症中发挥重要作用,如miR-196a-5p通过靶向Smad4调节胃癌干细胞特征[9],miR-196a通过CRISPR/Cas9基因组编辑恢复胰腺癌细胞中Annexin A1敲除的侵袭性表型[10]。然而,miR-196-5p在CSCC中的表达水平、作用和潜在的分子机制尚不清楚。因此,本研究拟探讨miR-196-5p在CSCC中的表达及临床意义,并评价其在CSCC中的作用及潜在机制。
1 材料与方法
1.1 主要试剂及设备
从我院选取CSCC组织和癌旁正常组织标本(距病变位置约为10 cm)保存在液氮中。CSCC A431细胞和人永生化上皮HaCaT细胞均来自上海通派生物科技有限公司;DMEM(Dulbecco′s-modified Eagle′s medium)培养基(中国赛默飞世尔科技公司);JAK通路抑制剂AG490(美国Selleck公司);Trizol、PrimeScriptTMRT reagent Kit with gDNA Eraser(日本Takara公司);E-cadherin、N-cadherin和GAPDH多克隆抗体(英国Abcam);siRNA NC、HOXA5 siRNA、miR-196-5p mimics、miR-196-5p inhibitor(GenePharma公司)。37 ℃恒温培养箱(黑龙江东拓仪器制造有限公司);酶标仪(Thermo Fisher Scientific公司);荧光定量PCR仪(Bio-Rad公司);凝胶成像仪(美国伯乐公司)。
1.2 实验方法
1.2.1 细胞培养 CSCC A431细胞和人永生化上皮HaCaT细胞用含有10% FBS的DMEM培养基培养,置于37 ℃、5% CO2、95%湿度的培养箱中,长满后进行传代培养。
1.2.2 细胞转染 显微镜观察A431细胞密度为95%左右时,加入胰酶进行消化,加入DMEM培养基重悬细胞,稀释后的细胞铺于12孔板,细胞密度达75%时,添加DMEM培养基,将Turbofect、质粒、Opti-MEM混匀后静置15 min,滴加于细胞中,2 h后更换为含有10% FBS的DMEM培养基,48 h后收集细胞RNA和蛋白用于检测。
1.2.3 细胞增殖测定 A431细胞密度为95%左右时,加入胰酶进行消化,将稀释后的细胞铺于96孔板中,细胞汇合至75%时,用Turbofect试剂转染质粒,常规培养箱孵育48 h,加入PBS清洗3次,将10 μL CCK-8工作液加入细胞内,孵育2 h,在酶标仪读取各孔细胞在450 nm处的吸光值。
1.2.4 双荧光素酶报告基因活性检测 首先TargetScan预测miR-196-5p的潜在靶基因,构建HOXA5 wt载体后,通过点突变试剂盒构建HOXA5 mut载体。A431细胞密度为95%左右时,加入胰酶进行消化,并接种于12孔板,细胞密度达到70%~75%时,将HOXA5 wt、HOXA5 mut分别与miR-196-5p mimics、mimics NC质粒通过Turbofect试剂共转染至A431细胞,48 h后测定荧光素酶活性强度。
1.2.5 细胞侵袭实验 用无FBS DMEM培养基稀释融化的matrigel使其浓度为1 mg/mL,取稀释后的100 μL matrigel添加于每个上室中,成胶状后取状态良好、密度为5×105/mL的A431细胞添加到Transwell小室中,下室添加完全DMEM培养基,常规培养箱放置48 h,用PBS洗涤2次,取多聚甲醛加入其中固定20 min,再加入0.1%结晶紫染色20 min,选取5个视野细胞在显微镜下查看细胞侵袭情况,拍照并记数。
1.2.6 RT-qPCR 取出保存的组织标本和RNA样品,完全溶解后加入Trizol,提取组织和细胞总RNA,测定RNA浓度和纯度后将总RNA反转成cDNA。最后以GAPDH为内参,cDNA为模板进行实时荧光定量PCR,反应条件:预变性95 ℃ 10 min;变性95 ℃ 10 s,退火60 ℃ 20 s,延伸72 ℃ 30 s,40个循环。2-△△Ct法分析结果。

表1 引物序列Table 1 Primer sequence
1.2.7 Western blot 提取组织和细胞中的总蛋白后,使用BCA试剂盒对蛋白进行定量。取50 μg蛋白进行SDS-PAGE凝胶电泳,将蛋白湿转转移到PVDF膜上,与5%脱脂奶粉配置的封闭液在室温封闭1 h后,加特异性一抗在4 ℃过夜反应,加入TBST清洗5次,加二抗在室温孵育1 h,最后滴加增强型化学发光液,进行蛋白曝光和定量分析。
1.3 统计学分析
所有数据应用GradPad Prism 5.0软件进行统计分析。miR-196-5p mimics组与Control组、mimics NC组,miR-196-5p inhibitor组与Control组、inhibitor NC组,pcDNA-HOXA5组与Control组、pcDNA-3.1(+)组,HOXA5 siRNA组与Control组、siRNA NC组、HOXA5 siRNA+AG490组,HOXA5 wt+mimics NC组与HOXA5 wt+miR-196-5pmimics组,HOXA5 mut+mimics NC组与HOXA5 mut+miR-196-5p mimics组等组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 过表达miR-196-5p促进A431细胞增殖、侵袭和EMT
miR-196-5p在CSCC A431细胞中的表达水平明显高于HaCaT细胞(2.26±1.02比1.28±0.64,t=18.58,P=0.003),在CSCC组织的表达水平亦明显高于癌旁正常组织(1.86±0.36比0.97±0.42,t=6.32,P=0.024)。与Control(1.13±0.72)或mimics NC组(1.18±0.09)相比,miR-196-5p mimics组的miR-196-5p表达量(2.21±0.92)明显升高(t分别为19.25、18.75,均P<0.01)。与Control或mimics NC组相比,miR-196-5p mimics组的细胞增殖能力明显升高(t分别为7.97、7.85,均P<0.05,图1A);细胞侵袭数目明显增加(t分别为23.21、23.82,均P<0.05,图1B),N-cadherin蛋白表达量明显上升(t分别为17.27、17.59,均P<0.05,图1C),E-cadherin蛋白表达量明显下降(t分别为11.50、11.86,均P<0.05,图1C)。
2.2 下调miR-196-5p抑制A431细胞增殖、侵袭和EMT
与Control(1.28±0.64)或inhibitor NC组(1.16±0.23)相比,miR-196-5p inhibitor组的miR-196-5p表达量(0.34±0.06)明显降低(t分别为13.86、13.92,均P<0.01)。miR-196-5p inhibitor组的细胞增殖能力明显低于inhibitor NC组或Control组(t分别为12.97、13.06,均P<0.01,图2A),细胞侵袭数目明显减少(t分别为10.93、11.26,均P<0.01,图2B),E-cadherin蛋白表达量明显上升(t分别为10.29、10.36,均P<0.01,图2C),N-cadherin蛋白表达量明显下降(t分别为19.26、19.35,均P<0.01,图2C)。

图1 过表达miR-196-5p促进A431细胞增殖、侵袭和EMT 1A:CCK-8检测对A431细胞增殖的影响;1B:细胞侵袭实验检测对A431细胞侵袭的影响;1C:Western blot检测对A431细胞EMT的影响
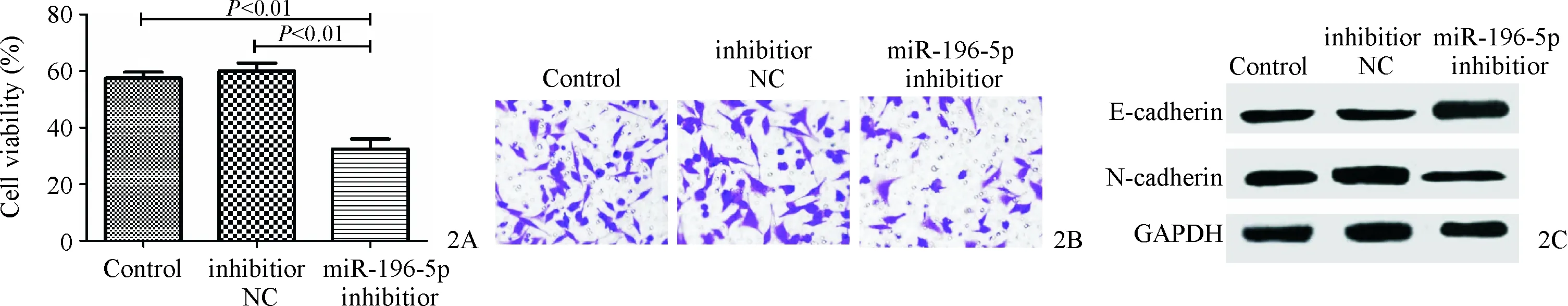
图2 下调miR-196-5p抑制A431细胞增殖、侵袭和EMT 2A:CCK-8检测对A431细胞增殖的影响;2B:细胞侵袭实验检测对A431细胞侵袭的影响;2C:Western blot检测对A431细胞EMT的影响
2.3 miR-196-5p与HOXA5的靶向和调控关系
预测miR-196-5p和HOXA5之间的结合位点见图3。与HOXA5 wt+mimics NC组(1.15±0.32)相比,HOXA5 wt+miR-196-5p mimics组(0.54±0.07)细胞荧光素酶活性明显降低(t=26.55,P=0.001);与HOXA5 mut+mimics NC组(1.32±0.75)相比,HOXA5 mut+miR-196-5p mimics组(1.29±0.32)细胞荧光素酶活性无明显变化(t=4.03,P=0.057)。与mimics NC组(1.36±0.98)相比,miR-196-5p mimics组HOXA5表达量(0.56±0.05)明显降低(t=23.33,P=0.002);与inhibitor NC组(1.25±0.27)相比,miR-196-5p inhibitor组HOXA5表达量(2.32±0.24)明显升高(t=16.10,P=0.004)。
2.4 过表达HOXA5抑制A431细胞增殖、侵袭和EMT
HOXA5在CSCC A431细胞中的表达水平明显低于HaCaT细胞(0.67±0.02比1.23±0.52,t=19.72,P=0.003),在CSCC组织的表达水平明显低于癌旁正常组织(0.51±0.36比1.45±0.08,t=7.60,P=0.017)。与Control(1.32±0.72)或pcDNA-3.1(+)组(1.46±0.15)相比,pcDNA-HOXA5 组的HOXA5表达量(2.36±0.83)明显升高(t分别为47.01、47.56,均P<0.01)。与Control或pcDNA-3.1(+)组相比,pcDNA-HOXA5组的细胞增殖能力明显降低(t分别为26.87、27.23,均P<0.01,图4A),细胞侵袭数目明显减少(t分别为28.27、28.49,均P<0.01,图4B),E-cadherin蛋白表达量明显上升(t分别为19.80、19.87,均P<0.01,图4C),N-cadherin蛋白表达量明显下降(t分别为21.63、22.42,均P<0.01,图4C)。

图3 TargetScan预测miR-196-5p和HOXA5之间的结合位点Figure 3 TargetScan predicted binding sites between miR-196-5p and HOXA5.
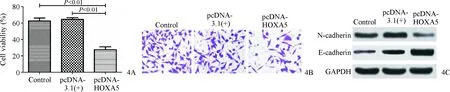
图4 过表达HOXA5抑制431细胞增殖、侵袭和EMT 4A:CCK-8检测对A431细胞增殖的影响;4B:细胞侵袭实验检测对A431细胞侵袭的影响;4C:Western blot检测对A431细胞EMT的影响
2.5 下调HOXA5激活JAK/STAT通路促进A431细胞增殖、侵袭和EMT
与Control或siRNA NC组相比,HOXA5 siRNA组细胞内JAK、STAT蛋白磷酸化水平明显升高(t分别为18.50、18.68,均P<0.01,图5A)。与siRNA NC组相比,HOXA5 siRNA的细胞增殖能力明显升高(t分别为28.40、28.86,均P<0.01),细胞侵袭数目明显增加(t分别为23.32、23.85,均P<0.01),E-cadherin蛋白表达量明显降低(t分别为26.14、27.03,均P<0.01),N-cadherin蛋白表达量明显升高(t分别为15.04、16.23,均P<0.01);与HOXA5 siRNA组相比,HOXA5 siRNA+AG490组细胞增殖能力明显降低(t分别为4.45、4.49,均P<0.05),细胞侵袭数目明显减少(t分别为10.43、10.58,均P<0.01),E-cadherin蛋白表达量明显升高(t分别为11.86、12.36,均P<0.01),N-cadherin蛋白表达量明显降低(t分别为14.04、14.76,均P<0.01),见图5B~5D。

图5 下调HOXA5激活JAK/STAT通路促进A431细胞增殖、侵袭和EMT 5A:Western blot检测对JAK/STAT通路的影响;5B:CCK-8检测对A431细胞增殖的影响;5C:细胞侵袭检测对A431细胞侵袭的影响;5D:Western blot检测对A431细胞EMT的影响
3 讨论
近年研究表明,在人类许多恶性肿瘤中miRNA发挥了关键重要。如在多形性胶质母细胞瘤中,microRNA-376a通过直接靶向特异性蛋白1抑制细胞增殖和侵袭[11]。miR-144通过靶向RUNX1可能抑制卵巢癌细胞的增殖和迁移[12]。microRNA-365靶向多种癌基因,抑制侵袭性子宫内膜癌细胞的增殖、侵袭和自我更新[13]。miR-196-5p最初被鉴定为一种靶向annexin A1促进食管癌细胞增殖和防止凋亡的致癌miRNA[14]。miR-196a-5p在宫颈癌和非小细胞肺癌等恶性肿瘤组织中存在异常表达,其表达水平与这些癌症的进展相关[15]。例如,miR-196a-5p在口腔癌组织中明显过表达,通过NME4-JNK-TIMP1-MMP轴加速了口腔癌细胞迁移和侵袭[16]。miR-196a-5p在CRC样本中上调,并通过增强CRC细胞的侵袭和对铂衍生物的敏感性来发挥促癌作用[17]。与以上研究结果一致的是,本研究发现miR-196 -5p在CSCC组织和A431细胞中表达量明显升高,且过表达miR-196-5p促进A431细胞增殖和侵袭,而下调miR-196-5p则抑制A431细胞增殖和侵袭,这些结果证实miR-196-5p在A431细胞发展过程中发挥了明显的致癌作用,尤其是促转移作用。
上皮-间充质转化是一个可逆过程,被认为是癌症转移级联过程中的一个关键环节。在此过程中,细胞抑制E-cadherin,表达间充质蛋白如N-cadherin、纤连蛋白等,使细胞失去黏附,获得迁移和侵袭能力[18]。本研究评估miR-196-5p在A431细胞EMT过程中的作用,结果显示,在A431细胞上调miR-196-5p表达可通过下调E-cadherin、上调N-cadherin促进EMT,而沉默miR-196-5p则可通过上调E-cadherin、下调N-cadherin表达而抑制A431细胞EMT。以上研究提示,促进EMT对miR-196-5p在A431细胞中的促转移有重要作用。后续研究发现miR-196-5p和HOXA5具有靶向和负调控作用。包含HOXA5的HOX家族在维持人体轴向细胞生长和定位中起着重要作用,它们的异常表达可能会阻碍胚胎的正常生长并引发恶性肿瘤的发作[19]。有文献报道,microRNA-196a通过靶向HOXA5促进非小细胞肺癌细胞增殖和侵袭[20]。本研究结果与其一致,发现二者在A431细胞中也具有靶向关系。检测HOXA5在CSCC组织和A431细胞中的表达量及其生物学功能,结果发现HOXA5在CSCC组织和A431细胞中明显下调,过表达HOXA5抑制A431细胞增殖、侵袭和EMT,而siRNA下调HOXA5表达明显促进A431细胞增殖、侵袭和EMT,表明HOXA5在A431细胞中发挥了明显的抑癌作用。许多信号转导途径,包括PI3K/AKT、丝裂原活化蛋白激酶和Wnt,参与肿瘤细胞的增殖、侵袭和EMT过程[21-22]。有文献报道shRNA靶向沉默ZEB2表达通过Wnt/β-catenin信号通路降低肺癌细胞增殖活性[23]。本研究表明下调HOXA5激活了A431细胞内的JAK/STAT信号通路,且通过该通路促进癌细胞的增殖、侵袭和EMT;提示miR-196-5p靶向HOXA5可能通过JAK/STAT信号通路促进A431细胞的EMT过程,从而促进CSCC的增殖和侵袭,但本研究只选择了A431细胞进行研究,miR-196-5p及其HOXA5对其它CSCC细胞发展是否具有同样的生物学功能尚不清楚,仍需进一步深入研究。
综上所述,本研究表明miR-196-5p靶向HOXA5激活JAK/STAT信号通路,促进CSCC A431细胞的增殖、侵袭和EMT,为深入理解CSCC的发病机制提供了理论依据。
致谢感谢郑州大学基础医学院胡蓉老师在实验研究中给予的诸多帮助。
