Streptomyces lavendulae X33海藻糖合酶基因克隆及酶学特性
2021-09-29陈允妲李雪亮赵晓艳张丽霞吴晓玉陈金印
陈允妲,李雪亮,赵晓艳,张丽霞,吴晓玉,,王 飞,*,陈金印
(1.江西农业大学 生物科学与工程学院,江西 南昌 330045;2.江西省果蔬保鲜与质量安全创新中心,江西 南昌 330045)
【研究意义】海藻糖是由2个葡萄糖分子以1,1-糖苷键连接的一种非还原性双糖,在生物体中具有多种功能[1]。海藻糖对生物大分子有良好的保护性能,当细胞处于饥饿、干燥、高渗透压、脱水等胁迫环境时,海藻糖能有效地保护蛋白质不变性,保护细胞膜不受损伤,从而提高这些生物的抗逆性[2-4]。因此,海藻糖在食品、化妆品、医药等保护剂的应用前景广阔[5]。在已知的海藻糖生物合成途径中,海藻糖合酶途径(TS 途径)只需要一个酶参与反应,即利用海藻糖合酶通过转糖苷作用催化麦芽糖与海藻糖之间的可逆反应,可以将麦芽糖转化为海藻糖[6]。生产流程相对简单,转化率高,生产原料的成本比较低廉,稳定性能好,适合大规模的工业生产,受到广泛关注[7]。【前人研究进展】国内外研究者从Picrophilus torridus、Mycobacterium smegmatis、Paenarthrobacter aurescens、Arthrobacter chlorophenolicus、Deinococcus radiodurans、Pseudomonas stutzeri、Acidiplasmasp.MBA-1、Enterobacter hormaechei等G-菌株中分别克隆到海藻糖合酶[8-11],但目前已报道的海藻糖合酶的热稳定性不强,限制了其工业化应用。【本研究切入点】前期工作中,项目组分离得到的一株耐热性良好的链霉菌Streptomyces lavendulaeX33 通过基因组测序,发现其基因组中含有一个海藻糖合酶的编码序列。【拟解决的关键问题】本文拟对其进行克隆和异源表达后,对其酶学特性进行表征,为海藻糖合酶开发提供新的酶资源。
1 材料与方法
1.1 菌株
Streptomyces lavendulaeX33,克隆菌株E.coliDH5α,表达宿主菌株E.coliBL21(DE3)保藏于江西农业大学江西省农业微生物资源开发与利用工程重点实验室。
1.2 培养基与试剂
LB培养基:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L,pH 7.0~7.2。
限制性核酸内切酶Hind Ⅲ和NdeⅠ、T4DNA 连接酶、DNA marker、PrimeSTAR Max DNA polymerase购于大连宝生物工程有限公司(Takara Biotechnology Co.,Ltd.),其余各化学试剂均为分析纯。凝胶回收试剂盒与质粒提取试剂盒购自北京百泰克生物技术有限公司(BioTeke Corporation),核酸测序委托湖南擎科生物科技有限公司(Qingke Biotechnology Co.,Ltd.)。
1.3 仪器
梯度PCR 仪(Bio-Rad)、高速冷冻离心机(Beckman Coulter,Allegra X-22R)、超净工作台(苏州安泰公司)、凝胶成像系统(上海天能,Tanon 1600)、核酸电泳仪(北京六一,DYCP-31DN)、蛋白垂直电泳仪(Bio-Rad,Mini-PROTEAN Tetra)、超声波细胞破碎仪(宁波新芝,JY99-11D)等。
1.4 重组菌株的构建
高盐法[10]提取菌株Streptomyces lavendulaeX33 总DNA,以菌株X33 总DNA 作模板,设计引物SlTs-F:5'-GGAATTCCATATGATCAACGACCCCG-3'(划线部分表示NdeI酶切位点)和SlTs-R:5'-CCCAAGCTTATCGGCGCGGCGGTCAC-3'(划线部分表示Hind Ⅲ酶切位点)进行PCR 扩增,扩增反应体系:PrimeSTAR Max DNA polymerase 25 μL,引物(25 pmol/μL)各1 μL,菌株X33 总DNA(约50 ng/μL)1 μL,灭菌双蒸水至50 μL。反应条件:98 ℃变性2 min,98 ℃10 s,61 ℃5 s,72 ℃15 s,30 个循环;最后72 ℃延伸10 min。
PCR 扩增产物经琼脂糖凝胶电泳回收,试剂盒纯化后以限制酶Hind Ⅲ和NdeⅠ进行双酶切,同时将原核载体pET-29a(+)按照相同体系进行双酶切。两者酶切后的产物以T4DNA 连接酶在16 ℃下过夜酶连,酶连产物热激转化至E.coliDH5α。涂布于含卡那霉素终浓度为50 μg/mL 的LB 平板,37 ℃培养16 h 后,挑取阳性克隆至3 mL 液体LB(Kan+),37 ℃,180 r/min 培养8 h 后提质粒电泳,NdeI/Hind Ⅲ双酶切检测[12]。
阳性克隆经电泳检测,大小无误后,送样品至湖南擎科生物科技有限公司测序,测序正确的质粒转化至E.coliBL21(DE3)感受态细胞,构建突变表达菌株。
1.5 突变表达菌株诱导表达
将经0.2 mmol/L IPTG 诱导培养后的突变表达菌株培养液6 000 r/min,10 min 离心,超声破碎后,12 000 r/min离心10 min,SDS-PAGE电泳后以考马斯亮蓝R-250染色,脱色液脱色后观察结果[13]。
1.6 重组酶rSlTs的催化特性
1.6.1 重组酶rSlTs 的最适反应温度 取15 μg 重组酶rSlTs 加入至终浓度为0.03%(w/w)麦芽糖的20 mmol/L PBS缓冲液(pH 6.0)中,分别在0,10,20,30,40和50 ℃温度下反应1 h后,加入1 mol/L DNS试剂1 mL,沸水浴5 min,以蒸馏水稀释2倍测定OD540,以rSlTs最适反应温度下的酶活力为100%进行比较。
1.6.2 重组酶的最适反应pH 取15 μg 重组酶rSlTs 加入不同pH 值的20 mmol/L PBS 缓冲液中,加入底物麦芽糖终浓度为0.03%(w/w),在20 ℃温度下反应1 h后,测定酶活,以rSlTs最适反应pH下的酶活力为100%进行比较。
1.6.3 重组酶的pH 稳定性 取1.5 mg 重组酶rSlTs,分别在pH 为3~9 的缓冲液中0 ℃孵育12 h,取出15 μg,加入至pH 6.0的反应体系,于20 ℃条件下反应1 h后,测定酶活,以rSlTs最稳定pH 条件下的酶活力为100%进行比较。
1.6.4 重组酶的热稳定性 取15 μg 重组酶rSlTs,于10,20,30,40,50 和60 ℃条件下保温后,定时取出,加入至终浓度为0.03%(w/w)麦芽糖的20 mmol/L PBS缓冲液(pH 6.0)中,在20 ℃温度下反应1 h后,测定酶活,以重组酶rSlTs在0 ℃条件下处理0 h的酶活力为100%,比较热稳定性。
1.6.5 金属离子对重组酶酶活的影响 取15 μg 重组酶rSlTs,在反应体系中添加终浓度为1 mmol/L 的不同金属离子,水浴反应1 h,以未加金属离子的反应体系为100%,测定酶活并进行比较。
1.6.6 有机溶剂对重组酶酶活的影响 取15 μg 重组酶rSlTs,在反应体系中分别添加10%的甲醇、乙醇、丙酮、异丙醇、乙腈,5%的DMSO、DMF、PMSF 和20 mg/mL 的吐温80、TritonX-100,10 mmol/L 的EDTA,2 mg/mL的SDS,以不添加任何化合物的测活体系为对照,测定酶活并进行比较。
1.7 酶活测定方法
将破碎、离心后的适量纯酶rSlTs 加入至终浓度为0.03%(w/w)麦芽糖的20 mmol/L PBS 缓冲液(pH 6.0)中,以灭活重组酶为对照,于20 ℃条件下反应1 h后,加入1 mol/L DNS试剂1 mL,沸水浴5 min,以蒸馏水稀释2倍测定OD540,计算酶活[14-15]。
酶活定义为20 ℃、pH 为7.5反应条件下,以0.03%麦芽糖为底物,每分钟催化消耗1 μmoL 麦芽糖所需的蛋白量(mg)为一个活力单位(U)[16]。
海藻糖合酶活性=[麦芽糖差值毫克数(空白-酶反应)×106]/(342.3×60)
1.8 蛋白含量的测定
按Bradford方法进行,以牛血清蛋白作为标准蛋白,具体操作见参考文献[17]。
1.9 分析软件
以BioEdit 7.0 软件进行核酸序列和氨基酸序列分析,以MEGA5.5 软件进行系统发育树分析,以https://web.expasy.org/compute_pi/在线软件进行分子量和等电点分析。
2 结果与分析
2.1 表达载体的构建
以菌株X33 基因组DNA 为模板,PCR 扩增得到SlTs基因全长,其大小在2 kb 左右(图1a),符合预期结果,通过双酶切与pET29a(+)酶连后构建重组质粒(图1b)。将测序正确的核酸序列提交至GenBank,登录号为:MW217513。
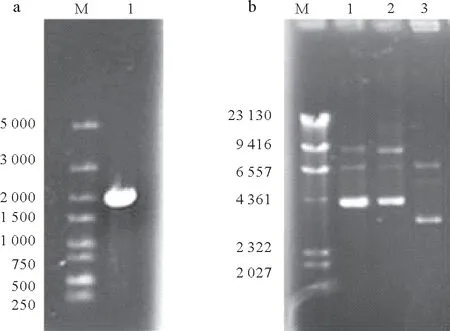
图1 SlTs基因PCR产物和重组质粒电泳Fig.1 Agarose gel electrophoresis of fragment of SlTs by PCR and pET-29a(+)-SlTs
将SlTs 氨基酸序列与已报道的海藻糖合酶序列以MEGA5.5 软件进行比较,泊松法1 000 次校正,邻接法构建系统发育树,见图2。
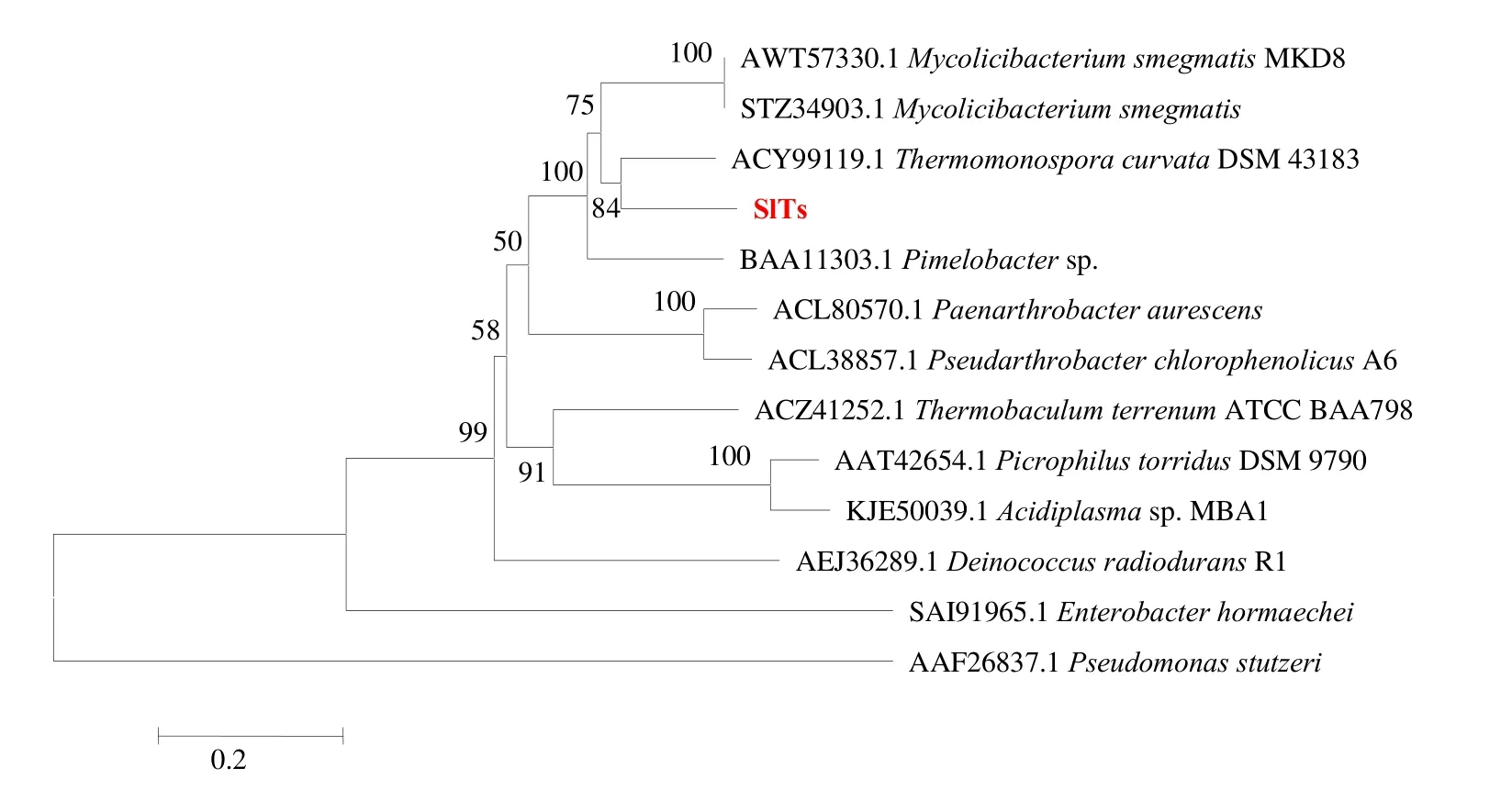
图2 SlTs的系统发育树Fig.2 Phylogenetic tree of SlTs and related trehalose synthases
SlTs 与来源于古细菌Thermomonospora curvataDSM 43183 海藻糖合酶TcTs 相似性为84%,在系统发育树上与来源于Mycolicibacterium smegmatis的海藻糖合酶MsTs 聚为一类。但与来源于Paenarthrobacter aurescens、Enterobacter hormaechei、Pseudomonas stutzeri、Picrophilus torridus等G-细菌所产的海藻糖合酶有较远的亲缘关系。
将SlTs 氨基酸序列与已解析结构的海藻糖合酶TcTs(PDB.5h2t,Thermomonospora curvataDSM 43183)[18]、MsTs(PDB.3zo9,Mycolicibacterium smegmatis)[19]、MtTs(PDB.4lxf,Mycobacterium tuberculosisH37Rv)[20]、TtTs(PDB.5x7u,Thermobaculum terrenumATCC BAA-798)[21]、DrTs(PDB.4tvu,Deinococcus radioduransR1)[22]进行比较(图3),SlTs具有几个保守序列DGGYD,NHTS,QPDLN,RXDAVPYL,LLAEANQ和LRNHDELTLE。底物结合位点D78,H121,Q186,R216,H329,D330,金属离子结合位点N120,D188,Y222,L223 以及三联体催化中心D218-E260-D330 均位于保守区域内。不同的是,MsTs 中另一个金属离子位点E237与SlTs对应的位点为A225,这一位点的不同是否影响到酶活性有待考证。

图3 SlTs与其它海藻糖合酶氨基酸序列的比较Fig.3 Comparison of amino acid sequences of different trehalose synthases
2.2 重组酶诱导表达
将测序正确的重组质粒热激转化至E.coliBL21(DE3),表达菌株经0.2 mmol/L IPTG 在16 ℃条件下诱导表达后,6 000 r/min 离心10 min,收集菌体,以20 mmol/L PBS 缓冲液(pH 7.5)重悬,超声破碎,12 000 r/min 离心10 min,取5 μL 上清液(约20 μg 蛋白),进行SDS-PAGE 电泳(图4)。图4 显示经IPTG诱导表达后,重组酶rSlTs 在E.coliBL21(DE3)内以可溶蛋白的形式大量表达。经Ni2+-NTA 亲和层析,以含200 mmol/L 咪唑的PBS缓冲液(pH 7.5)洗脱后,重组酶rSlTs达到电泳纯标准,分子量在66 ku左右,经ExPasy软件预测,其等电点为4.85。
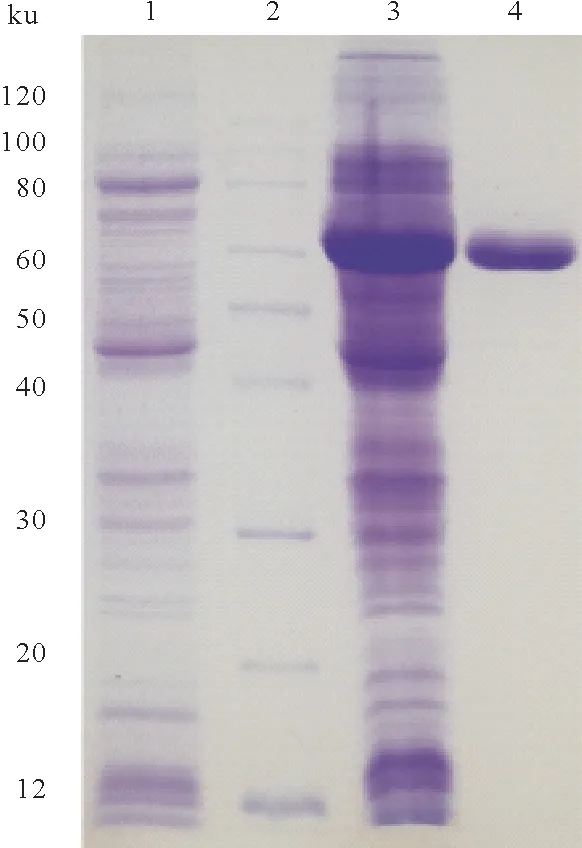
图4 重组酶rSlTs 表达和纯化SDS-PAGE电泳图谱Fig.4 Analysis of the expression of the recombinant enzyme rSlTs on SDS-PAGE
2.3 重组酶rSlTs的最适反应温度和最适反应pH
以麦芽糖为底物,对重组酶rSlTs的最适反应温度进行测定,结果如图5a所示。重组酶rSlTs的最适反应温度为20 ℃,在30 ℃条件下反应,酶活性为最适温度的90%,在60 ℃条件下反应1 h未能检测到酶活,最适反应温度与来源于Pseudomonas stutzeri的海藻糖合酶一致[23]。重组酶rSlTs的最适反应pH 为7.5(图5b),与来源于Pseudomonas putida的海藻糖合酶一致[24],在此条件下,测得的酶活为67.6 U/(min·mg)protein。在pH 为7.0和pH为8.0条件下,酶活性为最适pH反应条件的85%和80%。
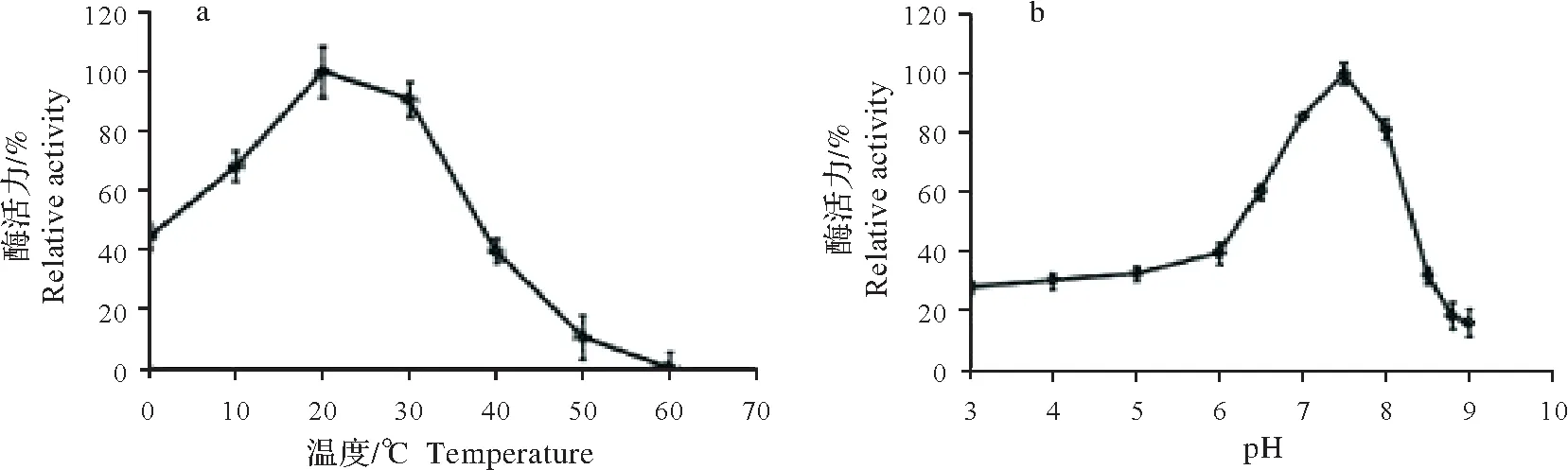
图5 重组酶rSlTs的最适反应温度和最适反应pHFig.5 Optimum temperature and pH of recombinant rSlTs
2.4 重组酶rSlTs的温度稳定性和pH稳定性
将重组酶在不同温度条件下保藏,定时取出测定酶活,比较其在不同温度条件下的稳定性,结果如图6a。重组酶rSlTs 对热敏感,在20 ℃条件下放置9 h,残留酶活为60%,在50 ℃条件下30 min 酶活彻底丧失。在40 ℃条件下保持1 h,残留酶活仅为5%。将重组酶在不同pH 条件下保藏12 h,取出测定酶活,比较其在不同pH缓冲液中的稳定性,结果如图6b。重组酶rSlTs在pH 6.5~8稳定,在pH为6条件下放置12 h,残留酶活为30%,在pH 为8.5 条件下放置12 h,残留酶活为34%,而在pH 为6.5 和7.5 条件下放置12 h,残留酶活分别为86%和94%。
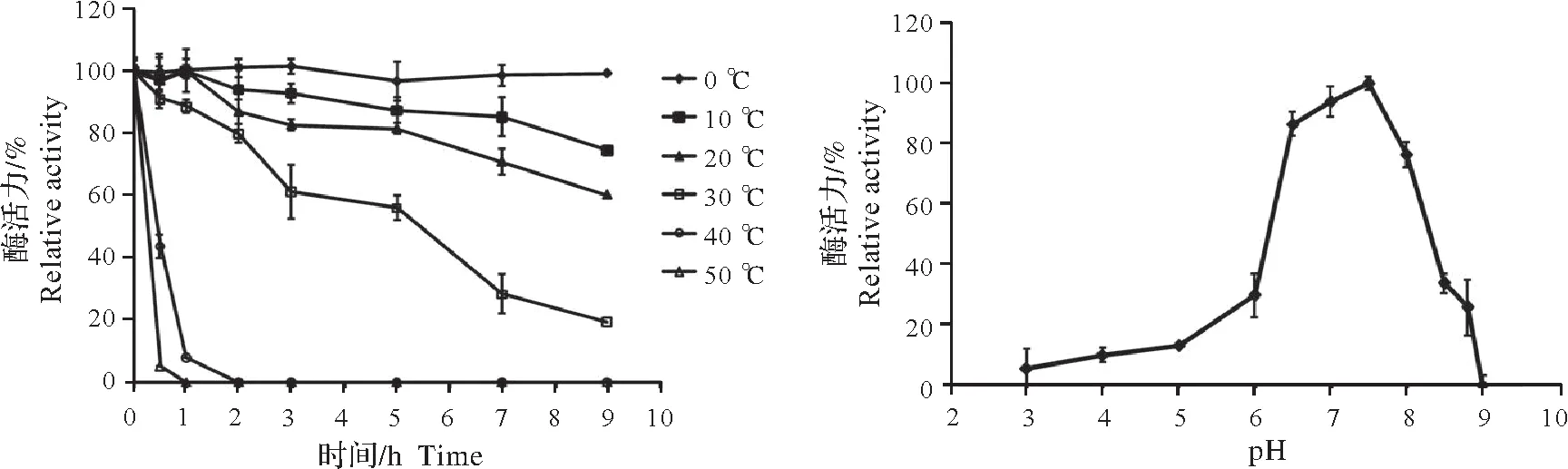
图6 重组酶rSlTs的温度稳定性和pH稳定性Fig.6 Effects of pH and temperature on stablity of the recombinant rSlTs
2.5 金属离子对重组酶rSlTs酶活的影响
重组酶rSlTs酶活性受到Ni2+、Zn2+、Cu2+的强烈抑制,在含有浓度为1 mmol/L上述离子的反应条件下,酶活性仅有35%,26%和32%。Ca2+对重组酶rSlTs 活性有激活作用,其酶活达到115%,Mn2+对重组酶rSlTs活性也有轻微的激活作用,其相对酶活达到104%(图7)。
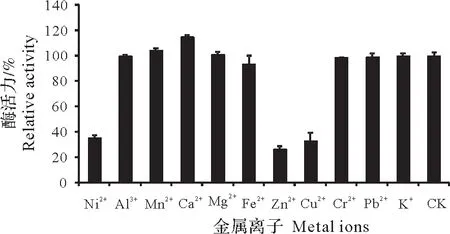
图7 金属离子对重组酶rSlTs活性的影响Fig.7 Effect of metal ions on enzyme activity of recombinant rSlTs
2.6 化学试剂、有机溶剂对重组酶rSlTs酶活的影响
重组酶rSlTs 酶活性受到DMSO、SDS、丙酮、乙腈等有机溶剂和化学试剂的强烈抑制,在含有上述化学试剂和有机溶剂的反应条件下,相对酶活性仅有52%,0%,0%和12%。EDTA对重组酶rSlTs活性无显著影响(图8)。
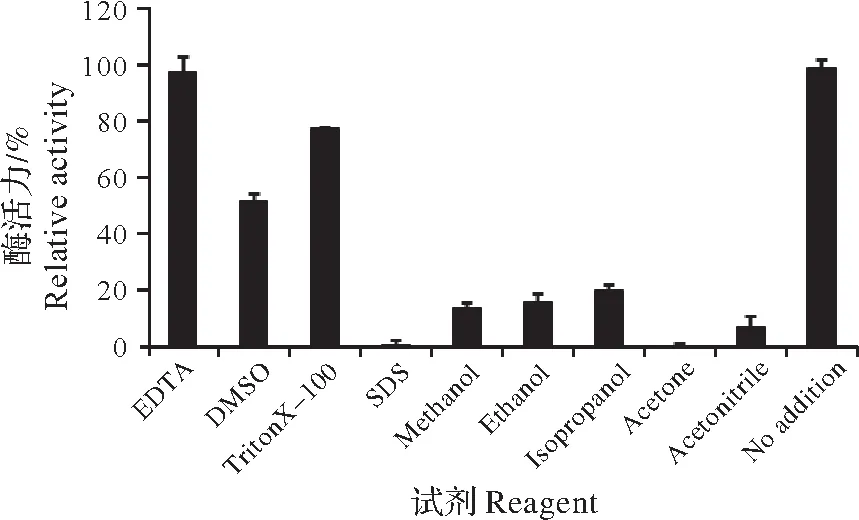
图8 化学试剂对重组酶rSlTs活性的影响Fig.8 Effects of chemical agent on enzyme activity of recombinant rSlTs
3 讨论
海藻糖合酶在工业化酶法生产海藻糖上具有很强的应用潜力,本研究从链霉菌Streptomyces lavendulaeX33克隆到的海藻糖合酶基因,并通过原核表达体系对其进行了重组表达,得到有活性的重组海藻糖合酶rSlTs。重组酶rSlTs 分子量为66 ku,等电点为4.85,最适反应温度为20 ℃,最适反应pH 为7.5,对热敏感,在pH 6~8 条件下稳定,1 mmol/L Ca2+对重组酶rSlTs 有激活作用,三联体催化中心由D218-E260-D330组成。系统发育进化树显示,SlTs与古细菌Thermomonospora curvataDSM 43183来源的海藻糖合酶同属一个亚类,进化关系最近,而与Pseudomonas、Enterobacter hormaechei等G-细菌来源的海藻糖合酶距离较远。尽管如此,SlTs 与不同来源的海藻糖合酶之间的氨基酸序列多重比对仍显示存在某些氨基酸残基高度保守,如底物结合位点D78,H121,Q186,R216,H329,D330,金属离子结合位点N120,D188,Y222,L223以及三联体催化中心D218-E260-D330等。此外,SlTs氨基酸序列中还存在一些相对保守的区段,与已知晶体结构的TcTs(PDB.5H2T)相比,在数目和位置上都高度一致。
重组酶最适反应pH 为7.5,与来源于Pimelobactersp.R48、Pseudomonas putida的海藻糖合酶一致,而来源于Thermus aquaticusATCC33923、Picrophilus torridus最适反应pH 为6.5[24]。重组酶rSlTs 的最适反应温度为20 ℃,与来源于Pseudomonas stutzeri的海藻糖合酶最适反应温度一致,而来源于Thermus aquaticusATCC33923的海藻糖合酶最适反应温度为65 ℃。有意思的是,SlTs在氨基酸序列上和来源于古细菌Thermomonospora curvataDSM 43183、Thermus aquaticusATCC33923 等的耐高温海藻糖合酶具有更高的相似性,但在酶学特性上却与来源于Pseudomonas stutzeri、Pimelobactersp.R48等G-细菌海藻糖合酶更为相似,表明SlTs 为研究氨基酸位点突变对酶学特性之间的关系提供了良好的材料。与古细菌来源的海藻糖合酶相比,重组酶rSlTs 热稳定性较差。而酶的热稳定性也是制约其应用价值的重要因素,因此在后续的研究中课题组将尝试对酶进行改造,以提高其温度的稳定性。此外,EDTA 对重组酶rSlTs无显著抑制作用,表明SlTs对金属离子没有很强的依赖性。
