基于超高效液相色谱串联质谱技术的山楂核抗菌、抗氧化药效物质基础研究
2021-09-28杨悦刘颖刘晓谦杨立新冯伟红李春王智民
杨悦 刘颖 刘晓谦 杨立新 冯伟红 李春 王智民
摘要 目的:筛选山楂核新的生物活性并阐释其药效物质基础。方法:通过测定最小抑菌浓度(MIC),评价2,2-二苯基-1-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除率及Fe3+还原能力考察山楂核乙醇提取物及其不同极性萃取部位的抗菌和抗氧化活性,得到活性部位,并通过超高效液相色谱与飞行时间质谱联用技术分析活性部位的化学成分。结果:乙酸乙酯萃取部位是山楂核抗菌、抗氧化的活性部位。经LC-MS/MS分析从活性部位中共推测出21个化学成分,包含16个木脂素、3个苯丙素和2个黄酮类成分。结论:木脂素类成分是山楂核的主要药效成分,值得深入研究。
关键词 山楂核;抗菌;抗氧化;超高效液相色谱串联质谱;木脂素
Study on Anti-bacterial and Anti-oxidative Material Basis of Pharmacodynamics of Hawthorn Seeds Based on Ultra Performance Liquid Chromatography-tandem Mass Spectrometry
YANG Yue,LIU Ying,LIU Xiaoqian,YANG Lixin,FENG Weihong,LI Chun,WANG Zhimin
(National Engineering Laboratory for Quality Control Technology of Chinese Materia Medica, Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
Abstract Objective:To screen new biological activities of hawthorn seeds and explain its material basis of pharmacodynamics.Methods:By measuring the minimum inhibitory concentration(MIC),the DPPH,ABTS radical scavenging rate and Fe3+ reducing ability were evaluated,and the antibacterial and antioxidant activities of the ethanol extract and different polar solvent extracts of hawthorn seeds were investigated,and the active fraction was obtained.Then,the chemical constituents of the active fraction was analyzed by Ultra performance liquid chromatography tandem time of flight mass spectrometry(UPLC-Q-TOF/MS).Results:The ethyl acetate extraction part is the active fraction of hawthorn seed for anti-bacterial and anti-oxidative.A total of 21 chemical components were inferred from the active fraction by LC-MS/MS analysis,including 16 lignans,3 phenylpropanoids and 2 flavonoids.Conclusion:Lignans are the main medicinal effective ingredients of hawthorn seeds and deserve in-depth study.
Keywords Hawthorn seeds; Anti-bacterial; Anti-oxidative; Ultra performance liquid chromatography-tandem mass spectrometry; Lignans
中图分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.17.003
山楂为蔷薇科植物山楂(Crataegus pinnatifida Bge.)或山里红(Crataegus Pinniatifidia Bge.var.major N.E.Br.)的干燥果实[1]。山楂核为山楂的种子,药用历史悠久,始载于明代《滇南本草》,其药性平、味苦,归肝、胃经,具有消食、散结、催生、杀虫、止痒的功效,常用于食积不化、疝气、睾丸偏坠、难产、湿热下注等症[2]。许多医药古籍对山楂核都有记载,如《本草纲目》记载其“吞之,化食磨积,治癫疝”,并且提出其与橄榄核、荔枝核合用可治阴肾癫肿[3];《得配本草》记载其“核亦有用,化磨积食,治疝催生”[4]。作为中国传统的药食两用品种,人们已经对山楂进行了广泛的研究[5],而山楂核却常被作为工业废物而丢弃[6]。现代研究表明,山楂核富含木脂素、黄酮和三萜类成分,具有抗菌、抗炎、降血脂等藥理活性[7-9]。然而,目前山楂核的主要相关产品只有基于其干馏工艺的抑菌液,红核妇洁洗液和蔷薇红液[10-11],且存在味道刺鼻的缺点。已有研究表明,山楂核总黄酮对2,2-二苯基-1-三硝基苯肼[2,2-diphenyl-1-(2,4,6-trinitrophenyl)-hydrazinyl,DPPH]和羟基自由基(Hydroxyl Radical,·OH)均有一定的清除力,并对Fe3+有较强的还原能力[12],从山楂核中分离得到的一些芳香族化合物也具有较强的自由基清除活性[13]。为使山楂核资源变废为宝,我们对山楂核醇提物及不同极性萃取部位的抗菌和抗氧化活性进行了评价,筛选得到山楂核抗菌和抗氧化活性部位,并采用LC-MS/MS技术对其活性部位化学成分进行分析,推测其药效物质基础,为山楂核的深入开发利用提供依据。
1 仪器与试药
1.1 仪器 超高液相色谱仪(Waters公司,美国,型号:Acquity UPLC H-CLASS);高分辨飞行时间质谱仪(Waters公司,美国,型号:Xevo G2-S QTOF);数据采集与处理采用Mass Lynx V4.1软件;生物安全柜(苏州净化设备有限公司,型号:BSC-1000 II B2);恒温培养箱(上海一恒科学仪器有限公司,型号:LRH-1000L);倒置显微镜(德国徕卡,型号:DMI3000);酶标仪(美国赛默飞世尔科技公司,型号:Multiskan Go1510);可调微量移液器(Eppendorf公司,德国,货号:3120000240);十万分之一电子分析天平(瑞士梅特勒-托利多公司,型号:XS105DU);万分之一电子分析天平(瑞士梅特勒-托利多公司,型号:XSE104);电子天平[上海越平科学仪器(苏州)制造有限公司,型号:YP20002];旋转蒸发仪(上海爱朗仪器有限公司,型号:N-1300);数控超声波清洗器(昆山市超声仪器有限公司,型号:KQ-250DB);NEST 96孔深孔板(广州市百菱生物科技有限公司,货号:503501)。
1.2 材料 甲醇(批号:205308)、乙腈(批号:205302)为色谱级,购自美国Fisher公司;甲酸(美国Tedia公司,批号:20C8562)为色谱级;纯净水(屈臣氏集团香港有限公司,批号:20210726);三水合乙酸钠(批号:20191127)、无水乙酸钠(批号:20180307)、氢氧化钠(批号:20140318)、乙酸乙酯(批号:20200914)、甲醇(批号:20201127)、冰乙酸(批号:20200616)和盐酸(批号:20201106)等试剂均为分析纯,购自国药集团化学试剂有限公司;红色毛癣菌(ATCC公司,美国,货号:MYA-4438);马铃薯葡萄糖琼脂培养基(PDA培养基,货号:PDA1358)、沙氏葡萄糖琼脂培养基(SDA培养基,货号:HB0253-81)购自英国OXOID公司;RPMI-1640液体培养基(Thermo Fisher,美国,货号:00883);二甲基亚砜(Dimethyl Sulfoxide,DMSO,批号:20190218)、DPPH(批号:W27F10E81251)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS](批号:K18N8M48402)、2,4,6-三吡啶基三嗪(2,4,6-tripyridyl triazine,TPTN)(批号:M19M7E14190)、阳性对照VC(批号:J21S9R70775)和氟康唑(批号:HY-B0101)均购自上海源叶生物有限公司;FeSO4·7H2O(北京化工厂,批号:20180719);FeCl3·6H2O(北京市朝阳通惠化工厂,批号:20190418)。
1.3 分析样品 山楂核由山西振東制药有限公司提供(批号:20191011),由中国中医科学院中药研究所李春研究员鉴定为蔷薇科植物山楂(Crataegus pinnatifida Bge.)的种子。
2 方法与结果
2.1 山楂核乙醇提取物和各萃取部位的制备 山楂核粗粉1 kg,加8倍量70%乙醇回流提取2次,1.5 h/次,过滤,合并2次的滤液,回收乙醇至无醇味并浓缩至2 L,取其中500 mL收干得到浸膏,作为乙醇提取物,备用。剩余1 500 mL水液依次用同等体积的石油醚、乙酸乙酯和正丁醇萃取,减压回收溶剂得石油醚萃取部位2.76 g,乙酸乙酯萃取部位18.24 g,正丁醇萃取部位10.32 g,以及剩余水部位5.23 g。
2.2 抗红色毛癣菌活性研究
2.2.1 样品工作液的制备 取2.1项下各部位样品适量,精密称定,加DMSO溶解样品至浓度为20 mg/mL,用RPMI-1640液体培养基稀释至2 mg/mL,经0.2 μm无菌滤膜过滤至无菌Ep管作为样品工作液。
2.2.2 菌接种液的制备 将受试的皮肤癣菌接种于PDA斜面上,28 ℃培养7~14 d。吸取2 mL无菌的0.9%的NaCl溶液,轻轻冲洗菌落表面的菌丝和孢子,吸取菌液转移至无菌试管中,振荡器上振荡15 s,将含有菌丝和孢子的冲洗液用血细胞计数板计数,将其浓度调至0.5×105~1.5×105 CFU/mL之间,用RPMI-1640培养基稀释50倍,备用。
2.2.3 接种 参考改良的CLSI M38-A2方法[14],向96孔板中第2~11列各加入100 μL RPMI-1640液体培养基,取200 μL样品工作液加入第1列,取第1列孔中100 μL液体加入第2列孔中混匀,再取第2列孔中100 μL液体加入第3列孔中混匀,依序配制后续至第10列各列孔中的样品,吸取第10列孔中液体100 μL弃掉0,第12列孔中加入200 μL RPMI-1640培养基。96孔板的第1~11列孔中各加入红色毛癣菌工作液100 μL。至此,第1~11列孔中红色毛癣菌孢子浓度500~1 500 CFU/mL,样品浓度依次为1 000、500、250、125、62.5、31.3、15.6、7.8、3.9、2、0 μg/mL。阳性对照氟康唑的浓度依次为64、32、16、8、4、2、1、0.5、0.25、0.125、0 μg/mL。第1~10列为样品孔,第11列为正常生长对照,第12列为空白对照。
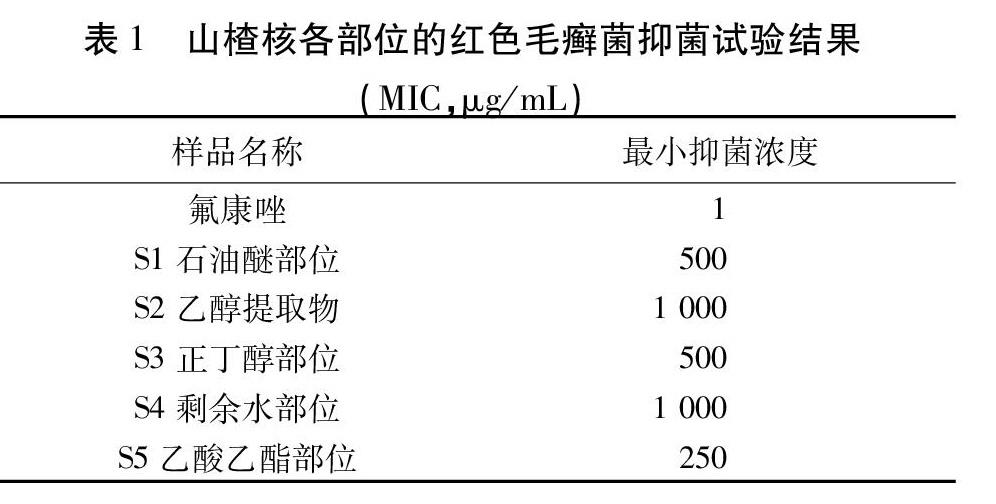
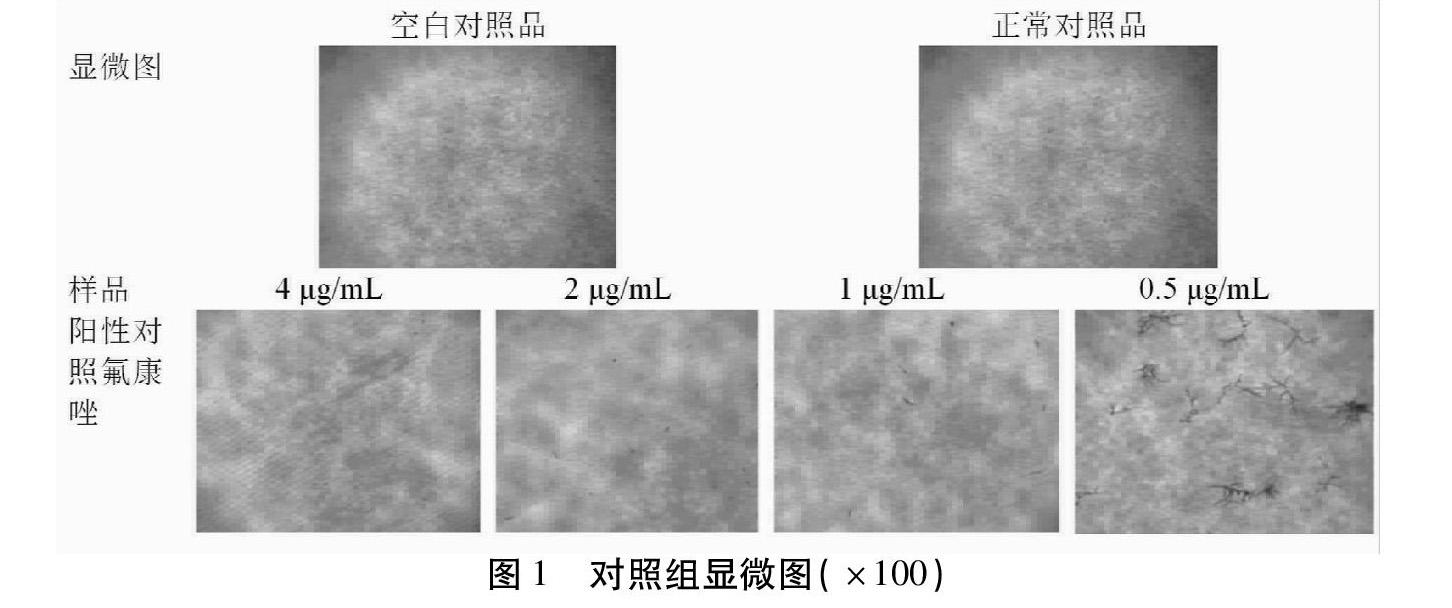
2.2.4 培养条件和结果判定 35 ℃恒温静止培养4 d,显微镜下观察各孔中是否有菌丝。与正常生长对照比较,出现80%以上生长抑制的浓度为对红色毛癣菌的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)值。倒置显微镜下拍照结果见图1和2(物镜×10,目镜×10)。山楂核各部位的MIC值见表1。
结果表明,乙酸乙酯萃取部位是山楂核抑制红色毛癣菌的活性部位。
2.3 抗氧化活性
2.3.1 样品溶液的制备 称取2.1项下的各部位样品约50 mg,精密称定,加70%乙醇配制成浓度约为5 mg/mL的样品溶液,作为储备液,备用。
2.3.2 DPPH自由基清除能力测定 参照Mukazayire等[15]的方法并略加改动。96孔板中依次加入100 μL DPPH工作液(浓度为0.1 mg/mL,溶剂为无水乙醇)和100 μL各样品溶液(浓度分别为5、2.5、1.25、0.625、0.312 5、0.156 3、0.031 25、0.006 25 mg/mL,均由5 mg/mL的储备液稀释而得),37 ℃避光静置30 min,空白组用溶剂代替DPPH工作液,对照组用溶剂代替样品溶液,于517 nm处测定吸光度。每组样品重复3次,求吸光度的平均值。以VC为阳性对照(浓度分别为0.2、0.1、0.05、0.025、0.012 5、0.006 25、0.003 125 mg/mL),结果以清除率表示。
清除率(%)=[1-(A样-A对)/A空]×100%
2.3.3 ABTS自由基清除能力测定 参考Ozgen等[16]的测定方法进行。于96孔板中依次加入140 μL的ABTS工作液(浓度为2.45 mmol/L的K2S2O8储备液和浓度为7.4 mmol/L的ABTS储备液各5 mL,混合摇匀,黑暗中室温静置12~16 h,用水稀释至吸光度为0.7±0.02,避光保存,现用现配)和60 μL不同浓度的样品溶液(浓度分别为1.25、0.625、0.312 5、0.156 3、0.031 25、0.006 25 mg/mL,均由5 mg/mL的储备液稀释而得),对照组用溶剂代替样品溶液,37 ℃下反应6 min,于734 nm处测定吸光度,每组样品重复3次,求吸光度的平均值。以VC为阳性对照(浓度同DPPH试验),结果以清除率表示。
清除率(%)=[(A样-A对)/A样]×100%
以山楂核各部位不同质量浓度对DPPH自由基和ABTS自由基清除率作图。见图3~4。应用SPSS 17.0统计软件进行数据处理,对DPPH和ABTS自由基的清除能力以IC50值大小表示。IC50值越小,表明受试物对2种自由基的清除率越好。见表2。
2.3.4 Fe3+还原能力测定 参考张舒婷等[17]的测定方法并略做改动。于96孔板中精密加入30 μL70%乙醇与180 μL FRAP(Ferric Ion Reducing Antioxidant Power)工作液(分别按10∶1∶1比例量取50 mL浓度为300 mmol/L醋酸盐缓冲液、5 mL浓度为10 mmol/L TPTZ工作液、5 mL浓度为20 mmol/L FeCl3溶液,混合摇匀,避光保存,现配现用)混合作为空白对照;30 μL样品溶液(浓度分别为5、2.5、0.625、0.312 5、0.156 3、0.031 25 mg/mL)与180 μL FRAP工作液混合为样品组;37 ℃孵育反应75 min后,于593 nm测定吸光度值A。以VC为阳性对照(浓度同DPPH试验)。每组样品重复3次,求吸光度的平均值。将不同浓度的FeSO4溶液代替样品溶液,同上操作测定A,以A为纵坐标,质量浓度为横坐标,绘制标准曲线,得回归方程A=1.597 2C+0.056 0(R2=0.992 5)。以公式A=A樣-A空白计算,代入上述标准曲线,计算FeSO4当量。FeSO4当量越大,表示样品的还原能力越强。以山楂核各部位质量浓度对相应部位求得的FeSO4当量作图。见图5。综合以上结果可知,乙酸乙酯萃取部位是山楂核的抗氧化活性部位。
2.4 活性部位的化学成分分析
前期试验结果表明,乙酸乙酯部位是山楂核发挥抗菌和抗氧化的活性部位,因此采用LC-MS/MS方法对乙酸乙酯萃取部位的化学成分进行推测。
2.4.1 供试品溶液的制备 取2.1项下乙酸乙酯萃取部位样品0.2 g,精密称定,加2 mL色谱甲醇超声溶解,溶液经0.22 μm微孔滤膜过滤,备用。
2.4.2 色谱-质谱条件 色谱条件:色谱柱:Waters UPLC C18(2.1 mm×100 mm,1.7 μm),流动相为乙腈(A)-0.01%甲酸(B),梯度洗脱,洗脱程序:0~9.5 min,8% A~26% A;9.5~14 min,26% A~40% A;14~20 min,40% A~100% A;检测波长:320 nm,流速0.2 mL/min,进样量2 μL,柱温30 ℃。质谱条件:电喷雾电离离子源(ESI);正离子模式扫描,毛细管电压3.0 kV,锥孔电压20 V,离子源温度100 ℃,脱溶剂气温度400 ℃,锥孔气流量为50 L/h,脱溶剂气流量700 L/h。低能量扫描传输碰撞能量为6 eV,高能量扫描传输碰撞能量为20 eV,扫描质量范围质荷比(m/z):100~1 500。
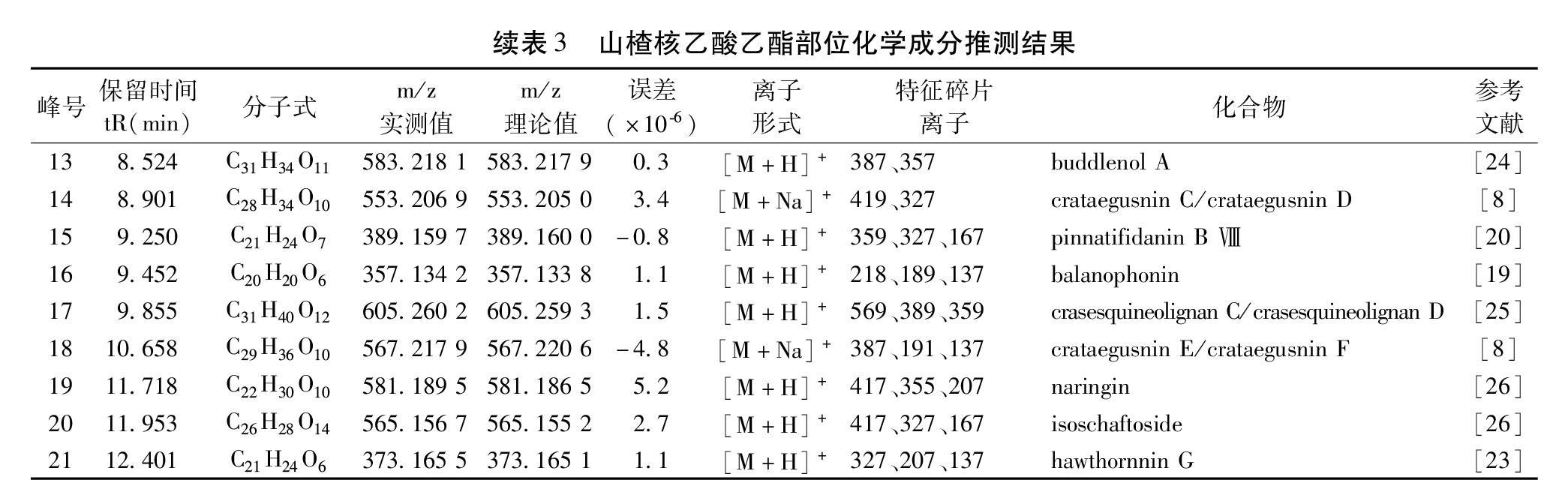
2.4.3 成分分析 山楂核乙酸乙酯部位的总离子流图见图6。运用MassLynx V4.1对正离子模式下色谱图进行分析处理,分子式匹配软件Elemental composition TM计算分子式,将各色谱峰的紫外光谱,一级质谱和二级质谱给出的离子信息与文献值进行比较,并经数据库检索对各色谱峰进行识别。结果见图6和表3。从山楂核乙酸乙酯部位共推测了21个化合物,其中16个为木脂素类,3个为苯丙素类,2个为黄酮类化合物。LC-MS分析结果显示,山楂核活性部位中主要化学成分为木脂素,类型以氧新木脂素和苯骈呋喃型新木脂素为主。
3 结论与讨论
红色毛癣菌(Trichophyton Rubrum)是临床最常见的皮肤癣菌,是浅部真菌病的主要病原菌,其中69.5%的皮肤癣菌病是由红色毛癣菌感染所致[27]。目前临床上皮肤癣菌耐药现象较为普遍,抗真菌药物的耐药性问题已经引起了国内外学者的高度重视和广泛研究,从传统中药中寻找新型抗真菌药物具有广阔的市场前景。研究结果表明,山楂核乙酸乙酯萃取部位对红色毛癣菌抑菌活性最好,MIC=250 μg/mL。在同一种评价体系中,不同极性萃取部位表现出不同的抗氧化能力,而在DPPH和ABTS自由基清除试验以及Fe3+还原能力试验3种不同的评价体系中,山楂核各萃取部位抗氧化活性趋势基本一致,乙酸乙酯萃取部位的抗氧化活性最好。综合分析可知,乙酸乙酯萃取部位是山楂核发挥抗红色毛癣菌和抗氧化的活性部位。LC-MS/MS分析结果表明该部位主要含有氧新木脂素和苯骈呋喃型新木脂素类成分,而木脂素类成分具有多种良好的生物活性,如肝脏保护、神经保护、抗炎、抗氧化和抗肿瘤等[28-29],因此今后应加强度对乙酸乙酯部位单体成分的分离鉴定和活性评价,以为深入开发利用山楂核资源奠定基础。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020:31.
[2]许洪波,唐志书,刘澳昕,等.山楂核化学成分与药理活性研究进展[J].中成药,2018,40(3):674-680.
[3]李时珍.本草纲目[M].张守康主校.北京:中国中医药出版社,1998:751-752.
[4]严洁,施雯,洪炜.得配本草[M].北京:人民卫生出版社,2007:185-186.
[5]史国玉,武卫红,商庆节,等.药食两用山楂的药理作用及保健应用研究进展[J].现代食品,2020,6(15):126-128.
[6]杜斌.山楂核综合利用试验研究[J].中国野生植物,1989,8(4):7-10.
[7]Huang XX,Bai M,Zhou L,et al.Food Byproducts as a New and Cheap Source of Bioactive Compounds:Lignans with Antioxidant and Anti-inflammatory Properties from Crataegus pinnatifida Seeds[J].J Agric Food Chem,2015,63(32):7252-7260.
[8]Peng Y,Lou LL,Liu SF,et al.Antioxidant and anti-inflammatory neolignans from the seeds of hawthorn[J].Bioorg Med Chem Lett,2016,26(22):5501-5506.
[9]顧军,庄桂东.山楂核黄酮的提取及其调血脂保健功能的研究[J].食品研究与开发,2003,24(5):83-84.
[10]王慧慧,夏军,董梦婷,等.红核妇洁洗液治疗需氧菌性阴道炎的疗效研究[J].中国实用妇科与产科杂志,2020,36(5):474-477.
[11]侯文欣,商闯,杨更亮,等.蔷薇红液中主要成分的GC-MS分析[J].安徽农业科学,2010,38(12):6209,6249.
[12]郭文娟,王娜,王娜娜,等.山楂核总黄酮的超声提取及抗氧化活性[J].精细化工,2016,33(2):152-156.
[13]程卓阳,周乐,刘思帆,等.山楂核中的芳香族化合物及其抗氧化活性[J].沈阳药科大学学报,2015,32(11):844-847.
[14]Qian X,Hamad B,Dias-Lalcaca G.The Alzheimer disease market[J].Nat Rev Drug Discov,2015,14(10):675-676.
[15]Mukazayire MJ,Tomani JC,Stévigny C,et al.Essential oils of four Rwandese hepatoprotective herbs:Gas chromatography-mass spectrometry analysis and antioxidant activities[J].Food Chem,2011,129(3):753-760.
[16]Ozgen M,Reese RN,Tulio AZ Jr,et al.Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(abts) method to measure antioxidant capacity of Selected small fruits and comparison to ferric reducing antioxidant power(FRAP) and 2,2′-diphenyl-1-picrylhydrazyl(DPPH) methods[J].J Agric Food Chem,2006,54(4):1151-1157.
[17]Zhang S,Cui Y,Li L,et al.Preparative HSCCC isolation of phloroglucinolysis products from grape seed polymeric proanthocyanidins as new powerful antioxidants[J].Food Chem,2015,188:422-429.
[18]Huang XX,Liu S,Lou LL,et al.Phenylpropanoids from Crataegus pinnatida and their chemotaxonomic importance[J].Biochem Syst Ecol,2014,54:208-212.
[19]Huang XX,Zhou CC,Li LZ,et al.Cytotoxic and antioxidant dihydrobenzofuran neolignans from the seeds of Crataegus pinnatifida[J].Fitoterapia,2013,91:217-223.
[20]Huang XX,Zhou CC,Li LZ,et al.The cytotoxicity of 8-O-4′ neolignans from the seeds of Crataegus pinnatifida[J].Bioorg Med Chem Lett,2013,23(20):5599-5604.
[21]羡冀,徐扬,罗显峰,等.山楂核化学成分的分离与鉴定[J].沈阳药科大学学报,2014,31(6):448-450,504.
[22]李殿明,黄肖霄,赵雷,等.山楂核化学成分的分离与鉴定Ⅰ[J].沈阳药科大学学报,2012,29(11):869-871,892.
[23]Huang XX,Bai M,Zhou L,et al.Food Byproducts as a New and Cheap Source of Bioactive Compounds:Lignans with Antioxidant and Anti-inflammatory Properties from Crataegus pinnatifida Seeds[J].J Agric Food Chem,2015,63(32):7252-7260.
[24]Li LZ,Peng Y,Niu C,et al.Isolation of cytotoxic compounds from the seeds of Crataegus pinnatifida[J].Chin J Nat Med,2013,11(4):411-414.
[25]Cheng ZY,Lou LL,Yang PY,et al.Seven new neuroprotective sesquineolignans isolated from the seeds of Crataegus pinnatifida[J].Fitoterapia,2019,133:225-230.
[26]潘廣彦,朱传合,乔聚林,等.快速高分离液相色谱/四级杆串联飞行时间质谱分析山楂籽中的主要黄酮成分[J].北京工商大学学报:自然科学版,2012,30(6):52-56.
[27]傅裕,鲍迎秋,常建民,等.红色毛癣菌的生物学特性和致病特点[J].中华全科医师杂志,2007,6(8):482-484.
[28]Teponno RB,Kusari S,Spiteller M.Recent advances in research on lignans and neolignans[J].Nat Prod Rep,2016,33(9):1044-1092.
[29]Zále ák F,Bon D,Pospí il J.Lignans and Neolignans:Plant secondary metabolites as a reservoir of biologically active substances[J].Pharmacol Res,2019,146:104284.
(2021-08-06收稿 责任编辑:王明)
