UPLC-MS/MS法测定人血浆中20(S)-原人参二醇的浓度
2021-09-28刘胜兰唐智陈磊吴素芬周玲廖音娟张杰
刘胜兰 唐智 陈磊 吴素芬 周玲 廖音娟 张杰
中圖分类号 R917;R593.22 文献标志码 A 文章编号 1001-0408(2021)18-2248-06
DOI 10.6039/j.issn.1001-0408.2021.18.12
摘 要 目的:建立测定人血浆中20(S)-原人参二醇(简称为“PPD”)浓度的方法。方法:血浆样品经乙腈沉淀蛋白后,以非那雄胺为内标,采用超高效液相色谱-串联质谱法测定。色谱柱为Waters ACQUITY UPLC HSS T3,流动相为5 mmol/L碳酸氢铵溶液-乙腈(梯度洗脱),流速为0.4 mL/min,柱温为40 ℃,进样量为10 μL;离子源为电喷雾离子源,以多反应监测模式(MRM)进行负离子扫描,用于定量分析的离子对分别为m/z 459.40→375.20(PPD)、m/z 371.30→315.30(内标)。同时将该法用于临床样品的测定。结果:PPD检测质量浓度的线性范围为0.25~30.00 ng/mL(r=0.999 2),定量下限为0.25 ng/mL;批内、批间RSD均小于10%,相对误差(RE)为-14.61%~12.69%;提取方法和基质效应均不影响PPD的定量测定。人参皂苷CK片100 mg组、人参皂苷CK片200 mg组、人参皂苷CK片300 mg组类风湿性关节炎患者口服相应药物第84天时的平均cmax分别为18.06、30.03、27.00 ng/mL,中位tmax分别为12.0、6.0、12.0 h,平均AUC0-t分别为622.52、668.15、1 155.97 ng·h/mL。结论:本研究成功建立了测定人血浆中PPD浓度的方法,且方法灵敏、准确、稳定,操作简便,血浆用量少,可用于临床样本的定量测定。
关键词 20(S)-原人参二醇;超高效液相色谱-串联质谱法;蛋白沉淀法;血药浓度
Determination of 20(S)-protopanaxadiol Concentration in Human Plasma by UPLC-MS/MS
LIU Shenglan1,TANG Zhi2,CHEN Lei3,WU Sufen3,ZHOU Ling2,LIAO Yinjuan1,ZHANG Jie4(1. Dept. of Pharmacy, Changsha Hospital of Hunan Normal University/the Fourth Hospital of Changsha, Changsha 410006, China; 2. Hunan Key Laboratory for Bioanalysis of Complex Matrix Samples, Changsha Duxact Biotech Co., Ltd., Changsha 410205, China; 3. Central Research Institute, Zhejiang Hisun Pharmaceutical Co., Ltd., Zhejiang Taizhou 318000, China; 4. Dept. of Pharmacy, the Third Xiangya Hospital of Central South University, Changsha 410013, China)
ABSTRACT OBJECTIVE: To establish the method for the determination of 20(S)-protopanaxadiol (PPD) concentration in human plasma. METHODS: Plasma samples were precipitated with acetonitrile and determined by UPLC-MS/MS, using finandrogen as internal standard. The determination was performed on Waters ACQUITY UPLC HSS T3 column with mobile phase consisted of 5 mmol/L ammonium bicarbonate aqueous solution-acetonitrile (gradient elution) at the flow rate of 0.4 mL/min. The column temperature was set at 40 ℃, and sample size was 10 μL. The ion source was electrospray ion source, and negative ion scanning was carried out with multiple reaction monitoring mode. The ion pairs used for quantitative analysis were m/z 459.40→375.20 (PPD) and m/z 371.30→315.30 (internal standard). At the same time, the method was applied to the determination of clinical samples. RESULTS: The linear range of PPD was 0.25-30.00 ng/mL (r=0.999 2), and the limit of quantitation was 0.25 ng/mL. RSDs of intra-batch and inter-batch were all lower than 10%, and relative errors (RE) were -14.61%-12.69%. Extraction method and matrix effect did not affect the quantitative determination of PPD. In ginsenoside CK 100 mg group, ginsenoside CK 200 mg group and ginsenoside CK 300 mg group, mean cmax of patients with rheumatoid arthritis after oral administration of corresponding drugs were 18.06, 30.03, 27.00 ng/mL; median tmax were 12.0, 6.0, 12.0 h; mean AUC0-t were 622.52, 668.15, 1 155.97 ng·h/mL. CONCLUTIONS: The method for the determination of PPD concentration in human plasma is successfully established. The method is sensitive, accurate, stable, easy to operate and less plasma consumption. It can be used for the quantitative determination of clinical samples.
KEYWORDS 20(S)-protopanaxadiol; UPLC-MS/MS; Protein
precipitation method; Plasma concentration
20(S)-原人参二醇[20(S)-PPD,以下简称“PPD”]为二醇型人参皂苷的苷元,是稀有人参二醇皂苷Rd、F2、Rg3、CK、Rh2的主要活性代谢产物[1],具有抗癌、抗抑郁、止血、激活氯离子通道和抑制钠离子通道去极化等诸多药理活性[2-5]。有报道称,人参皂苷CK在体内和体外均可被胃酸和/或肠道微生物进一步分解并转化为PPD,且PPD为二醇型人参皂苷活性最强的代谢产物[6]。对于人参皂苷CK等二醇型人参皂苷的临床药动学研究而言,准确、快速测定生物样品中PPD的浓度极为重要。
虽然,目前已有报道采用液相色谱-串联质谱法(LC-MS/MS)检测血浆中PPD的浓度,但大多数文献的前处理方法复杂,如液液萃取法[7-12]、固相萃取法[13]、柱前衍生化法[14]、基于C8-修饰内孔壁的磁性核-介孔壳微球制备法[15]等;也有文献采用蛋白沉淀法进行前处理,但其定量下限过高,且方法学验证不够全面[16-17]。随着临床试验伦理审核要求以及生物分析法规的不断提高和完善,文献报道的方法已经很难满足临床试验批量样品检测和现阶段法规的要求[18]。基于此,本研究采用蛋白沉淀法对血浆样品进行前处理,再结合超高效液相色谱-串联质谱法(UPLC-MS/MS)测定人血浆中PPD的质量浓度,并成功将此法应用于人参皂苷CK片的临床ⅠB期研究,现报道如下。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ACQUITY UPLC Ⅰ-Class型超高效液相色谱(UPLC)仪(美国Waters公司),AB Sciex 6500+型三重四极杆质谱仪及配备的电喷雾离子源(ESI)、Analyst 1.6.3数据处理软件(美国Applied Biosystem公司),MSA6.6S.CE型百万分之一电子天平(德国Sartorius公司),MilliQ Direct 8型超纯水仪(美国Millipore公司),ST16R型离心机(美国Thermo Fisher Scientific公司),Talboys型数显多管式涡旋振荡器(美国Troemner公司)等。
1.2 主要药品和试剂
人参皂苷CK片(规格50 mg)由浙江海正药业股份有限公司提供;PPD对照品(批号111747-201602,纯度96.6%)、非那雄胺对照品(内标,批号100611-201302,纯度99.6%)均购自中国食品药品检定研究院;甲醇(色谱纯)、乙腈(色谱纯)均购自德国Merck公司;碳酸氢铵(分析纯)购自天津科密欧化学试剂有限公司;其余试剂均为实验室常用规格或分析纯,水为超纯水。
1.3 空白血浆
人空白血浆和空白全血均从健康受试者中采集(伦理批件号快LS2017120502),溶血血浆采用空白血浆+空白全血配制而成(全血体积占比为2%),高脂血浆采用空白血浆+三酰甘油配制而成(三酰甘油含量≥3 mg/mL)。
2 方法与结果
2.1 色谱条件
以Waters ACQUITY UPLC HSS T3(2.1 mm×50 mm,1.8 ?m)为色谱柱,以5 mmol/L碳酸氢铵溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~0.5 min,60%A;0.5~2.5 min,60%A→15%A;2.5~3 min,15%A,3~4 min,15%A→60%A);流速为0.4 mL/min;柱温为40 ℃;自动进样器温度为10 ℃;进样量为10 μL。
2.2 质谱条件
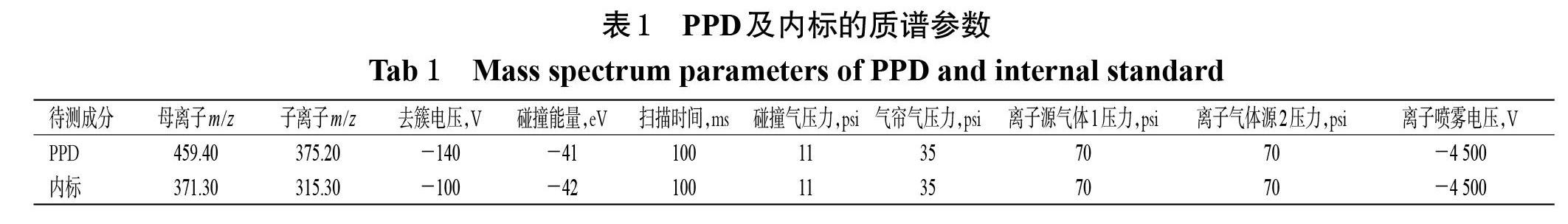
离子源为ESI,以多反应监测模式(MRM)进行负离子扫描,具体质谱参数见表1。
2.3 溶液制备
2.3.1 PPD标准溶液和质控溶液 称取PPD对照品适量,用50%乙腈溶解并稀释,制成质量浓度为0.500 mg/mL的贮备液。取该贮备液适量,用50%乙腈稀释,制成质量浓度分别为600、480、240、120、60、30、10、5 ng/mL的系列标准溶液和质量浓度分别为450、90、15、5 ng/mL的质控溶液。
2.3.2 内标工作液 称取内标对照品适量,用50%乙腈溶解并稀释,制成质量浓度为0.200 mg/mL的贮备液。取该贮备液适量,用乙腈(沉淀剂)稀释,制成质量浓度为10 ng/mL的内标工作液。
2.4 血浆样品前处理
取血浆样品200 ?L,加入内标工作液(空白样品以乙腈替代)600 ?L,振荡30 s,以13 500 r/min離心8 min,取上清液进样分析。
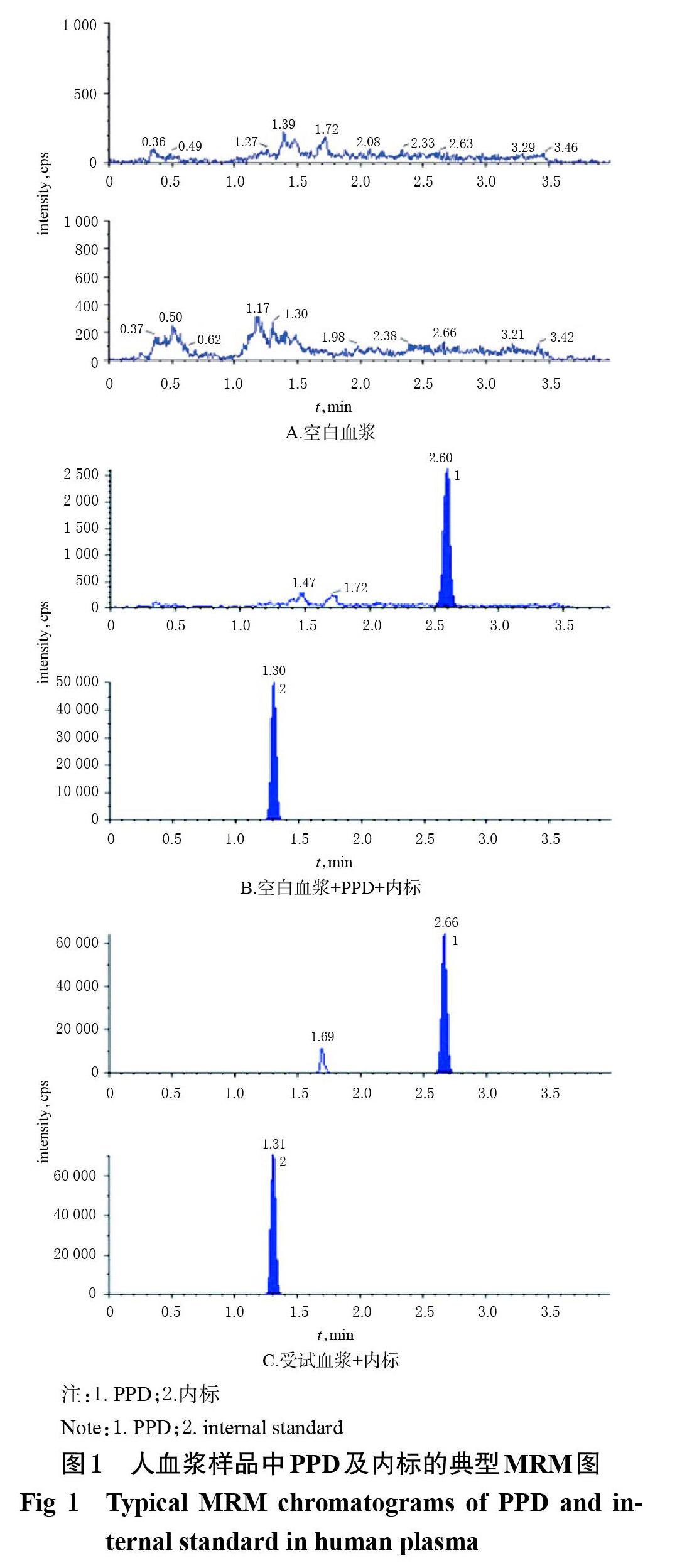
2.5 专属性考察
取6份不同来源的空白血浆,按“2.4”项下方法处理后,再按“2.1”“2.2”项下条件进样分析,得图1A;另取不同来源的空白血浆各190 ?L,精密加入PPD标准溶液(5 ng/mL)10 ?L,涡旋混匀,按“2.4”项下方法处理后,进样分析,得图1B。另取受试血浆(给药后24 h采集)适量,按“2.4”项下方法处理后,进样分析,得图1C。由图1可见,PPD和内标的分离度良好,内源性物质对其定量分析无干扰,表明本方法专属性良好。
2.6 线性范围与定量下限考察
取空白血浆190 μL,精密加入“2.3.1”项下PPD系列标准溶液各10 ?L,涡旋混匀,制成PPD质量浓度分别为0.25、0.50、1.50、3.00、6.00、12.00、24.00、30.00 ng/mL的系列标准血浆样品,按“2.4”项下方法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面积。以PPD质量浓度为横坐标(x,ng/mL)、PPD与内标的峰面积比值为纵坐标(y)进行线性回归,得回归方程为y=0.241 0x+0.016 6(r=0.999 2)。结果显示,PPD检测质量浓度的线性范围为0.25~30.00 ng/mL,定量下限为0.25 ng/mL。
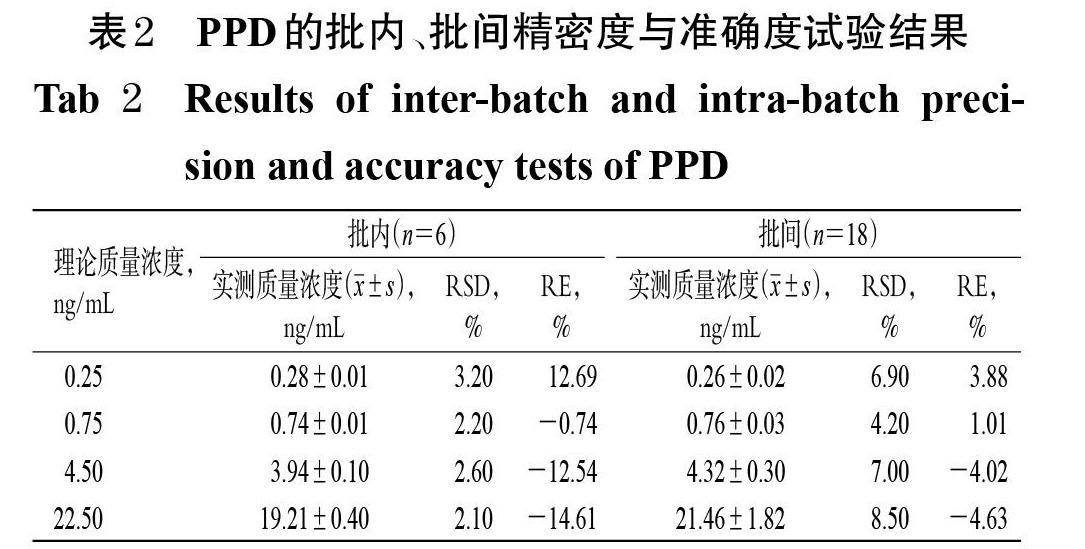
2.7 精密度与准确度考察
取“2.3.1”项下PPD质控溶液,按“2.6”项下方法制成定量下限质量浓度(0.25 ng/mL)和低、中、高质量浓度(0.75、4.50、22.50 ng/mL)的质控血浆样品,按“2.4”项下方法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面积。每个分析批平行操作6个样品、连续操作3个分析批,分别根据随行批标准曲线计算各质控血浆样品中待测物的实测质量浓度,计算批内、批间精密度[以相对标准偏差(RSD)表示]和准确度[以相对误差(RE)表示]。结果显示,各样品批内、批间RSD均小于10%,RE为-14.61%~12.69%,详见表2。
2.8 提取回收率与基质效应考察
按“2.6”项下方法配制PPD低、中、高质量浓度(0.75、4.50、22.50 ng/mL)的质控血浆样品各6份,按“2.4”項下方法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面积(A)。将不同来源的空白血浆、溶血血浆、高脂血浆按“2.4”项下方法处理后,加入相应质量浓度的PPD标准溶液,使最终质量浓度与前者对应,再按“2.1”“2.2”项下条件进样测定,记录峰面积(B)。分别用50%乙腈配制含内标且质量浓度与前者对应的PPD标准溶液,按“2.1”“2.2”项下条件进样测定,记录峰面积(C)。按下式计算提取回收率和基质效应:提取回收率(%)=A/B×100%,基质效应=B/C。结果显示,PPD和内标的提取回收率为(98.43±6.39)%~(103.90±0.89)%,RSD均小于10%;PPD和内标在空白血浆、溶血血浆、高脂血浆中的基质效应分别为(0.87±0.03)~(1.07±0.06)、(0.88±0.03)~(0.99±0.14)、(0.92±0.06)~(1.12±0.09),RSD均小于10%,详见表3。
2.9 稳定性试验
按“2.6”项下方法配制PPD低、高质量浓度(0.75、22.50 ng/mL)的质控血浆样品各6份,考察其处理前在室温下放置24 h、反复冻融(-70 ℃~室温)4次、 -20 ℃下冻存13 d、-70 ℃下长期冻存192 d的稳定性,处理后在进样器条件(10 ℃)下放置27 h的稳定性,处理后在进样条件(10 ℃)下放置24 h再进样的稳定性,全血样品(用空白全血配制的含PPD的全血样品)处理前在室温下放置2 h的稳定性,PPD贮备液在室温下放置33 h、4 ℃下放置66 d的稳定性,PPD标准溶液在室温下放置33 h、4 ℃下放置8 d的稳定性。结果显示,在上述条件下,各样品实测质量浓度与理论质量浓度的RE均在±10%以内,表明PPD在样品采集、运输、储存及分析过程所涉及的各个环节中均具有良好的稳定性。
2.10 稀释可靠性考察
按“2.6”项下方法配制PPD质量浓度为60 ng/mL的标准血浆样品,用空白血浆稀释5倍,按“2.4”项下方法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面积。按此稀释倍数平行操作6份,以考察稀释是否会对待测物的定量分析造成影响。结果显示,实测质量与理论质量浓度的RE为0.01%,实测质量浓度的RSD为3.98%(n=6),提示血浆样品经空白血浆稀释5倍不会影响其定量分析。
2.11 分析批长度考察
按“2.6”项下方法配制线性范围内且含PPD及内标的血浆样品,均匀穿插在质控血浆样品之间进样测定,可重复进样,考察分析批长度。结果显示,该分析批至少可以连续进样160个样品,其质控血浆样品的实测质量浓度均在理论质量浓度的±15%之内。
2.12 测定方法的应用
2.12.1 给药方案与血样采集 在一项多中心、随机、双盲、多剂量、平行的人参皂苷CK片用于类风湿性关节炎(RA)患者安全性、药动学和初步疗效的ⅠB期临床研究试验(伦理批准号2013L01910)中,共有受试者3组:人参皂苷CK片100 mg组(6例)、人参皂苷CK片200 mg组(5例)、人参皂苷CK片300 mg组(5例)。各组受试者均于每天早餐后2 h给药1次,连续给药84 d。每例参加药动学试验的受试者除筛选前(基线)及各次随访给药前(0、2、4、8、12周)采血5 mL用于血药浓度测定外,还均分别于第1天服药前30 min及服药后0.25、0.5、1、1.5、2、3、4、6、8、12、24 h采血5 mL以及于末次服药前30 min及服药后0.25、0.5、1、1.5、2、3、4、6、8、12、24、48、72、96 h采血5 mL用于血药浓度测定。使用含乙二胺四乙酸二钾(EDTA-K2)抗凝剂的真空采血管采集血样,于4 ℃下以3 000 r/min离心10 min,分离血浆,-70 ℃保存,待测。
2.12.2 样品测定及数据分析 取3个剂量组受试者各采血点的血浆样品,稀释至线性范围内,按“2.4”项下方法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面积。使用AB Analyst 1.6.3软件对数据进行采集和定量分析,通过随行标准曲线计算各待测样品中PPD的质量浓度,得到3个剂量组受试者给药第1天和给药第84天PPD的平均药-时曲线,见图2(图中小图为局部放大图);采用Phoenix WinNolin 7.0药动学软件中的非房室模型计算3个剂量组受试者的药动学参数,原始数据取自然对数后再进行比较,结果见表4(由于本研究纳入的样本例数较少,导致数据离散程度较大,从而导致部分数据的标准差大于均值)。
3 讨论
3.1 流动相的选择
PPD采用负离子模式检测,一般情况下,碱性流动相有利于其离子化,但碱性条件不利于化合物与基质中的酸性物质分离,容易出现明显的基质效应。所以在方法建立的过程中,本课题组分别对酸性流动相、碱性流动相进行了考察。结果显示,在酸性流动相条件下,PPD的检测受基质影响较小,但响应也明显减弱,定量下限无法满足检测要求;在碱性流动相条件下,所得色谱峰的响应较强,噪音明显弱于酸性流动相,并且基质效应满足检测要求。另外,在碱性流动相的选择中,本课题组还分别考察了氨水和碳酸氢铵作为pH调节剂的效果。结果显示,当用氨水作为pH调节剂时,随着分析批进样数量的增加、进样时间的延长,PPD的出峰时间和响应均不稳定,其原因可能是流动相中氨水挥发,导致流动相的pH发生改变所致;而用碳酸氢铵作为pH调节剂时,因为其是缓冲盐,在室温条件下基本不会挥发,使得流动相的pH相对稳定,所以本方法最终选择5 mmol/L碳酸氢铵溶液作为水相。碳酸氢铵于湿度25%~75%的室温下保存,使用期限为2 d。
3.2 前处理方法的选择
在方法建立阶段,本课题组参考文献[7-12]采用液液萃取法进行样品前处理,但发现该方法提取回收率不高、处理步骤繁琐,而且血浆用量较大。由于本研究涉及临床Ⅰ期试验,临床样品量较大且后期试验周期较长,故有必要探索蛋白沉淀法作为样品前处理的可行性。结合液相条件优化、内标选择,本课题组发现,采用乙腈沉淀可以满足本研究大样本检测的要求,同时具有处理过程简单、效率高、血浆用量少的优点,且回收率明显高于液液萃取法且更稳定[19],故最终采用该法进行样品前处理。
3.3 基质效应的改善
蛋白沉淀法的缺点是基质效应明显[19]。为了尽可能消除基质的影响,本研究首先采用梯度洗脱方式,通过优化水相和有机相的比例、调整两者比例变化的快慢,尽可能地将PPD与基质中的干扰物分离,从而减小基质的影响;其次,筛选合适的内标,通过比较地高辛、地塞米松、氯唑沙宗、非那雄胺等多个化合物,最终确定非那雄胺最为合适;最后,在满足测定条件的前提下尽可能增加沉淀剂体积,一般情况下沉淀剂乙腈-血浆体积比超过1.5 ∶ 1即可满足蛋白沉淀的要求,但在这种情况下基质的影响也较大,所以本方法采用乙腈-血浆体积比3 ∶ 1进行沉淀,以进一步减小基质的影响。
3.4 定量方法的应用
不同剂量人参皂苷CK片在RA患者体内的药动学试验结果均表明,与给药第1天比较,代谢产物PPD在多剂量给药第84天时的cmax和AUC0-t均明显增加,tmax明显缩短,说明PPD在体内可能存在蓄积现象,与已有文献[20]报道相符。
本研究建立的PPD定量分析方法按照国内外相关指导原则[18,21-22]进行了完整的方法学验证,包括全血稳定性、分析批长度等,而迄今已报道的PPD浓度测定方法均没有全血稳定性考察。本研究建立的方法已成功用于人参皂苷CK片的临床ⅠB期研究,且在临床试验样品检测过程中还开展了试验样品再分析(ISR)检测,ISR为100%。
综上所述,本研究成功建立了人血浆中PPD浓度的测定方法,且方法灵敏、准確、稳定,操作简便,血浆用量少,可用于人参皂苷CK等二醇型人参皂苷的临床药动学研究。
参考文献
[ 1 ] 韩铭鑫,李方彤,张琰,等.稀有原人参二醇型皂苷的人肠道菌群生物转化[J].高等学校化学学报,2019,40(7):1390-1396.
[ 2 ] PENG B,HE R,XU Q,et al. Ginsenoside 20(S)-protopanaxadiol inhibits triple-negative breast cancer metastasis in vivo by targeting EGFR-mediated MAPK pathway[J]. Pharmacol Res,2019,142:1-13.
[ 3 ] ZHANG Y L,ZHANG R,XU H L,et al. 20(S)-protopanaxadiol triggers mitochondrial-mediated apoptosis in human lung adenocarcinoma A549 cells via inhibiting the PI3K/Akt signaling pathway[J]. Am J Chin Med,2013,41(5):1137-1152.
[ 4 ] JIANG N,JINGWEI L,WANG H,et al. Ginsenoside 20(S)-protopanaxadiol attenuates depressive-like behaviour and neuroinflammation in chronic unpredictable mild stress-induced depressive rats[J]. Behav Brain Res,2020,393:112710.
[ 5 ] ZHANG H,PAN D,WU X,et al. Platelet protease activa- ted receptor 1 is involved in the hemostatic effect of 20(S)-protopanaxadiol by regulating calcium signaling[J]. Front Pharmacol,2020,11:549150.
[ 6 ] CHEN M Y,SHAO L,ZHANG W,et al. Metabolic analysis of Panax notoginseng saponins with gut microbiota- mediated biotransformation by HPLC-DAD-Q-TOF-MS/MS
[J]. J Pharm Biomed Anal,2018,150:199-207.
[ 7 ] YANG L,WANG C,XIE X,et al. LC-MS/MS determination of ginsenoside compound K and its metabolite 20(S)-protopanaxadiol in human plasma and urine:applications in a clinical study[J]. Bioanalysis,2019,11(5):365- 380.
[ 8 ] JIN S,JEON J,LEE S,et al. Detection of 13 ginsenosides(Rb1,Rb2,Rc,Rd,Re,Rf,Rg1,Rg3,Rh2,F1,compound K,20(S)-protopanaxadiol,and 20(S)-protopanaxatriol)in human plasma and application of the analytical method to human pharmacokinetic studies following two week-repeated administration of red ginseng extract[J]. Molecules,2019,24(14):2618.
[ 9 ] LING J,YU Y,ZHU J,et al. A highly sensitive HPLC- MS/MS method for quantification of 20(S)-protopanaxadiol in human plasma and its application in phase ⅡA clinical trial of a novel antidepressant agent[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2016,1031:214-220.
[10] 金鑫,張振海,孙娥,等.原人参二醇脂质立方液晶纳米粒在大鼠体内的药动学研究[J].中国中药杂志,2013,38(2):263-268.
[11] XIE F,LI S,CHENG Z,et al. Determination of 20(S)-protopanaxadiol in human plasma by HPLC-MS/MS:application to a pharmacokinetic study[J]. Acta Pharmaceutica Sinica B,2013,3(6):385-391.
[12] WANG W,SHAO Y,MA S,et al. Determination of 20(S)-protopanaxadiol ocotillol type epimers in rat plasma by liquid chromatography tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2012,887/888:19-24.
[13] HAN M,CHEN J,CHEN S,et al. Development of a UPLC-ESI-MS/MS assay for 20(S)-protopanaxadiol and pharmacokinetic application of its two formulations in rats[J]. Anal Sci,2010,26(7):749-753.
[14] ZHAO X E,LV T,ZHU S,et al. Dual ultrasonic-assisted dispersive liquid-liquid microextraction coupled with microwave-assisted derivatization for simultaneous determination of 20(S)-protopanaxadiol and 20(S)-protopanaxatriol by ultra high performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A,2016,1437:49-57.
[15] LING J,YU Y,FENG J,et al. Restricted access magnetic core-mesoporous shell microspheres with C8-modified interior pore walls for the identification of 20(S)-protopanaxadiol metabolites in rat plasma using UPLC-Q-TOF-
MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2017,1054:73-79.
[16] BAO Y,WANG Q,TANG P. Lithium adduct as precursor ion for sensitive and rapid quantification of 20(S)-protopanaxadiol in rat plasma by liquid chromatography/qua- drupole linear ion trap mass spectrometry and application to rat pharmacokinetic study[J]. J Mass Spectrom,2013,48(3):399-405.
[17] LI J Q,WANG J F,LI J,et al. Simultaneous determination of 20(S)-protopanaxadiol and its three metabolites in rat plasma by LC-MS/MS:application to their pharmacokine- tic studies[J]. Biomed Chromatogr,2018,32(8):e4252.
[18] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[19] VOELKER T,MENG M. Handbook of LC-MS bioanalysis[M].Shoboken,New Jersey:John Wiley & Sons,2013:170.
[20] CHEN L,ZHOU L,HUANG J,et al. Single- and multiple-dose trials to determine the pharmacokinetics,safety,tolerability,and sex effect of oral ginsenoside compound k in healthy chinese volunteers[J]. Front Pharmacol,2018,8:965.
[21] Food and Drug Administration. Bioanalytical method validation guidance for industry[S]. 2018-05.
[22] European Medicines Agency. Guideline on bioanalytical method validation[S]. 2011-07-21.
(收稿日期:2021-05-25 修回日期:2021-08-26)
(编辑:邹丽娟)
