色素辣椒InDel-PCR反应体系优化及引物筛选
2021-09-28李辉玲董洁张国儒火顺利叶远荣杜珊珊张建文
李辉玲 董洁 张国儒 火顺利 叶远荣 杜珊珊 张建文

摘要:为建立和优化色素辣椒的InDel标记PCR反应体系,筛选多态性良好且重复性高的引物,为InDel分子标记在色素辣椒辅助育种、品种纯度鉴定及遗传多样性分析等提供可靠的技术支持。采用正交试验、单因素试验方法,对影响扩增体系中的模板DNA用量、引物浓度、2×Taq PCR Mix添加量等参数进行3因素4水平的正交试验比较分析,对循环数进行单因素试验优化分析。结果表明,对InDel-PCR体系扩增结果的影响程度中引物浓度最大,其次是模板DNA用量,而2×Taq PCR Mix添加量的影响不大。根据检测结果,出于成本和模板DNA用量的考虑,确定最佳InDel-PCR反应体系(10 μL):模板DNA用量为35 ng、引物浓度为0.5 μmol/L、2×Taq PCR Mix添加量为5 μL。扩增程序:94 ℃预变性3 min;94 ℃变性30 s,退火30 s,72 ℃变性60 s,35个循环;72 ℃变性5 min;扩增产物在4 ℃保存。从240对InDel通用引物中最终筛选出14对适用于色素辣椒InDel-PCR候选引物。InDel标记是基于PCR的分子技术,选择适宜的引物及模板DNA浓度对扩增出清晰、稳定的条带很重要,优化后的10 μL InDel-PCR反应体系及扩增程序,成功筛选出14条多态性较高的InDel引物,为后续的色素辣椒分子标记研究提供了可靠技术依据。
关键词:色素辣椒;InDel-PCR;反应体系;引物筛选;扩增产物;参数优化
中图分类号:S641.303 文献标志码: A
文章编号:1002-1302(2021)18-0072-05
收稿日期:2020-12-30
基金项目:巴州财政支持基本科研业务经费(编号:202008、202104)。
作者简介:李辉玲(1988—),女,甘肃兰州人,硕士,助理研究员,主要从事特色作物的育种与栽培。E-mail:12354399@qq.com。
通信作者:张建文,硕士,副研究员,主要从事番茄、色素辣椒等作物的育种与栽培。E-mail:1220743143@qq.com。
辣椒(Cicer arietinum L.)为全球第三大作物,年产量约60亿kg[1]。近4年,我国辣椒平均年种植面积占世界辣椒总种植面积的35%,平均年产量占总产量的46%左右[2];辣椒产业已然跃升为我国最大的蔬菜产业[3-4]。近年来许多领域限制人工色素的使用,天然色素需求量呈现逐年增长趋势,据报道近年来辣椒红素的市场销售额年增长率一直保持在10%以上[4]。新疆色素辣椒在20世纪90年代开始在南北疆大范围、规模化种植,主要有线椒、板椒、牛角椒、羊角椒等品种。与其他辣椒产地相比,新疆具有光照充足且温差大的自然条件、机械化种植程度高、设施农业发展快速[5]等现实优点,这些都为色素辣椒的规模化生产提供了有利的先决条件,使其生产出的色素辣椒红色素含量和产量高、病虫害少而被国际市场青睐,成为新疆“红色产业”重要组成之一[6]。
InDel标记(insertion deletion length polymorphism)通过对比同一物种不同个体或近缘种间的DNA序列,根据同一位点上插入或缺失(insertion-deletion)的核苷酸片段设计引物并用PCR检测其多态性[7]。InDel标记具有共显性、特异性、可重复性、准确性和稳定性好且操作简单等优点[8],在动植物群体遗传分析、辅助育种等研究中得到了广泛运用[9-10]。目前为止,对InDel标记在色素辣椒PCR反应体系、扩增程序和引物筛选等方面进行综合性研究的报道很少。鉴于此,本试验通过正交及单因素试验,对反应体系中的引物浓度、模板DNA用量、2×Taq PCR Mix添加量、循环数、退火温度(Tm)等进行优化,旨在建立一套适用于色素辣椒InDel标记的最优反应体系,并从InDel分子标记通用引物中筛选有效引物,为色素辣椒品种鉴定、亲缘关系分析等分子标记辅助育种提供可靠的技术基础。
1 材料与方法
1.1 供试材料
8份色素辣椒种子均由巴音郭楞蒙古自治州农业科学研究院特色作物室提供,分别为B58、7-UC、MY、A27、FGH、HJZ、E8、B13(编号为1~8),于2020年10月在人工气候室播种育苗,每份材料育苗40株。
1.2 试验方法
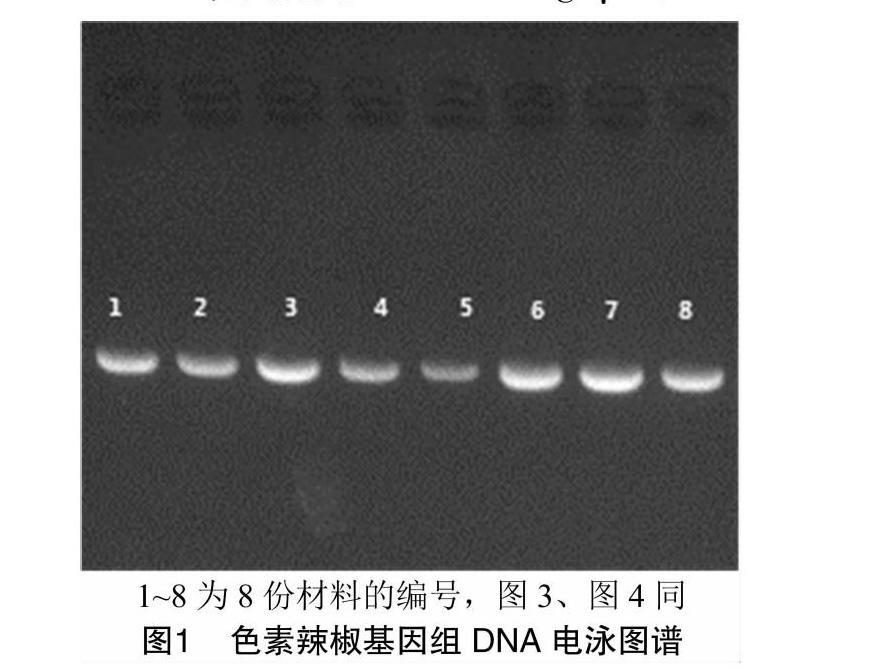
1.2.1 基因组DNA提取及检测 每个材料随机取至少10株幼苗的嫩叶于密封袋中,经液氮速冻后置于-80 ℃冰箱保存备用。提取时用组織研磨仪钢珠高频振荡破碎法进行破碎研磨后参照天根生化科技有限公司DNA提取试剂盒(目录号:DP320)的说明提取8份色素辣椒的DNA。具体试验步骤:液氮预冷研磨仪配套的离心管盒、离心管和钢珠等,称取0.4 g叶片置于离心管内,放置2个钢珠后盖好盖子,振荡破碎频率设置为1 800次/min,振荡 2 min,结束后用磁铁小心取出钢珠,依照试剂盒说明书的提取步骤获得叶片粉末基因组DNA。在 140 V 恒压下,用1%琼脂糖凝胶电泳15 min后,用凝胶成像系统检测并拍照。另用基因枪吸取1 μL DNA在核酸测定仪(NanoDrop-1000)上测定其质量及浓度,获取的DNA于-20 ℃保存备用。
1.2.2 引物设计与合成 参考文献[11]及新疆农业科学院园艺作物研究所测序结果,共设计240对引物,引物由生工生物工程(上海)股份有限公司合成。
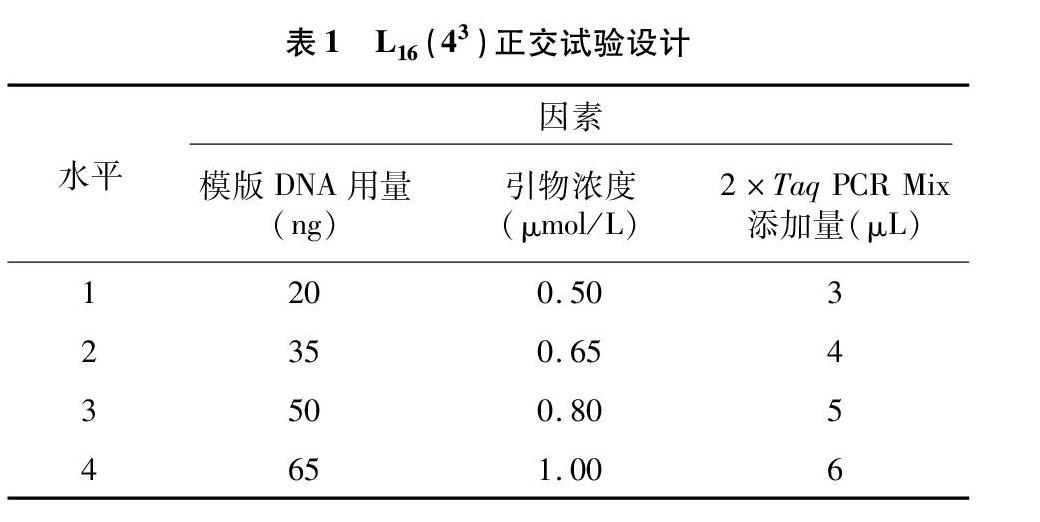
1.2.3 InDel-PCR扩增体系正交试验 PCR扩增在PCR扩增仪(Bio-Rad PCR仪)上进行。试验采用10 μL体系,引物浓度、DNA模板量和2×Taq PCR Mix按L16(43)正交试验设计(表1),以CIDH303为引物,总计16次试验。扩增程序为94 ℃ 预变性3 min;94 ℃变性30 s,退火30 s,72 ℃延伸60 s,30个循环;72 ℃延伸5 min,4 ℃冰箱保存扩增产物。
1.2.4 退火温度和循环数优化 由于引物数量较多且不同引物最适Tm不同,为提高效率且尽可能地考虑每对引物的Tm,可根据引物报告单上的退火温度初步设定范围。以CIDH303为引物,结合上述检测最优参数配比,对循环数进行单因素试验优化,设置梯度为25、35、40、45个循环。观察电泳图,选择多态性好且条带清晰的循环数。
1.2.5 电泳检测 采用6.0%的非变性聚丙烯酰胺凝胶来检测各个扩增产物,用北京六一电泳仪厂的DYY-12型电泳仪,在200 V恒定电压下电泳 80 min,结束后小心拆胶,用银染法显色直至条带清晰,在医用胶片观察灯下用数码相机拍照。参考尚小红等的直观分析法[12]对16个正交组合的电泳图谱中的条带进行打分,打分依据:1~4分(清晰条带少,杂带多,重复性差,背景模糊),5~8分(清晰条带多,有杂带,重复性好,背景比较干净),9~12分(清晰条带多,无杂带,重复性好,背景清晰),13~16分(清晰条带多,亮度强,无杂带,重复性好,背景清晰)。数据录入Excel 2016,通过分析16个组合的均值(k)和极差(R),得出最佳因素配比和各因素影响程度的大小。
1.2.6 引物筛选 以8份辣椒材料为模板、利用优化获得的最佳InDel-PCR反应体系和循环数,对文献[11]中提到的部分240条InDel引物进行筛选,筛选出条带清晰、稳定性良好、差异明显的引物作为色素辣椒InDel-PCR候选引物。
2 结果与分析
2.1 DNA模板的检测
如图1所示,电泳图谱中条带整齐清晰、带型一致、未见拖尾,样品间浓度较为均匀。核酸检测仪测定结果表明,所提DNA质量测定值D260 nm/D280 nm为 1.85~2.00,浓度为81~193 ng/μL。
2.2 InDel-PCR扩增体系正交试验的优化
扩增产物的电泳结果(图2)表明,16个处理组合的PCR均有条带显示,然而扩增效果存在明显差异。进行遗传多样性分析,要求扩增条带数量丰富、清晰度高。R越大,说明该因素对扩增效果影响越大,k越大,说明该水平下的扩增效果越好。由表2可知,各因素影响程度表现为引物浓度>模板DNA用量>2×Taq PCR Mix添加量,引物浓度为0.50 μmol/L、模板DNA用量为35 ng、2×Taq PCR Mix添加量为5 μL组合效果最好。综合考虑以第5组合为最佳组合,即10 μL体系:0.50 μmol/L 引物,35 ng模版DNA,5 μL 2×Taq PCR Mix。
2.3 循环数的优化
由图3可知,当循环数为25个时,扩增结果谱带模糊;当循环数达到35、40、45个时扩增谱带清晰易辨。综合考虑扩增总时长和谱带质量,最佳的循环数为35个。
2.4 引物筛选
以8份色素辣椒的DNA基因为模板,从240对InDel通用引物中最终筛选出14对有效引物(图4,表3)。
3 讨论
运用InDel分子标记技术分析不同作物种质资源的遗传多样性,分析结果的分辨率、可重复性和准确性都有很大程度的提高[13],从而在根本上解决了育种过程中时有发生的引种混乱、整理资源费时费力、育种材料间遗传背景相似性高、培育新品种艰难等问题[14]。采用正交设计能够用最少的试验次数来阐明各试验因素在不同水平间的相互作用,揭示各因素对扩增结果的影响程度和规律,由此得出最适宜的优化结果。
InDel分子标记具有多态性高、扩增条带简单稳定等优点,但扩增结果也受体系中各个因素、多水平的综合影响。引物浓度过低时扩增反应不完全,条带数量少并且不够清晰,无法进行有效扩增;浓度过高产生错配, 且形成大量引物二聚体导致非特
异性扩增产物增加。DNA模板量浓度太低会造成没有扩增产物、或者扩增条带不完全不稳定;模板量浓度过高又会增加反应体系中抑制反应的成分,出现非特异性扩增条带[15]。而扩增产量的多少很大程度上由循环次数决定。循环次数太少,扩增产物相应的减少不足以满足电泳需要,条带不清晰;循环次数过多,当反应物消耗完就会进行非特异性扩增。综合考虑扩增时间和带型质量,应选择较少的循环次数[16-17]。
本试验最终确定色素辣椒Indel-PCR最优反应体系(10 μL):模板DNA用量为35 ng、引物浓度为0.5 μmol/L、2×Taq PCR Mix添加量为5.0 μL,其余用 ddH2O补足。最佳擴增程序:94 ℃预变性 3 min;94 ℃变性30 s,不同引物的退火温度下退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸5 min。以上述最佳反应体系和扩增程序为基础, 进一步在240对通用引物中筛选出高多态性、重复性良好的14对InDel有效引物,为色素辣椒的品种鉴定、遗传多样性等分子辅助研究提供了理论和技术支持。
参考文献:
[1]刘 超. 中国加工辣椒产业现状及发展前景分析[J]. 食品安全导刊,2018(21):55.
[2]黄任中,黄启中,吕中华,等. 我国干制辣椒产业现状及发展对策[J]. 中国蔬菜,2015(2):9-11.
[3]郑井元,李雪峰,周书栋,等. 2017 年度辣椒科学研究进展[J]. 中国蔬菜,2018(5):9-15.
[4]FAO. FAO stat database[DB/OL].[2021-05-08]. http://faostat.fao.org.
[5]张建伟. 伊犁河谷色素辣椒产业发展前景及建议[J]. 新疆农业科技,2010(5):7.
[6]李 艳,王 亮,刘志刚. 新疆绿洲干旱区制干辣椒生产技术现状与产业发展对策[J]. 北方园艺,2014(13):189-192.
[7]杨 洁,赫 佳,王丹碧,等. InDel标记的研究和应用进展[J]. 生物多样性,2016,24(2):117-123.
[8]Jander G,Norris S R,Rounsley S D,et al. Arabidopsis map-based cloning in the post-genome era[J]. Plant Physiology,2002,129(2):440-450.
[9]冯芳君,罗利军,李 荧,等. 水稻InDel和SSR标记多态性的比较分析[J]. 分子植物育种,2005,3(5):725-730.
[10]冯芳君. SSR和InDel标记在水稻籼粳亚种分化与杂种纯度鉴定中的应用[D]. 武汉:华中农业大学,2006.
[11]Li W P,Cheng J W,Wu Z M,et al. An InDel-based linkage map of hot pepper(Capsicum annuum)[J].Molecular Breeding,2015,35:32.
[12]尚小红,严华兵,曹 升,等. 葛根SCoT-PCR反应体系优化及引物筛选[J]. 南方农业学报,2018,49(1):1-7.
[13]高 颖,罗双霞,王彦华,等. 大白菜抽薹开花时间与SSR和InDel 标记的关联分析[J]. 园艺学报,2012,39(6):1081-1089.
[14]Hayashi K,Yoshida H,Ashikawa I. Development of PCR-based allele-specific and InDel marker sets for nine rice blast resistance genes[J]. Theoretical and Applied Genetics,2006,113(2):251-260.
[15]郑道君,谢良商,曾建华,等. 海南龙血树ISSR-PCR反应体系建立与有效引物筛选[J]. 热带亚热带植物报,2011,19(2):177-183.
[16]王东娜,牟长城,冯富娟. 胡桃楸ISSR-PCR反应体系的建立及优化[J]. 实验室研究与探索,2010,29(11):18-22,37.
[17]李房英,黃彦晶,吴少华. 三角梅ISSR反应体系的建立和优化[J]. 海峡科学,2010(10):216-219.
