在质体中表达EPSPS赋予烟草草甘膦抗性
2021-09-27李凡路史展刘羽鑫林拥军吴高兵周菲
李凡,路史展,刘羽鑫,林拥军,吴高兵,周菲
1.华中农业大学作物遗传改良国家重点实验室,武汉 430070; 2.华中农业大学植物科学技术学院,武汉 430070
草甘膦又名N-(磷酸甲基)甘氨酸,是一种内吸传导型广谱系统性除草剂,自20世纪70年代以来,已成为全世界使用最广泛的除草剂[1]。5-烯醇式丙酮酰莽草酸-3-磷酸合酶(5-enolpyruvylshikimate-3-phosphate synthase,EPSPS)是一种由核编码的叶绿体定位蛋白,它参与植物、微生物体内重要的莽草酸代谢途径,通过催化磷酸烯醇丙酮酸(phosphoenolpyruvate,PEP)的烯醇丙酮酰基转移至莽草酸-3-磷酸(shikimate-3-phosphate,S3P)的5-OH处合成5-烯醇丙酮酰莽草酸-3-磷酸(5-enolpyruvylshikimate-3-phosphate,EPSP)[2]。草甘膦不直接与游离的EPSPS酶结合[3-4],而是形成EPSPS-S3P-复合物,竞争性抑制PEP的结合[5-6],阻断莽草酸途径,抑制下游芳香族氨基酸合成,从而导致蛋白合成受阻、次生代谢产物缺乏,最终造成植物死亡。研究表明,莽草酸途径具有低毒性,且在人和哺乳动物中尚未发现该途径,因此,认为草甘膦对人畜基本没有毒性[7],是培育耐除草剂作物的优良靶标除草剂。
AroAI.va*基因是由华中农业大学生命科学技术学院刘子铎教授团队从放线菌属变异白蚁菌(Isoptericolavarialilis)中鉴定到的一类非敏感型EPSPS合酶基因,并已申请了专利[8]。与已报道的具备天然草甘膦抗性的EPSPS的序列相似性均小于30%,属于具有新型序列特征的EPSPS,且酶动力学分析表明AroAI.va*在对草甘膦具有耐受性的同时还保持了对底物PEP较强的亲和力[9]。Cui等[10]将AroAI.va*通过密码子优化人工合成后,利用遗传转化导入到水稻中,培育获得了农艺性状优良、具有商业应用潜力的高抗草甘膦的转基因水稻家系。AroAI.va*也在油菜中获得了转化,创制的转化体能耐受4倍田间推荐使用剂量的草甘膦[11]。
基因漂移在自然界中是普遍现象,花粉介导的基因漂移引起花粉污染已被证实,转基因作物可能造成的基因漂移是目前公众对转基因生物安全担忧的问题之一,如抗草甘膦转基因植株与近源杂草或附近非转基因作物远交导致“超级杂草”的出现。由于质体转基因植株具有母系遗传的特点,将耐草甘膦基因转入作物质体中高效表达,培育抗除草剂转基因作物,无疑是一种良好的替代方案。在已有研究中,尝试将bar基因转入烟草质体中表达可以使转化植株获得草甘膦除草剂抗性[12-13];Daniell等[14]将矮牵牛来源的EPSPS基因转入烟草质体中,转叶绿体基因植物能够耐受高达5 mmol/L草甘膦;Ye等[15]在烟草质体中分别过表达了原核生物(芽孢杆菌、无色杆菌和农杆菌)来源的EPSPS基因,其中转入CP4 EPSPS的家系叶片中EPSPS的含量占可溶性总蛋白的10%,并具有高水平的草甘膦抗性。
本研究使用来源于I.variabilis的新型抗草甘膦基因AroAI.va*[8-11],根据质体密码子偏爱性优化后,利用Zhang等[16]鉴定到的非绿色组织高效表达顺式元件驱动,导入烟草质体中高效表达,旨在为通过质体转化培育抗草甘膦烟草以及其他作物提供理论基础和可行性参考。
1 材料与方法
1.1 材 料
试验在华中农业大学作物遗传改良国家重点实验室进行。进行叶绿体遗传转化的烟草(Nicotianatabacum)品种为Petit Havana。所用表达载体为烟草叶绿体转化载体pJZ120[12],其玉米来源的ZmPrrn:PclpP:clpP顺式元件能够驱动外源基因在非绿色组织中高效表达,以具有壮观霉素、链霉素抗性的aadA基因作为筛选标记,烟草质体基因组插入位点为trnG和trnfM之间的基因间区。所用大肠杆菌菌株为DH5α。
1.2 烟草叶绿体转化载体的构建及遗传转化
根据叶绿体密码子偏爱性对I.variabilisAroA基因进行密码子优化,5′端和3′端分别加入NdeⅠ和XbaⅠ酶切位点,并去除基因内部常用酶切位点,由金斯瑞公司进行基因合成,获得载体pAroAI.va*。使用NdeⅠ和XbaⅠ双酶切pAroAI.va*及中间载体pZF4,通过T4 DNA连接酶(NEB)将AroAI.va*基因连接到pZF4上,获得具有AroAI.va*基因表达盒的载体pAroAI.va*-box。根据pJZ120载体酶切位点及AroAI.va*基因表达盒序列,设计如下引物:pLSZ3-F(5′-TATTAATCTACCATGGTGCATATGACTCCTGCTCCTGCTTC-3′)和pLSZ3-R(5′-GTCGACGGTATCGATAAGCTTGCTAGATTTTGTATTTCAA ATCTTG-3′),其中下划线的序列分别为NcoⅠ和HindⅢ酶切位点及Gibson法组装所需同源区段。使用NcoⅠ和HindⅢ酶切pJZ120载体使其线性化;以载体pAroAI.va*-box为模板,使用KOD FX(Toyobo)进行PCR扩增,程序为:94 ℃ 2 min;98 ℃ 10 s,56 ℃ 30 s,68 ℃ 100 s,扩增32个循环。使用DNA纯化回收试剂盒(Tiangen)分别将酶切产物以及PCR产物纯化,再使用ClonExpress Ⅱ One Step Cloning Kit(Vazyme)进行连接反应,重组质粒经双酶切及测序验证正确后将其命名为pLSZ3,转入DH5α大肠杆菌中,使用QIAGEN Plasmid Midi Kit抽提高浓度质粒,用无菌ddH2O溶解后将浓度调整至2 000 ng/L。
参照Svab等[17]的方法通过基因枪介导的质体转化技术获得质体转基因烟草,经过多轮筛选后将再生幼苗放入生根培养基中,待其长出完整根系后进行炼苗,随后移栽至营养土中,最终获得转基因烟草植株T0代种子。
1.3 转基因烟草的同质化检测
T0代转基因植株移栽2周后长出新叶片。取烟草转化植株幼嫩叶片,使用CTAB法分离、纯化烟草基因组DNA,使用限制性内切酶BglⅡ将8 μg基因组DNA消化完全。通过琼脂糖凝胶电泳分离大小不同的DNA片段,变性后转移到尼龙膜上。与经DIG-11-dUTP标记的特异性探针DIG-psaB杂交后,使用偶联碱性磷酸酶的地高辛抗体检测标记探针,最后利用碱性磷酸酶的化学发光底物产生可见光,并使用X射线胶片记录,从而检测特定DNA分子含量,验证烟草转化植株是否同质化。
取阳性转化烟草T0代种子,依次使用75%乙醇和6%次氯酸钠(沪试)消毒后,用无菌蒸馏水清洗5次,接种到含有500 mg/L壮观霉素的RM培养基上培养15 d,观察统计绿苗率。
1.4 转基因烟草基因表达量检测
取烟草转化植株,使用异硫氰酸胍法分别提取叶片和根部组织的总RNA。通过甲醛变性凝胶电泳分离后,转移到尼龙膜上。经DIG-11-dUTP标记的特异性探针DIG-AroAI.va*杂交后,使用偶联碱性磷酸酶的地高辛抗体检测标记探针,最后利用碱性磷酸酶的化学发光底物产生可见光,并使用X射线胶片记录,从而检测AroAI.va*基因表达量。
取500 ng叶片和根部组织的总RNA,使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit(Vazyme)进行逆转录合成cDNA。根据目的基因AroAI.va*和烟草内参基因ef1α(elongation factor 1-alpha)序列,设计RT-PCR引物:AroAI.va*-RT-F(5′-GCTTCTCCTGATGCTACTTCTCC-3′)、AroAI.va*-RT-R(5′-TCAACATCAACAGCACCTCCTC-3′)、ef1a-RT-F(5′-GCTGACTGTGCTGTCCTGAT-3′)、ef1a-RT-F(5′-CTTGTCTGAGGGCCTCTTGG-3′)。以逆转录合成的cDNA为模板,使用rTaq酶(TAKARA)分别扩增AroAI.va*和NtEf1α基因片段。扩增程序为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s;28个循环。
取烟草转化植株叶片和根部组织,在液氮中充分研磨后使用蛋白抽提液提取总蛋白,并使用BCA法测定蛋白浓度。取5 μg总蛋白样品,变性后通过SDS-聚丙烯酰胺凝胶电泳分离总蛋白,使用半干转移法将蛋白转移至PVDF膜上,封闭后用一抗和二抗对膜进行免疫反应,最后经过底物显色检测特异性目的基因表达的蛋白成分。
1.5 转基因烟草草甘膦抗性检测
取消毒后的烟草转化植株T0代种子,均匀接种到含草甘膦的RM培养基,在光照培养室培养15 d后,拍照记录幼苗根部,使用Image J软件(https://imagej.nih.gov/ij/)对照片中根部长度进行测量记录。
取4叶期烟草阳性植株无菌苗,将叶片切成5 mm×5 mm大小,根部切成1 cm长的小段,分别放置于含有50 mg/L草甘膦的RMOP培养基上,在光培室中培养30 d,观察并记录叶片或根部分化及再生情况。
将41%草甘膦异丙胺盐(Roundup,Monsanto Company,USA)配制成900、1 800、4 500 mg/L的草甘膦溶液,在温室中分别均匀喷洒于4叶期烟草阳性转化植株叶面,并在喷洒后30 d记录烟草植株的生长状况。
2 结果与分析
2.1 烟草质体转化载体构建
基因表达盒PCR扩增产物和pJZ120载体酶切产物经1%琼脂糖凝胶电泳检测,得到预期的条带(图1A、B)。切下所需条带后使用胶回收试剂盒纯化,再根据一步法连接试剂盒说明书进行连接反应,重组质粒经酶切及测序验证(图1C)后,转入大肠杆菌进行大量质粒抽提,并将质量浓度调整至2 000 ng/μL待用。
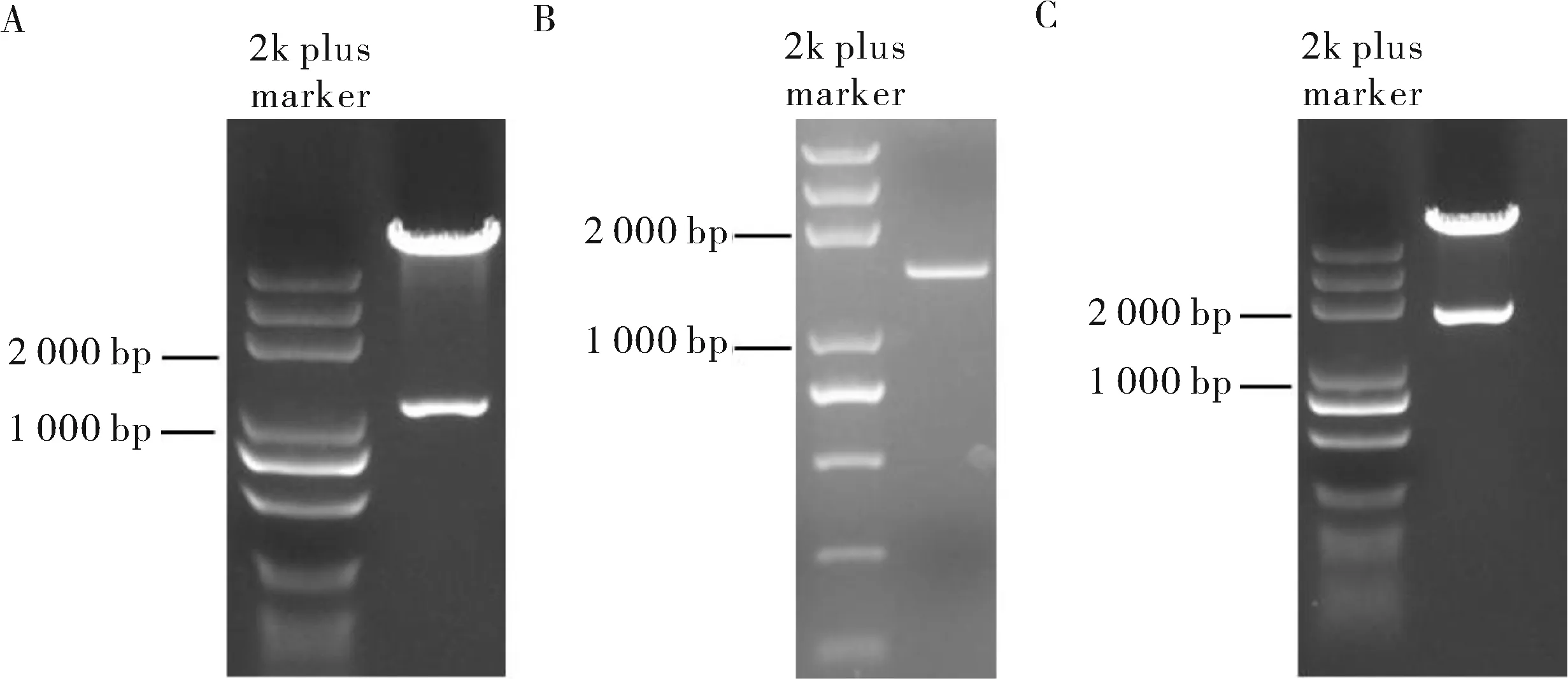
A:pJZ120载体的线性化; B:AroAI.va片段的的PCR扩增; C:重组质粒的酶切验证。A:Linearization of pJZ120; B:PCR amplification of AroAI.va fragment; C:Enzyme digestion verification of recombinant plasmid.
2.2 烟草叶绿体遗传转化
取4叶期烟草无菌苗幼嫩叶片(共7片)平铺在RMOP培养基上,通过基因枪技术将携带有pLSZ3质粒DNA的金微粒分7次轰击进入叶片中,轰击后将叶片切成5 mm×5 mm大小,转入含有500 mg/L壮观霉素的RMOP培养基上初筛,待再生出幼芽后,取其叶片切成3 mm×3 mm大小,分别转入只含有壮观霉素及同时含有壮观霉素和链霉素的RMOP培养基,记作第1轮筛选,若在含有2种抗生素的培养基上可以分化出绿色愈伤,则表明此转化事件为阳性,而非自发突变(图2);继续取只含有壮观霉素的培养基上幼芽叶片进行第2轮筛选。取出第2轮筛选中长出的幼芽,转入含有草甘膦的生根培养基中生根培养,待根系充分形成且植株长大后进行炼苗移栽,成熟后收取转基因植株的T0代种子。最终,利用质体转化技术,获得了3个在双抗RMOP培养基上分化出绿色愈伤的阳性转化事件,并选择pLSZ3#2、pLSZ3#3质体转化家系进行后续实验。
图2 第1轮筛选中双抗培养皿上愈伤生长状况Fig.2 Growth condition of callus on medium containing spectinomycin and streptomycin in first section
2.3 转基因烟草同质化检测
利用基因枪转化将pLSZ3质粒转入烟草质体中,通过载体两端的同源重组序列能够保证目的基因组插入位点在trnG和trnfM之间的基因间区,根据预测利用BglⅡ酶切后跑胶,用psaB探针在野生型基因组中杂交条带大小应为3.5 kb,同源重组后转基因植株基因组中杂交条带大小应为7 kb(图3A)。由Southern 杂交结果可见,野生型烟草中杂交条带为3.5 kb,阳性转基因烟草植株pLSZ3#2和pLSZ3#3中杂交条带为7 kb,且未见野生型条带,故可判断所获2株阳性转基因烟草pLSZ3#2和pLSZ3#3中目的基因已定点插入到质体基因组中,并且达到同质化(图3B)。
种子发芽试验结果显示,烟草种子在含有500 mg/L壮观霉素的生根培养基上培育15 d后,野生型烟草无抗性,表现为发育不正常的白色幼苗,而pLSZ3#2和pLSZ3#3植株的T0代种子在培养基中全部正常发育,未见白色幼苗发生,进一步验证所获2株阳性转基因烟草pLSZ3#2和pLSZ3#3已达到同质化(图3C)。
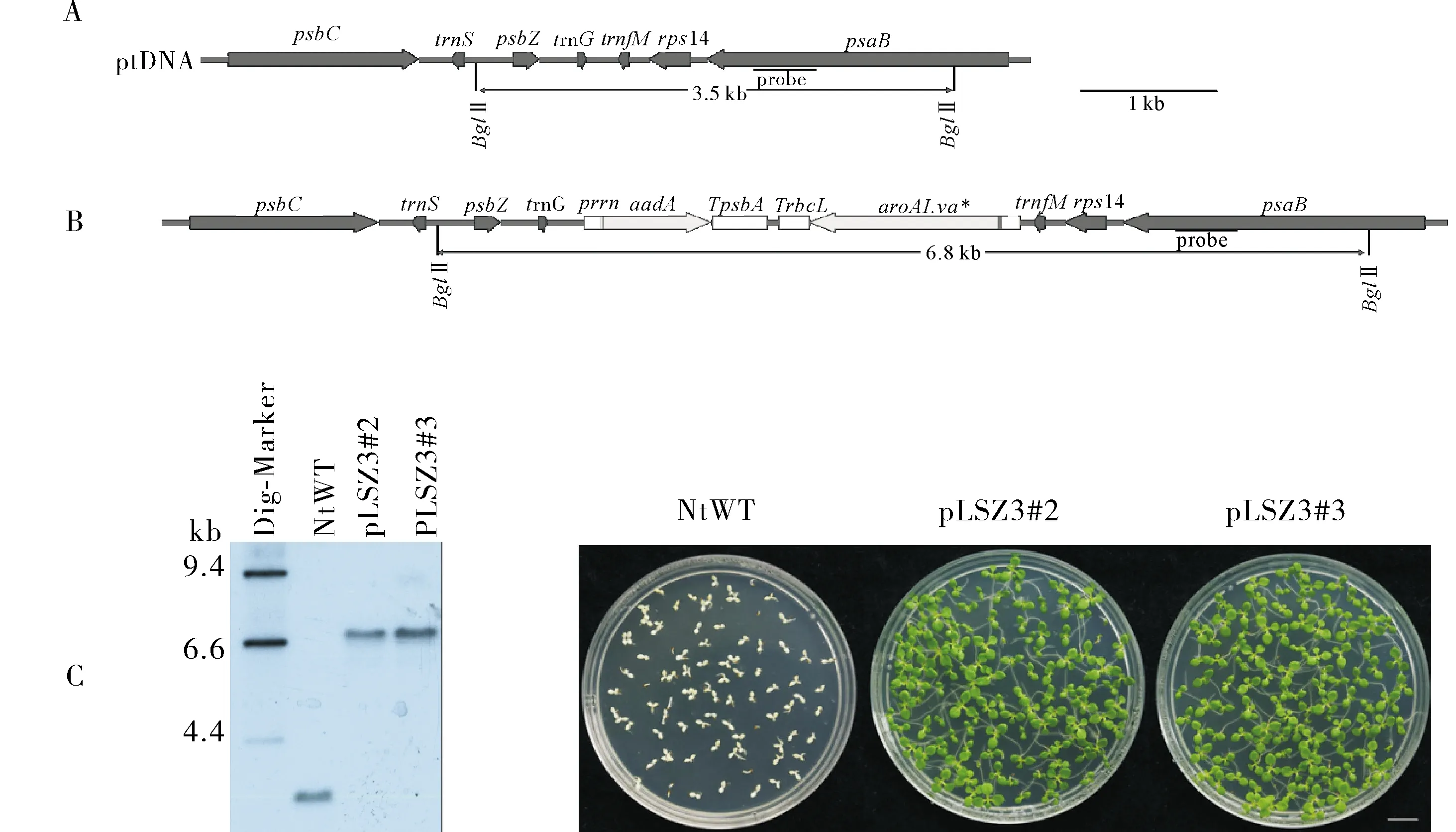
A:质体基因组中靶向区域的物理图谱。转基因靶向trnfM和trnG之间的基因间区; B:质体转基因烟草品系的Southern杂交分析。用BglⅡ消化总DNA,并与地高辛标记探针杂交,以检测质体基因组中转基因插入位点的区域,杂交信号表明质体转基因烟草品系已达到同质化; C:质体转基因品系pLSZ3#2和pLSZ3#3和野生型(WT)T0代种子,在含有500 mg/L壮观霉素的RM培养基上生长2周后的幼苗。标尺为1 cm。A:Physical map of the targeting region in the plastid genome. The transgenes are targeted to the intergenic region between trnfM and trnG; B:Southern blotting of transplastomic lines. Total DNA was digested with BglⅡ and hybridized to a radiolabeled probe detecting the region of the plastid genome that anks the transgene insertion site. Hybridization signal indicates homoplasmy of all transplastomic lines; C:Seedlings after 2 weeks of growth on RM medium containing 500 mg/L spectinomycin. Transplastomic lines and wild-type plants (WT) were compared. Scale bar=1 cm.
2.4 转基因烟草基因表达量检测
分别提取5叶期转基因烟草植株叶片和根部组织的总RNA和总蛋白,进行基因表达量检测。Northern 杂交(图4A)及RT-PCR(图4B)结果均显示抗草甘膦AroAI.va*基因在转录水平上得到有效表达,在根部组织表达量低于叶片中。Western 杂交分析(图4C)检测结果显示蛋白在叶片和根部组织中均有较高累积。
2.5 转基因烟草草甘膦抗性检测
为了检测质体转化植株pLSZ3#2、 pLSZ3#3对于草甘膦的耐受性,取转基因烟草T0代种子,消毒后分别接种到含有不同质量浓度的草甘膦的RM发芽培养基上培养2周后进行抗性观察。结果表明,野生型烟草种子在含50 mg/L 草甘膦培养基上叶片完全不能萌发,pLSZ3质体转化植株为正常绿色幼苗。取在含有草甘膦RM培养基上萌发的幼苗,拍照并测量幼苗根部生长状况。结果显示,pLSZ3质体转化植株根部生长未受到明显抑制,表明在非绿色组织高效顺式元件驱动下,AroAI.va*基因在根部组织中获得了高水平表达(图5A、B)。结果进一步显示,pLSZ3的后代能够在含有12 mmol/L(2 000 mg/L)和15 mmol/L(2 500 mg/L)草甘膦培养基上萌发(图5C)。
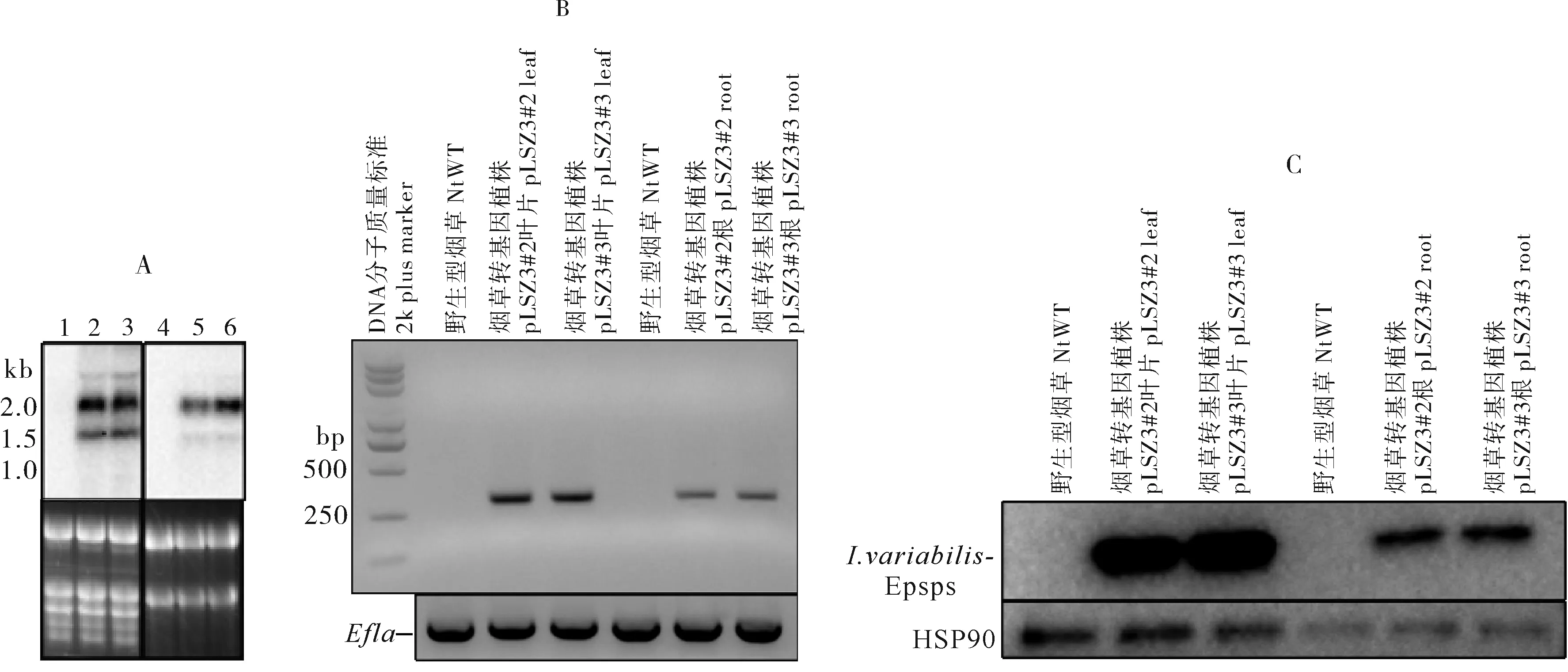
1.野生型烟草; 2.烟草转基因植株pLSZ3#2叶片; 3.烟草转基因植株pLSZ3#3叶片; 4.野生型烟草; 5.烟草转基因植株 pLSZ3#2根; 6.烟草转基因植株pLSZ3#3根. A:Northern杂交分析叶片以及根部组织中AroAI.va*基因mRNA表达水平。左侧为RNA分子质量标准,溴化乙锭染色的凝胶显示在每个印迹下方;B:以总RNA反转录获得的cDNA为模板,RT-PCR分析叶片以及根部组织中AroAI.va*基因mRNA表达水平。DNA分子质量标准在左侧给出,烟草内源基因Ef1α作为参照在下方给出;C:Western杂交分析叶片以及根部组织中I. variabilis EPSPS积累水平,烟草内源蛋白HSP90作为参照在下方给出。A:Northern blot analysis of AroAI.va* mRNA expression in leaves and roots.1.NtWT; 2.pLSZ3#2 leaf; 3.pLSZ3#3 leaf; 4.NtWT; 5.pLSZ3#2 root; 6.pLSZ3#3 root. The band sizes of the RNA marker are given on the left. The ethidium bromide-stained gels are shown below each blot; B:RT-PCR analysis of AroAI.va* mRNA expression in leaves and roots using cDNA obtained by reverse transcription of the total RNA. The band sizes of the DNA marker are given on the left. The band of tobacco endogenous Ef1α gene is given below as a reference; C:Western blot analysis of I. variabilis- EPSPS protein accumulation in leaves and roots using an anti-EPSPS antibody. The band of tobacco endogenous HSP90 protein is shown below the protein blot as a control.
取叶片和根部组织在含有草甘膦的RMOP中均能形成绿色愈伤组织并再生幼芽,但根部组织幼芽再生较慢,且部分会分化出无再生能力的非胚性愈伤,可能是由于AroAI.va*基因在根部表达弱于叶片组织(图5D)。
让转基因烟草在温室中生长1个月,并喷洒不同剂量的草甘膦溶液。结果显示,野生型在喷洒7 d后整个叶片表面和茎尖分生组织萎缩并表现出不同程度的除草剂破坏症状。而pLSZ3质体转基因家系均可耐受900 mg/L和1 800 mg/L的剂量,当草甘膦施加量达4 500 mg/L时,除了植株底部老叶表现出明显黄化外,其余组织未发生草甘膦为害症状(图5E)。
2.6 草甘膦抗性的母系遗传
质体遗传信息遵循母系遗传的特点,能够避免转基因植株花粉漂移造成的安全性问题。将抗草甘膦质体转化植株与野生型烟草进行正反交及自交实验,取50~100粒后代种子消毒后放置在含有50 mg/L草甘膦的RM培养基上萌发15 d。只有以质体转化烟草为母本时,草甘膦抗性才能遗传给后代,表现为正常绿色幼苗;其余条件后代未获得草甘膦抗性性状,无法正常生长(图6A)。与预期结果相同,说明质体转化植株遵循严格的母系遗传,通过质体转化培育抗除草剂作物品种在生物安全性上具有明显的优势。
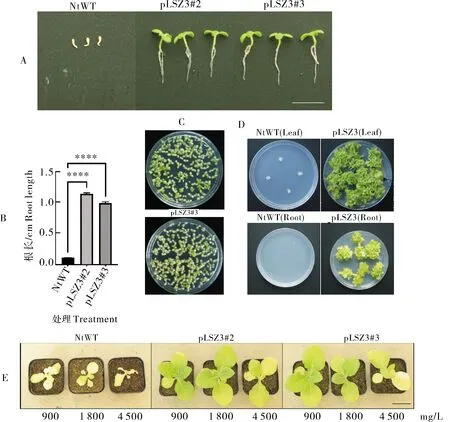
A:在含有50 mg/L草甘膦的培养基上生长2周后的幼苗。标尺为1 cm。B:通过图像定量分析根部生长(n=3)。标尺为1 cm。C:在含有12 mmol/L和15 mmol/L草甘膦的培养基上生长2周后的pLSZ3 T1代植株。D:将叶片和根外植体放置于含草甘膦(50 mg/L)的再生培养基中来分析抗性。标尺为1 cm。E:施用草甘膦后质体转化植株的生长状况。标尺为5 cm。A:Seedlings after 2 weeks of growth on medium containing 50 mg/L glyphosate. B:Resistance was analyzed by exposure of leaf and root explants to glyphosate-containing regeneration medium (50 mg/L). Scale bar=1 cm. C:T1 pLSZ3 seedlings after 2 weeks of growth on medium containing 12 mmol/L and 15 mmol/L glyphosate. Scale bar =1 cm. D:Quantification of root growth by image analysis. The values shown represent the length of the primary root,and are means + standard deviation (n=3). Scale bar=1 cm. E:Growth condition of transplastomic line after glyphosate application. The dose of glyphosate application is is shown below the photos. Scale bar=5 cm.
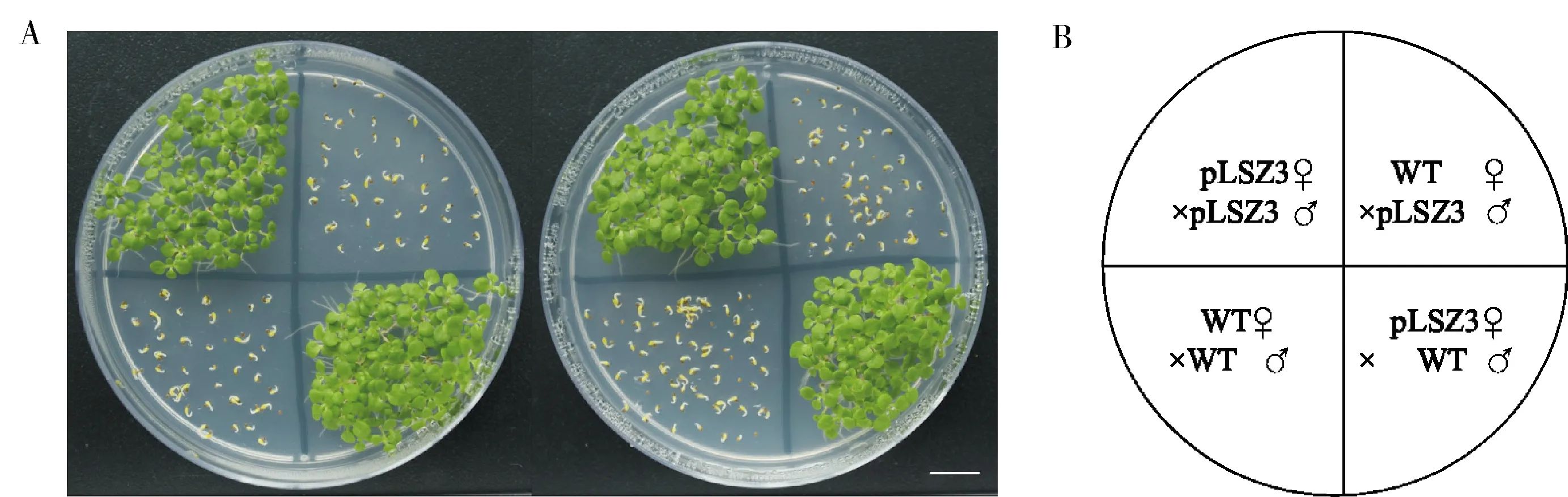
A:质体转化家系pLSZ3#2(左)、pLSZ3#3(右)与野生型进行杂交或自交,后代种子在含有50 mg/L的RM培养基上发芽,抗性幼苗均为绿色,而敏感幼苗则被漂白;B:种子在培养基上的分布。A:The transplastomic line (pLSZ3#2(left),pLSZ3#3(right)) self-crosses or crosses with wild type. Next generation seeds were germinated on medium containing 50 mg/L glyphosate. Note that resistant seedlings are uniformly green whereas sensitive seedlings are bleached; B:Distribution of seeds on culture medium.
3 讨 论
研究发现自然界中存在一些对草甘膦不敏感的EPSPS,根据EPSPS的序列特征以及对草甘膦的敏感度,可将其大致分为Ⅰ型和Ⅱ型。Ⅰ型对草甘膦敏感,包含绝大多数植物、微生物来源的EPSPS。而Ⅱ型对草甘膦不敏感,与Ⅰ型序列差异较大,其中来源于Agrobacteriumsp. CP4的EPSPS基因已被用于商业化生产。除此之外,近年来还发现了许多不属于Ⅰ型和Ⅱ型的新型抗草甘膦基因,如Yan等[18]将来源于Pseudomonasputida4G-1的EPSPS基因转入烟草中,过表达PpAroA1基因的转基因烟草表现出对草甘膦的高耐受性,这表明新型的PpAroA1是今后培育具有草甘膦耐受性的转基因作物中的一种新的优良候选基因;Cui等[10]将来源于Isoptericolavariabilis的EPSPS基因AroA转入水稻中,培育出了具有自主知识产权和商业化潜力的抗草甘膦水稻新品种。尽管目前发现的抗草甘膦EPSPS种类较多,但用于商业化生产的只有CP4 EPSPS和TIPS EPSPS,因此,鉴定具有新型高水平的草甘膦耐受性的EPSPS对于培育草甘膦耐受性的转基因作物具有重大意义。
叶绿体转化是植物基因工程中的一项新兴技术,其优势也逐渐被人们认识。Cui等[10]通过核转化将AroAI.va转入粳稻品种中花11中,在获得的单拷贝株系中有50%的株系在180 mg/L草甘膦培养基上生长受到抑制。而本研究利用叶绿体转化获得的转基因烟草可在12 mmol/L(2 000 mg/L)的培养基上生长(图5C),耐受性提高了近20倍,表明叶绿体转化在提高外源基因表达量上相比核转化具有显著优势。另一方面,在核转化中由于T-DNA的随机插入有可能产生的位置效应和基因沉默现象,在创建转基因育种材料时,通常需要获得大量的转化体,并鉴定单拷贝转化株系中T-DNA插入位点,寻找插入基因间区的转化事件,工作量大且繁琐。叶绿体转化则通过同源重组机制能够将目的基因定点插入,获得的转基因家系的分子特征是一致的,相互之间不会因为位置效应影响目的基因的表达效率,故在叶绿体转化中所需的转基因事件数量少,工作量相对简单易行。本研究通过转化载体中的同源臂将目的基因定点插入到trnfM和trnG之间,并利用Southern 杂交进行了验证(图3B) 。
草甘膦具有强烈的内吸传导性,能转移至植物各个器官组织中,但绝大部分叶绿体基因在非绿色组织中会显著下调。番茄果实的有色体和马铃薯块茎中淀粉体转录和翻译的全基因组分析显示质体基因组在非绿色组织中有明显的下调表达[19-20]。Li等[21]发现以Prrn启动子驱动的外源基因转入质体后在根部组织中表达水平大幅降低。aacD和clpP基因是目前发现的能在非绿色组织中上调表达的基因。本研究中驱动草甘膦为玉米来源的ZmPrrn:PclpP:clpP组合顺式元件[16],在质体转基因植株根部组织中能检测到基因的高效表达:根部组织在含有草甘膦的RMOP培养基上能正常分化出愈伤并再生幼芽;在含有生根培养基上萌发幼苗根部组织能正常伸长(图5D)。因此,高耐受性草甘膦基因配合非绿色组织表达调控元件在培育草甘膦高抗性质体转化植株上具有更大的应用前景。本研究筛选出的新型抗广谱性除草剂草甘膦转基因烟草株系,也将为我国抗除草剂转基因烟草品种培育提供优异的种质资源。
