芒萁的生态学与资源利用研究进展
2021-09-27邱子豪陈远其
张 煜,张 旭,邱子豪,陈远其
(1.湖南科技大学生命科学学院,湖南湘潭 411201;2.湖南科技大学煤炭资源清洁利用与矿山环境保护湖南省重点实验室,湖南 湘潭 411201;3.湖南科技大学资源环境与安全工程学院,湖南湘潭 411201)
芒萁(Dicranopteris pedata)是热带亚热带地区广泛分布的一种草本植物,具有较高的生态与药用价值,全面认识其生态学功能及其潜在药用价值对芒萁资源综合利用具有重要的指导意义。近年来国内外学者对芒萁的生态学特性和资源利用开展了较为深入的研究,但目前相关信息仍较为零散。因此,本文整理了芒萁在光合生理生态,对稀土和重金属胁迫的富集与耐受,化感物质与化感效应,克隆繁殖,化学计量学,对养分循环、土壤生物和微气候等的影响以及药用成分与功效等方面的研究成果,并指出了未来应重点关注的研究方向,旨在为芒萁资源的综合利用提供科学依据。
1 芒萁的生物学特性
芒萁隶属于真蕨目里白科(Gleicheniaceae)芒萁属。在《Flora of China》中,铁芒萁(D.linearis)和芒萁(D.dichotoma)两个近缘种均被归并其中[1]。该种植物株高0.5~3 m,具根状茎,叶片远生,叶轴一至多回二叉分枝,孢子囊群圆形,生长于海拔100~2 200 m的林下、溪边、山坡等。主要分布于我国安徽、湖北、湖南、江苏、江西、浙江、福建、广东、广西、贵州、四川、云南、海南等省,以及印度、印度尼西亚、锡兰、马来西亚、尼泊尔、新加坡、泰国、越南、日本及澳大利亚等地[1],有文献报道美国夏威夷雨林中也有芒萁的分布[2]。
芒萁的繁殖方式以地下根状茎繁殖为主,根状茎一般在表土层3 cm 深度水平匍匐生长,茎尖在旱热的地表很难延伸,遇到地表45 ℃以上高热时立即停止生长直至死亡[3]。孢子繁殖也是芒萁的繁殖方式之一,但水分、土壤湿度、荫蔽与避风条件是限制其孢子在野外萌发与生长的关键因子[4]。此外,组培快繁亦可作为芒萁人工繁殖的备选方案[5]。
2 芒萁的生态学研究
芒萁在热带亚热带生态系统中扮演着重要角色,大多数研究均采用生物量收获法来估算芒萁生物量[6-8],也有学者利用基于芒萁叶片的长展幅、宽展幅和叶高建立的芒萁叶生物量模型和根状茎的长度及其与根生物量之间的显著相关关系来估算芒萁各器官的生物量和总生物量[9],这为非破坏性取样估算芒萁生物量提供了途径,也为连续监测芒萁生物量动态变化提供了解决方案。目前芒萁生态学研究主要集中于以下几个方面。
2.1 光合生理生态学研究
芒萁为阳生性蕨类植物,但在一定遮阴条件下仍能正常生长。近年来,在芒萁对不同生长光强的光合生理生态响应规律研究方面已取得一些成果(表1),如遮阴能够增加芒萁的净光合速率、色素、PSⅡ原初光能转化效率及其潜在活性,从而提高芒萁的最大净光合速率[10]。芒萁对光环境变化的适应主要是通过调节光合生理参数、抗氧化酶活性、可溶性蛋白和丙二醛含量来实现[15]。芒萁光合特性对酸雨的响应表现为酸雨提高低光强条件下芒萁的净光合速率,且超氧化物歧化酶和过氧化物酶活性随酸雨浓度增加而增强[11-12]。芒萁光合特性对氮(N)添加的响应则表现为一定程度遮阴条件下芒萁叶片的最大净光合速率及光能利用范围在N 添加后得以提高,且叶面积、叶绿素含量与叶片N 含量也会显著增加[13-14]。

表1 环境因子对芒萁光合生理生态的影响Table1 Effectsof environmental factorson photosynthesisphysiology in Dicranopteris pedata
2.2 芒萁对环境胁迫的适应性
由于芒萁自身的生理特性,使得其对环境胁迫具有较强的适应性。芒萁作为酸性土壤的指示植物,在土壤pH为3.5~5.5时,其生长不受显著影响,它主要通过内部解毒(如提高叶片过氧化物酶和过氧化氢酶活性及可溶性糖和脯氨酸含量等)和外部排斥等途径适应酸铝胁迫[16]。此外,芒萁能够富集稀土元素及部分重金属,对一些不能富集的重金属也有较强的耐受性。
芒萁对稀土元素有显著的超富集作用[17],且具有明显的分馏现象,即轻稀土元素浓度高于重稀土元素[18]。芒萁不同器官的稀土元素富集能力也有差异,依次为叶片> 叶柄> 地下根茎[19]。芒萁对稀土元素的富集和耐受可能与其含有高浓度的铝(Al)有关,Al 能与硅(Si)和稀土元素产生共沉降[20],它能通过改变叶片的β胡萝卜素含量来降低甚至避免高浓度稀土元素对生长的不利影响[21]。目前可以通过强化离子交换淋洗过程有效回收芒萁中的稀土元素,回收率可达78%[22],也可利用真空–热解–浓缩的生态友好型技术来处理富含稀土元素的芒萁[23]。
芒萁对部分重金属如镉(Cd)、铅(Pb)和铜(Cu)有较强的吸收能力,被认为是潜在的多金属富集植物[24],同时芒萁亦是放射性核素镭(226Ra)和钍(232Th)的超富集植物[25]。研究表明芒萁对其他重金属虽无明显富集作用,但仍有较强的适应性,如芒萁对土壤中锑(Sb)、砷(As)、铋(Bi)、汞(Hg)的富集能力较弱,但它仍能适应被这些重金属离子污染的土壤[26-27]。分子生物学证据表明,重金属胁迫可能导致芒萁发生适应重金属污染的分化和微进化[28]。通过高通量测序技术得到芒萁孢子体的转录组数据,挖掘出与重金属结合蛋白密切相关的基因序列,预测其功能主要为来自PEC金属硫蛋白家族的Cd、Cu、Zn 结合蛋白[29]。芒萁叶片高通量测序结果显示,芒萁能富集和耐受高浓度的重金属元素与其含重金属转运和耐受的基因有关,这些基因有助于检测土壤重金属污染,其中芒萁叶片基因c44988_g1和c84121_g1可用于植物地球化学找矿[30]。
2.3 芒萁的功能性状研究
植物功能性状是指能够反映植物对环境的适应性以及植物内部不同功能之间进化与平衡的形态与生理属性[31]。目前芒萁功能性状研究除上述的环境对其光合生理影响之外,还有芒萁克隆繁殖特性对环境的响应。研究发现光强会影响芒萁克隆分株的形成,且显著改变分株生物量在各器官中的分配比例;施氮有利于增强芒萁克隆繁殖力[32]。芒萁在克隆生长过程中能够通过形态整合和生理整合来提高对环境的适应性和竞争优势,如通过增加叶芽、茎芽构件数抵消芽构件的高死亡率对种群扩散的不良影响[33]。再者,土壤理化性质对芒萁功能性状的影响也是研究的热点。土壤磷(P)是影响芒萁生长的主要因子[34],该结论在芒萁的生态化学计量学研究中也得到了证实[35];土壤全碳(C)、全氮(N)和全P含量则是引起芒萁叶片和根系功能性状发生变化的关键土壤因子[36]。土壤N、P添加试验表明,适量的N、P添加均促进芒萁株高和生物量的增加以及根系的生长,提高叶片N、P含量,同时降低其根冠比,但对根组织密度的影响较小,而过量的N、P添加则会抑制芒萁生长;生态化学计量学研究揭示芒萁N꞉P随土壤N ꞉P的增加而增加[15,31,37],且芒萁能够通过调节自身C、N、P含量来适应不同的土壤生境[38]。在南方侵蚀退化红壤区的研究发现,土壤pH 与芒萁叶面积和叶片N含量显著负相关,与叶片P含量显著正相关[15]。
2.4 芒萁的化感作用
人们对芒萁化感作用的认识较早,芒萁在生态系统中容易形成单一群落,则可能与此有关[39]。研究表明,芒萁对木豆(Cajanus cajan)、白车轴草(Trifolium repens)等植物的种子或幼苗有不同程度的抑制作用[40-47](表2)。芒萁水提液含有氨基酸、多肽、蛋白质、酚类、有机酸及强心甙等[43],其水提液对我国华南地区入侵植物薇甘菊(Mikania micrantha)亦有较强的化感作用,抑制综合效应可达72.4%[45]。芒萁对杂草密度、种子萌发和幼苗生长的化感效应是由于其分泌到土壤中的酚类化合物和芳香类物质起作用,可见它有作为环境友好型除草剂的潜力[48-49]。因此,基于环境保护、可持续农业和生物防治等的考虑,可充分利用芒萁化感物质的分离纯化进行新型无公害生物制剂(如除草剂、驱虫剂等)的研发。

表2 芒萁水提液对一些受体植物的化感作用Table 2 Allelopathic effectsof extractsfrom Dicranopteris pedata on several plants
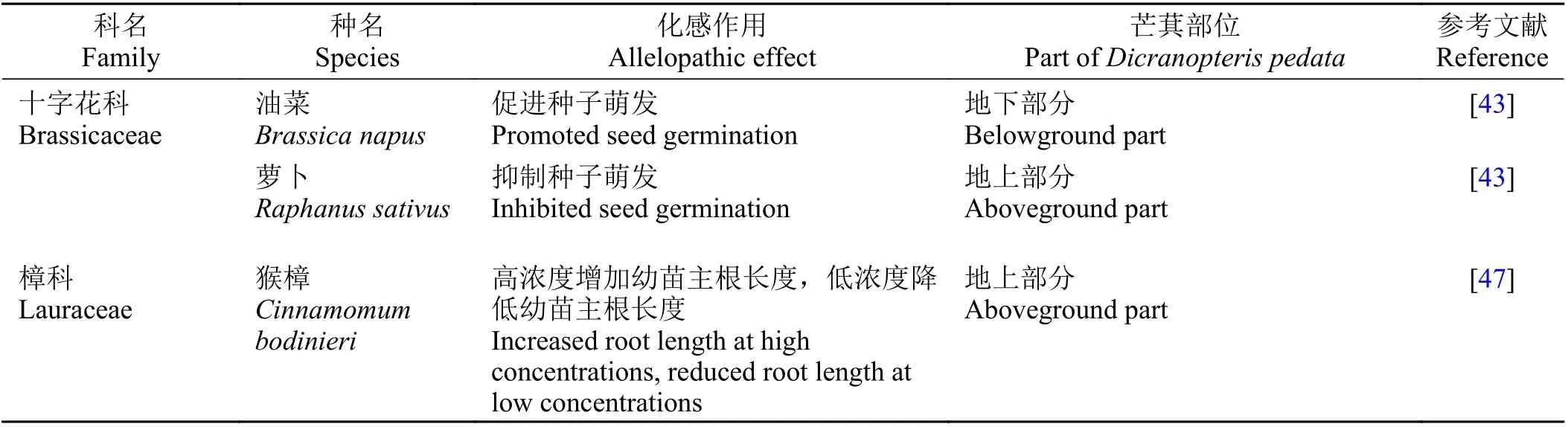
续表2Table 2(Continued)
2.5 芒萁在生态系统中的作用
芒萁是生态退化区植被恢复的先锋物种,它的N、P含量低,但利用效率高,特别是土壤侵蚀严重、养分极度贫瘠的生境[38,50]。研究表明,红壤退化区未治理地和林下芒萁覆盖地土壤C、N 含量(总有机碳、可溶性有机碳、总氮、可溶性氮、微生物量氮、铵态氮)显著高于林下裸地,其可溶性有机质的芳香化指数和腐殖化指数也均显著高于林下裸地[51-52],且芒萁对恢复地表层0−10 cm 土层土壤总有机碳含量的贡献在54%~61%[53]。由此可见,芒萁覆盖能够固持土壤养分并使得土壤养分可利用性更高、微生物生物量和群落结构更为丰富、活性也更强,从而促使土壤生态系统更加稳定[54]。芒萁覆盖亦能改变土壤食物网组成,从而对土壤生物造成显著影响。如芒萁去除后土壤真菌生物量和真菌细菌比显著降低,0−5 cm 土层中土壤线虫总密度有所下降,主要体现在植食性线虫密度显著降低,同时它也显著降低了土壤跳虫密度,而对土壤螨虫和其他小型节肢动物无显著影响[55]。
芒萁作为亚热带人工林的重要组成部分,能够显著维持林下微气候并影响林下生态过程。林下芒萁可降低土壤温度,增加土壤含水量,并促进林下凋落物分解[56]。当芒萁在林下形成致密层时会大量截留林冠乔木的凋落物,进而影响其凋落物分解和养分循环过程[57]。芒萁还有利于下层乔木幼苗的存活和生长,如马尾松(Pinus massoniana)、西南木荷(Schima wallichii)、鸭脚木(Schefflera heptaphylla)、红锥(Castanopsis hystrix)、厚壳桂(Cryptocarya chinensis)和锥栗(Castanea chinensis)等,同时也能促进桉树林上层乔木尾叶桉(Eucalyptus urophylla)的生长[58-59]。
3 芒萁的资源开发利用现状
芒萁体内黄酮类化合物含量较高,黄酮由于具有降血压、降血脂、抗衰老等功效[60],因此芒萁的药用价值引起学者的广泛关注(表3)。芒萁的药性质量主要取决于药用部位的总黄酮累积量,不同生长期、不同组织间均有差异,根状茎中总黄酮含量在9 月−10月最高,叶片中总黄酮含量在12月初最高[63]。目前有关产地是否影响芒萁药性质量的结论仍不一致,如江西省不同产地芒萁的黄酮类物质槲皮素和山柰素含量差别较大[60],但是贵州省不同产地芒萁的槲皮素和山柰酚含量则无明显差异[64],其影响机理尚待进一步研究。

表3 芒萁的药用成分和功效Table 3 Medical ingredients obtained from Dicranopteris pedata and their efficacies
芒萁含有皂苷、多酚和次级代谢物,它们在抗氧化、抗肿瘤、抗菌和保肝方面有较强的药理活性[61,65]。研究报道芒萁富含的多酚物质能够诱导细胞修复、纤维细胞扩增和迁移,在诱导伤口恢复和处理皮肤问题方面具有潜在应用价值[62]。同时,芒萁叶片提取物具有保肝药的药理活性[66],其作用机理可能是通过和皂苷与三萜类成分协同作用来调节内源性抗氧化酶系统,从而阻止乙酰氨酚诱导的肝中毒[67]。芒萁提取液还具有抗氧化、抗菌和镇痛等药理活性[68],以及潜在的细胞毒素活性以抵抗各种癌细胞[69-70],因此它有作为新镇痛药物和抗癌药物的开发潜力。
芒萁提取液中的萜类、黄酮类和酚类化合物具有驱虫性,能用于茶园螨虫(Helopeltis theivora)和红蜘蛛螨(Oligonychus coffeae)的防治[71];芒萁合成的纳米银颗粒能有效阻止蚊子(Aedes aegypti)产卵,对预防登革热可能有效[72]。芒萁亦是制备生物甲烷的生物资源[73],同时它含有具有纤维素降解能力的内生细菌,增加了纤维素降解菌的来源[74]。此外,芒萁的植硅体材料可使水溶液中的铁氧化物快速聚集,减少扩散与移动,在净水方面有一定的应用潜力[75]。
4 研究展望
综上所述,芒萁在生态恢复中扮演着非常重要的角色。未来应加强以下几方面的研究(图1):1)增温等气候变化因子对芒萁光合生理生态的影响。2)从基因水平上揭示芒萁富集和耐受多种重金属的遗传调控机制,挖掘重金属应答和适应的功能基因资源并鉴定分析,进而为重金属污染土壤的生物修复提供新的途径。3)在森林生态系统中芒萁对林下灌木和乔木种子萌发及幼苗生长是否存在明显的化感作用;针对芒萁如何快速高效定植开展全面系统的理论研究与技术开发,为生态退化区植被恢复和水土保持提供技术支持。4)加强对芒萁的分布面积、生产力及其生长的主要受控生态因子的研究,探究其群落动态和驱动机制,深入解析生态系统动态平衡过程。5)芒萁与其他植物和大中型土壤动物的互作机制及其对降水格局改变、增温等全球变化因子响应过程与机理的研究等。另外,芒萁还有重要的药用价值,开展对其单一化合物的分离鉴定与纯化并进行药物活性物质种类的研究,同时探索提升芒萁药用成分提取工艺效率的新方法,为全面高效地开发利用芒萁资源提供理论依据与技术支撑。
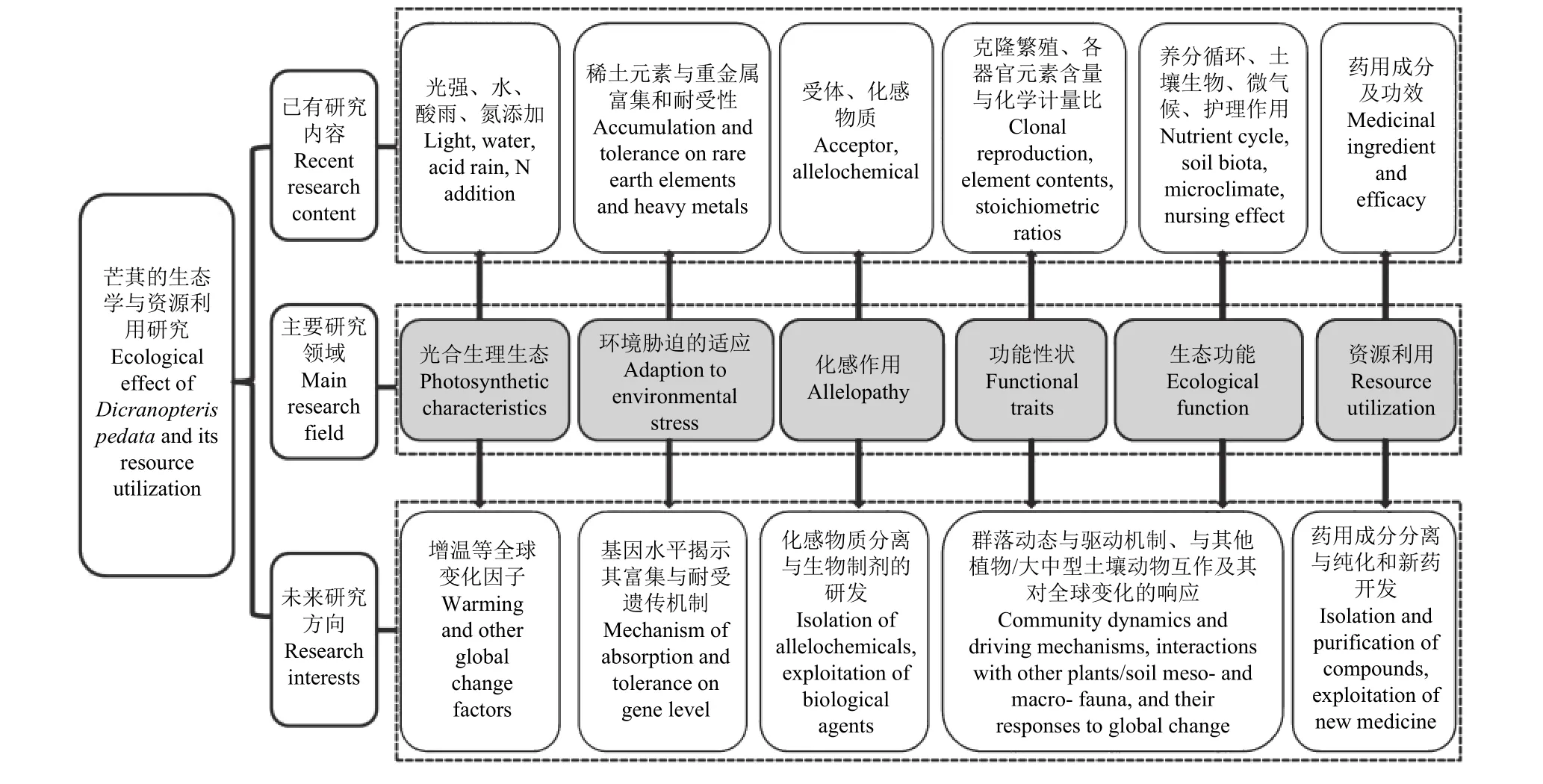
图1 芒萁的生态学与资源利用研究Figure 1 Ecological effect of Dicranopteris pedata and its resource utilization
