杀菌剂防治结缕草大斑病效果及生理响应
2021-09-27徐彦花张巨明刘天增
傅 强,徐彦花,张巨明,刘天增
(华南农业大学林学与风景园林学院/ 广东省草业工程技术研究中心,广东广州 510642)
随着经济、社会的发展,草坪已广泛融入人类生活,成为现代社会不可分割的一部分[1]。结缕草(Zoysia japonica)是一种优良暖季型草坪草,具有抗旱、耐寒、耐贫瘠、耐践踏等优良特性,被广泛应用于高尔夫球场、运动场、绿化及水土保持等领域[2-4]。兰引Ⅲ号结缕草是目前在我国南方地区运动场上广泛应用的结缕草品种,于1994 年正式通过全国牧草品种审定委员会审定登记。该品种具有扩展性强、生长迅速、成坪快、耐高温、耐修剪、耐践踏、抗寒、青绿期长、观赏性好、管理成本低等优良特性[5-10],被广泛应用于热带、亚热带地区的运动场草坪建植。但由于我国南方地区气候湿热,病害频发,防治难度大,严重影响了运动场草地的功能使用性和景观观赏性[11]。因此,病害防治成为结缕草草坪养护管理过程中一个急需解决的问题[12-13]。
结缕草大斑病是夏季暖季型草坪质量下降的一个重要因素,主要由立枯丝核菌(Rhizoctonia solani)引发[14]。研究发现,大斑病是钝叶草(Stenotaphrum helferi)、海滨雀稗(Seashore paspalum)和结缕草上发生的最严重的病害之一[15]。立枯丝核菌引起的大斑病能使与叶茎相连的叶鞘产生腐烂,造成宿主茎、叶和根死亡,形成大的圆形病斑,严重时甚至病斑直径可达数米[16-17]。
近年来,国内外对立枯丝核菌的研究尤其以防治措施的研究为热点[18-19]。虽然草坪病害有多种防治方法,如化学防治、生物防治、农业防治等[20-21],但在生产实践中仍然以化学防治为主,其他防治方法难以奏效[22]。草坪草大斑病的防治通常需要喷施杀菌剂进行预防,以防止其造成持久性损害[15]。在化学防治过程中长期使用单一杀菌剂,会导致病原菌出现抗药性,防治效率下降,用药量增加,草坪病害防治成本上升。目前杀菌剂种类繁多,需要筛选出低毒、高效的杀菌剂,有针对性地解决草坪养护中急需解决的问题。
鉴于此,利用菌丝生长速率法判定杀菌剂对病原菌菌株的抑制效果,筛选对供试菌株抑制效果较好的杀菌剂,通过喷施杀菌剂对结缕草病害的影响,并结合在接菌后经杀菌剂处理的结缕草植株的一系列生理响应,以期探索出合理的化学防治方法,为结缕草大斑病的防治提供指导,为提高草坪观赏价值和使用功能奠定基础。
1 材料与方法
1.1 立枯丝核菌对杀菌剂的敏感性测定
1.1.1 供试材料
供试菌株:立枯丝核菌R. solaniZS-1由本团队成员从感染大斑病的兰引Ⅲ号结缕草上分离获得,保存在华南农业大学草坪实验室。立枯丝核菌R. solaniZW54是从海南省感染大斑病的细叶结缕草(Z. tenuifolia)上分离获得,由岭南师范学院提供。
供试药剂:3种内吸式杀菌剂‘扮绿’(156 g·L−1丙环唑)、‘绘绿’(50%嘧菌酯)、‘赛达’(0.31%嘧菌酯+0.75%丙环唑)以及一种触杀式杀菌剂‘卉乐’(12%咯菌腈)均由先正达生物科技有限公司提供。
1.1.2 室内毒力测定
将储存于马铃薯葡萄糖琼脂(PDA)斜面培养基的立枯丝核菌R. solaniZS-1和ZW54移至PDA 平板培养基上培养,再进行带毒培养基的制备。将供试药剂用无菌水和培养基稀释至所需浓度,杀菌剂‘绘绿’的 浓度 梯度 为0.05、0.1、0.5、1、5、10、20、50 mg·L−1,杀菌剂‘扮绿’、‘卉乐’、‘赛达’的浓度梯度为0.5、1、5、10、20、50 mg·L−1。将菌饼分别接种到各个不同浓度的带毒培养基上,每个培养基上接种1个菌饼,在30℃、光周期为12 h 的智能人工气候箱中培养2 d,采用十字交叉法测量菌落直径,求出抑菌率,并以药剂浓度梯度的对数值为横坐标,以抑菌率的机率值为纵坐标,求出各药剂对两种病原菌的毒力回归方程,再根据毒力回归方程计算每种药剂的抑制中浓度EC50值。
抑菌率=(对照菌落直径−处理菌落直径)/对照菌落直径×100%。
1.2 盆栽防效测定
1.2.1 供试植株培养
将河沙、泥炭土(德国Hawita)和采自华南农业大学增城教学科研基地草坪草地的田间土壤以体积比1꞉1꞉1充分混匀,置于121℃高温灭菌2 h 后分装于8 cm×8 cm 的塑料花盆中,将采自华南农业大学增城教学科研基地的兰引Ⅲ号结缕草的健康植株草茎移栽其中,将植物材料置于温度30 ℃昼/25℃夜、光周期12 h、空气湿度50%、光照强度320 μmol·(m2·s)−1的温室中。每天浇无菌水50 mL以确保土壤湿润,定期进行施肥,每周修剪一次,保留植株高度约5 cm。
1.2.2 接种物培养
将20 g 小麦(Triticumaestivum)种子置于装有无菌水的烧杯中浸泡24 h,取出浸泡后的小麦种子于121℃高温高压灭菌锅中灭菌2 h,再置于超净工作台上晾干。再将小麦种子分别平铺于已培养3 d 的立枯丝核菌菌株ZS-1和ZW54平板培养基上,置于智能人工气候箱30℃培养7 d 后取出,置于研钵中研磨,得到病原菌接种物[23]。
1.2.3 接种与杀菌剂处理
根据室内毒力测定的结果,选取抑菌效果较好的杀菌剂‘绘绿’和‘扮绿’进行结缕草叶面喷施处理,每个处理4次重复,喷施等量无菌水作为对照。杀菌剂喷施浓度均为0.5 mg·L−1,处理2 d 后分别接种立枯丝核菌菌株ZS-1 和ZW54,先喷洒无菌水使叶片湿润,再将病原菌接种物均匀洒在结缕草叶片表面,每盆0.2 g 病原菌接种物,套袋保湿继续置于智能人工气候箱30℃培养。分别在接菌后4、8、12 d取样测定各项指标。
接菌后12 d,每盆随机取50个叶片,统计各杀菌剂处理后结缕草发病叶片数,参照公式计算发病率,发病率= 病叶数/50×100%。每个处理的发病率为4个重复的平均值。再根据公式计算各药剂相对防效,防效=(对照发病率−处理发病率)/对照发病率×100%。
1.2.4 测定指标及方法
叶片相对含水量、叶绿素含量、脯氨酸含量的测定参考王学奎[24]的测定方法;丙二醛含量的测定采用硫代巴比妥酸法[25]进行测定;苯丙氨酸解氨酶活性的测定参考陈转成[26]、褚洪龙[27]以及欧阳路平[28]的方法;几丁质酶活性及β-1,3-葡聚糖酶活性的测定参考苏州科铭生物试剂盒说明书进行。
1.3 数据分析
采用Excel 2016软件进行数据的基本处理,使用SPSS 17.0进行毒力测定,求各杀菌剂对两种病原菌的毒力回归方程,并在置信区间为95%的条件下对盆栽试验的叶片相对含水量、叶绿素含量、脯氨酸含量、丙二醛含量、苯丙氨酸解氨酶活性、几丁质酶活性、β-1,3-葡聚糖酶活性、发病率进行单因素方差分析,对防治效果进行独立样本t检验。
2 结果与分析
2.1 室内药效试验
测试结果表明,4种杀菌剂对立枯丝核菌ZS-1和ZW54的菌落生长均有抑制作用。‘绘绿’对菌株ZS-1菌丝生长的抑制效果最好,‘绘绿’和‘扮绿’对菌株ZW54菌丝生长的抑制效果较好,其EC50值均小于1 mg·L−1,因此杀菌剂‘绘绿’和‘扮绿’是下一步盆栽和田间药效试验的首选药剂(表1)。其次,4种供试杀菌剂对菌株ZS-1的EC50值大于菌株ZW54的EC50值,说明菌株ZS-1对杀菌剂的耐受性强于菌株ZW54,在施用药剂防治病害的过程中要注意病原菌的抗药性问题。

表1 杀菌剂对立枯丝核菌菌株的毒力测定Table 1 Toxicity test of different fungicideson mycelial growth of Rhizoctonia solani
2.2 杀菌剂处理对结缕草叶片相对含水量的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,叶片相对含水量呈现逐渐下降的趋势(图1)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草叶片相对含水量显著高于未使用杀菌剂的对照(P<0.05)。杀菌剂处理后的叶片相对含水量下降缓慢,而对照的叶片相对含水量下降更快。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,叶片相对含水量在二者处理间无显著差异(P> 0.05)。

图1 杀菌剂处理对结缕草叶片相对含水量的影响Figure 1 Effect of fungicides on the relative water content of zoysiagrass
2.3 杀菌剂处理对结缕草叶绿素含量的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,叶绿素含量呈现逐渐下降的趋势(图2)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草叶绿素含量显著高于未使用杀菌剂的对照(P<0.05)。杀菌剂处理的叶绿素含量下降缓慢,而对照的叶绿素含量下降更快。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,在接种病原菌ZS-1后的第4 天、第8天和第12天叶绿素含量在二者处理间无显著差异(P>0.05),在接种病原菌ZW54后的第4天、第8天叶绿素含量在二者处理间无显著差异,在第12天经杀菌剂‘绘绿’处理的结缕草叶绿素含量显著高于‘扮绿’杀菌剂处理和对照。
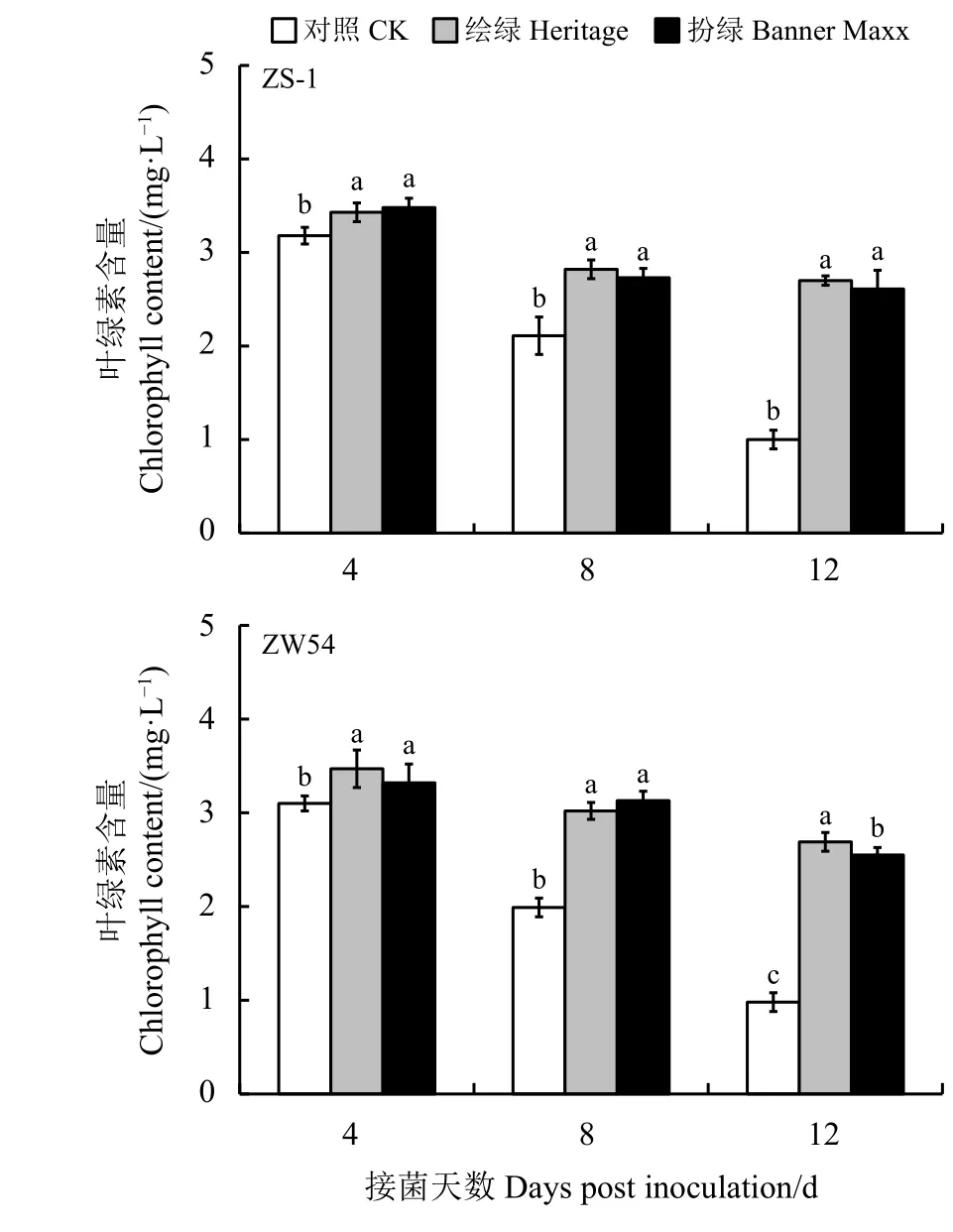
图2 杀菌剂处理对结缕草叶绿素含量的影响Figure2 Effect of fungicideson the chlorophyll content of zoysiagrass
2.4 杀菌剂处理对结缕草脯氨酸含量的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,脯氨酸含量呈现逐渐上升的趋势(图3)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草脯氨酸含量显著低于未使用杀菌剂的对照(P<0.05)。杀菌剂处理的脯氨酸含量上升缓慢,而对照的脯氨酸含量上升更快。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,脯氨酸含量在二者处理间无显著差异(P>0.05)。

图3 杀菌剂处理对结缕草脯氨酸含量的影响Figure 3 Effect of fungicides on the proline content of zoysiagrass
2.5 杀菌剂处理对结缕草丙二醛含量的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,对照的丙二醛含量呈现逐渐上升的趋势,而杀菌剂处理的丙二醛含量呈现先上升后下降的趋势(图4)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草丙二醛含量显著低于未使用杀菌剂的对照(P<0.05)。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,二者间无显著差异(P> 0.05)。
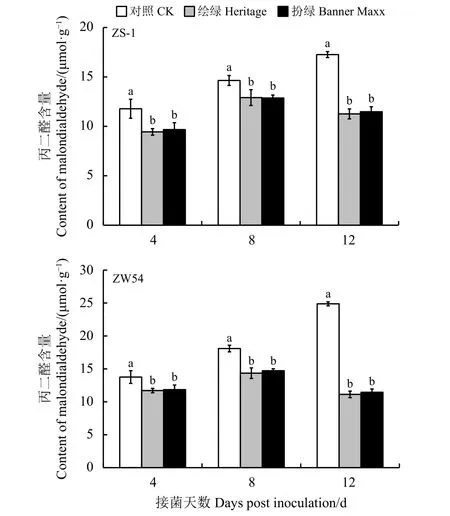
图4 杀菌剂处理对结缕草丙二醛含量的影响Figure4 Effect of fungicideson themalondialdehyde content of zoysiagrass
2.6 杀菌剂处理对结缕草苯丙氨酸解氨酶活性的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,对照的苯丙氨酸解氨酶活性呈现逐渐下降的趋势,而杀菌剂处理的苯丙氨酸解氨酶活性呈现先上升后下降的趋势(图5)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草苯丙氨酸解氨酶活性显著高于未使用杀菌剂的对照(P<0.05)。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,经杀菌剂‘绘绿’处理的结缕草苯丙氨酸解氨酶活性显著高于杀菌剂‘扮绿’处理(P< 0.05)。

图5 杀菌剂处理对结缕草苯丙氨酸解氨酶活性的影响Figure 5 Effect of fungicides on the phenylalanine ammonia-lyase activity of zoysiagrass
2.7 杀菌剂处理对结缕草几丁质酶活性的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,对照的几丁质酶活性呈现逐渐下降的趋势,而杀菌剂处理的几丁质酶活性呈现先上升后下降的趋势(图6)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草几丁质酶活性显著高于未使用杀菌剂的对照(P<0.05)。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,经杀菌剂‘绘绿’处理的结缕草几丁质酶活性显著高于杀菌剂‘扮绿’处理(P< 0.05)。

图6 杀菌剂处理对结缕草几丁质酶活性的影响Figure 6 Effect of fungicides on the chitinase activity of zoysiagrass
2.8 杀菌剂处理对结缕草β-1,3-葡聚糖酶活性的影响
结缕草接种立枯丝核菌ZS-1和ZW54后,随着接种时间的延长,发病率增加,对照的β-1,3-葡聚糖酶活性呈现逐渐下降的趋势,而杀菌剂处理的β-1, 3-葡聚糖酶活性呈现先上升后下降的趋势(图7)。在接种病原菌后的第4天、第8天和第12天,经杀菌剂处理的结缕草β-1,3-葡聚糖酶活性显著高于未使用杀菌剂的对照(P<0.05)。杀菌剂‘绘绿’和‘扮绿’对立枯丝核菌均有较好的抑制效果,经杀菌剂‘绘绿’处理的结缕草β-1,3-葡聚糖酶活性显著高于杀菌剂‘扮绿’处理(P< 0.05)。
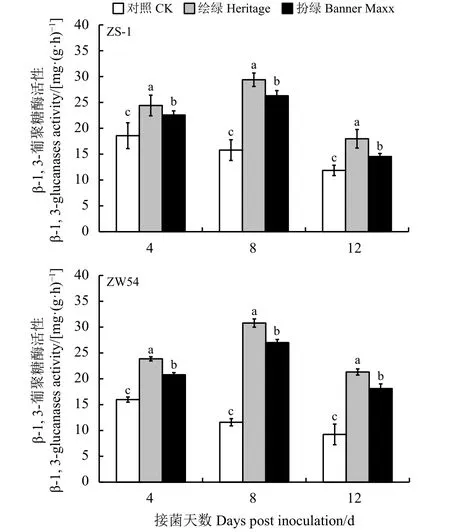
图7 杀菌剂处理对结缕草β-1, 3-葡聚糖酶活性的影响Figure 7 Effect of fungicides on the β-1, 3-glucanase activity of zoysiagrass
2.9 杀菌剂处理后结缕草大斑病的发病率
立枯丝核菌菌株ZS-1和ZW54对结缕草均具有较强的致病性(图8)。在接菌后12 d,染病植株叶片和叶鞘上出现水渍状或褐色斑点,然后整个叶片迅速变黄死亡。经杀菌剂处理的结缕草大斑病发病率显著低于未使用杀菌剂的对照(P<0.05)。杀菌剂‘扮绿’处理的发病率较高,菌株ZS-1和ZW54的发病率分别为43.49%和41.18%。杀菌剂‘绘绿’处理的发病率显著低于杀菌剂‘扮绿’处理(P<0.05)。在杀菌剂‘绘绿’、‘扮绿’处理下病原菌为ZS-1的病株发病率均高于病原菌为ZW54的病株的发病率。经杀菌剂处理的结缕草死亡率显著低于未使用杀菌剂的对照(P< 0.05),杀菌剂‘绘绿’处理的死亡率最低。

图8 杀菌剂处理后结缕草大斑病的发病率Figure 8 Effect of fungicides on the incidence rate of large patch
2.1 0杀菌剂对结缕草大斑病的防治效果
杀菌剂‘绘绿’、‘扮绿’处理对立枯丝核菌菌株ZS-1和ZW54引发的结缕草大斑病均具有一定的防治效果(图9)。杀菌剂‘绘绿’处理对结缕草大斑病的防效显著高于杀菌剂‘扮绿’处理(P<0.05)。杀菌剂‘绘绿’防效最优,对菌株ZS-1和ZW54的防效分别为43.61%和49.58%。杀菌剂‘绘绿’、‘扮绿’处理对病原菌ZS-1的病株防效均低于对病原菌ZW54的病株的防效。

图9 杀菌剂处理对结缕草大斑病的防效Figure 9 Effect of fungicides on control efficacy of large patch
3 讨论与结论
本研究通过4种杀菌剂分别对结缕草大斑病菌株ZW54和大斑病菌株ZS-1的抑制效果的测定,结果表明,供试的4种杀菌剂对菌株ZS-1和ZW54均有抑制作用,且各杀菌剂处理间抑制效果差异显著;杀菌剂‘绘绿’(50%嘧菌酯)对供试的两株结缕草病原菌菌株的抑制作用最强。两株菌株对各杀菌剂的耐受性也有差异,4种供试杀菌剂对菌株ZS-1的抑制作用均比ZW54的抑制作用弱,即菌株ZS-1对4种杀菌剂的耐受性比菌株ZW54高。其原因之一可能是菌株的来源和生境不同导致,菌株ZS-1是从深圳大运中心体育场的兰引Ⅲ号结缕草感病植株中分离出的,在日常的场地养护中经常施用多种杀菌剂,因此菌株ZS-1 对杀菌剂具有一定的耐药性,敏感性有所降低;而菌株ZW54从野生细叶结缕草的感病植株中分离获得,在此前的生境中处于自然发病状态,并未接触任何杀菌剂,所以对杀菌剂较为敏感。另一种造成耐药性的原因可能是触杀式杀菌剂‘卉乐’不能在植物体内传导或移动性差,只对植物直接接触杀菌剂的部位起作用,发挥作用比较快,表现直观;3种内吸式杀菌剂‘扮绿’、‘绘绿’和‘赛达’可被植物根、茎、叶等部位吸收,并经输导组织从吸收部位传导到其他部位发挥作用,药效较慢。
有研究发现植物在受到病害胁迫时,叶片相对含水量和叶绿素含量会有所降低,而下降速度越慢,说明植物的生长代谢越好,更有利于抵御病害[26,28]。本研究在结缕草叶片相对含水量和叶绿素含量的变化中发现杀菌剂处理后的结缕草对菌株ZS-1和菌株ZW54的抵抗性有所提高。在受到病原菌侵染时,植物自身会产生脯氨酸,用来分解活性氧自由基,从而抵抗病原菌对自身细胞的影响[27],植物组织细胞发挥正常生理功能的基础是细胞膜结构的完整性和流动性。植物组织受病害胁迫时,会使植物组织细胞膜受损,丙二醛含量积累[29-30]。也有研究表明丙二醛含量越高,说明植物细胞膜受到的危害越大[31-32]。本研究中,在接种菌株后经杀菌剂处理的植株中丙二醛含量显著低于对照,与上述研究结果类似。说明杀菌剂对病原菌均有抑制作用。
苯丙氨酸解氨酶、几丁质酶以及β-1,3-葡聚糖酶活性是研究植物抗病性的重要指标[26]。在苯丙烷代谢途径中苯丙氨酸解氨酶起关键作用,参与了多种激发子诱导的抗性,有效提高了植物抵抗病原侵染的能力[33]。本研究中,杀菌剂‘绘绿’处理的植株苯丙氨酸解氨酶活性在所有处理中最低,这说明杀菌剂‘绘绿’处理后,菌株ZS-1和菌株ZW54对植株的侵染受到抑制,与上述研究结果一致。几丁质酶通过降解侵染植株的真菌病原菌菌株的细胞壁,从而提高植物自身对病原的抗性[28]。杀菌剂处理的植株几丁质酶活性在感病后期均有所降低,说明药剂处理可以有效抑制病原菌菌株的侵染。在植物的抗病防御体系中,植物对病原菌的抑制作用主要是通过几丁质酶和β-1,3-葡聚糖酶等协同作用来完成[34]。在接种菌株后,杀菌剂‘绘绿’处理的植株β-1,3-葡聚糖酶活性随接菌天数的增加而呈现下降趋势。在感病初期杀菌剂‘绘绿’可能会提高植株的β-1,3-葡聚糖酶活性,从而减少菌株的侵害,在感病后期由于杀菌剂对病原菌的抑制和植物体内的β-1,3-葡聚糖酶活性的提高对于病原菌的防御作用共同降低了植株受病原菌的侵害,说明杀菌剂对2株病原菌引起的病害均有防治作用。
杀菌剂防治病害是一个极其复杂的生理生化过程,涉及到多种物质的相互作用[35],所以仅从药剂防治的效果不能非常全面地反映杀菌剂对病害的防治作用。本研究综合相对含水量、叶绿素含量、脯氨酸含量、丙二醛含量、苯丙氨酸解氨酶活性、几丁质酶活性及β-1,3-葡聚糖酶活性各项生理指标,探究了不同杀菌剂对病害的综合影响,筛选出对结缕草大斑病病原菌抑制效果较强的两种杀菌剂‘绘绿’和‘扮绿’。而杀菌剂‘绘绿’对两株病原菌ZS-1和ZW54的抑制作用均为最优,其防效分别为43.61%和49.58%。
