刺梨多酚对急性酒精中毒大鼠的解酒和护肝作用
2021-09-27周宏炫谭书明涂永丽罗继伟
周宏炫,黄 颖,谭书明*,涂永丽,罗继伟
(贵州大学酿酒与食品工程学院,贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
急性酒精中毒(acute alcoholism,AAH)又称醉酒,是由于一次过量饮酒导致血液中乙醇浓度过高,从而引起头晕、恶心呕吐、昏迷等症状,并伴随着肝脏、心脑血管等多系统损伤的现象,严重危害消费者身体健康[1]。近年来,随着人们生活水平的提高和饮酒习惯的改变,AAH的发病率越来越高,并成为除心脑血管及肿瘤外的世界第三大公共卫生问题[2]。肝脏是乙醇代谢的主要器官,AAH最常见的症状就是酒精性肝病[3]。研究表明,乙醇造成肝损伤的主要机制是氧化应激和脂质过氧化反应,表现为乙醇可以降低机体抗氧化能力,诱导肝脏发生脂质过氧化进而损伤肝细胞[4]。近期植物多酚缓解酒精性肝损伤机制的研究众多,如蜂蜜多酚、茶多酚、石榴叶多酚、葡萄多酚、苹果多酚等均被证明有较好的护肝作用,其作用机理包括激活机体的抗氧化系统、抑制脂质过氧化和调节信号通路,从而改善肝损伤[5]。
刺梨(Rosa roxburghiiTratt.)属蔷薇科多年生落叶小灌木,广泛分布于中国西南地区[6],具有抗炎[7]、抗氧化[8]、抗癌[9]和抗动脉粥样硬化[10]等作用。刺梨富含多种生物活性成分,如VC、超氧化物歧化酶(superoxide dismutase,SOD)、多酚和多糖等,因此被誉为“中国三大新兴水果之一”[11]。刺梨中多酚类物质含量丰富,具有多元酚结构,主要由没食子酸、儿茶素、鞣花酸、绿原酸、阿魏酸、表儿茶素等成分复合而成,是极具开发利用价值的优质资源[12]。目前相关人员对刺梨多酚(Rosa roxburghiiTratt.polyphenols,RRTP)的功能研究多集中在美白[13]、抗氧化[14]方面,而有关其对AAH的解酒和护肝作用研究鲜见报道。
本研究采用一次灌胃过量白酒的方式建立大鼠AAH模型,通过测定血液乙醇质量浓度和肝脏乙醇代谢酶活力考察RRTP的解酒作用;通过生化指标测定、病理学检查以及实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测,进一步研究RRTP对AAH大鼠肝脏的保护作用,并从肝脏组织氧化损伤角度探讨其作用机制,以期为RRTP保健食品的开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
雄性SD大鼠由长沙市天勤生物技术有限公司提供,体质量为180~200 g,生产许可证号:SCXK(湘)2019-0014。
刺梨 贵州宏财聚农投资集团有限责任公司;白酒(乙醇体积分数56%) 北京红星股份有限公司;海王金樽(主要成分为牡蛎提取物) 深圳市海王健康科技发展有限公司。
AB-8大孔树脂 天津波鸿树脂科技有限公司;乙醇、乙醇脱氢酶(alcohol dehydrogenase,ADH)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)ELISA试剂盒 上海桥杜生物科技有限公司;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、还原型谷胱甘肽(glutathione,GSH)、SOD试剂盒 南京建成生物工程研究所;苏木精-伊红(hematoxylin-eosin,HE)染色液 赛维尔生物科技有限公司;cDNA合成试剂盒、TRIzol试剂盒 美国赛默飞世尔科技公司。
1.2 仪器与设备
SG8200HPT超声波清洗仪 上海冠特超声仪器有限公司;CTFD-12S真空冷冻干燥机 青岛永合创信电子科技有限公司;Stepone plus型荧光定量PCR仪 美国ABI公司;SpectraMax190连续波长多功能酶标仪 美国Molecular Devices公司;H1-16KR高速冷冻离心机湖南可成仪器设备有限公司;DY89-II电动玻璃匀浆机宁波新芝生物科技股份有限公司;BMJ-III型包埋机常州郊区中威电子仪器厂;Motic BA400生物显微镜麦克奥迪实业集团有限公司;MODEL SPX-150B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 RRTP的制备
称取20 g切碎的新鲜刺梨果,以料液比1∶10加入60%(体积分数,后同)的乙醇溶液,于50 ℃、350 W条件下超声提取60 min后抽滤,收集滤液,于45 ℃条件下旋蒸去除乙醇。参考文献[15]提取RRTP,得到冻干的RRTP。采用Folin-Ciocalteu法[16]测得RRTP样品中多酚质量分数为65.41%。
1.3.2 动物分组与建模
60 只雄性大鼠随机分为正常组、模型组、阳性对照组以及RRTP低、中、高剂量组,每组10 只。实验室温度(22±2)℃、相对湿度(55±5)%,12 h光暗循环,自由饮水、饮食。适应性喂养1 周后,每日给正常组和模型组大鼠灌胃生理盐水,阳性对照组每日灌胃100 mg/kgmb的海王金樽,RRTP低、中、高剂量组分别每日灌胃50、100、200 mg/kgmb的RRTP,灌胃量均为10 mL/kgmb,连续30 d。于末次给药30 min后,除正常组给予生理盐水外,其他5 组均灌胃白酒(乙醇体积分数56%)。根据本实验室前期研究[17],选择白酒灌胃剂量15 mL/kgmb进行灌胃,建立AAH模型。
1.3.3 血清指标测定
分别于灌酒后30、60、90、120 min剪尾取血,止血后放回笼中,血液于4 ℃、3 000 r/min离心15 min得到上清液即血清,用于后续相关指标的测定。使用试剂盒测定血液中的乙醇质量浓度。然后于灌酒后12 h摘眼球取血,收集的血液于4 ℃、3 000 r/min离心15 min得到上清液,使用相应试剂盒检测血清中ALT、AST和TG水平。
1.3.4 肝脏指标测定
摘除眼球采血完成后,颈椎脱臼处死大鼠,快速取出肝脏,用预冷生理盐水漂洗并用滤纸吸干。剪取少量肝组织,加入9 倍体积的生理盐水,采用电动玻璃匀浆机于冰上匀浆,在4 ℃条件下,以2 500 r/min离心10 min,得到上清液。按照试剂盒说明书的方法测定肝脏组织中ADH、ALDH、SOD、GSH-Px、CAT活力以及MDA、GSH含量。
1.3.5 肝脏切片观察
参照Song Haizhao等[18]的方法,将肝脏组织样品浸泡在体积分数10%的福尔马林溶液中固定,经脱水、包埋、切片及HE染色处理后,使用光学显微镜观察各组大鼠肝脏形态学改变。
1.3.6 实时荧光定量聚合酶链式反应
按照TRIzol试剂盒说明书,液氮研磨肝脏组织后转入离心管,加入TRIzol提取剂处理组织,5 min后加入氯仿,以12 000 r/min离心5 min,取上清液经酚/氯仿抽提,用乙醇沉淀后室温晾干得到大鼠肝组织总RNA,将mRNA经逆转录合成cDNA,进行定量PCR检测核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、血红素加氧酶-1(heme oxygenase-1,HO-1)的mRNA相对表达水平。PCR反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸34 s,40 个循环。使用2-ΔΔCt法计算基因的mRNA相对表达,以β-actin作为内参基因。引物序列见表1。
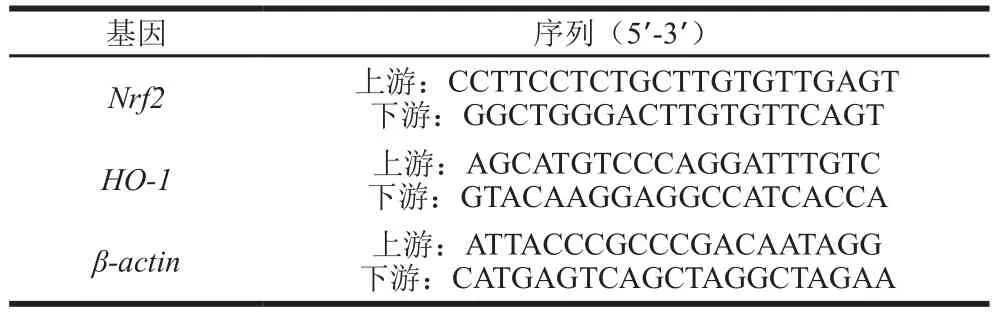
表1 目的基因引物序列Table 1 Sequences of primers used for amplification of target genes
1.4 数据统计与分析
2 结果与分析
2.1 RRTP对AAH大鼠血液乙醇质量浓度的影响
一次过量摄入乙醇会引起血液中乙醇质量浓度的急剧升高,如表2所示,与正常组相比,模型组大鼠血液乙醇质量浓度显著上升(P<0.05),并于灌酒后30 min达到最高值316.95 mg/dL,而后缓慢下降,到120 min时仍具有较高水平,说明AAH模型建立成功;与模型组相比,RRTP低剂量组在灌酒后60、90 min时可显著降低血液中的乙醇质量浓度(P<0.05),而中、高剂量组在灌酒后30、60、90、120 min时均可显著降低血液乙醇质量浓度(P<0.05)。结果表明,RRTP对AAH大鼠具有一定的解酒作用,且存在一定的剂量-效应关系。

表2 RRTP对大鼠血液乙醇质量浓度的影响(n =10)Table 2 Effect of RRTP on blood alcohol concentration in rats with acute alcoholism (n = 10)mg/dL
2.2 RRTP对AAH大鼠乙醇代谢酶的影响
ADH和ALDH是乙醇代谢的关键酶,其活力的变化会直接影响血液中的乙醇浓度[19]。如表3所示,与正常组相比,模型组肝脏中ADH和ALDH活力显著升高(P<0.05),表明饮酒会增强大鼠体内乙醇代谢酶活力。与模型组相比,阳性对照组及RRTP低、中、高剂量组均能显著增强AAH大鼠肝脏ADH活力(P<0.05);中、高剂量RRTP组中ALDH活力显著增强(P<0.05),但低剂量RRTP组ALDH活力无显著性差异(P>0.05)。结果表明RRTP可以通过增强ADH和ALDH活力加快乙醇代谢,从而降低血液中的乙醇水平。

表3 RRTP对大鼠肝脏ADH和ALDH活力的影响(n=10)Table 3 Effect of RRTP on ADH and ALDH activities in liver of rats (n = 10)
2.3 RRTP对AAH大鼠肝损伤的影响
血清ALT、AST和TG水平是评价急性肝损伤的重要指标,过量饮酒会导致肝脏受损,引起血清ALT、AST和TG水平显著升高[20]。如表4所示,与正常组相比,模型组大鼠血清中ALT、AST和TG水平显著上升(P<0.05),表明AAH会诱导肝脏发生损伤,提示急性酒精性肝损伤模型建立成功;与模型组相比,阳性对照组和RRTP各剂量组均能显著降低大鼠血清中ALT、AST和TG水平(P<0.05),表明RRTP对肝脏具有一定的保护作用。

表4 RRTP对大鼠血清中ALT、AST和TG水平的影响(n =10)Table 4 Effect of RRTP on serum ALT, AST and TG levels in rats (n = 10)
2.4 RRTP对AAH大鼠氧化应激的影响
低水平SOD、GSH-Px、CAT、GSH和高水平MDA是肝脏发生氧化应激的重要标志[21]。如表5所示,与正常组相比,模型组大鼠肝脏SOD、GSH-Px、CAT活力和GSH含量均显著降低,MDA水平显著升高(P<0.05),表明乙醇致肝损伤大鼠肝脏抗氧化能力降低,氧化应激增强。与模型组相比,RRTP各剂量组均能显著增加大鼠肝脏SOD、GSH-Px活力,显著降低MDA水平(P<0.05);其次,RRTP也能明显增加CAT和GSH水平,尽管仅在RRTP高剂量组中观察到统计学差异(P<0.05)。结果说明RRTP能改善肝脏的氧化应激状态,且存在一定的剂量-效应关系。

表5 RRTP对大鼠肝脏SOD、CAT、GSH-Px活力和GSH、MDA水平的影响(n=10)Table 5 Effect of RRTP on SOD, CAT and GSH-Px activities, and GSH and MDA levels in liver of rats (n = 10)
2.5 RRTP对Nrf2、HO-1 mRNA相对表达水平的影响
图1A、B分别显示了Nrf2、HO-1在AAH大鼠肝脏中的表达情况。与正常组比较,模型组大鼠肝组织中Nrf2、HO-1mRNA相对表达水平显著降低(P<0.05),表明乙醇可以抑制Nrf2/抗氧化反应元件(antioxidant response element,ARE)信号通路。与模型组比较,阳性对照组大鼠肝组织Nrf2、HO-1mRNA的表达量显著提升(P<0.05),不同的RRTP剂量组HO-1mRNA相对表达水平均显著提升(P<0.05),Nrf2mRNA相对表达水平只有中、高剂量组显著升高(P<0.05),说明RRTP可以剂量依赖的激活Nrf2/ARE通路,提高机体抗氧化体系能力。

图1 RRTP对大鼠肝组织中Nrf2(A)和HO-1(B)mRNA相对表达水平的影响Fig.1 Effect of RRTP on mRNA expression of Nrf2 (A) and HO-1 (B)in liver of rats
2.6 RRTP对AAH大鼠肝脏的组织病理学影响
由图2肝脏HE染色结果可知,正常组大鼠肝细胞形态结构完整,肝索排列规则,在中央静脉呈放射状排列,胞浆内无脂滴,肝窦未见明显淤血扩张及炎性浸润。模型组大鼠肝细胞肿胀,出现局部坏死,肝索排列紊乱,胞质中出现大小不一的脂滴,并伴有少量炎性细胞浸润。与模型组相比,阳性对照组及3 个RRTP剂量组肝细胞损伤程度明显减轻,阳性对照组肝索排列整齐,肝窦无扩张,少量肝细胞出现轻微的变性和坏死;RRTP低剂量组有少量肝细胞发生变性坏死,胞浆内有部分脂滴出现;RRTP中、高剂量组肝细胞结构较完整,肝索形状排列比较清晰,胞浆内无脂滴出现,脂肪变性程度轻于低剂量组。

图2 大鼠肝脏组织病理学变化Fig.2 Histological observations of liver tissues
3 讨 论
AAH是由过量饮酒引起的,对全球发病率和死亡率有重要影响[22]。研究表明,摄入的乙醇经胃肠道吸收后迅速分散到血液中,引起血液乙醇含量的上升,之后被输送到肝脏中进行代谢而清除[23]。ADH和ALDH是体内参与乙醇代谢的关键酶,主要存在于肝细胞的细胞质和线粒体中。乙醇经ADH氧化成乙醛,再通过ALDH氧化为乙酸,乙酸进一步代谢成H2O和CO2排出体外,从而显著降低血液中的乙醇含量[24]。本研究结果显示,AAH大鼠血液中的乙醇质量浓度急剧上升,肝脏ADH和ALDH活力增加;相比于模型组,RRTP预处理显著降低血液乙醇水平(P<0.05),且ADH和ALDH活力进一步增强。说明RRTP能通过提高ADH和ALDH活力加快乙醇代谢,降低血液乙醇质量浓度,具有一定的解酒作用。该结果与Kaviarasan等[25]对葫芦巴多酚解酒机理的研究结果相同。
ALT和AST是存在于肝细胞浆和线粒体的两种主要转氨酶。正常情况下,ALT和AST在血清中的含量很少,但当肝脏受到损伤时,肝细胞膜通透性增加,ALT和AST就会渗透至血液中,所以血清中的ALT和AST水平可反映肝脏的健康状况[26];TG水平升高是肝细胞发生脂肪变性的早期表现;临床上通常将ALT、AST和TG水平作为反映肝损伤程度的血清学指标[27]。本研究发现,模型组大鼠血清ALT、AST和TG水平显著升高,病理组织切片也显示肝细胞形态结构发生破坏,胞浆内有大量脂滴出现;而RRTP组肝细胞结构相对完整,脂肪变性程度减轻,且ALT、AST和TG水平均降低,表明AAH会引起大鼠肝细胞变性或坏死,补充RRTP能显著减轻乙醇引起的肝损伤。与邢佳等[28]研究的石榴叶多酚能够降低血清ALT、AST和TG水平,对急性酒精性肝损伤具有保护作用的结论一致。
大量研究表明,乙醇造成的肝损伤与氧化应激和脂质过氧化反应密切相关。乙醇在体内代谢主要依赖于肝脏,摄入过量乙醇会超过肝脏的代谢能力,促进大量的活性氧(reactive oxygen species,ROS)产生,这些ROS会破坏机体内部氧化-抗氧化系统的动态平衡,导致氧化系统失衡[29],而在体内过度累积会引发脂质过氧化进而损伤肝细胞。因此,AAH易导致酒精性肝损伤。在内源性抗氧化系统中,SOD/GSH-Px/CAT是最主要的一组抗氧化酶,它们共同抵御机体受到的氧化应激损伤。SOD主要将ROS转化为过氧化氢,然后经GSH-Px和CAT将过氧化氢进一步分解成水[30]。此外,GSH也是抵抗氧化应激的重要防御线,可直接清除体内的ROS[31]。这些抗氧化剂均能保护肝脏免受氧化应激的损害,但很容易被脂质过氧化物清除。MDA是脂质过氧化的主要产物,其不仅会干扰抗氧化防御,还会引起肝细胞的变性和坏死,使血液中ALT、AST和TG水平升高[32]。在本研究中,模型组大鼠肝脏SOD、GSH-Px、CAT活力和GSH含量显著下降(P<0.05),MDA含量显著升高(P<0.05),表明AAH后机体的抗氧化应激能力降低,导致脂质过氧化物的积累从而引起肝细胞损伤。而预处理RRTP能够明显增加肝脏SOD、GSH-Px、CAT活力和GSH含量,降低MDA含量,表明RRTP可通过增强机体抗氧化能力,抑制脂质过氧化反应来改善急性酒精引起的肝损伤,与相关文献报道结果[33]一致。
Nrf2/ARE通路作为抵抗内外界氧化的防御性信号通路,在维持机体的抗氧化体系中占有重要的地位[34]。Nrf2是调节机体抗氧化应激的重要转录因子,能进入细胞核与ARE结合形成Nrf2/ARE通路,调控下游抗氧化基因的转录。HO-1是Nrf2/ARE通路调节的主要抗氧化防御基因,具有清除自由基、保护细胞的作用[35]。因此,Nrf2/ARE抗氧化信号通路可能会成为治疗酒精性肝损伤的有效靶点[36]。Shu Guangwen等[37]研究发现,乙醇暴露会下调Nrf2、HO-1表达量,本实验显示急性乙醇摄入会显著降低肝组织Nrf2及其下游的HO-1mRNA相对表达水平,而RRTP能够剂量依赖地提高Nrf2和HO-1mRNA相对表达水平,说明RRTP可能通过调控Nrf2/ARE通路提高机体抗氧化防御能力,发挥对急性酒精性肝损伤的保护作用。
4 结 论
RRTP具有良好的解酒和护肝作用,可改善因乙醇引起的醉酒和肝损伤,其解酒机制可能与增强乙醇代谢酶活力有关;能够通过抑制氧化应激和脂质过氧化而改善肝损伤,其抗氧化应激作用机制可能与上调肝组织Nrf2/ARE信号通路中Nrf2表达和激活其下游抗氧化酶HO-1相关。因此,RRTP可作为功能保健食品缓解因乙醇引起的AAH,其能否改善晚期酒精性肝损伤如纤维化、肝硬化等仍有待研究。
