不同栽培基质对茵芋幼苗生长以及生理指标的影响
2021-09-25龙海燕陈菊艳徐超然
龙海燕 陈菊艳 徐超然 李 鹤
(贵州省林业科学研究院,贵州 贵阳 550005)
茵芋(SkimmiareevesianaFort.)为芸香科(Rutaceae)茵芋属(SkimmiaThunb.)常绿灌木。中国东南沿海各省、台湾、湖南、湖北、广西、贵州、云南以及西藏喜马拉雅山等有原生分布,通常生长在海拔1200~2600 m地带[1]。茵芋花开时极芳香,秋冬季节红果满枝,是观赏效果极佳的优良观赏花木,此外,茵芋还具有较高的药用价值,可治疗风湿痹痛、筋骨疼痛、四肢挛急和两足软弱等,是我国传统的药用植物[2]。目前针对茵芋的研究主要集中在扦插繁殖[3-4]和药用成分研究[5-6]方面,引种栽培的相关报道较少,鉴于茵芋的广阔市场开发前景,野生种质资源又十分稀缺,因此尽快开展茵芋的引种栽培至关重要,对满足市场需求及保护野生茵芋资源具有重要意义。本研究以一年生茵芋幼苗为研究对象,比较不同栽培基质对茵芋幼苗生长及生理指标的影响,探究茵芋幼苗的最适宜栽培基质,以期为茵芋引种栽培提供理论依据。
1 材料与方法
1.1 试验材料
采用种源为雷山县的一年生茵芋播种苗,选取生长一致、无病虫害的植株各30盆,每盆1株。
1.2 供试栽培基质
试验基质配方以泥炭、珍珠岩、蛭石、黄心土、椰糠、腐殖土等为组成材料按照表1所示的体积比例配制,腐殖土与黄心土取自贵州省林科院试验林场基地,泥炭土为花卉市场购买的新西兰进口泥炭;椰糠为网上购买无菌椰砖用水泡发后晾干使用;珍珠岩(规格8~12mm颗粒大小)与蛭石(规格1~3mm)均于网上购买。配比好的基质用1g/L浓度的多菌灵、杀虫剂,进行杀菌、消毒,覆膜7d~10d后装袋备用。
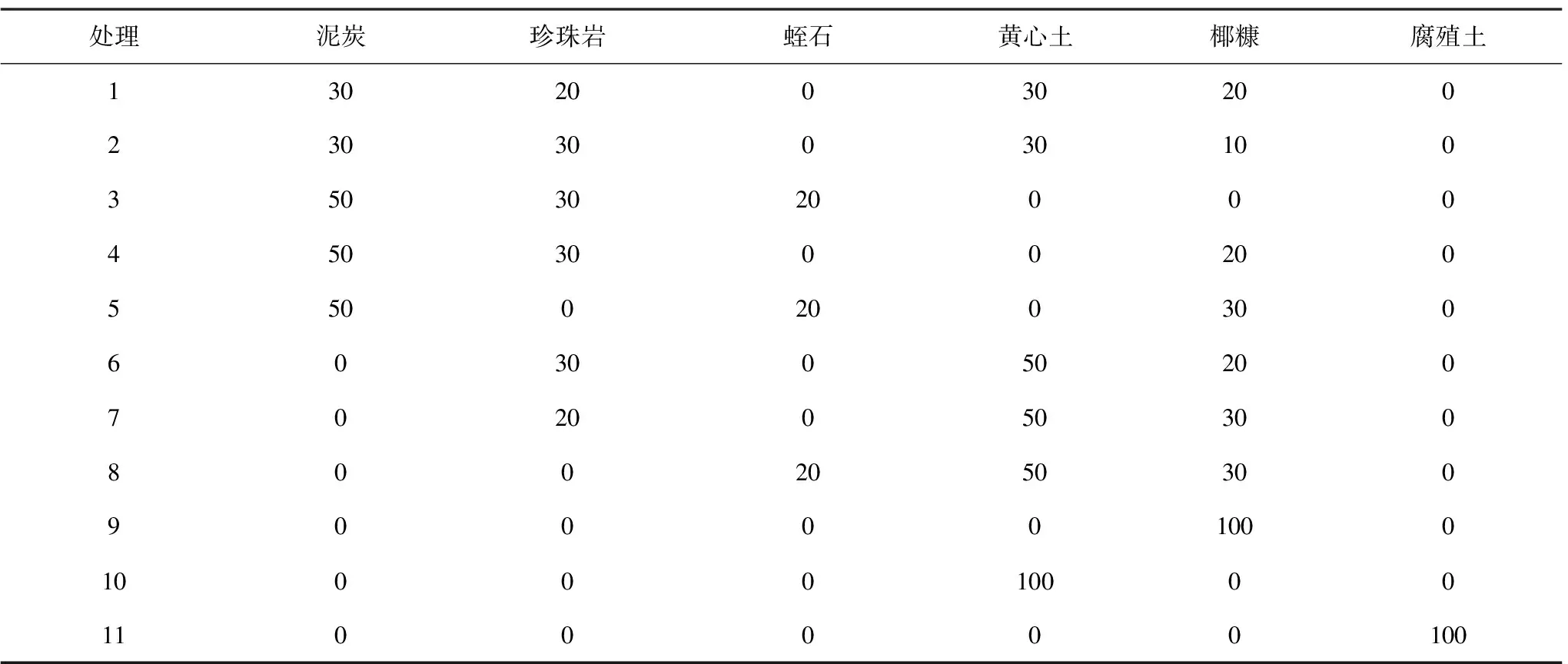
表1 基质试验配比表
1.3 试验设计
实验采用随机区组设计,共设置11个处理。单株小区,每处理30株,常规管理。
1.4 试验方法
试验于2018年5月初,将茵芋移栽,选择10×20 cm(直径×高)黑色聚丙烯塑料营养钵填装基质,并定植树种。试验在林科院中试基地温室中进行。
1.5 测定指标
1.5.1生长指标
(1)苗高:从植株基部至植株最高点的长,用直尺(精确到1 mm)测定;(2)地径:苗木土痕处的直径,用游标卡尺测定,以上各处理选取10株为1组,重复3次,取均值,6月开始,幼苗期茵芋生长较缓慢,于每月初测定一次苗高、地径。
1.5.2生物量测定
每处理随机抽取5株,将采集的植株清洗干净,用吸水纸吸干多余水分,称量总鲜重,然后用剪刀将根、茎、叶分别剪下,用天平测量鲜重,然后分别将根、茎、叶装入牛皮纸袋放入烘箱,在105 ℃下杀青30 min,在65 ℃下烘干至恒重,称量(精确到0.001 g),生物量为地下部分(根系)和地上部分(茎和叶)干质量的总和。
1.5.3生理指标
各生理指标测定方法如下:(1)光合色素:丙酮-乙醇混合液提取法[7];(2)可溶性糖含量:蒽酮比色法[8];(3)可溶性蛋白含量:考马斯亮蓝G-250法[8];(4)丙二醛(MDA)含量:硫代巴比妥酸法[9];(5)游离脯氨酸含量:采用酸性茚三酮比色法[10]。以上各指标所需材料均在早上8∶00对各处理随机采5枚相同部位的成熟叶片,去除叶柄和中脉,剪碎混合均匀,用722型分光光度计测定,每个处理各指标均重复3次,取平均值。
1.6 数据处理
采用Excel 2010进行数据统计,用SPSS20.0软件进行数据分析。
2 结果与分析
2.1 不同栽培基质对茵芋苗高生长的影响
植物的形态指标直观的反映了苗木生长的好坏,由图1可知,不同栽培基质下茵芋1年生播种苗生长特性之间有明显差异,生长前期各处理的苗高不一,但差异不大,7月到9月为苗高快速生长期,7月1日苗高最大的是处理7,最小的是处理6,处理5和处理10的苗高增幅较为明显。9月到10月各处理苗高生长进入缓慢阶段,10月1日,各处理苗高的大小顺序为:处理11(5.47 cm)>处理10(5.34 cm)>处理7(4.64 cm)、处理1(4.64 cm)>处理4(4.45 cm)>处理2(4.39 cm)>处理8(4.08 cm)>处理5(3.93 cm)>处理3(3.87 cm)>处理6(3.70 cm)>处理9(3.61 cm),到次年1月,苗高增长趋于稳定,处理11的苗高仍为最高,与处理10没有显著差异,但显著高于其他各处理(P<0.05),最小的为处理9,与处理6、处理3和处理5无显著差异,与其他各处理有显著差异。由此可见,处理11、处理10对茵芋苗高生长促进作用最明显。
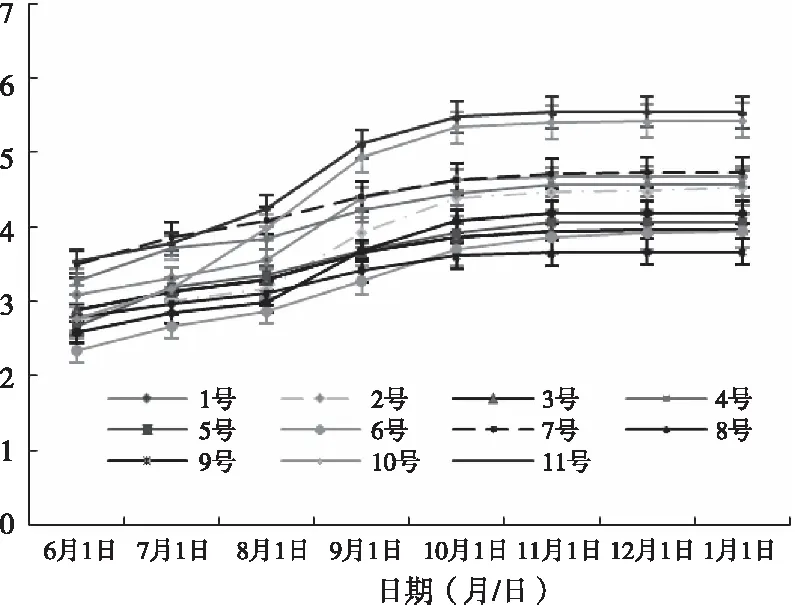
图1 不同基质处理下茵芋苗高的生长
2.2 不同栽培基质对茵芋地径生长的影响
不同栽培基质下茵芋实生苗地径生长规律如图2所示。7月1日以前各基质处理的地径生长差异不大,7月到8月为地径快速生长期,8月1日,处理4的地径最大,显著高于其他各处理(P<0.05),处理10和处理11的地径增长较快,排到了第二和第三,处理6的地径最小,与处理9、处理1无显著差异,由此可见,处理9、处理6和处理1对茵芋地径生长的促进作用不明显。8月到10月期间地径的增长减缓,10月1日,处理10的地径超过处理4,位居第一位,一直保持较快的增长,到1月1日,处理10的地径仍为最大,与7月份相比,地径增长了158%,其次是处理4和处理11,处理6和处理9的地径最小。由此可见,处理10、处理4和处理11对茵芋地径生长的促进作用较为明显。

图2 不同基质处理下茵芋地径的生长
2.3 不同栽培基质对茵芋生物量的影响
从表2可知,不同基质处理对茵芋苗木生物量影响显著。其中,处理4和处理5的根鲜重最大,与处理6、处理1、处理3没有显著差异,与其他各处理有显著差异(P<0.05);茎鲜重、叶鲜重和总鲜重最大的均为处理10,处理10的茎鲜重与处理4、处理5、处理11、处理1无显著差异,与其他各处理有显著差异(P<0.05);处理10的叶鲜重显著高于其他各处理;处理10的总鲜重和处理4差异不显著,但显著地高于其他各处理,处理9的总鲜重最小。
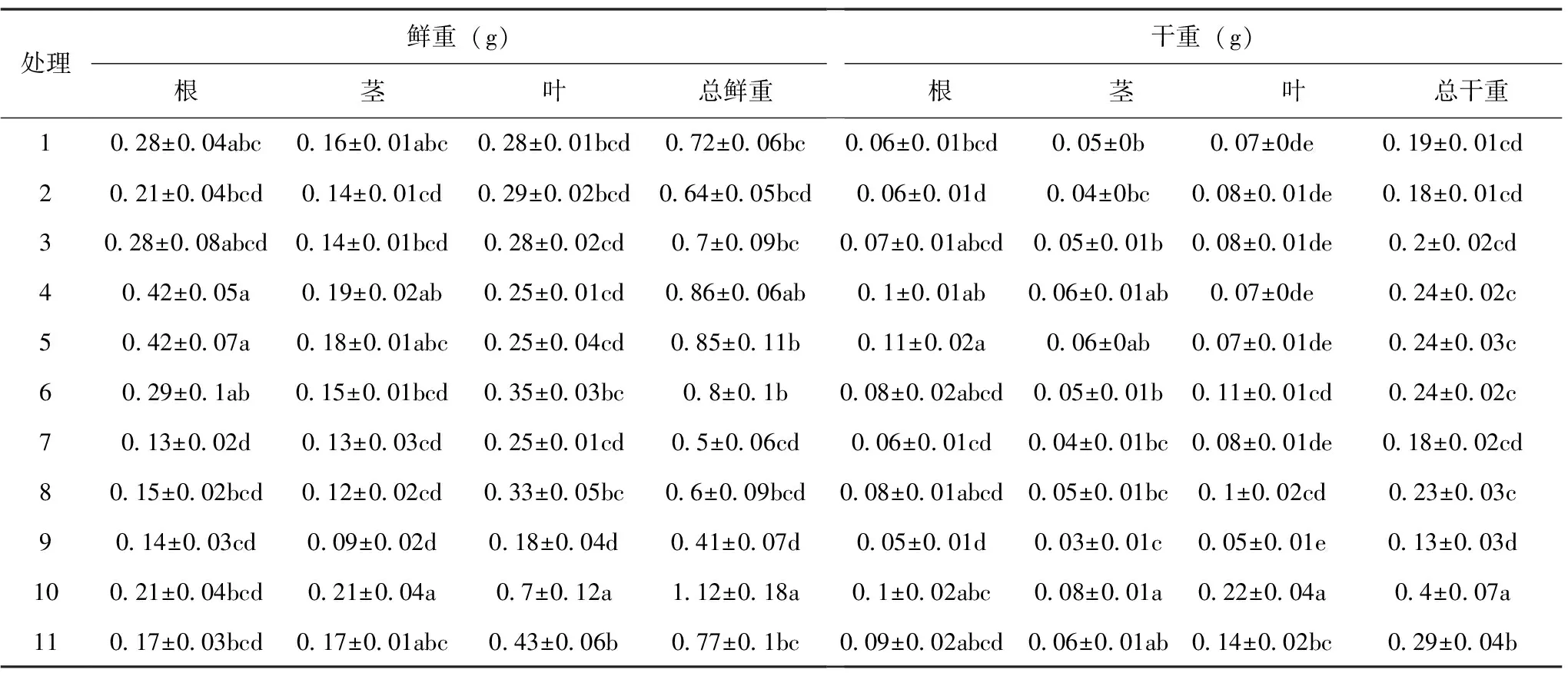
表2 不同基质处理下茵芋的生物量变化
根干重各处理间的差异并不显著,茎干重、叶干重和总干重均在处理10下最大,在处理9下最小,处理10的总干重显著高于各处理(P<0.05),其次是处理11,与其他各处理有显著差异(p<0.05),处理9与处理1、处理2、处理3、处理7无显著差异,与其他各处理有显著差异(P<0.05)。综合生物量各指标所述,可见均是以处理10效果最优,其次是处理11,处理9效果最差。
2.4 不同栽培基质对茵芋叶绿素含量的影响
光合色素作为植物光合作用过程中主要吸收光能的物质色素,能影响植物光合作用的光能利用,包括叶绿素和类胡萝卜素。表3可见,处理10和处理11的叶绿素a含量显著高于其他各处理(P<0.05),其次是处理7,处理4的含量最小;叶绿素b含量中,处理5显著高于各处理(P<0.05),其次是处理9,处理9与处理10、处理8和处理4无显著差异。处理11和处理10的叶绿素a/b值显著高于各处理;类胡萝卜素含量和叶绿素总含量均为处理10最高,叶绿素总含量大小排序为:处理10>处理11>处理7>处理8>处理6>处理5>处理9>处理3>处理1>处理4>处理2,处理10、处理11和处理7分别较处理2的叶绿素总含量高出110.26%、85.62%和53.21%,说明不同栽培基质对茵芋幼苗叶绿素含量有显著影响,其中处理10、处理11和处理7能显著提高叶片中叶绿素的含量。

表3 不同栽培基质下茵芋的叶绿素含量变化
2.5 不同栽培基质对茵芋可溶性糖含量的影响
如图3所示,7号处理的可溶性糖含量最高,其次是11号处理和10号处理,这三个处理间差异不显著,处理2与处理1和处理3无显著差异,与其他各处理差异显著(P<0.05),处理4和处理9的可溶性糖含量最低,显著低于其他各处理。可溶性糖作为植物碳素营养物质之一,能够为各种有机物的合成和各种生命活动提供所需的能量,同时能够保证植物叶片细胞中新陈代谢的顺利进行,因此,可以看出处理7和处理11能够促进茵芋叶片可溶性糖含量的积累,更有利于茵芋生长。
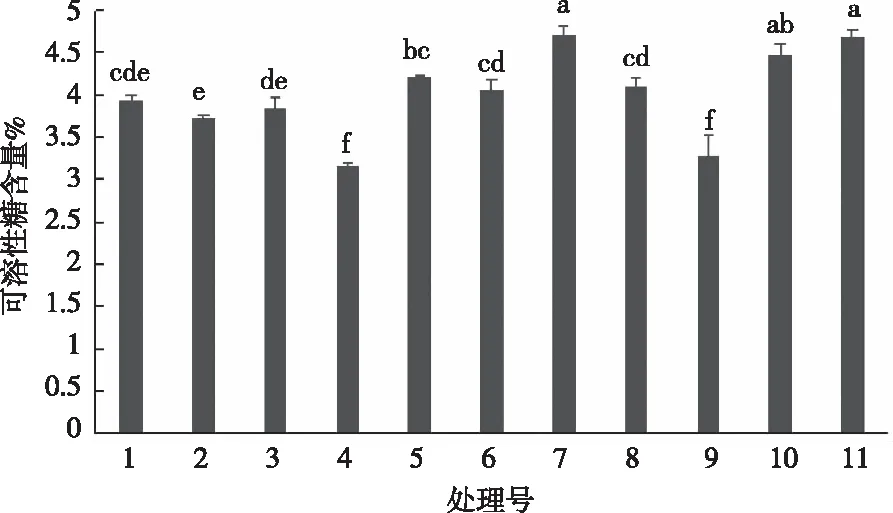
图3 不同基质处理对茵芋可溶性糖含量的影响
2.6 不同栽培基质对茵芋可溶性蛋白含量的影响
由图4可以看出,不同基质处理下的茵芋叶片中可溶性蛋白含量差异较大。处理10的含量最高,除与处理11和处理8不显著以外,显著高于其他各处理(P<0.05)。4号处理的可溶性蛋白含量最小,与处理9和5无显著差异,处理10和处理11的可溶性蛋白含量较处理4分别高出了61.58%和54.83%,因此,在各处理中,处理10和处理11可明显提高植株蛋白质的合成能力,可以有效地维持其正常生长的稳定性。
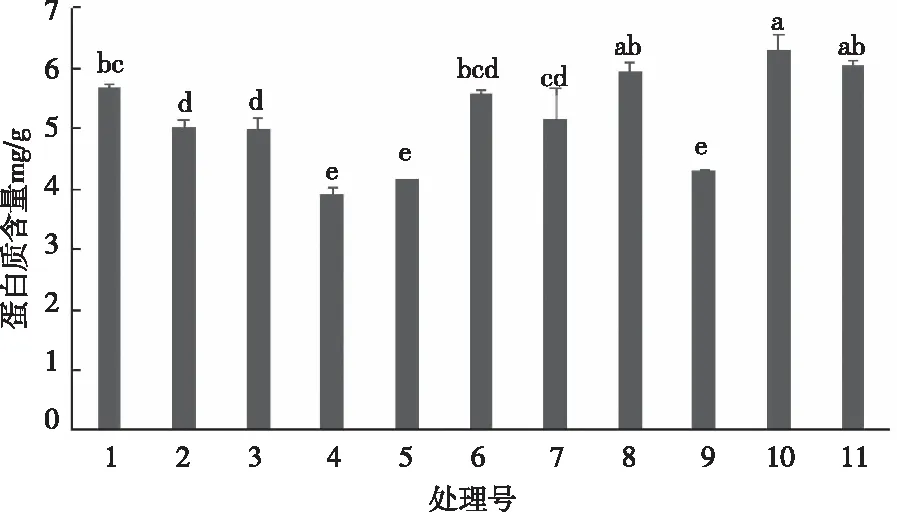
图4 不同栽培基质对茵芋可溶性蛋白含量的影响
2.7 不同栽培基质对茵芋丙二醛(MDA)含量的影响
植物在不利条件下生长往往发生膜脂过氧化作用,产生丙二醛(MDA),植物体内的MDA含量的多少能够反映膜脂过氧化及膜伤害的程度[10]。由图5可见,各处理间MDA含量差异显著,处理9的MDA含量最小,与处理10、处理3、处理4和处理2无显著性差异,显著低于其他各处理(P<0.05)。处理5的 MDA 含量显著高于其他各处理,说明它的膜脂过氧化程度较高。
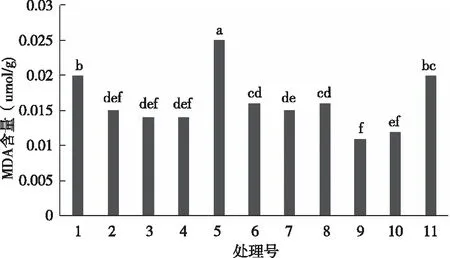
图5 不同基质处理对茵芋MDA含量的影响
2.8 不同栽培基质对茵芋脯氨酸(Pro)含量的影响
不同基质处理下,茵芋叶片中的脯氨酸含量如图6所示,11号处理的脯氨酸含量最高,显著高于各处理(P<0.05),其次是处理10和处理2,二者无显著差异,与其他各处理差异显著,处理6的脯氨酸含量最低,与处理7、处理8、处理9无显著差异。脯氨酸作为植物叶片中较为重要的渗透调节物质,有助于植物在逆境中进行渗透调节,以维持细胞一定的含水量和膨压势,从而增强植物的抗旱能力和抗逆性。因此,可以看出,处理11和处理10、处理2的茵芋幼苗叶片能够保持较高的脯氨酸含量,有助于抵抗逆境。
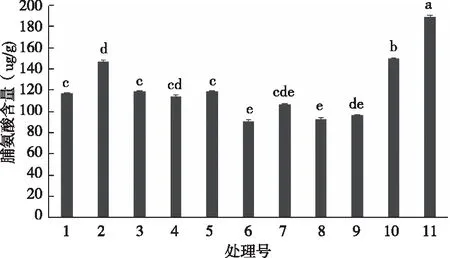
图6 不同基质处理对茵芋脯氨酸含量的影响
3 讨论与结论
育苗基质影响植物的生长发育,是容器育苗的关键[11],如何在满足苗木生长要求的前提下,选择资源丰富、容易获得且价格便宜的基质原料是容器苗基质发展的趋势。本试验以泥炭、蛭石、珍珠岩、椰糠、黄心土、腐殖土经过消毒处理后,将其按不同体积比例配制成11种栽培基质,研究其对茵芋容器苗生长以及生理指标的影响。
苗高、地径等都是衡量植物生长势的基本形态学指标,本研究中不同基质处理下茵芋一年生播种苗的苗高和地径有明显差异,处理11和处理10对茵芋苗高生长促进作用最明显,显著高于其他各处理(P<0.05),说明纯腐殖土和黄心土的配比是较适合茵芋的栽培基质,处理9的苗高最小,可能是因为纯椰糠虽保水性较强,但本身不含有养分,不能满足茵芋幼苗期的生长,其次处理7的基质配比,即珍珠岩∶黄心土∶椰糠=2∶5∶3,对茵芋苗高的促进作用也值得关注。处理10对茵芋地径生长的促进作用也较为明显,其次是处理4和处理11。在生物量方面,处理10的总鲜重和总干重显著高于各处理(P<0.05),说明黄心土作为基质能够促进幼苗生物量的积累,其次是处理11,仍以处理9效果最差。
植物生理指标方面,叶绿素反应光合作用的强弱,直接影响植株的养分积累,是植物营养状况的重要指标[7]。本试验中,处理10、处理11和处理7显著提高了茵芋叶片中叶绿素的含量,进而促进植物养分积累促进植物生长。处理7与处理11、处理10的可溶性糖含量显著高于其他处理,可溶性蛋白含量也是在处理10和处理11下最高,11号处理的脯氨酸含量显著高于其他各处理,处理10保持了较低的丙二醛(MDA)含量,综上各指标所述,说明用处理11与处理10基质栽培的茵芋对营养物质的积累更为高效,同时保持了较高的脯氨酸等渗透调节物质含量,降低了膜脂过氧化作用,更有效地维持了植物各项生理活动的进行。
黄心土保水性好且杂菌少,能够减少植物病虫害发生,但资源量有限且运输成本较高,腐殖土含有大量的有机质,土质疏松,透气性能好,保水保肥能力强且质地轻,综合考虑基质的资源可获得性以及成本等因素,处理11(腐殖土)较10(黄心土)更适宜于作为茵芋的栽培基质,处理9(纯椰糠)不适宜单独用于茵芋栽培,但是若与其他基质搭配使用,如处理7,也能够取得不错的育苗效果。本试验从11种不同栽培基质中初步选出了适宜作为茵芋容器育苗的栽培基质,但是由于试验周期有限,仅在茵芋的幼苗生长阶段,而各基质对于茵芋开花、结果等的影响如何,还有待于进一步深入研究。
