共表达PD-L1抑制剂的溶瘤病毒增强胃癌的溶瘤活性研究
2021-09-25李婷王爱平王红玲刘适郭文涛三亚市人民医院消化内科一区海南572000
李婷 王爱平 王红玲 刘适 郭文涛(三亚市人民医院消化内科一区,海南572000)
胃癌是胃黏膜癌变的一种恶性肿瘤。目前胃癌已经是全球癌症相关死亡率第三的恶性癌症,2013年的统计数据显示,约有98.4万胃癌新发病例和84.1万死亡病例,且近年来数字进一步增长[1]。由于早期患者缺乏具体的疾病表现,大多数胃癌患者确诊时已经疾病晚期阶段,预后较差[2]。
溶瘤病毒可以在肿瘤细胞中选择性复制,并能够摧毁癌细胞,进一步将肿瘤抗原暴露至抗原提呈细胞中[3]。一些研究表明,其可以通过局部免疫激活、免疫原性溶瘤细胞死亡、新抗原释放和呈递,以及改变免疫抑制的肿瘤微环境来激活T细胞反应,从而进一步增强抗肿瘤免疫反应。值得注意的是,近年来,具有肿瘤选择性的溶瘤病毒被证明可作为一种载体,携带一些免疫调节因子进入肿瘤微环境,从而改变肿瘤微环境。用携带致炎细胞因子编码基因的肿瘤选择性溶瘤病毒治疗有望增强肿瘤微环境中的抗肿瘤免疫反应,一些溶瘤病毒已经在几种癌症中进行评估[4-6]。Talimogene laherparepvec(T-VEC)于2015年在美国被批准为治疗转移性黑色素瘤的一类溶瘤病毒,是一种工程化的单纯疱疹病毒,插入编码粒细胞-巨噬细胞集落刺激因子(GM-CSF)的基因作为免疫佐剂来调节免疫微环境[7-8]。Pexastimogene devacirepvec(PexA-VEC,JX-594)也携带编码GM-CSF的基因,目前已经在晚期肝细胞癌患者的Ⅲ期临床试验中进行活性评估[9-10]。
有研究表明,溶瘤病毒感染后肿瘤微环境中PD-L1表达会上调,导致肿瘤对溶瘤免疫治疗产生抵抗,这一问题应当在溶瘤病毒治疗过程中予以克服[11]。本研究中,构建了一种共表达PD-L1抑制剂和GM-CSF的工程溶瘤痘苗病毒。发现这种工程化溶瘤病毒能够有效裂解肿瘤细胞并表达PD-L1抑制剂,体内实验表明其可以增强溶瘤病毒的抗肿瘤活性,激活肿瘤特异性T细胞。结果表明,这种工程化的溶瘤病毒对胃癌的治疗提供了一种新的方法。
1 材料与方法
1.1 材料
1.1.1 细胞人胃癌细胞MGC803及人胃癌细胞AGS由中科院上海细胞库提供;鼠胃癌细胞MFC细胞及HUTK-143B细胞由美国模式菌种保藏库提供。以上所有细胞均在DMEM完全培养基(额外添加10%FBS)37℃、5%CO2条件下生长。
1.1.2 试剂MTT及二甲基亚砜购自美国Sigma公司,anti-CD8、anti-IFN-γ及anti-TNF-α流式抗体购自Biolegend(美国),anti-PD-L1抗体购自R&D(美国)。GAPDH购自杭州联科生物科技有限公司。Fix/Perm溶液及Perm/Wash溶液购自BD Biosciences(美国)。
1.2 方法
1.2.1 重组病毒的构建PD-L1抑制剂由PD-1受体胞外结合域与IgG1 Fc片段组成。穿梭载体pSel-DsRed2N1中插入PSE/l启动子控制的iPDL1或/和p7.5启动子控制下的GM-CSF。为获得重组溶瘤痘病毒(OV),以VGF基因缺失的vSC20为亲本病毒进行同源重组。将vSC20以MOI值为0.1感染HUTK-143B细胞2 h,然后将重组穿梭质粒转染HUTK-143B细胞。挑选3个RFP阳性斑块进行分离并使其悬浮,进一步感染HUTK-143B细胞,重复3个周期的空斑选择,直到所有斑块均为RFP阳性。1 000 r/min离心5 min去掉上清液收获细胞。再悬浮于冰浴的10 mmol/L Tris缓冲液(pH=9.0)中,超声1 min,干冰/乙醇交替浴冻融3次。将细胞裂解液小心预置于2 ml 40%蔗糖溶液中,在4℃、20 000 r/min离心2 h。将超速离心后试管底部的白色颗粒重悬在200 ml 10 mmol/L Tris缓冲液中,保存于-80℃。病毒滴定通过HuTK-143B细胞(2×105个)接种于12孔板中,在细胞单层上加入10倍梯度稀释的病毒溶液。摇床上孵育1 h后,加入2 ml培养基,孵育24~48 h,洗涤并固定于0.1%结晶紫的乙醇溶液中。在显微镜下对斑块进行计数。
1.2.2 Western blot用MOI值为1的溶瘤病毒感染MFC细胞,孵育48 h后收集上清液,10 000 r/min离心2 min。细胞在1×RIPA缓冲液和1×蛋白酶抑制剂中冰浴15 min,10 000 r/min离心2 min。用12%的SDS-聚丙烯酰胺凝胶电泳,将分离的蛋白质样品转移到硝酸纤维素膜上。在含有5%脱脂牛奶的TBS缓冲液中室温下封闭60 min。使用抗PD-1一抗(1∶1 000)4℃孵育过夜,用TBST清洗后与羊抗兔二抗(1∶10 000)室温孵育1 h后,用奥德赛成像仪进行曝光。GAPDH作为内参。
1.2.3 MTT检测细胞毒作用将肿瘤细胞以1×104个/孔 接种 于96孔 板中,并 以不 同MOI值(0.1、0.5、1、5)的溶瘤病毒对细胞进行感染。肿瘤细胞活力测定采用MTT法。在VersaMax酶标仪上以490 nm波长读取光密度。细胞裂解率(%)=[1-OD570(实验组)/OD570(对照组)]×100%
1.2.4 流式细胞术检测肿瘤细胞经过溶瘤病毒感染后,离心收集细胞,洗涤3次后用抗PD-L1的抗体避光孵育30 min,进行流式细胞术分析。
肿瘤组织经过消化及过滤获得单细胞悬液,细胞表面染色通过anti-CD8抗体避光孵育30 min,之后利用PBS洗涤3次,然后进行胞内抗原染色,用于检测IFN-γ和TNF-α的表达量。细胞在Fix/Perm溶液中固定后,用Perm/Wash Buffer洗涤,然后使用抗体细胞内染色30 min,Perm/Wash Buffer洗涤后进行流式细胞术分析。所有样本在LSRⅡ细胞仪(BD)上进行操作,并用FACS DIVA软件v8.0(BD Biosciences)进行分析。
1.2.5 体内实验将5~7周龄的雌性裸鼠饲养在武汉大学实验动物中心,在标准无菌室中饲养,每日监测。在小鼠皮下注射MFC细胞建立异种移植模型。接种后第7天,通过瘤周注射PBS,OV-GM,OV-GM/iPD-L1(5×107PFU/只)监测肿瘤的生长状况。每2~3 d检查1次瘤体积和小鼠体重。对表现出垂死状态的小鼠实施安乐死。实验结束后对肿瘤进行剥离,拍照称重。
1.3 统计学分析所有实验数据采用SPSS19.0软件进行统计学处理。计量数据采用±s表示,组间样本比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 工程化溶瘤病毒的构建及验证本研究中构建了3种溶瘤病毒,分别为OV,编码GM-CSF的溶瘤痘病毒(OV-GM)以及同时编码GM-CSF和PD-L1抑制剂的溶瘤痘病毒(OV-GM/iPD-L1),如图1A所示。将3种溶瘤病毒分别感染鼠胃癌细胞MFC,检测其分泌PD-L1抑制剂的能力。Western blot结果表明,只有感染OV-GM/iPD-L1可以分泌PD-L1抑制剂,感染其他病毒的细胞不能分泌PD-L1抑制剂(图1B、C)。以上结果说明所构建的溶瘤病毒可以有效感染肿瘤细胞并表达相应的目的蛋白。
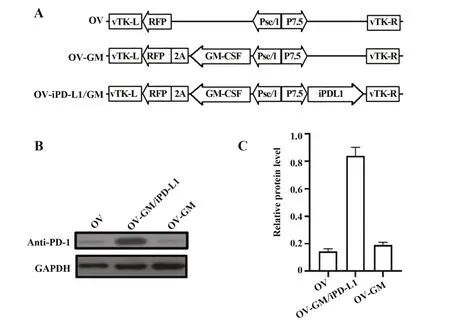
图1 重组溶瘤病毒的产生和鉴定Fig.1 Generation and characterization of recombinant oncolytic virus
2.2 溶瘤病毒对靶细胞的裂解能力如图2所示,分别选取了小鼠胃癌细胞MFC、人胃癌细胞MGC803及人胃癌细胞ASG作为靶细胞,将不同的溶瘤病毒以不同的MOI值分别感染肿瘤细胞,检测其对靶细胞的裂解能力。结果表明,3种溶瘤病毒都可以有效的感染并裂解肿瘤细胞,并且3种溶瘤病毒的溶瘤能力随着MOI值的升高而增强。以上结果表明,这3种OV病毒可以以剂量依赖的方式裂解肿瘤细胞。
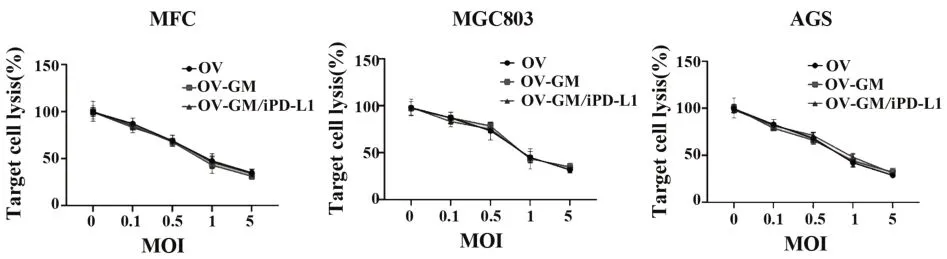
图2 重组溶瘤病毒在不同MOI下对靶细胞的细胞毒性Fig.2 Cytotoxicity of recombinant oncolytic virus to tar⁃get cells in different MOI
2.3 OV-GM/iPD-L1中和靶细胞PD-L1的表达用OV-GM和OV-GM/iPD-L1溶瘤病毒分别感染MFC细胞后,检测其对肿瘤细胞表面PD-L1表达的影响(图3)。流式细胞术检测结果表明,与OV-GM感染相比,感染OV-GM/iPD-L1的肿瘤细胞表面PDL1的表达量明显降低,(t=22.98,P<0.000 1,图3)。以上结果表明,OV-GM/iPD-L1分泌的PD-L1抑制剂可以中和肿瘤细胞表面PD-L1的表达。
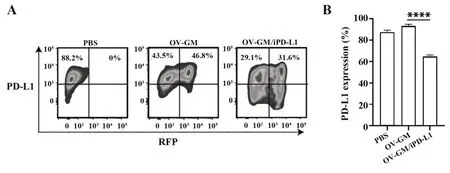
图3 感染细胞中PD-L1表达的分析Fig.3 Analysis of PD-L1 expression in infected cells
2.4 OV-GM/iPD-L1的体内抗肿瘤活性首先建立了小鼠胃癌细胞的皮下移植瘤模型,瘤周注射PBS、OV-GM及OV-GM/iPD-L1,监测肿瘤的生长情况,结果表明,OV-GM和OV-GM/iPD-L1治疗较对照组而言可以显著抑制肿瘤的生长,而OV-GM/iPD-L1的抑制肿瘤生长的能力较OV-GM更强(t=13.32,P<0.05,图4A)。实验结束后分析肿瘤重量,结果表明OV-GM/iPD-L1治疗组的肿瘤质量比OV-GM治疗组更轻(t=3.641,P<0.05,图4B、C)。并且在整个治疗过程中,3个实验组中的小鼠体重无显著性差异,说明并没有产生明显的毒性(图4D)。以上结果说明,OV-GM/iPD-L1可以显著抑制小鼠体内的肿瘤生长。
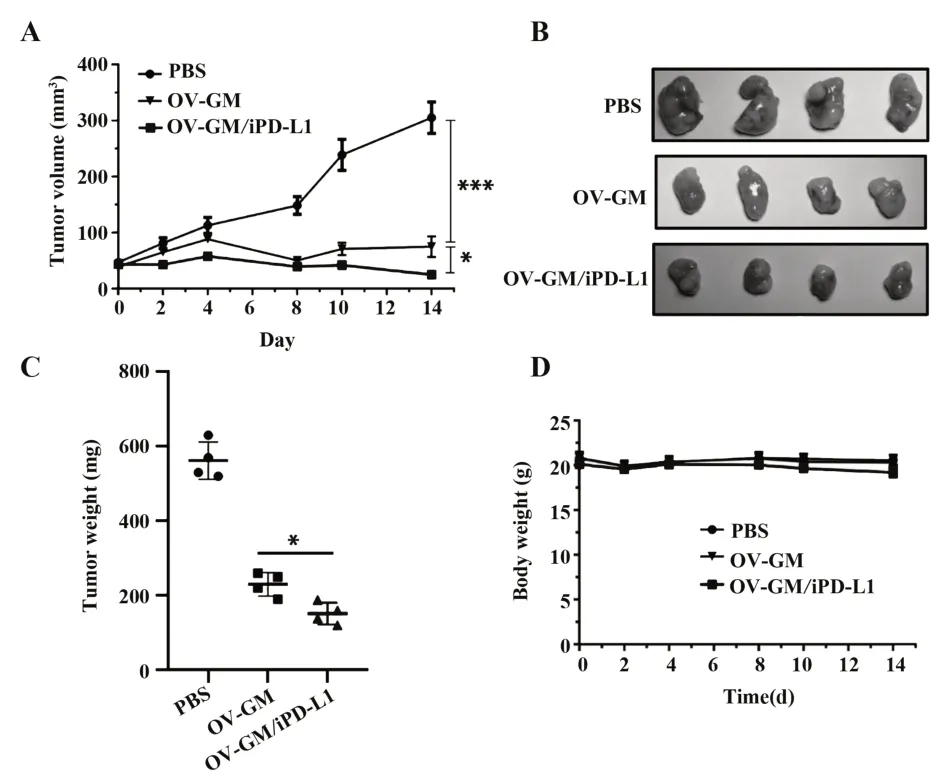
图4 重组溶瘤病毒对小鼠胃移植瘤的抗肿瘤效果Fig.4 Antitumor efficacy of recombinant oncolytic virus against xenografts derived from gastric tumor cell lines in mice
2.5 OV-GM/iPD-L1对浸润T细胞的抗肿瘤活性的影响对各个治疗组小鼠的肿瘤浸润T细胞的抗肿瘤活性进行了分析(图5)。流式细胞术检测结果表明,OV-GM/iPD-L1治疗组的肿瘤浸润T细胞中,IFN-γ+(t=9.214,P<0.01,图5A、B)及TNF-α+(t=3.207,P<0.05,图5A、C)的T细胞比OV-GM治疗后的肿瘤浸润T细胞明显增多,说明OV-GM/iPD-L1显著增强了小鼠自身T细胞的抗肿瘤免疫反应。总之,以上实验说明OV-GM/iPD-L1可以通过抑制PD-1/PD-L1通路增强T细胞的抗肿瘤免疫功能,从而协同增强抑制肿瘤的能力。

图5 肿瘤浸润性淋巴细胞免疫活性的流式细胞术分析Fig.5 Flow analysis of immune activity of tumor infiltrat⁃ing lymphocytes
3 讨论
胃癌是全球发病率第四的癌症,同时也是全球第三大病死率的癌症。目前来看,早期的胃癌患者和可以通过化疗及靶向治疗药物获得较好的治疗效果,但是一些晚期以及一些复发的患者没有很好的治疗手段,因此急需开发有效的药物来应对这一挑战[12]。
溶瘤病毒具有选择性感染肿瘤细胞的能力,而对正常细胞的感染能力有限。由于溶瘤病毒在肿瘤治疗领域的潜力,现在已经有越来越多的临床前研究探索其在实体瘤中的应用[13-14]。本研究结果表明,共表达OV-GM/iPDL1能够产生PD-L1抑制剂,并能够中和肿瘤细胞PD-L1的表达。瘤内注射OVGM/iPDL1可有效抑制肿瘤生长,并增强自身的T细胞的抗肿瘤活性,从而更有效地阻断肿瘤生长。
在一些早期研究中,溶瘤病毒被工程化改造,使其可以表达免疫刺激因子,如热休克蛋白、趋化因子和细胞因子,以激活抗肿瘤免疫反应[15-16]。然而,到目前为止,溶瘤病毒疗法对癌症患者的疗效有限。最近的一些研究报道了表达PD-1/PD-L1抑制剂的武装溶瘤病毒,可以激活抗肿瘤免疫反应[17]。一种表达抗人PD-L1抗体的“武装”溶瘤腺病毒被证明能增强人肿瘤异种移植模型中的溶瘤活性[18]。表达PD-1单链抗体的溶瘤单纯疱疹病毒(HSV)在临床前的脑胶质瘤小鼠模型中被发现能够诱导持续的抗肿瘤反应[19]。一种表达PD-1胞外区的重组黏液瘤病毒(VPD1)被发现能抑制PD-1/PDL1信号通路,并激活抗肿瘤免疫[20]。最近的研究发现,病毒感染后肿瘤微环境中PD-L1表达的反应性上调导致肿瘤对溶瘤免疫治疗产生抵抗[21]。本研究证明,“武装”溶瘤病毒分泌的PD-L1抑制剂、GMCSF产生了较传统的溶瘤病毒更好的抑瘤活性,这一方面归因于PD-L1抑制剂与肿瘤微环境中高表达的PD-L1结合,解除了免疫抑制活性,同时GM-CSF作为一种免疫刺激因子,进一步激活了机体的免疫反应,在本项研究中,这种协同增效的作用充分反应在经过“武装”溶瘤病毒治疗后,肿瘤浸润的CD8+T细胞的炎症细胞因子分泌能力显著增强,因此这种经过改造的溶瘤病毒代表了一种有效的、个体化的肿瘤特异性溶瘤免疫疗法。
综上所述,这种经过改造的溶瘤病毒能够通过发挥溶瘤活性,并通过表达GM-CSF和PD-L1抑制剂产生协同作用来激活T细胞抗肿瘤反应,从而提供了一种有效的、特异性的肿瘤免疫疗法,该疗法可单独或与免疫检查点抑制剂、靶向治疗和化疗联合用于胃癌患者,为胃癌的治疗提供新的思路。