UHPLC-MS/MS法对人参和枸杞配伍中皂苷类成分定性和定量分析
2021-09-24黄仁嵩王和宇焦传新焦丽丽刘淑莹
黄仁嵩, 王和宇, 焦传新, 李 慧, 焦丽丽, 刘淑莹, 吴 巍
(长春中医药大学,吉林省人参科学研究院,吉林 长春 130117)
人参PanaxginsengC.A.Mey.大补元气,复脉固脱,是一种珍贵药材[1-2],人参皂苷是其主要活性成分,具有抗衰老、提高免疫力等药理作用[3],其结构可分为原人参二醇型、原人参三醇型和齐墩果酸型[4]。枸杞LyciumbarbarumL.具有抗肿瘤、抗衰老等药理作用, 主要活性成分为枸杞多糖[5]。传统中医认为,合理的配伍可以达到减毒增效的效果[6]。人参和枸杞应用广泛,两者配伍可用于治虚劳、下焦虚伤、微渴、小便数(出自《圣惠方》枸杞子散);现代研究表明,二者配伍可以增加疗效[7-9]。目前,对于人参和枸杞的配伍研究较少,大多为药效分析,而中药配伍后成分通常会发生变化[10],因此建立一个快速稳定的分析方法非常重要。质谱法因其灵敏度高、分析速度快、样品用量少,正成为一种强有力的分析工具[11-14]。UHPLC-ESI-LTQ MS可以短时间内同时实现母离子、子离子的采集和多级质谱碎裂,提高对中药复杂体系中化学成分的快速鉴定与分析能力[15-18]。
本研究通过UHPLC-ESI-LTQ MS法对人参和枸杞配伍后人参皂苷结构进行系统的定性和定量分析,并测定两者在不同煎煮方式下人参皂苷的含量变化,以期为该药对质量控制提供参考。
1 材料
1.1 仪器 TU-1810紫外可见分光光度计(北京普析通用仪器有限公司);FA2004A分析天平(上海精天电子仪器有限公司);FDU-1100冷冻干燥机(日本EYELA仪器公司);粉碎机(德国IKA集团);Agilent RRLC色谱仪(美国Agilent公司);LTQ XL质谱,配备双喷雾ESI源、自动校准系统。
1.2 试剂与药物 对照品人参皂苷Rb1、Rb2、Rb3、Rc、Re、Rg1、Rg3、Rf、Rd、R1购于上海源叶生物科技有限公司。乙腈(色谱纯,美国Fisher公司);甲酸(色谱纯,纯度96%,美国Tedia公司);Milli-Q超纯水(18.2 MΩ/cm);其他试剂均为分析纯。人参购于吉林抚松,枸杞购于北京福永源饮片有限公司,均经长春中医药大学王淑敏教授鉴定为正品,保存于长春中医药大学吉林省人参科学研究院。
2 方法与结果
2.1 溶液制备
2.1.1 对照品溶液 精密称取对照品人参皂苷Rb1、Rb2、Rb3、Rc、Re、Rg1、Rg3、Rf、Rd、R1各1 mg,80%甲醇溶解制备成1 mg/mL溶液,精密移取适量于2 mL量瓶中,80%甲醇定容,制备成对照品溶液,质量浓度分别为15、5、1、10、3、15、5、2、8、2 μg/mL,即得。
2.1.2.1 人参枸杞共煎液 称取人参粗粉10 g、枸杞75 g,加入30倍量水,80 ℃水浴,提取2次,每次90 min,提取前室温浸泡1 h,3 500 r/min离心10 min,合并滤液,去除沉淀,60 ℃水浴浓缩,冻干,得到共煎液总皂苷提取物31.853 4 g,收率约为10.73%。精密称定共煎液中总皂苷提取物5 mg,80%甲醇定容至5 mL量瓶中,稀释为质量浓度为400 μg/mL的溶液,过0.45 μm微孔滤膜,即得。
2.1.2.2 人参枸杞合并液 称取人参粗粉10 g、枸杞75 g,分别进行单煎实验,加入30倍量水,80 ℃水浴提取2次,每次90 min,提取前室温浸泡1 h,3 500 r/min离心10 min,合并滤液,去除沉淀,60 ℃水浴浓缩,冻干,得合并液总皂苷提取物,精密称定5 mg,80%甲醇溶解定容至5 mL量瓶中,稀释为质量浓度400 μg/mL的溶液,0.45 μm微孔滤膜过滤,即得。
2.2 测定方法
2.2.1 色谱条件 C18色谱柱(2.1 mm×150 mm,1.7 μm);流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱(0~5 min,20%B;5~8 min,20%~30%B;8~40 min,30%~40%B;40~45 min,40%~90%B;45~47 min,90%B;47~50 min,90%~20%B;50~55 min,20%B);体积流量0.2 mL/min;柱温35 ℃;进样量5 μL。
2.2.2 质谱条件 采用电喷雾离子源(ESI);负离子模式;喷雾电压3.0 kV;透镜电压100 V;毛细管电压32 V;质量扫描范围m/z100~2 200;鞘气体积流量30.0 L/min;辅助气体积流量10.0 L/min; 毛细管温度320 ℃。
2.3 UHPLC-MS定性分析 在“2.2”项条件下,得到10种人参皂苷对照品的总离子流色谱图,见图1,可知均基本达到基线分离,在人参枸杞提取物中均被检测出。人参皂苷在负离子模式下的UHPLC-MS TIC 谱图见图2。通过化合物的保留时间、精确的质核比和串联质谱,鉴定了人参中20种人参皂苷。由于以0.1%甲酸溶液作为流动相,在负离子模式全扫描质谱图中均给出[M-H]-准分子离子和[M+HCOO]-加合离子峰,为确定人参皂苷的质核比提供了有用的信息。通过MS/MS特征碎片离子分析和精确质量测定,分析了化合物苷元类型和取代糖链序列,见表1。碎片离子的命名采用Costello命名法。
2.3.1 结果分析 图1~2显示,在上述色谱条件下人参枸杞提取物得到很好的分离。为进一步确定化合物的结构,分别对峰1~20进行了串联质谱分析,通过化合物的保留时间,精确分子量,质核比(m/z)和串联质谱图确定了20个人参皂苷化合物,见表1。以三醇型人参皂苷Re和二醇型人参皂苷Rc为例,阐述人参枸杞提取物中人参皂苷的串联质谱,见图3。

图1 10种人参皂苷的UHPLC-MS TIC图Fig.1 UHPLC-MS TIC chromatogram of ten ginsenosides

表1 人参枸杞配伍中人参皂苷的碎片离子

图2 人参枸杞共煎液中人参皂苷负离子模式下UHPLC-MS图Fig.2 UHPLC-MS chromatogram of ginsenosides in P. ginseng-L. barbarum mixed decoction under negative ion mode

图3 人参皂苷相关图谱Fig.3 Related spectra of ginsenosides
对峰11中[M+HCOO]-离子m/z1 123进行二级串联质谱分析,产生碎片离子m/z1 077,其为母离子[M+HCOO]-丢失甲酸根产生的[M-H]-,再对[M-H]-离子m/z1 077进行三级串联质谱分析,见图4,产生碎片离子m/z945、m/z783、m/z621、m/z459,母离子[M-H]-丢失Ara(132 Da)残基产生离子m/z945(Y1α),进一步丢失Glc残基(162 Da)产生离子m/z783(Y0α),表明化合物在α位为一分子Glc和一分子Ara取代,随后又丢失Glc残基(162 Da)产生离子m/z621(Y1β),进一步丢失Glc残基(162 Da)产生二醇型苷元的特征离子m/z459(Y′0β),表明化合物在β位为两分子Glc取代,推测峰11为人参皂苷Rc。
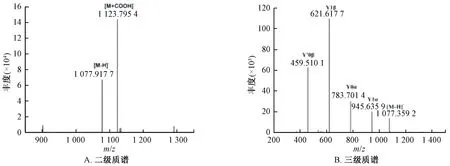
图4 人参皂苷Rc质谱图Fig.4 Mass spectra of ginsenoside Rc
对峰2中[M+HCOO]-离子m/z991进行二级串联质谱分析,产生碎片离子m/z945,其为母离子[M+HCOO]-丢失甲酸根产生的[M-H]-,再对[M-H]-离子m/z945进行三级串联质谱分析,见图5,产生碎片离子m/z783、m/z637、m/z475,母离子[M-H]-丢失Glc残基(162 Da)产生离子m/z783 (Y0α),表明Glc为末端取代糖,进一步丢失Rha残基(146 Da)产生离子m/z637(Y′1β),表明化合物有1个Glc和1个Rha取代,随后丢失Glc残基(162 Da)产生离子m/z475(Y′0β),离子m/z475为三醇型苷元的特征离子,推断峰2为人参皂苷Re。

图5 人参皂苷Re质谱图Fig.5 Mass spectra of ginsenoside Re
前期研究表明,人参皂苷在负离子模式下有更好的响应值,在负离子模式下对人参皂苷母离子及多级质谱碎裂进行采集,获得碎片峰的m/z,根据化合物精确的相对分子质量、碎片峰信息,对20种人参皂苷进行准确的鉴定分析。人参皂苷经ESI源离子化以后,大多数在二级质谱的负离子模式下形成[M-H]-和[M+HCOO]-的准分子离子峰。在三级质谱中,人参皂苷类成分容易发生侧链糖苷键的断裂。人参二醇型皂苷、人参三醇型皂苷的裂解主要都发生糖苷取代基的断裂产生去糖基化离子,如人参皂苷Rc在三级串联质谱中产生[M-H-Ara(f)]-、[M-H-Ara-Glc]-等去糖基化离子。而由于母核的不同,人参二醇型皂苷和人参三醇型皂苷在裂解过程中会产生m/z459、m/z475特征碎片离子,可区分不同种类的人参皂苷。
2.4 UHPLC-MS定量分析
2.4.1 线性关系考察 取对照品溶液,在“2.2”项条件下进样2、4、6、8、10 μL各3次。以进样量为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,表明各成分在各自范围内线性关系良好。

表2 各人参皂苷线性关系
2.4.2 精密度试验 取供试品溶液,在“2.2”项条件下连续进样6次,考察日内精密度;连续3 d同法测定,考察日间精密度。结果,10种人参皂苷的日内精密度RSD在1.08%~2.34%之间,日间精密度RSD在0.97%~2.81%之间,表明该仪器精密度良好。
2.4.3 稳定性试验 取供试品溶液,于0、2、4、6、8、12、24 h在“2.2”项条件下进样,测得10种人参皂苷RSD在1.39%~3.08%之间,表明溶液在24 h内稳定性良好。
2.4.4 重复性试验 精密称取人参枸杞提取物6份,按“2.1”项下方法制备供试品溶液,在“2.2”项条件下进样,测得10种人参皂苷峰面积RSD在0.91%~2.76%之间,表明该方法重复性良好。
2.4.5 加样回收率试验 取含量已知的人参枸杞提取物6份,加入上述10种对照品溶液(质量浓度均为1 mg/mL)各100 μL,按“2.1”项下方法制备供试品溶液,在“2.2”项条件下进样,测得10种人参皂苷RSD在0.75%~2.77%之间。
2.4.6 样品含量测定 取供试品溶液,在“2.2”项条件下进样5 μL,重复6次,结果见表3。人参枸杞共煎液中总多糖质量分数为425.08 mg/g,提取率为42.58%。

表3 各人参皂苷含量测定结果
3 讨论
本实验结果表明,人参枸杞共煎与分别单煎相比,人参皂苷R1、Re、Rf、Rb2、Rb3、Rd、Rg3含量下降,人参皂苷Rg1、Rb1、Rc含量上升,其中以人参皂苷Rb1增加最多,为88.9%,人参皂苷Rg1、Rc也分别增加了8.23%、23.6%,表明在共煎过程中主要成分的溶出会相互影响。现代研究表明,人参枸杞配伍使用具有更好的抗疲劳、补肾壮阳等作用[7,9],同时溶出增加的人参皂苷Rb1具有提高免疫力活性[19],人参皂苷Rg1具有抗疲劳、抗衰老等活性[20],人参皂苷Rc具有抗炎、抗氧化等活性[21],这符合中药配伍的“增效”理论。本研究从人参皂苷含量变化的角度证明了人参枸杞配伍的科学性,可为相关应用提供参考。
