木犀草素固体脂质纳米粒的制备及其体内药动学研究
2021-09-24尚曙玉郭锐税冯永豪
杨 娟, 尚曙玉, 贾 安, 郭锐税, 冯永豪
(1.黄河科技学院医学院,河南 郑州 450006;2.上海雷允上药业有限公司,上海 201401)
木犀草素属于黄酮类化合物,主要来源于白毛夏枯草、裸花紫珠、密蒙花、野菊花等植物中[1],并且在洋葱、芹菜等蔬菜中也存在,具有神经保护、抗炎、保肝、抗肿瘤等药理作用[2-3],研究价值较高。但该成分口服吸收较差,从而限制了其药效发挥及临床应用,故采用新型制剂技术改善其口服吸收生物利用度非常必要。目前,已有包合物、胶束、微乳等制剂学报道[4-6],但缺少药动学研究。
固体脂质纳米粒是采用单一或混合脂质材料作为载体,将药物夹嵌或包裹在载体材料中制得的粒径在50~1 000 nm之间的胶粒给药系统[7-8],促进药物口服吸收效果明显。本实验将木犀草素制成该剂型后,对其粒径、电位、药物存在状态、体外溶出进行研究,再考察其体内药动学,以期为该成分开发利用提供参考。
1 材料
XP205型电子天平(瑞士梅特勒-托利多公司);Agilent 1200型高效液相色谱仪(美国Agilent公司);DF-101S型磁力搅拌器(巩义市予华仪器有限责任公司);Vortex-2型涡旋振荡仪(上海沪析实业有限公司);Nanosep©型超滤离心管(截留相对分子质量10 000,美国Pall公司);DW-86L328型超低温冰箱(浙江捷胜低温设备有限公司);FD-1A-80型冷冻干燥机(上海豫明仪器有限公司);GY-GSDCY-24型氮气吹扫仪(上海归永电子有限公司);LS13320XR激光衍射粒度分析仪(美国贝克曼公司)。
木犀草素对照品(批号111751-201812,纯度98.9%,中国食品药品检定研究院);香叶木素对照品(批号P0587,上海源叶生物科技有限公司);木犀草素原料药(批号P201005,纯度98.1%,北京索莱宝生物有限公司);单硬脂酸甘油酯(批号1521489324-2)、泊洛沙姆188(F-68,批号1815004)(德国巴斯夫公司);磷脂[PC-98T,辅必成(上海)医药科技有限公司]。
SD大鼠购自上海斯莱克实验动物有限公司,体质量(300±20)g,动物生产许可证号SCXK(沪)2012-0003,于温度25 ℃、相对湿度55%的实验室中饲养1周后开始实验。
2 方法与结果
2.1 木犀草素固体脂质纳米粒制备 采用乳化蒸发-低温固化法。取20 mg木犀草素、150 mg单硬脂酸甘油酯、150 mg磷脂,置于20 mL乙醇中,在75 ℃水浴中磁力搅拌加热溶解,作为有机相;取0.8 g泊洛沙姆188、0.4 g聚山梨酯80,溶于40 mL蒸馏水中,于75 ℃水浴中磁力搅拌(转速1 000 r/min)加热溶解,作为水相,将有机相缓慢加到水相中,温度维持在75 ℃,持续磁力搅拌浓缩至25 mL,迅速置于-4 ℃冰箱中固化,即得。同法制备空白固体脂质纳米粒混悬液。
2.2 木犀草素含量测定
2.2.1 色谱条件 Agilent C18色谱柱(4.6 mm ×200 mm,5 μm);流动相乙腈-四氢呋喃-0.1%磷酸二氢钾(70∶1∶29);体积流量1.0 mL/min;柱温35 ℃;检测波长282 nm;进样量20 μL。
2.2.2 线性关系考察 称取木犀草素对照品20 mg,溶于100 mL乙腈中,混匀,得到贮备液(0.2 mg/mL),取10 mL至100 mL量瓶中,乙腈-四氢呋喃-0.1%磷酸二氢钾(70∶1∶29)定容至20 μg/mL,稀释至10、5、1、0.1、0.05 μg/mL,在“2.2.1”项色谱条件下进样测定。以木犀草素质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=22.057 2X-1.078 6(r=0.999 8),在0.05~20 μg/mL范围内线性关系良好。
2.2.3 方法学考察 取1 mL木犀草素固体脂质纳米粒混悬液,置于10 mL量瓶中,5 mL乙腈超声处理5 min后定容至刻度,6 000 r/min离心20 min,取上清液1 mL,置于10 mL量瓶中,乙腈-四氢呋喃-0.1%磷酸二氢钾(70∶1∶29)定容,得到供试品溶液,于0、2、6、12、24 h在“2.2.1”项色谱条件下进样测定,测得木犀草素峰面积RSD为1.34%,表明溶液在24 h内稳定性良好。制备6份供试品溶液,在“2.2.1”项色谱条件下进样测定,测得木犀草素含量RSD为1.52%,表明该方法重复性良好。取0.05 μg/mL(低)、5 μg/mL(中)、20 μg/mL(高)对照品溶液,在“2.2.1”项色谱条件下进样测定6次,测得木犀草素峰面积RSD分别为0.41、0.11%、0.12%,表明仪器精密度良好。取9份空白固体脂质纳米粒混悬液各1 mL,分别置于10 mL量瓶中,加入800 μg/mL对照品溶液0.8、1.0、1.2 mL各3份,5 mL乙腈超声处理5 min后定容至刻度,6 000 r/min离心20 min,取上清液1 mL,置于10 mL量瓶中,乙腈-四氢呋喃-0.1%磷酸二氢钾(70∶1∶29)定容至刻度,取上清液,在“2.2.1”项色谱条件下进样测定,测得木犀草素平均加样回收率分别为99.09%、98.83%、100.17%,RSD分别为1.11%、1.69%、0.85%。
2.3 包封率、载药量测定 取2.0 mL混悬液,置于量瓶中,5 mL甲醇超声处理5 min后定容至10 mL,在“2.2.1”项色谱条件下进样20 μL测定木犀草素总含量m总,另取2.0 mL混悬液至4 mL超滤离心管中(截留分子量为30 kDa),10 000 r/min离心30 min,在“2.2.1”项色谱条件下进样20 μL测定游离药量m游离,计算包封率、载药量,公式分别为包封率=[(m总-m游离)/m总]×100%、载药量=[(m总-m游离)/(m总+m脂质)]×100%。结果,3批固体脂质纳米粒平均包封率为85.24%,载药量为5.24%。
2.4 形态观察 取木犀草素固体脂质纳米粒混悬液0.1 mL,加入4 mL蒸馏水混匀,滴于铜网上,2%磷钨酸染色,自然晾干,置于扫描电镜(TEM)下拍照,结果见图1。由此可知,所得纳米粒形状规整,呈类球形或球形,无粘连。

图1 木犀草素固体脂质纳米粒TEM图Fig.1 TEM image for luteolin solid lipid nanoparticles
2.5 粒径、Zeta电位测定 取木犀草素固体脂质纳米粒混悬液0.1 mL,加入4 mL蒸馏水混匀后置于比色皿中,测定粒径、Zeta电位,结果见图2~3,可知两者平均值分别为176.35、-33.8 mV。

图2 木犀草素固体脂质纳米粒粒径分布Fig.2 Particle size distribution of luteolin solid lipid nanoparticles
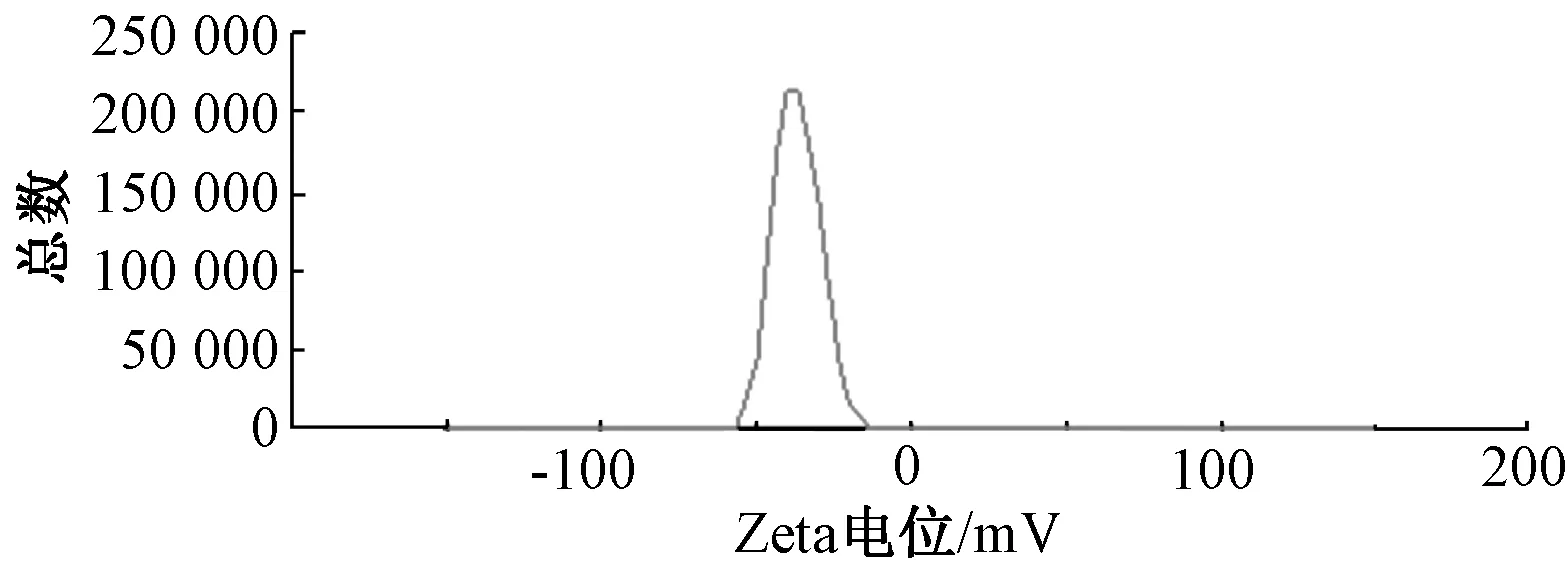
图3 木犀草素固体脂质纳米粒Zeta电位Fig.3 Zeta potential of luteolin solid lipid nanoparticles
2.6 冻干粉制备及其X射线粉末衍射(XRPD)研究
2.6.1 制备方法 取“2.1”项下木犀草素固体脂质纳米粒混悬液,以3%乳糖为冻干剂,混匀后密封,置于-70 ℃超低温冰箱中预冻2 d,迅速转移至冷冻干燥机中(-30 ℃)抽真空2 d,于6 h内匀速升温至25 ℃,取出,即得。复溶后,冻干粉平均粒径为236.81 nm,Zeta电位为-27.1 mV,包封率为78.85%,载药量为4.72%,木犀草素质量分数为0.85%。
2.6.2 XRPD 扫描条件为铜靶,管压40 kV,扫描范围3°~45°,扫描速度5°/min,分别对木犀草素、空白脂质纳米粒冻干粉、物理混合物(木犀草素+空白脂质纳米粒冻干粉)、木犀草素固体脂质纳米粒进行XRPD扫描,结果见图4。由此可知,木犀草素图谱中有许多晶体衍射峰,表明其存在状态为晶型;空白脂质纳米粒冻干粉也出现许多晶体衍射峰;物理混合物中仍可见在4.2°、9.3°处的特征晶体衍射峰;在木犀草素固体脂质纳米粒中未发现上述晶型衍射峰,表明木犀草素制成固体脂质纳米粒后的存在状态转变为无定型。

注:a~d分别为木犀草素固体脂质纳米粒、物理混合物、空白脂质纳米粒冻干粉、木犀草素。图4 各样品XRPD图Fig.4 XRPD patterns for various samples
2.7 体外释药研究 取木犀草素固体脂质纳米粒冻干粉1.4 g(含木犀草素10 mg),加入3 mL溶出介质后转移至透析袋(截留分子量8 000~14 000 Da)中,两端扎紧。取木犀草素10 mg,同法制备对照品。以900 mL 1%SDS溶液为释放介质,温度、转速分别设置为37 ℃、100 r/min,于0、0.25、0.5、1、1.5、2、2.5、3、4、6、8、12、24 h各取样3 mL,取样后立即补加3 mL 1%SDS溶液,5 000 r/min离心10 min,取上清液,在“2.2.1”项色谱条件下进样测定,结果见图5,可知原料药24 h累积溶出度仅为31.9%;固体脂质纳米粒释药过程分为快速释药期(前6 h)和缓慢释药期(6 h~24 h),累积溶出度提高至71.5%。再分别采用Higuchi模型、Weibull模型、零级模型、一级模型对固体脂质纳米粒释药过程进行拟合,发现Weibull模型拟合度最佳,方程为lnln[1/(1-Mt/M∞)]=0.511lnt-1.336(R2=0.979 2)。

图5 木犀草素体外释药曲线Fig.5 In vitro drug release curves for luteolin
2.8 体内药动学研究
2.8.1 灌胃液制备 取木犀草素固体脂质纳米粒冻干粉0.53 g,0.5%CMC-Na溶液制成1.5 mg/mL混悬液(以木犀草素计)。取木犀草素5 mg,同法制成1.5 mg/mL混悬液。
2.8.2 分组、给药及血样采集 12只大鼠采用抛币法随机分为2组,按10 mg/kg剂量分别灌胃给予“2.8.1”项下2种灌胃液,乙醚麻醉后于0.15、0.5、0.75、1、1.5、2、4、6、8、12 h立即眼眶取血适量(0.2~0.4 mL),置于肝素润湿的离心管中,振荡后4 000 r/min离心2 min,取上层血浆,冷冻保存。
2.8.3 血浆样品处理 参考文献[4,9]报道,精密吸取血浆样品100 μL至离心管中,加入内标溶液50 μL、 HCl溶液(3 mol/L)200 μL,置于60 ℃水浴中1.5 h,加入150 μL 5%HClO4溶液,振荡10 min后加入2 mL乙酸乙酯,涡旋5 min,8 000 r/min离心20 min后取出,取上层有机相,45 ℃氮气吹干得残渣,加入100 μL流动相复溶。
2.8.4 内标、对照品溶液制备 称取香叶木素对照品10 mg,溶于100 mL乙腈中(100 μg/mL),精密量取1 mL至100 mL量瓶中,乙腈定容混匀,精密吸取5 mL至10 mL量瓶中,即得500 ng/mL内标溶液。取“2.2.2”项下贮备液,乙腈依次稀释至1 500、750、300、100、20 ng/mL,即得对照品溶液。
2.8.5 专属性、线性关系考察 取1 500、750、300、100、20 ng/mL对照品溶液各100 μL,分别加入50 μL内标溶液,45 ℃氮气吹干得残渣,加入大鼠空白血浆100 μL,按“2.8.3”项下方法操作,在“2.2.1”项色谱条件下进样测定,结果见图6,可知该方法专属性良好。以木犀草素质量浓度为横坐标(X),木犀草素、内标(香叶木素)峰面积比值为纵坐标(Y)进行回归,得方程为Y=1.254 8X+0.102 2(r=0.991 2),在20~1 500 ng/mL范围内线性关系良好。
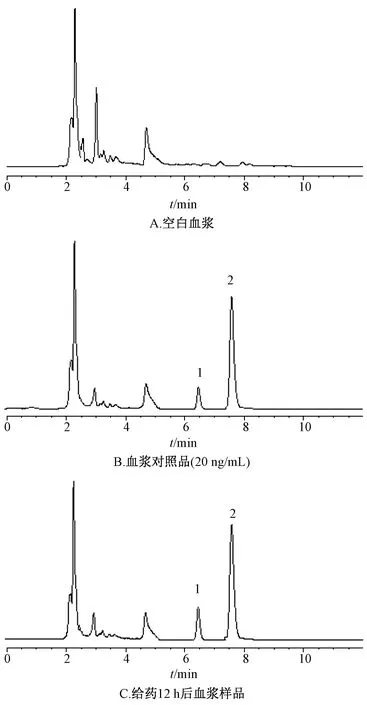
1.木犀草素 2.内标(香叶木素)1.luteolin 2.internal standard (diosmetin)图6 木犀草素HPLC色谱图Fig.6 HPLC chromatograms of luteolin
2.8.6 方法学考察 取处理后的血浆样品,于0、4、12、24、48 h在“2.2.1”项色谱条件下进样测定,测得木犀草素、内标(香叶木素)峰面积比值RSD为1.75%,表明溶液在48 h内稳定性良好。以1 500、300、20 ng/mL血浆对照品溶液为高、中、低质量浓度,在“2.2.1”项色谱条件下进样测定,测得日内精密度RSD分别为6.11%、9.03%、10.56%,日间精密度RSD分别为8.92%、9.93%、11.05%,表明该方法精密度良好。取100 μL空白血浆,依次制成1 500、300、20 ng/mL溶液,在“2.2.1”项色谱条件下各进样测定3次,测得木犀草素加样回收率87.14%~97.09%,RSD为10.14%。取20 ng/mL血浆对照品溶液(不含内标),逐步稀释后在“2.2.1”项色谱条件下进样测定,测得定量限为5 ng/nL,检测限为 2 ng/mL。
2.8.7 结果分析 图7、表1显示,与原料药比较,固体脂质纳米粒tmax延长(P<0.01),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度提高至2.28倍。
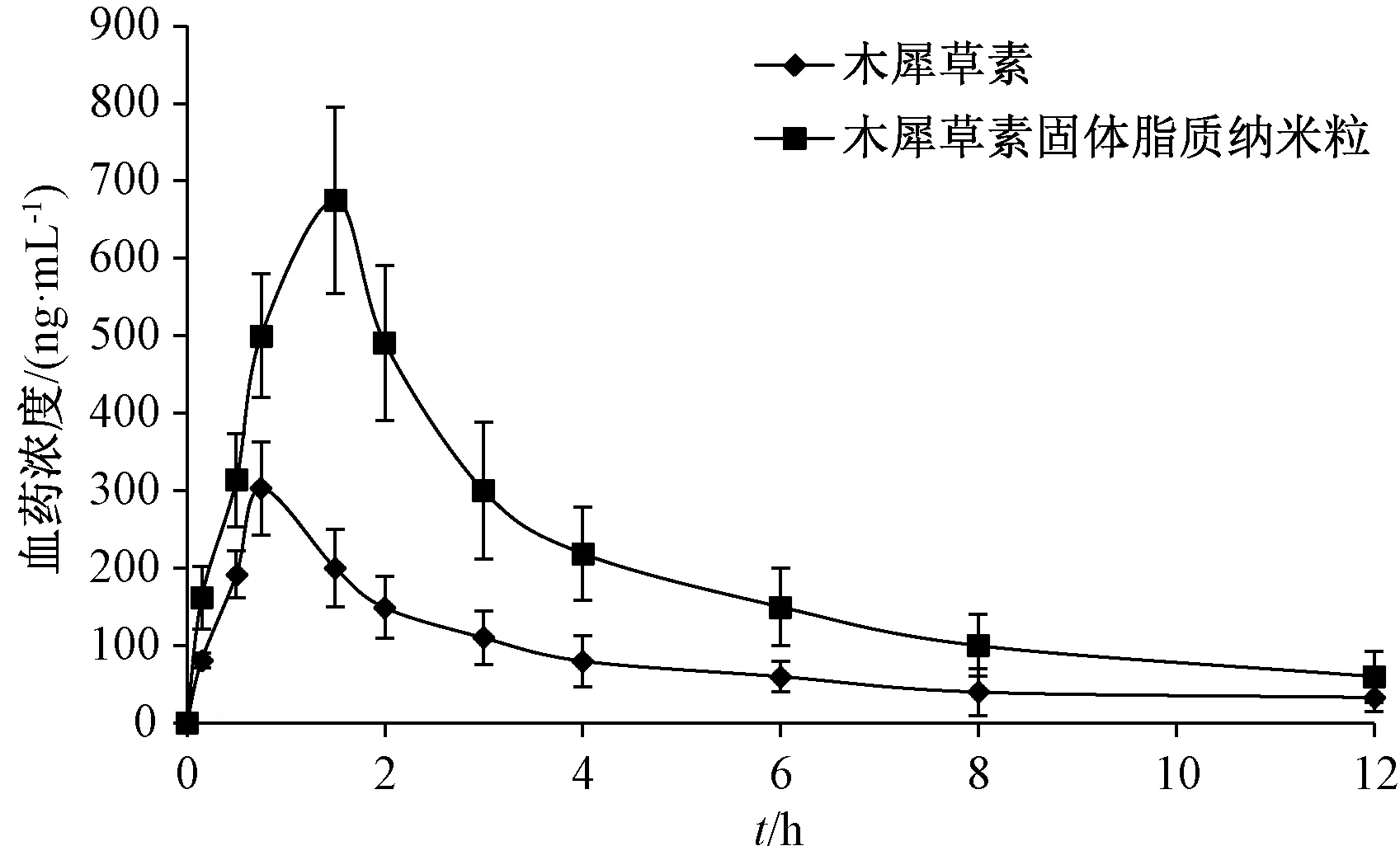
图7 木犀草素血药浓度-时间曲线Fig.7 Plasma concentration-time curves for luteolin

表1 木犀草素主要药动学参数
3 讨论
木犀草素水溶性较低,会发生溶出速率及溶出度受限、脂溶性差、透膜吸收困难、在胃肠道中容易受到酶解等问题[9-10],导致其口服吸收生物利用度不理想。本实验将该成分制成固体脂质纳米粒后,药物溶出速率、累积溶出度均得到提高,可能是由于它以无定型状态存在于纳米粒中,有助于溶解度提高;纳米载药系统使其比表面积明显增加,促进其快速溶出,增加其与胃肠道黏膜的接触面积[11-14]。另外,药物包裹于固体脂质纳米粒中时可避免与外界环境直接接触,降低被破坏几率,提高稳定性,同时纳米制剂可改善其渗透性[15],促进透膜吸收。
文献[16]报道,木犀草素进入人体后可与血清蛋白相结合,故需使该成分从结合态游离出来。本实验分别采用HCl、HClO4溶液对蛋白进行水解、沉淀,并以乙酸乙酯提取,药动学结果显示,固体脂质纳米粒tmax延后,可能是由于纳米粒粒径较小,提高了与胃肠道黏膜的粘附性,增加了在胃肠道中的滞留时间,导致tmax延后;Cmax显著升高,可能与纳米粒特殊吸收机制有关,可使药物被高效吸收进入血液循环,从而提高其口服生物利用度[17-18]。但固体脂质纳米粒促进药物吸收的程度还会受到纳米粒粒径、纳米材料性质、表面活性剂种类、纳米粒表面亲水亲脂性及空间特性、体内稳定性及跨膜吸收过程中诸多因素的影响[13, 18-20],今后尚需作进一步研究。
