马蓝BcASB基因的克隆、生物信息学及表达分析
2021-09-23马小毛宁书菊胡永乐蔡国倩魏道智
马小毛,宁书菊,叶 齐,胡永乐,3,蔡国倩,魏道智*
1.福建农林大学生命科学学院,福建 福州 350002
2.福建农林大学作物科学学院,福建 福州 350002
3.武夷学院生态与资源工程学院,福建 武夷山 354300
马蓝Baphicacanthus cusia(Nees) Bremek,爵床科马蓝属的双子叶多年生草本植物[1],是我国南方常见药用植物。其茎叶炮制而成的青黛,以福建产品质最佳,因此被称为建青黛,是福建道地药材之一[2]。马蓝化学成分研究报道,马蓝中含有生物碱、萜类、黄酮类、皂苷等多种植物次生代谢产物[3],其中吲哚类生物碱被认为是马蓝中主要的药效成分,分子药理实验表明,靛蓝、靛玉红在人体的神经系统、免疫系统等方面发挥着显著的药理作用。近年来,禽流感、甲型流感、新型病毒等流行病肆虐频发,推高了市场上以马蓝为基源的中药材的价格和需求,因此加强对药用植物马蓝的研究具有重要的理论和实践意义[4]。
目前,应用分子生物学技术研究相应的生物合成途径,克隆和分析关键酶基因是植物生物工程研究中提高特定代谢产物累积的重要手段之一[5]。本研究中,主要药效成分靛蓝、靛玉红的积累基于马蓝吲哚类生物碱合成途径,一般认为,吲哚生物合成途径包括2方面:一是莽草酸途径,二是色氨酸途径[6]。莽草酸和色氨酸在分支酸合成酶(chorismate synthase,CS)、邻氨基苯甲酸合成酶(anthranilate synthase,AS)、色氨酸合成酶(tryptophan synthase,TS)、细胞色素CYP450单氧氧化酶(cytphrome P450 monooxygenase,CYP450)、尿苷二磷酸葡萄糖转移酶(UDP-glycosyltransferase,UGT)等一系列关键酶的作用下,最终加氧聚合合成靛蓝、靛玉红等吲哚类生物碱或衍生为其他吲哚类物质,因此,邻氨基苯甲酸合成酶也被认为是调节色氨酸以及次生代谢产物积累的关键酶之一。
邻氨基苯甲酸合成酶大多存在于植物细胞质体内,是由α亚基和β亚基组成的复合酶[7],α亚基是关键的催化亚基,而β亚基为α亚基的催化反应提供氨基[8]。早在1992年,Niyogi等[9]首次从模式植物拟南芥中克隆出编码ASα亚基的基因。随后,于1995年,Bohlmann等[10]从芸香中克隆出编码ASα亚基的基因。此后陆续有科学家从水稻[11]、烟草[12]、长春花[13]、喜树[14]等植物中分离克隆出编码ASα亚基的基因。与ASα亚基相比,有关ASβ亚基的研究相对较少,但近年来,也有研究者从水稻中分离获得了编码ASβ亚基的基因[15],且表明了2个β亚基之间在酰胺基转移酶活性方面的功能差异。前期,课题组已从马蓝中分离克隆了邻氨基苯甲酸合成酶ASα亚基编码的BcASA基因(GenBank登录号MH976794),本实验则对ASβ亚基编码的BcASB基因进行研究。目前,在马蓝生物碱合成途径的研究中,尚未见邻氨基苯甲酸合成酶ASβ亚基的相关报道,因此,要阐释马蓝药效物质合成途径,没有BcASB基因的克隆和生物学信息的挖掘和分析是不完整的。
因此,本实验在前期马蓝转录组数据研究的基础上,通过RT-PCR和RACE技术从马蓝邻氨基苯甲酸合成酶中分离克隆了ASβ亚基编码的基因,获得完整的开放阅读框(open reading frame,ORF),命名为BcASB。通过生物信息学分析,预测该基因编码蛋白的结构和功能,最后运用实时荧光定量PCR技术(qRT-PCR)对BcASB基因在马蓝不同部位的表达进行分析以及检测马蓝叶在不同外源诱导子处理下的表达情况和马蓝有效成分靛蓝、靛玉红积累量的变化情况,为今后研究该基因的功能以及马蓝吲哚类生物碱合成途径的研究奠定科学基础。
1 材料与试剂
样品采自福建农林大学药植园,经福建农林大学生命科学学院魏道智教授鉴定为马蓝Baphicacanthus cusia(Nees) Bremek,于-80 ℃保存,用于后期RNA的提取。
克隆载体pENTR/D-TOPO为本实验保存,RNA提取试剂盒、反转录试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒购自北京全式金生物技术有限公司;DNA Marker、限制性内切酶、T4DNA连接酶、2×TransTaq PCR Mix均购自宝生物工程(大连)有限公司;大肠杆菌感受态细胞DH5α、实时荧光定量PCR试剂均购自TaKaRa公司;茉莉酸甲酯(methyl-jasmonate,MeJA)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、乙烯利(ethylene,ETH)均购自宝生物工程(大连)有限公司;色谱甲醇、色谱乙腈、色谱甲酸均购自默克股份两合公司;靛蓝、靛玉红对照品购自上海源叶生物科技有限公司,其他试剂均为国内分析纯。引物合成和样品测序由福州铂尚生物有限公司完成,引物序列见表1。

表1 基因克隆和荧光定量PCR引物Table 1 Sequences of primers designed for gene clone and real-time PCR
2 方法
2.1 马蓝总RNA的提取和cDNA的合成
使用RNA提取试剂盒(TaKaRa Mini BEST Universal RNA Extraction Kit)提取马蓝总RNA,用1%琼脂糖凝胶电泳和超微量分光光度计NanoDrop 2000检测RNA的完整性、浓度和纯度。当28 S是18 S的1.5~2倍时,说明提取的RNA完整性较好,A260/A280为1.9~2.0,RNA浓度≥400 ng/mL时,说明纯度和浓度较高,可用于后续实验。根据反转录试剂盒说明书(PrimeScript RT reagent Kit with gDNA Eraser),以提取到的马蓝总RNA为模板合成cDNA第一链,于-20 ℃保存备用。
2.2 BcASB基因的克隆及鉴定
根据实验组前期建立的马蓝转录组数据库信息,使用引物设计软件Primer Premier 5.0设计BcASB基因ORF序列的特异性引物(BcASB-F,BcASB-R),以“2.1”项中合成的cDNA为模板进行PCR扩增,PCR反应体系为30 μL:2×Taq PCR Master Mix 15 μL,正反向引物各1 μL,模板cDNA 3 μL,ddH2O 10 μL。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,30个循环,72 ℃延伸8 min[16]。反应结束后,琼脂糖凝胶电泳检测PCR产物,使用试剂盒回收和纯化目的片段,将纯化后的产物与与入门载体pENTR/D-TOPO连接,转化大肠杆菌DH5α感受态细胞,均匀涂布在含有卡那霉素(Kan)抗性的LB平板上过夜培养,筛选阳性克隆进行菌液PCR,并将阳性克隆送至福州铂尚生物有限公司测序。
2.3 BcASB基因的生物信息学分析
使用NCBI-ORF Finder平台查找和分析基因的ORF,并将ORF翻译成氨基酸序列。利用ExPASy-ProtParam tool软件预测基因编码蛋白的分子式、理论相对分子质量、等电点等各种理化性质;通过Plant-PLoc在线分析软件初步预测蛋白的亚细胞定位;利用NetPhos 3.1 Server和NetOGlyc 4.0 Server分别对蛋白的磷酸化位点和糖基化位点进行预测分析;采用TMHMM Server v.2.0进行蛋白跨膜结构的预测;通过SignalP 4.1 Server对信号肽进行预测;分别使用在线软件SOPMA和SWISS-MODEL预测蛋白的二级结构和三维结构;通过Blast对马蓝ASB基因与芝麻、烟草、丹参、陆地棉等15种植物的同源序列进行分析,使用DNAMAN软件进行同源序列的比对;利用MEGA 6.0软件对预测的氨基酸序列与GenBank上的其他序列进行系统进化分析,采用NJ法(neighbor-joining)绘制系统进化树,bootstrapping参数为1000个重复。
2.4 BcASB基因在马蓝中的诱导表达
采取马蓝的根、茎、叶,按照“2.1”项方法提取总RNA,以总RNA为模板合成cDNA第一链,测定BcASB基因在马蓝不同器官中的表达模式。以β-actin为内参基因[17],根据克隆获得的BcASB基因序列,通过Primer Premier 5.0设计荧光定量PCR引物(表1)。分别用100 μmol/L的MeJA、SA、ABA、ETH 4种不同外源激素对马蓝植株进行胁迫处理,对处理后不同时间点(0、1、2、4、6、8、12、24、36、72 h)BcASB基因表达量进行荧光定量PCR表达分析。反应体系为20 μL:SYBR Premix Ex TaqTM10 μL,正反向引物各1 μL,cDNA模板1 μL,ddH2O 7 μL。反应条件:95 ℃、30 s;95 ℃、5 s;60 ℃、20 s;72 ℃、20 s;40个循环,72 ℃、10 min。实验设计3次技术重复,每个样品3次重复,扩增曲线、溶解曲线、标准曲线由定量PCR仪软件自动生成。反应结束后采用2-△△Ct方法[18-19]计算分析BcASB基因在不同处理下的相对表达量。
2.5 激素诱导下吲哚类生物碱靛蓝、靛玉红含量的测定
2.5.1 色谱条件 色谱柱为YMC C18(200 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.04%甲酸水溶液(B)(0.04%甲酸水溶液的制备:移液枪吸取400 μL甲酸置于含200 mL蒸馏水的容量为1000 mL蓝盖瓶中,加蒸馏水至1000 mL,摇匀后,超声脱气20 min);检测波长为289 nm;柱温为30 ℃;体积流量为1.0 mL/min;进样量为10 μL。梯度洗脱过程:0~5 min,15%~20% A;5~10 min,20%~25% A;10~15 min,25%~30% A;15~20 min,30%~35% A;20~25 min,35%~15% A。色谱图见图1。

图1 对照品混合溶液 (A) 和供试品溶液 (B) 高效液相色谱图Fig.1 HPLC chromatograms of mixed solution (A) and test solution (B)
2.5.2 对照品溶液的制备 称取靛蓝对照品适量,精密称定15 mg,置于10 mL量瓶中,精密加入含50%N,N-二甲基甲酰胺(DMF)的甲醇溶液(超声溶解30 min),配制成质量浓度为1.5 mg/mL的溶液,用0.45 μm和0.22 μm的微孔滤膜滤过,取续滤液,即得。称取靛玉红对照品适量,精密称定10 mg,置于10 mL量瓶中,精密加入含50% DMF的甲醇溶液(超声溶解5 min),配制成1.0 mg/mL的溶液,用0.45 μm和0.22 μm的微孔滤膜滤过,取续滤液,即得。
2.5.3 供试品溶液的制备 取经80 ℃烘干至恒定质量的马蓝叶片(不同激素、不同时间处理),粉碎机粉碎过40目筛,精密称取粉末10 mg,置于10 mL量瓶中,加入50% DMF的甲醇溶液,45 ℃超声溶解后定容,过0.22 μm微孔滤膜,取续滤液,即得。
2.5.4 线性关系考察 精密吸取混标对照品溶液适量,加入甲醇进行倍比稀释,分别得到对照品系列浓度。0.22 μm微孔滤膜滤过后,依据“2.5.1”项色谱条件,取10 μL进样测定。以峰面积积分值(Y)对浓度(X)进行线性回归,得到各对照品的回归方程,靛蓝Y=0.697 3X+3.805 3,R2=0.999 6,线性范围为15.0~320.0 μg/mL;靛玉红Y=22.372 6X-6.805 3,R2=0.999 7,线性范围为5.0~50.0 μg/mL。
2.5.5 重复性试验 按样品测定方法对同一批号6份供试品样品进行测定,计算靛蓝、靛玉红RSD分别为1.47%、1.65%,表明该方法重复性良好。
2.5.6 稳定性试验 精密吸取同一供试品溶液(记录配制日期)依样品测定色谱条件,分别于0、2、4、24 h注入液相色谱测定,计算靛蓝、靛玉红含量的RSD分别为1.59%、1.99。
2.5.7 精密度试验 精密吸取同一供试品溶液,按照上述色谱条件连续测定6次,考察日内精密度,测得靛蓝、靛玉红的RSD分别为1.77%、2.74%。
2.5.8 加样回收率试验 取重复性试验同一批号样品6份,各约0.5 g,分别精密加入靛蓝、靛玉红对照品溶液,制备成加样供试品溶液,并分别测定和计算加样回收率。结果显示,靛蓝、靛玉红平均加样回收率分别为97.3%、103.9%,RSD分别为1.17%、1.76%。
3 结果与分析
3.1 马蓝BcASB基因的克隆与序列分析
以马蓝总RNA反转录后获得的cDNA为模板,用设计的特异引物BcASB-F、BcASB-R进行PCR扩增反应,结果显示单一明亮的条带(图2),经测序后得到正确的序列,大小为765 bp(命名为BcASB),编码256个氨基酸。将该基因的序列信息提交NCBI GenBank,登录号为QCF61930.1,BcASB基因核苷酸和氨基酸序列如图3所示。
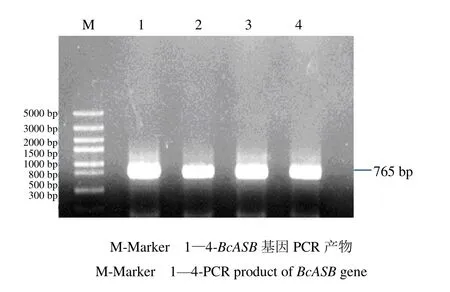
图2 PCR扩增BcASB基因Fig.2 PCR amplification of BcASB gene
3.2 马蓝BcASB蛋白的生物信息学分析
3.2.1 理化性质和细胞定位分析 通过ExPASy- ProtParam tool软件推测该基因编码蛋白的分子式为C1256H1956N342O369S9,相对分子质量为28 039.96,理论等电点(pI)为7.22,带正电荷的残基总数(Arg+Lys)为24,带负电荷的残基总数(Asp+G1u)为24,该蛋白不稳定性指数(II)为45.40,推测该蛋白属于不稳定蛋白,脂肪指数为81.84,亲水性的平均值(GRAVY):-0.210,说明该蛋白属于亲水性蛋白。通过NetPhos 3.1 Server预测该蛋白共包含43个磷酸化位点,其中包括丝氨酸(serine)21个,苏氨酸(threonine)13个和酪氨酸(tyrosine)9个;使用NetOGlyc 4.0 Server软件预测该蛋白包含3个糖基化位点;通过Plant-PLoc在线软件预测显示BcASB蛋白定位于叶绿体。
3.2.2 信号肽及跨膜区的预测分析通过SignalP 4.1预测蛋白的信号肽,结果显示无信号肽存在,说明该蛋白为非分泌型蛋白(图4-A);使用TMHMM Server v.2.0预测跨膜结构,结果显示BcASB蛋白不包含跨膜区,为非膜蛋白(图4-B)。

图3 马蓝BcASB基因的核苷酸序列及对应的氨基酸序列Fig.3 Nucleotide sequence and amino acid sequence of BcASB gene in B.cusia

图4 BcASB蛋白信号肽 (A) 和跨膜区 (B) 预测Fig.4 Prediction of signal peptide (A) and transmembrane domains (B) of BcASB protein
3.2.3 二级结构和三级结构预测 通过软件SOPMA预测BcASB蛋白的二级结构,结果显示α-螺旋50个,占19.53%;不规则卷曲117个,占45.70%;β-折叠25个,占9.77%;延伸链64条,占25.00%(蓝色代表α-螺旋,紫色代表不规则卷曲,绿色代表β-折叠;红色代表延伸链),这4个元件构成了BcASB蛋白的二级结构,其中α-螺旋和不规则卷曲为其主要结构元件,散布于整个蛋白中(图5-A)。通过SWISS-MODEL软件预测蛋白的三级结构,以谷氨酰胺酶为模板(SMTL ID:6qur.1.A),在第1~256位氨基酸处建模,三维模型覆盖率为57.45%,序列相似性为0.48(图5-B)。
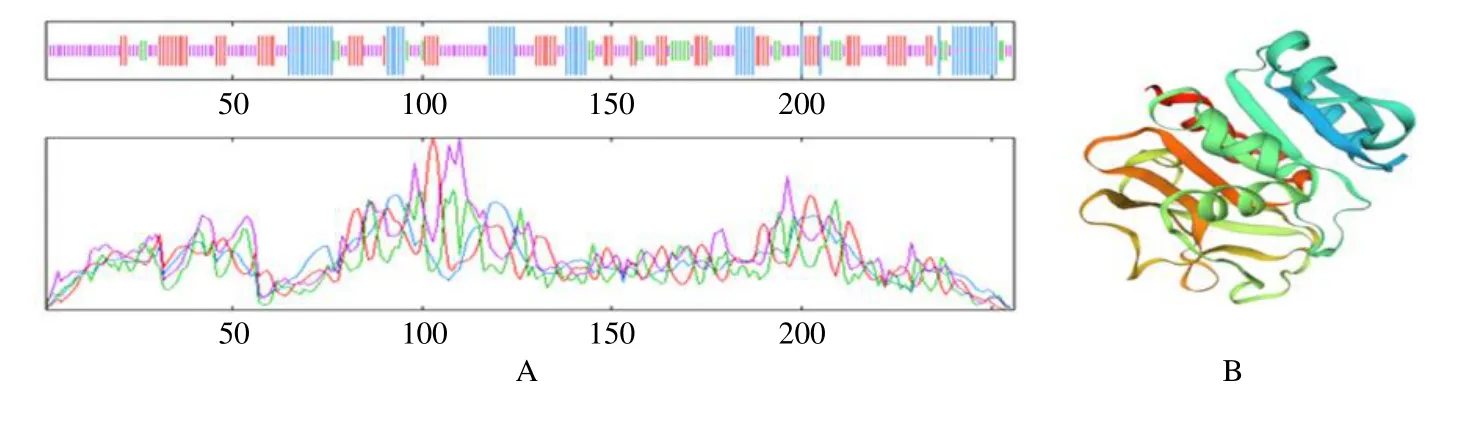
图5 BcASB蛋白二级结构 (A) 和三级结构 (B) 的预测Fig.5 Prediction of secondary structure (A) and tertiary (B) structure of BcASB protein

图6 不同物种BcASB氨基酸序列多重比对Fig.6 Multiple alignments of amino acid sequence of BcASB form different species
3.2.4 多重序列比对及系统进化树的构建 将BcASB基因编码的蛋白序列提交至NCBI-Blastp,与其他植物ASB蛋白序列进行同源比对,结果显示马蓝BcASB与上百种NCBI上登录的植物有相似性,挑选其中15种与马蓝相似度较高的植物蛋白序列,利用DNAMAN软件对其进行多重序列比对(图6)。分析结果显示马蓝Baphicacanthus cusia(Nees)Bremek(QCF61930.1)与芝麻Sesamum indicumLinn.(XP_011070537.2)、丹参Salvia splendensBunge(TEY57190.1)、三果杨Populus trichocarpaCarr(XP_002314761.1)、胡杨Populus euphraticaOliv(XP_011024607.1)、月季Rosa chinensisJacp (XP_024193401.1)、陆地棉Gossypium hirsutumLinn(XP_016703097.1)等植物同源性达到72%~88%,总相似度达72.01%。利用MEGA 6.0软件构建系统进化树(图7),结果显示马蓝BcASB蛋白与茄科一年或有限多年生草本植物辣椒的亲缘关系最近,可聚为一支,与锦葵科陆地棉和海绵ASB蛋白亲缘关系最远。
3.3 BcASB基因的时空表达分析
3.3.1 BcASB基因在不同器官中的表达模式分析分别提取马蓝根、茎、叶的总RNA,qRT-PCR法测定BcASB基因在马蓝不同组织的表达模式,结果表明,BcASB在3种不同的器官中均有表达,但相对表达量存在一定差异,在叶和茎中表达量显著高于根,表达量从高到低呈现出叶>茎>根,BcASB在叶中的表达量是茎的2.01倍,根的5.08倍(图8)。

图7 不同物种BcASB蛋白的系统进化分析Fig.7 Phylogenetic analysis of BcASB proteins from different species
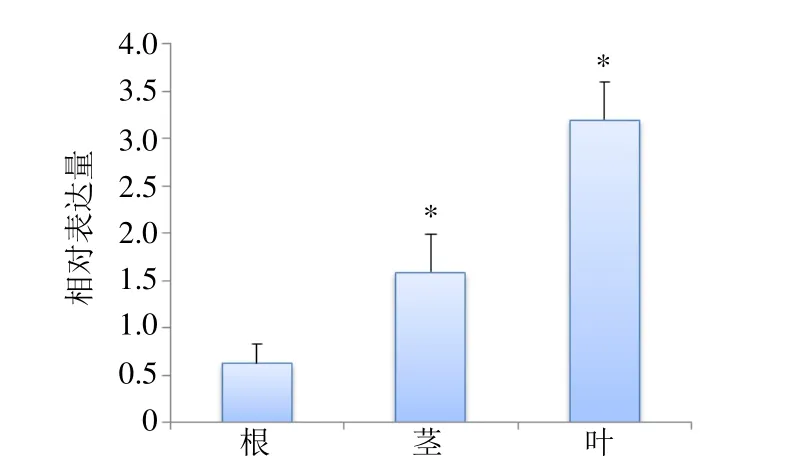
图8 BcASB基因在各器官中的相对表达量Fig.8 Relative expression of BcASB gene in various organs
3.3.2 不同外源激素对BcASB基因诱导表达的影响 对马蓝叶片进行了MeJA、SA、ABA、ETH 4种不同外源诱导物的胁迫处理,对不同时间点BcASB表达量进行qRT-PCR检测。检测结果表明,用MeJA处理后,马蓝BcASB基因表达量呈现先上升后下降的趋势,在4、6、8、12 h时表达量显著高于其他检测点,在6 h达到峰值,与0 h处理点存在显著差异,为0 h的5.89倍,随后逐渐下降,在24、36、72 h相对表达量水平接近(图9-A)。用SA处理后,BcASB基因表达量呈现先稳定后迅速上升的趋势,在24 h达到峰值,表达量为0 h的3.2倍,而在24、36、72 h时BcASB基因的相对表达量显著高于其他检测点,说明SA对基因的调节更为持久,对植物代谢影响显著(图9-B)。用ABA处理后,BcASB基因表达量在8、12、24 h时相对表达量显著高于其他检测点,在0~4 h趋于稳定,在6 h小幅度上升,为0 h的1.5倍,8 h达到峰值,为0 h的4倍,随后表达量逐渐下降,但在72 h表达量仍然高于0 h(图9-C)。而用ETH处理后,BcASB基因表达量在6 h达到峰值,显著高于其他检测点,为0 h的1.58倍,24、36、72 h时基因的表达量水平与其他检测点基本持平,没有显著性的差异,说明基因的相对表达量受ETH的影响较小(图9-D)。上述结果说明BcASB基因可以响应多种外源诱导子处理。
3.4 激素诱导下靛蓝、靛玉红含量测定分析
3.4.1 马蓝不同组织中靛蓝、靛玉红含量测定 对马蓝不同器官根、茎、叶中的吲哚类生物碱靛蓝和靛玉红含量进行了测定(图10),研究结果显示,靛蓝、靛玉红含量在马蓝叶、茎中的含量相差较大,靛蓝在叶中的含量达到400.98 μg/g,是靛玉红含量的10.1倍,靛蓝在茎中的质量分数为650.58 μg/g,是靛玉红含量的14倍,而在根中,两者含量没有显著性差异;且靛蓝在叶和茎中的含量显著高于根,而靛玉红在不同组织中的含量没有显著性差异。
3.4.2 不同激素处理的马蓝叶片中靛蓝、靛玉红含量测定 用MeJA处理马蓝叶片,采取处理后不同时间点的叶片,测定其含量的变化(图11-A),HPLC检测结果显示,叶片中靛蓝、靛玉红的含量随着时间的变化呈现先上升后下降的趋势,靛蓝在4、6、8、12 h时含量显著高于其他检测点,在6 h达到最大值,为786.35 μg/g,为0 h的1.96倍,在72 h下降到初始水平。靛玉红的含量在6 h也达到最大值, 为66.38 μg/g,为0 h的2倍,在36 h下降到初始水平,但靛玉红含量在各个检测点没有显著性差异。
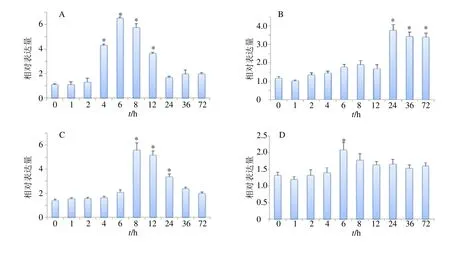
图9 MeJA (A)、SA (B)、ABA (C)、ETH (D) 胁迫下BcASB基因在不同时间点的表达Fig.9 Expression of BcASB gene at different time points under stress of MeJA(A),SA(B),ABA (C),and ETH (D)
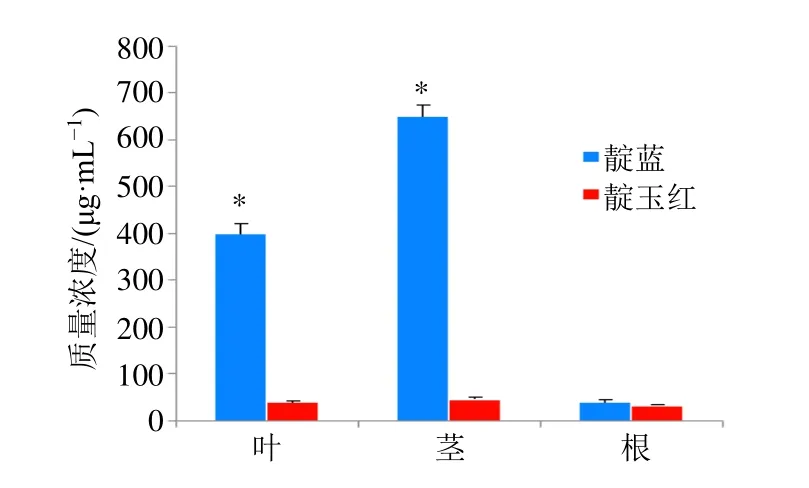
图10 马蓝不同组织中靛蓝、靛玉红含量测定Fig.10 Determination of indigo and indirubin in different tissues of B.cusia
用SA处理后(图11-B),实验结果显示,靛蓝含量随着时间的变化呈现先稳定后上升,再下降而后维持稳定的趋势,在0~2 h靛蓝含量维持稳定,4 h开始小幅上升,8 h含量达到最大值653.36 μg/g,且显著高于其他检测点,为0 h的1.69倍,8 h后,靛蓝含量下降,并于24 h维持稳定水平,和初始含量一致。而靛玉红含量随着时间的增长,没有显著的变化,在6 h出现了小幅上升,但整体变化趋势处于稳定水平,表明SA处理对马蓝叶片中靛玉红含量的影响不大。
在ABA的处理下(图11-C),靛蓝含量随着时间的变化呈现先上升后下降再上升的趋,在0~2 h呈现上升趋势,4~12 h相对于2 h有下降的趋势,但含量仍高于初始水平,24 h靛蓝含量达到最大值600.58 μg/g,36、72 h呈现下降趋势,但含量为0 h的1.25倍。而靛玉红含量随着时间变化没有显著差异,在24 h达到最大值60.36 μg/g,在72 h含量下降到初始水平。
在ETH处理下(图11-D),靛蓝含量在0~4 h呈现上升的趋势,在4 h含量达到750.68 μg/g,随后呈现下降的趋势,在12 h含量又持续上升,在72 h达到最大值790.69 μg/g。靛玉红含量同样呈现先上升后下降再上升的趋势,在0~4 h呈现上升趋势,在4 h含量达到最大值80.69 μg/g,在6 h之后,含量呈现下降的趋势,但在72 h含量上升至70.36 μg/g,为初始水平的1.5倍,总体上含量在各个检测点没有显著性差异。
综上所述,通过检测不同外源诱导子处理下,不同时间点靛蓝、靛玉红积累量的变化,发现在某个时间检测点靛蓝、靛玉红含量与0 h相比,均发生了显著的上调,这与BcASB基因的表达量相一致,说明马蓝有效成分靛蓝、靛玉红积累量受基因表达的影响,进一步说明基因表达在马蓝有效成分的合成中发挥着关键作用。
4 讨论
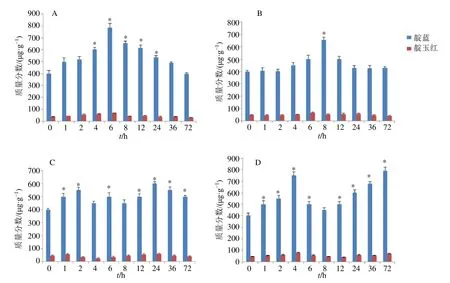
图11 MeJA (A)、SA (B)、ABA (C)、ETH (D) 处理下马蓝叶片中靛蓝、靛玉红含量测定Fig.11 Determination of indigo and indirubin in leaves of B.cusia under MeJA (A),SA (B),ABA (C),and ETH (D) treatment
吲哚类生物碱(靛蓝、靛玉红等)作为植物次生代谢的重要产物之一,具有抗菌、抗病毒、抗炎、抗肿瘤、增强免疫等显著药理活性[20]。ASB是植物体内吲哚类生物碱合成途径的关键酶之一,具有重 要的研究价值。近几年,ASB的研究多集中在拟南芥、烟草这样的模式植物中,在药用植物的研究中鲜见报道。本研究立足于前期建立的马蓝转录组数据库,克隆了马蓝BcASB基因,ORF区长为765 bp,编码256个氨基酸,与芝麻的ASB同源性最高,可达88%。生物信息学分析结果显示,BcASB蛋白相对分子质量为28 039.96,理论等电点为7.22,为非分泌型蛋白,因此不具有识别信号的功能。BcASB蛋白定位于叶绿体,这与一般报道的ASB蛋白的定位结果一致。同时对蛋白的亲疏水性、信号肽、跨膜区、二级结构、三级结构作了详细的分析,为马蓝BcASB基因提供了更多更详尽的信息。
组织特异性表达结果表明,BcASB基因在马蓝不同的器官中均有表达,佐证了马蓝根、茎、叶均可入药一说,且在叶中的表达量高于根和茎,这与已经报道的喜树[14]的研究结果具有一致性,喜树中AS亚基编码的基因在其不同器官中均有表达,且在幼苗的发育过程中表达量迅速升高。在水稻[11]中,AS亚基编码的基因在各组织中的表达模式却有所不同,ASA1在花序中的表达量高于根和叶,而ASA2在各组织的表达量差异不大,这说明同源蛋白之间组织表达也具有一定的差异,可能与蛋白参与的功能相关。MeJA、ABA、SA、ETH在植物的代谢过程中发挥着重要的作用[21-22]。本研究对马蓝叶片进行了MeJA、ABA、SA、ETH这4种不同外源激素的胁迫处理,ASB表达量和马蓝有效成分靛蓝、靛玉红积累量均呈现出不同程度的上调,说明BcASB基因响应并介导外源诱导子对代谢的调控。这与拟南芥、水稻的表达情况相近。前期,Sun等[23]就在拟南芥的研究中发现MeJA会刺激邻氨基苯甲酸合成酶基因的转录,从而促进拟南芥芽和根的生长。在水稻中也发现ASβ亚基编码的基因也具有可诱导性[15]。同时,也有很多研究验证了不同的信号诱导可以促进植物次生代谢产物的产生[24-25]。在马蓝等药用植物中,其生物合成过程中的关键酶活性高低也会影响药效成分的产量,因此,提高关键酶基因在植物中的表达也是提高药用活性成分产量、提高中药材品质的有效手段之一[26]。
近年来,随着分子生物学技术的发展,大多数的药用植物已经涉及分子生物学领域,最活跃的研究领域就是与药用活性成分形成相关的关键酶基因的克隆研究[27]。因此,本研究通过克隆马蓝邻氨基苯甲酸合成酶BcASB基因,以及对其进行生物信息学分析、时空表达分析,并检测有效成分积累量的变化,为后续构建基因超表达载体以及对该基因的功能研究奠定了基础,同时对马蓝有效成分含量的提高具有积极作用,有助于更深入的阐释马蓝吲哚类生物碱合成途径和调控机制。
利益冲突所有作者均声明不存在利益冲突
