基于特征图谱和网络药理学的经典名方黄连汤质量标志物(Q-Marker)预测分析
2021-09-23彭梅梅钱怡洁许金国陆兔林毛春芹
彭梅梅,郭 爽,陈 琪,王 梦,徐 祯,钱怡洁,毛 靖,许金国,季 德,陆兔林*,毛春芹*
1.南京中医药大学药学院,江苏 南京 210023
2.南京中医药大学附属医院江苏省中医院,江苏 南京 210029
黄连汤(Huanglian Decotion,HLD)出自东汉张仲景《伤寒论》,收录于《古代经典名方目录(第一批)》,全方由黄连、甘草(炙)、干姜、桂枝(去皮)、人参、半夏(洗)、大枣(擘)7味药组成,主治伤寒胸中有热、胃中有邪气、腹中痛、欲呕吐者[1]。黄连汤具有明显的特色与优势,目前仍广泛应用,现代临床研究表明黄连汤及其加减方常用于治疗胃肠疾病及其他疾病等[2-3]。质量标志物(quality marker,Q-Marker)这一概念最早于2016年由刘昌孝院士[4]提出,旨在解决中药质量控制指标与中药的有效性关联度低、质量控制指标专属性差等阻碍中药质量研究与行业发展的共性问题[5]。
本研究建立黄连汤基准样品特征图谱,对共有峰进行归属分析,明确“饮片-基准样品”的内在关联,以期形成稳定可行的物质基准质量标准;并结合网络药理学技术构建“成分-靶点-通路”网络,预测分析黄连汤发挥临床疗效的潜在Q-Marker,为全面控制和评价黄连汤的质量提供方法依据,并为研究黄连汤治疗疾病的药效作用机制提供参考。
1 实验材料
1.1 仪器
Waters e2695高效液相色谱仪,配备四元泵、柱温箱、自动进样器,2998检测器、Empower 3色谱工作站,美国Waters公司;FA1104型电子分析天平,上海精密科学仪器有限公司,d=0.1 mg;MS105DU型电子分析天平,梅特勒-托利多公司,d=0.01 mg;Milli-Q Intergral水纯化系统,美国Millipore公司;KQ-500E数控超声波清洗器,昆山市超声仪器有限公司;砂锅,江西舒雅陶瓷有限公司;电陶炉,中山市爱米生活电器有限公司。
1.2 试药
对照品盐酸小檗碱(批号110713-201814,质量分数86.7%)、盐酸巴马汀(批号110732-201611,质量分数86.8%)、盐酸黄连碱(批号112026- 201601,质量分数95.1%)、甘草苷(批号111610- 201607,质量分数93.1%)、甘草酸铵(批号110731- 201720,质量分数97.7%)、6-姜辣素(批号111833- 201806,质量分数99.9%)、桂皮醛(批号110710- 201217,质量分数99.5%)均购自中国食品药品检定研究院。
磷酸二氢钾、磷酸,色谱纯,上海阿拉丁生化科技有限公司;乙腈,色谱纯,默克股份有限公司;甲醇,色谱纯,江苏汉邦科技有限公司;其他试剂均为分析纯。
黄连汤原料药材购自道地产区或主产区,每个药材不少于3个产地,总批次不少于15批;药材基原、药用部位、产地、采收加工均明确,均经过南京中医药大学药学院陈建伟教授鉴定。经研究,除黑龙江及吉林通化人参药材批次不符合规定外,其余药材各产地质量均符合《中国药典》2020年版一部规定,药材来源批号见表1。按照《中国药典》2020年版及全国炮制规范将药材炮制成对应饮片,饮片经检测均符合《中国药典》2020年版各饮片规定标准。
2 方法与结果
2.1 供试品溶液的制备
按处方量分别称取黄连41.40 g,甘草(水炙)41.40 g,干姜41.40 g,桂枝41.40 g,人参27.60 g,半夏(汤洗)60.00 g,大枣42.00 g于砂锅中,加2000 mL水,浸泡60 min,以武火(2200 W)煮沸后,调节火力至文火(900 W)保持微沸,煎煮约60 min后,趁热滤过,滤液放凉后加水调整体积至1200 mL[1]。
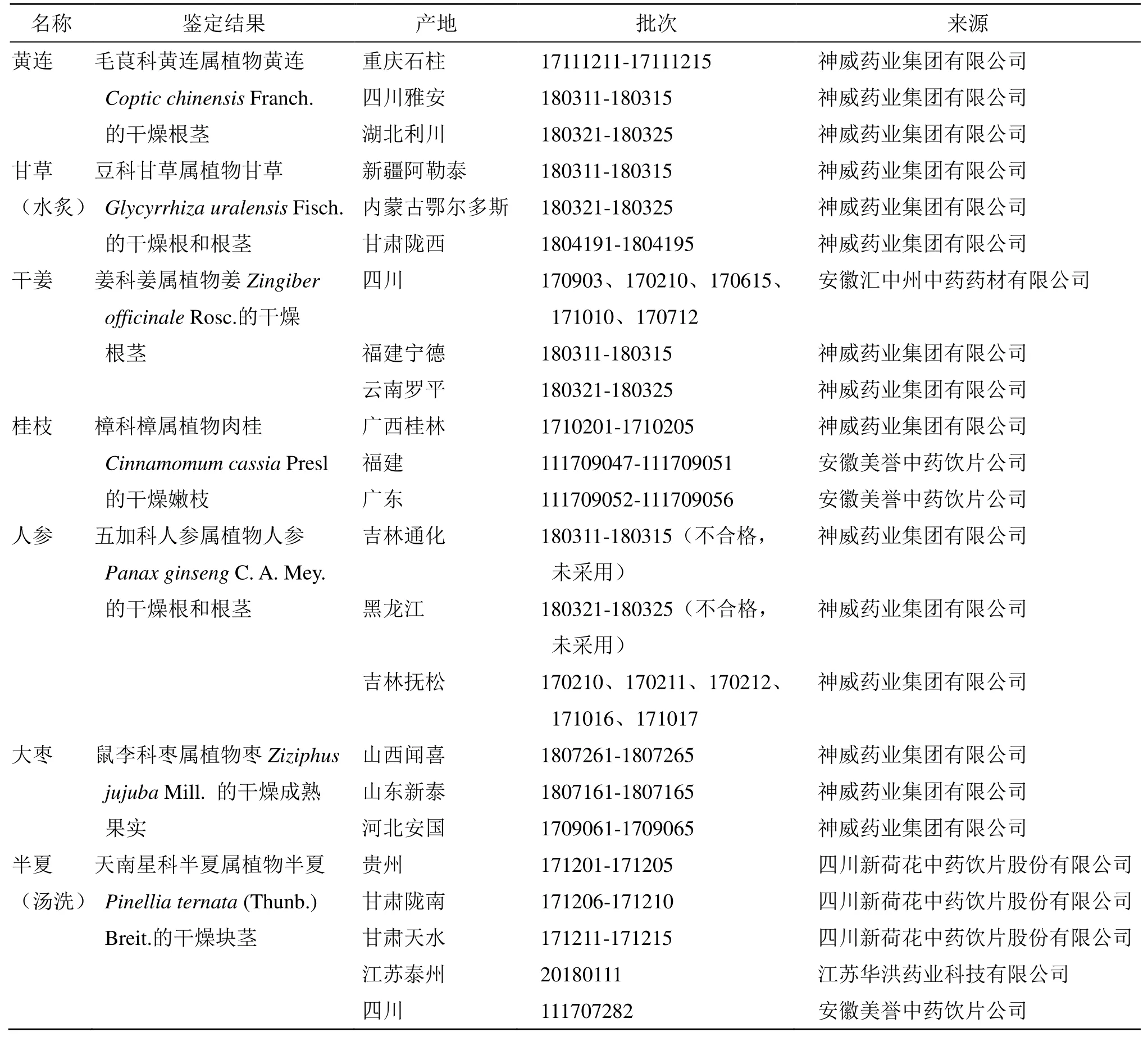
表1 黄连汤药材来源信息Table 1 Source information of Huanglian Decoction
精密量取上述液体2 mL至10 mL量瓶中,加入甲醇7 mL,加水至刻度,使甲醇浓度为70%,称定质量,超声30 min,放冷,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2 对照品溶液的制备
精密称取各对照品适量,加入甲醇配制成分别含盐酸小檗碱217.28 μg/mL、盐酸黄连碱113.96 μg/mL、盐酸巴马汀103.18 μg/mL、甘草苷104.30 μg/mL、甘草酸单铵盐173.60 μg/mL、桂皮醛34.30 μg/mL、6-姜辣素62.72 μg/mL的混合对照品溶液。
2.3 色谱条件
色谱柱为Merck Purospher Star LP RP-18endcapped柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(含0.05 mol/L磷酸二氢钾,磷酸调节pH值为3.0);梯度洗脱:0~7 min,10%~22%乙腈;7~19 min,22%~23.5%乙腈;19~28 min,23.5%~24%乙腈;28~42 min,24%~35%乙腈;42~52 min,35%~63%乙腈;52~54 min,63%~10%乙腈;54~56 min,10%乙腈;体积流量1 mL/min;检测波长280 nm;柱温25 ℃;进样体积10 μL。
2.4 方法学考察
2.4.1 精密度试验 取同一供试品溶液,按“2.3”项下色谱条件,连续进样6次。以稳定性好,分离度高的小檗碱(12号峰)为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<0.39%,相对峰面积RSD<2.46%,表明仪器精密度良好。
2.4.2 重复性试验 取同一份黄连汤基准样品,按“2.1”项下方法平行制备6份供试品溶液,按“2.3”项下色谱条件进样测定。以小檗碱为参照峰,计算各共有峰相对保留时间和相对峰面积的RSD,结果各共有峰相对保留时间RSD<0.65%,相对峰面积RSD<2.73%,表明方法重复性良好。
2.4.3 稳定性试验 取同一供试品溶液,按“2.3”项下色谱条件,分别于制样后0、2、4、8、12、24 h进样。以小檗碱为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<0.73%,相对峰面积RSD<2.44%,表明样品24 h内稳定性良好。
2.5 基准样品特征图谱建立及相似度评价
利用Excel中RANDBETWEEN函数生成随机数,将黄连、甘草(水炙)、干姜、桂枝、人参、大枣、半夏(汤洗)7味饮片的不同批次随机组合,按照“2.1”项下方法制备18批黄连汤基准样品(HLD1~HLD18)供试品溶液,并按“2.3”项下色谱条件进样,记录色谱图,将色谱图依次导入《中药色谱指纹图谱相似度评价系统》(2012A)软件,以HLD1号样品的特征图谱作为参照图谱,采用中位数法,进行多点校正和色谱峰匹配,得到18批样品叠加图及共有模式图,见图1、2,确定了17个共有峰,经与化学对照品的色谱行为进行比较,鉴定出7个色谱峰,分别为5号峰甘草苷,10号峰黄连碱,11号峰巴马汀,12号峰小檗碱,14号峰桂皮醛,15号峰甘草酸,17号峰6-姜辣素。与对照特征图谱相比为参照图谱,设其相似度为1.000,计算18批黄连汤基准样品的相似度,结果HLD1~HLD18的相似度分别为0.997、0.997、0.998、0.998、0.999、0.997、0.998、0.998、0.996、0.997、0.998、0.996、0.997、0.999、0.996、0.995、0.997、0.994,可见各批次样品特征图谱相似度均大于0.95,基准样品特征图谱相似度良好,表明基准样品的稳定性较好,主要物质群差异性小,形成的基准样品对照图谱能够作为衡量黄连汤制剂的标准参照物。
2.6 基准样品共有峰的归属研究
按供试品制备方法,分别制备单味饮片供试品溶液、各阴性供试品溶液及黄连汤基准样品供试品溶液,照“2.3”项下特征图谱条件进样检测,分别将7味饮片单味饮片供试品溶液、阴性供试品溶液和基准样品供试品溶液色谱图进行比对,结果见图3。可见黄连汤基准样品特征图谱中共有10个峰来自黄连,3个峰来自甘草(水炙),1个峰来自干姜,3个峰来自桂枝,半夏(汤洗)、大枣、人参在此条件下没有色谱信息。对黄连汤基准样品各共有峰进行归属分析,共归属17个共有峰,经对照品指认7个色谱峰信息,指认率为41.2%,结果见表2。其中1~3、6~9、10(黄连碱)、11(巴马汀)、12(小檗碱)号峰来源于黄连;4、5(甘草苷)、15(甘草酸)号峰来源于甘草;13、14(桂皮醛)、16号峰来源于桂枝;17号峰(6-姜辣素)来源于干姜;人参、半夏、大枣在此色谱条件下没有色谱信息,后续将进行进一步深入研究。
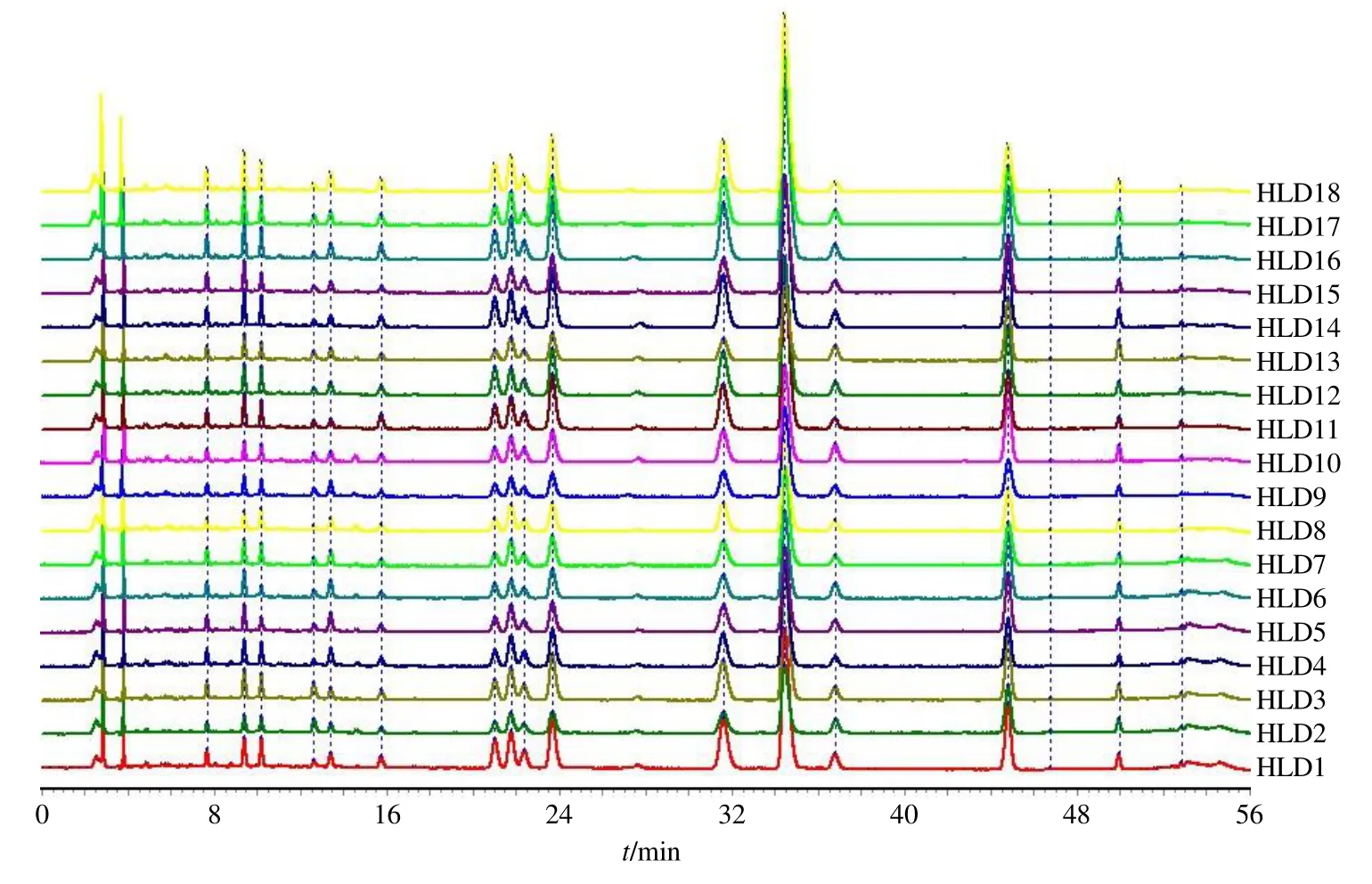
图1 18批黄连汤基准样品 HPLC特征图谱叠加图Fig.1 Overlay of characteristic spectrums of 18 batches of HLD reference samples
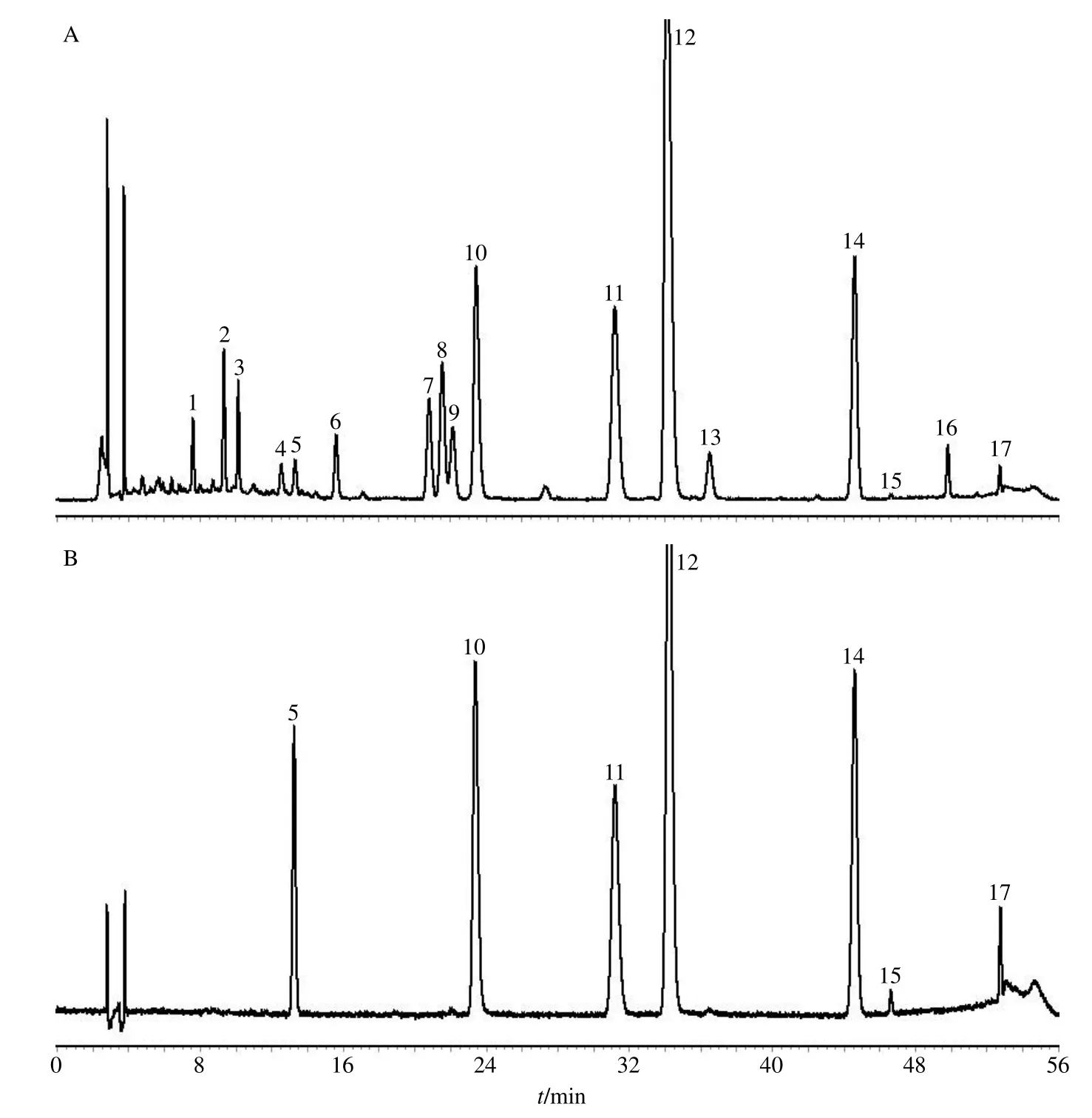
图2 黄连汤基准样品对照特征图谱 (A) 和混合对照品 (B) 图Fig.2 Characteristic spectrum of material reference of HLD (A) and mixed reference substances (B)
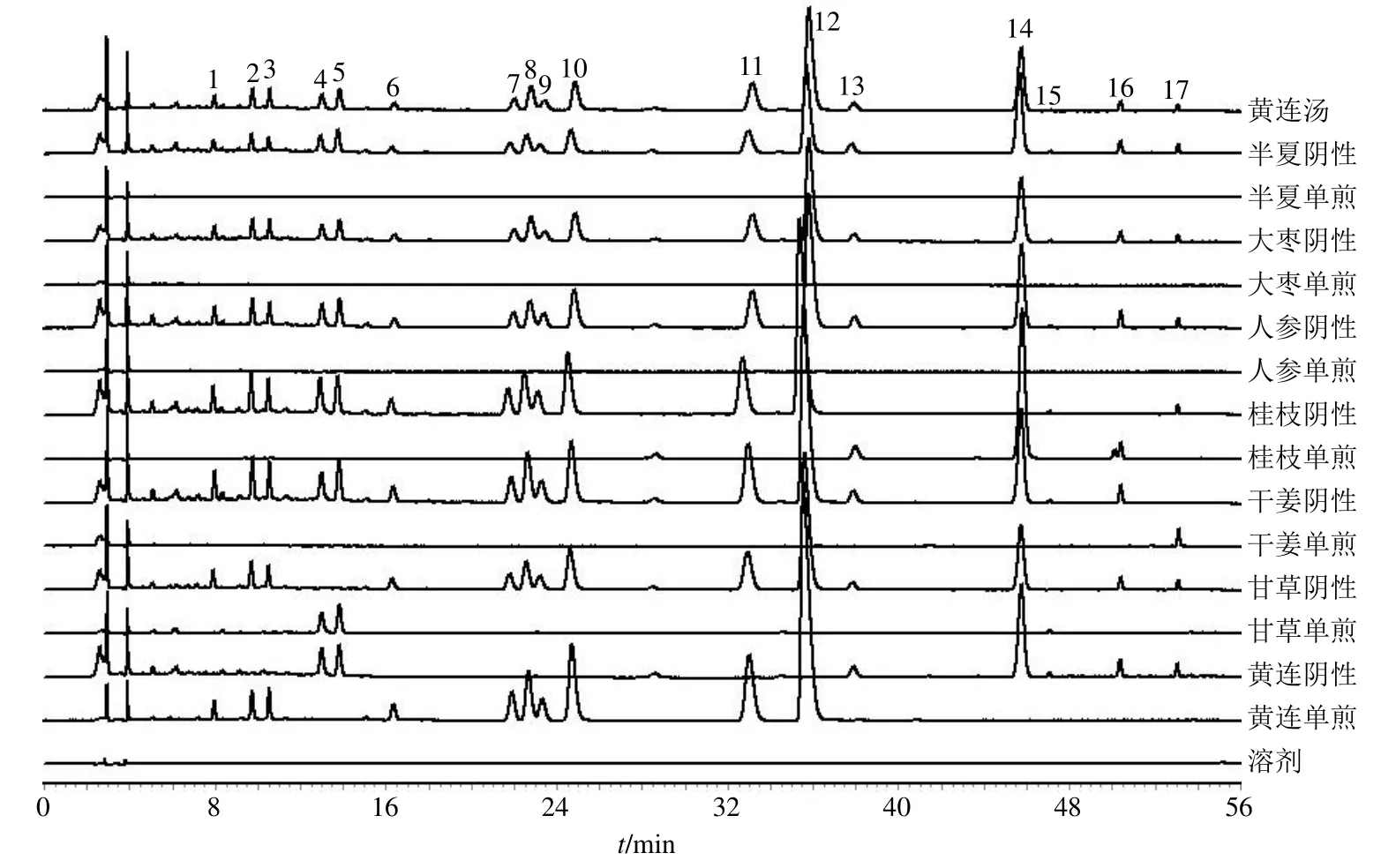
图3 黄连汤基准样品色谱峰归属Fig.3 Attribution of chromatographic peaks of HLD reference samples

表2 黄连汤基准样品共有峰归属情况Table 2 Attribution of common peaks of HLD reference samples
各味药材饮片特征图谱中主要物质群可以从饮片-基准样品较为完整地传递,且物质群的归属关系清晰,说明黄连汤基准样品的物质群可清晰的追溯到饮片,且色谱峰归属明确,指认率较高。
2.7 基于网络药理学的黄连汤功效关联物质预测分析
2.7.1 基于可测性及可溯性的活性成分筛选 根据文献研究,黄连为黄连汤君药,其主要活性成分为生物碱类成分[6],包含小檗碱、巴马汀、黄连碱、非洲防己碱等,具有抗菌、降糖调脂、抗肿瘤、抗胃溃疡等药理作用[7-8];甘草的主要活性成分为三萜类和黄酮类,甘草苷有清热解毒的功效,甘草酸有抗炎镇咳、免疫调节的作用[9];干姜的主要有效成分为姜辣素类,具有止呕等药理作用[10];桂枝的主要有效成分为挥发油类,具有抗菌抗炎、抗病毒等药理作用[11];人参的主要有效成分为多糖类、皂苷类,具有强心抗休克、抗心肌缺血等药理作用[12];半夏主要有效成分为生物碱类及有机酸类;大枣的有效成分为多糖类。
药典标准项下对于组方药的控制主要为黄连的黄连碱、巴马汀、小檗碱、表小檗碱,甘草的甘草苷及甘草酸,干姜的6-姜辣素,桂枝的桂皮醛,人参的人参皂苷Rg1、Re、Rb1。基于文献研究结合指纹图谱及特征图谱的可测性及可溯性,确定特征图谱所指认的黄连碱、巴马汀、小檗碱、甘草苷、甘草酸、6-姜辣素、桂皮醛7个活性成分为候选化合物。通过Pubchem Compound化合物数据库(https:// pubchem.ncbi.nlm.nih.gov/)获取7个候选化合物的Canonical SMILES编号,为后续黄连汤“成分-靶点-通路”网络的构建做准备。
2.7.2 黄连汤活性靶点预测 将7个成分的Canonical SMILES输入swiss target prediction数据库(http://www.swisstargetprediction.ch/)进行靶点预测,并结合中药系统药理学数据库与分析平台(TCMSP,https://lsp.nwu.edu.cn/tcmsp.php),获得7个化合物共涉及286个作用靶点蛋白,为相关通路的预测做准备。
将筛选出的286个靶点,导入在线STRING 11.0分析数据库(https://string-db.org),选择物种为“Homo sapiens”,选取最高置信度蛋白交互参数评分值>0.9的蛋白互作数据,筛选到229个靶点,将结果以TSV文本格式导入Cytoscape 3.8.1软件,并利用Cytoscape 3.8.1软件中的“Network Analyzer”功能对蛋白-蛋白相互作用(protein-protein interaction,PPI)网络进行拓扑属性分析,计算选取介数中心性(betweenness centrality)、接近中心性(closeness centrality)和度值(degree)3个重要拓扑参数均大于中位数且度值≥16的靶点作为核心靶点,经筛选得到30个核心靶点,结果见图4,图中节点大小与度值成正比关系。其中度值最高的磷脂酰肌醇3-激酶催化亚基α(phosphatidylinositol 3′-kinase catalytic subunit α,PIK3CA)能与57个蛋白发生相互作用。
2.7.3 黄连汤活性成分富集分析 利用R软件对黄连汤的30个核心靶点进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyotoencyclopedia of genes and genomes,KEGG)通路富集分析。背景数据库和基因集限定物种为“Homo sapiens”,阈值设置为P<0.05。前20条GO分析结果如图5所示,主要涉及聚合酶II特异性DNA结合转录因子结合(RNA polymerase II-specific DNA- binding transcription factor binding)、DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白丝氨酸/苏氨酸激酶活性(protein serine/ threonine kinase activity)等过程。KEGG分析共得到139条具有显著意义的通路,前20条与黄连汤相关度较高的通路如图6所示,主要包括炎症、感染、癌症等。
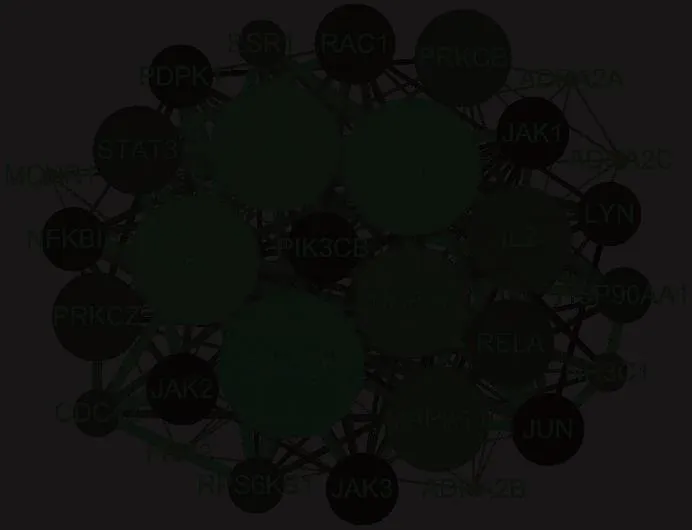
图4 PPI网络Fig.4 PPI network
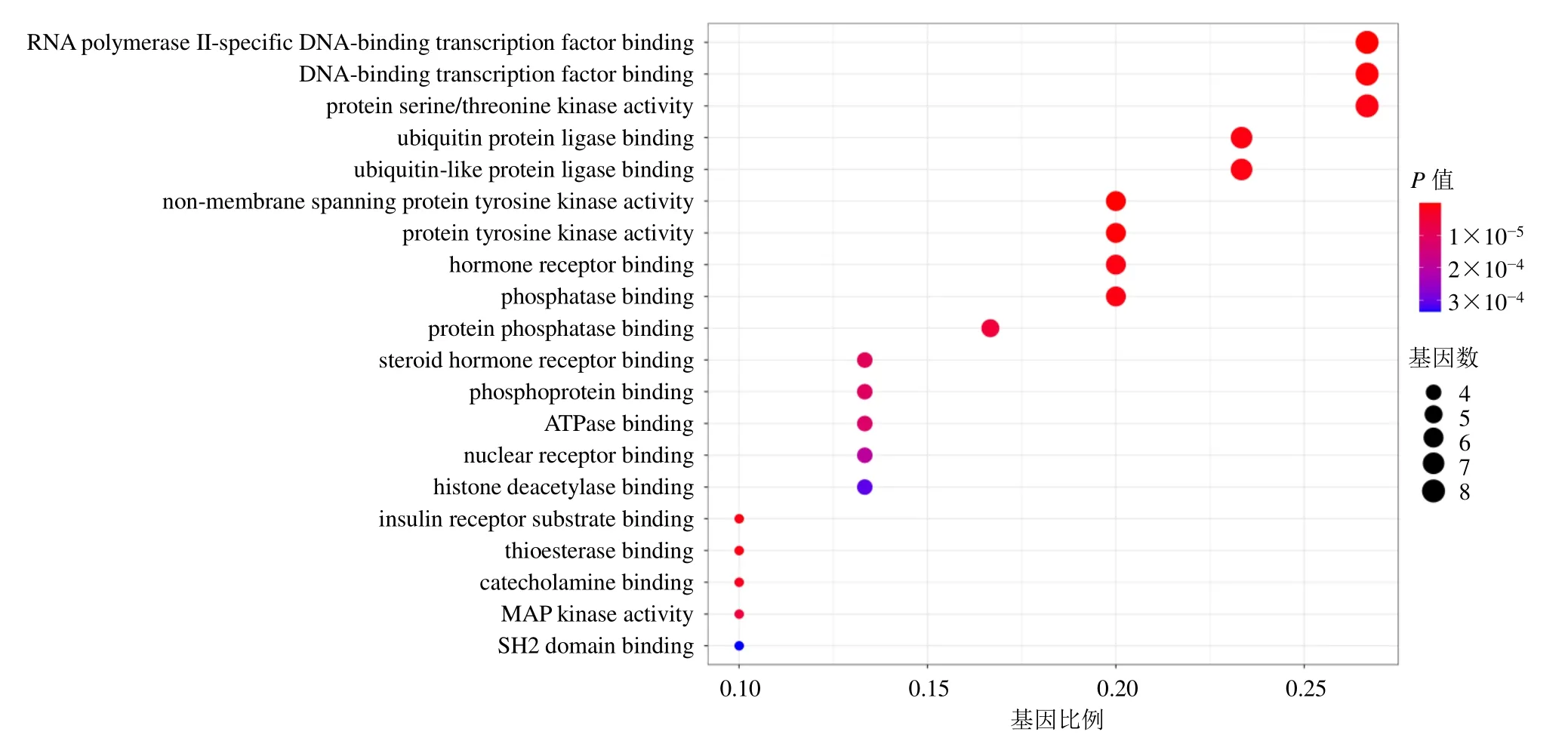
图5 GO富集分析的生物过程条目气泡图Fig.5 Entry bubble diagram of biological process by GO enrichment analysis
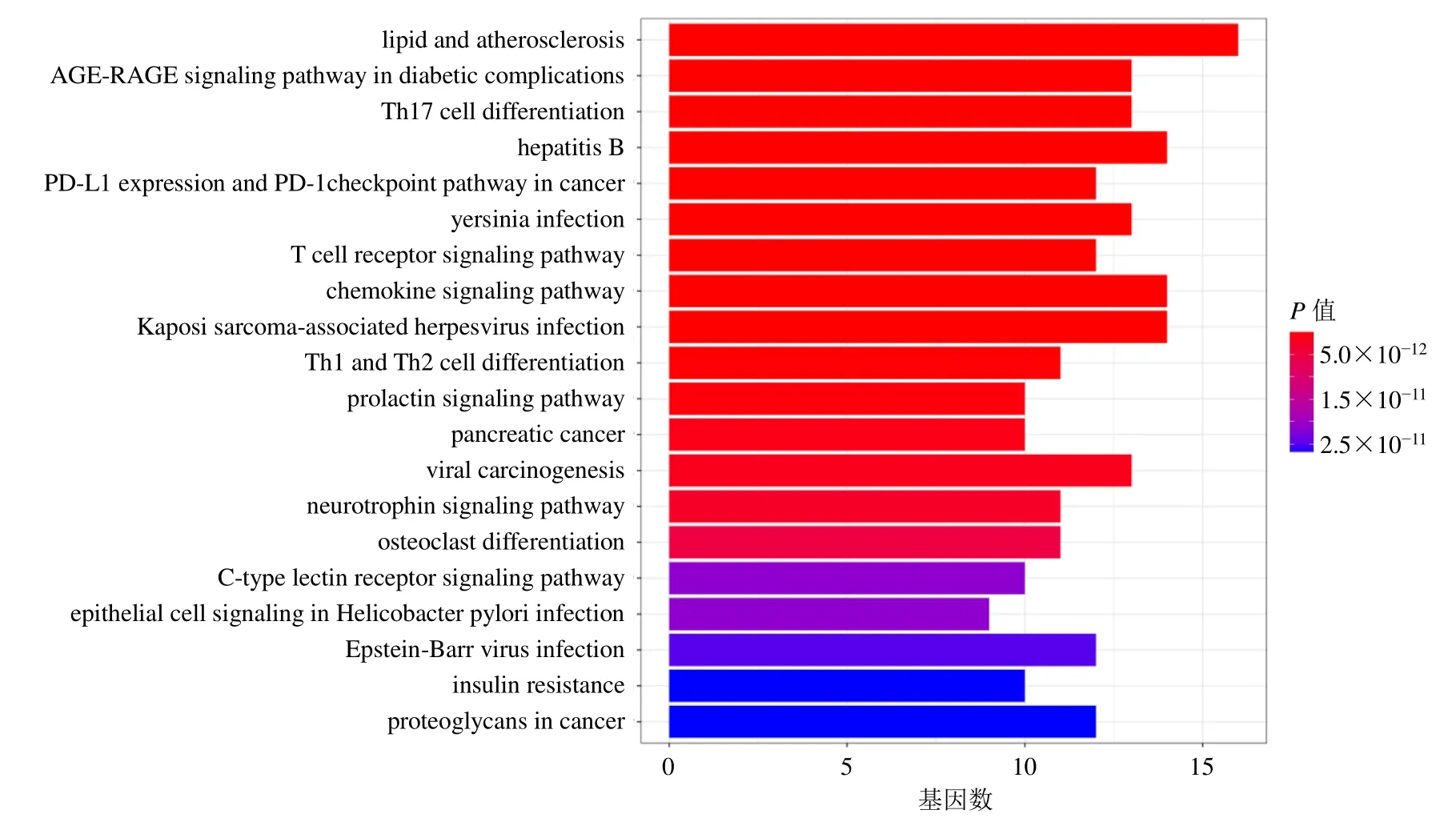
图6 核心靶点的KEGG分析Fig.6 KEGG analysis of core targets
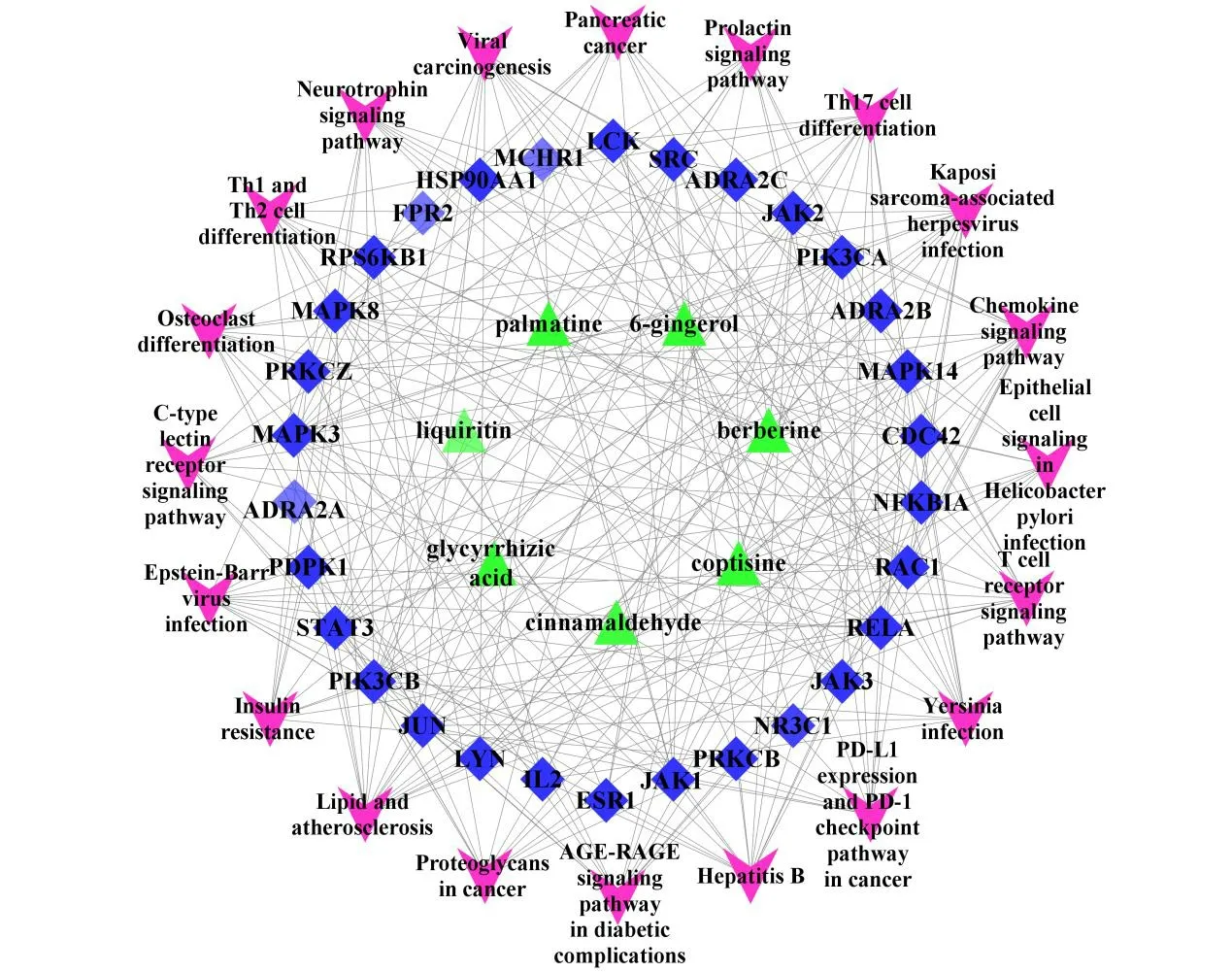
图7 “成分-靶点-通路”网络Fig.7 “Component-target-pathway” network
2.7.4 “成分-靶点-通路”网络构建及分析 将筛选到的黄连汤中的7个活性成分、30个核心靶点、排名前20条信号通路运用Cytoscape 3.8.1软件构建“成分-靶点-通路”网络,见图7。由网络图可以看 出,黄连汤中7个活性成分通过作用于多靶点在不同的信号通路中发挥作用,且成分、靶点、通路间存在错综复杂的关系,黄连中的黄连碱、巴马汀、小檗碱具有抗炎、抑菌功效,促使萎缩胃黏膜修复;桂枝中的桂皮醛及干姜中的萜类化合物抗氧化活性明显能促使胃黏膜损伤程度减轻;干姜醇提取物、甘草中的甘草苷和甘草酸、半夏水煎醇沉液均可经不同机制对胃黏膜幽门螺旋杆菌感染进行抑制,具有良好的抗溃疡作用;大枣多糖能促使胃肠道功能得到改善;显示了中药复方治疗疾病作用机制的复杂性。
2.7.5 Q-Marker的分析 黄连汤主治上热下寒诸症,现代临床主要治疗胃肠道疾病。现代研究发现黄连汤可通过抗炎、调节胃肠蠕动和调节肠道微生态等多个方面改善胃肠道疾病,临床疗效显著[13]。GO分析结果显示,黄连汤对蛋白丝氨酸/苏氨酸激酶活性,非跨膜蛋白酪氨酸激酶活性以及G蛋白偶联受体结合等途径具有广泛调节作用。KEGG分析结果表明,黄连汤主要对感染、炎症及癌症等相关信号通路起调节作用。研究发现,原癌基因肉瘤基因(sarcoma gene,SRC)表达活性增强及PIK3CA突变可能导致结肠癌,SRC能激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)和磷脂酰肌醇3激酶/蛋白激酶B(research of phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)等多条信号通路,其中信号转导蛋白和转录激活物(signal transducers and activators of transcription 3,STAT3)可通过介导炎症,介质的细胞外信号调控肿瘤细胞、免疫细胞等生物学行为,促进肿瘤发生及相关炎症的形成[14],PI3K/Akt信号通路通过对自噬产生负调控作用,促进肿瘤细胞的生长、增殖和存活[15]。另有研究表明,糖脂代谢紊乱利于幽门螺旋杆菌感染和繁殖[16],且可通过引起神经病变和微循环障碍导致胃蠕动障碍和胃黏膜萎缩[17],其通过调节AGE-RAGE信号通路、耶尔森菌感染、巨噬细胞病毒感染等通路抑制病毒感染与繁殖。趋化因子与相关受体结合吸引白细胞移行到感染部位,在炎症反应中具有重要作用,已有研究证实趋化因子10和28,趋化因子受体4和6在慢性胃炎的胃黏膜组织中均高表达,另有研究表明T细胞受体信号通路在识别特异性抗原、激活T细胞、确保调节性T细胞功能方面具有重要作用。此外,肿瘤的发生与发展与炎症微环境密切相关,慢性炎症可能是介导肿瘤侵袭和转移的关键节点[18],白细胞介素 2(interlenkin-2,IL-2)作为衔接炎症与肿瘤的炎症因子,与实质受体结合为酪氨酸磷酸激酶,从而启动细胞内蛋白激酶介导的磷酸化级联反应,最终导致STAT3磷酸化水平上调。
综上所述,黄连汤通过7味药间不同活性成分的协同作用,可能从以下方面发挥治疗胃肠道疾病作用:下调SRC蛋白表达水平,抑制结肠癌细胞增殖;调节IL-2炎症因子表达,抑制细胞内蛋白激酶介导的磷酸化级联反应;下调STAT3磷酸化水平,抑制肿瘤相关炎症形成;抑制PI3K/Akt信号通路活化,促进细胞自噬与细胞凋亡,降低促炎症因子IL2释放。基于网络药理学预测结果与已有文献结果较为接近,表明该方法具有一定的准确性,同时契合中药整体观、系统性的理念,为进一步阐明黄连汤物质基础及治疗胃肠道疾病机制提供了参考。
由此可见,黄连汤中关键效应成分可作用于多靶点,干预多个通路达到与临床治疗胃肠道疾病一致的疗效,进一步表明特征图谱所选指标成分的合理性。网络药理学从理论上证明了其有效性,结合前文及特征图谱和网络药理学对黄连汤中的Q-Marker进行预测分析,黄连碱、巴马汀、小檗碱、甘草苷、甘草酸、桂皮醛、6-姜辣素这7个成分基本符合Q-Marker的五原则,故预测其为黄连汤潜在的Q-Marker。
3 讨论
中药和复方制剂成分复杂,本研究以特征图谱为指标,考察饮片-基准样品的相关性及传递性。特征图谱结果显示主要物质群可以从饮片-基准样品逐级较为完整地传递,且归属关系清晰。从色谱峰个数和峰强度进行分析,黄连、桂枝与甘草对特征图谱的贡献最大;其次为干姜,其主要成分为挥发油,在本特征图谱条件下可检出1个色谱峰;半夏主要含淀粉和氨基酸、大枣主要含多糖和氨基酸,这几类成分水溶性大,含量低,且不具备HPLC-UV检测的结构特点,致使它们在此色谱条件下不能检出。方中人参主要含皂苷类物质,为末端吸收,且该类成分不稳定,在此色谱条件下未能检测,建议对人参单独建立特征图谱[19]。
中药质量是中药产业发展的生命线,中药质量研究方面存在的诸多问题将制约中药产业的健康与可持续发展[20]。Q-Marker的建立有利于中药全程质量控制及质量溯源,是中药质量评价与控制的指标。基于特征图谱和网络药理学研究,黄连汤中黄连碱、巴马汀、小檗碱、甘草苷、甘草酸、桂皮醛、6-姜辣素7个成分均具有传递性和溯源性,且与功能属性密切相关,可初步预测其为黄连汤的潜在Q- Marker。
本研究基于中药化学与中药药理学,整合多学科技术方法,基于可测性、可追溯性、有效性开展黄连汤功效关联物质的系统辨识与确认,为后期深入研究黄连汤的作用机制提供借鉴,也为黄连汤的质量控制提供了更全面的参考。
利益冲突所有作者均声明不存在利益冲突
