化脓性链球菌碳水化合物代谢及毒力影响研究进展
2021-09-23宋英莉王胜钰陈竑量蔡明辉
宋英莉, 王胜钰, 陈竑量, 蔡明辉, 朱 辉
(哈尔滨医科大学 生理学教研室,黑龙江 哈尔滨 150081)
化脓性链球菌(Streptococcuspyogenes),也称A组链球菌(group A streptococcus, GAS),是一种引起多种人类疾病的革兰阳性病原体,可以引起咽炎、猩红热和脓疱病等常见的感染性疾病,也可以引起坏死性筋膜炎、菌血症和肾小球肾炎等严重的侵袭性感染[1-2]。GAS在宿主体内必须从外界摄取营养物质来保证自身的生命活动和生长繁殖,碳水化合物可为其提供所需的元素和能量,GAS摄取足够的能量后才能利用自身的毒力因子使宿主致病,研究GAS碳水化合物摄取和毒力影响,对感染的预防和治疗有一定的指导意义。化脓性链球菌是一种多氨基酸营养缺陷型病原菌,优先使用葡萄糖作为主要能量来源,因此在宿主体内,GAS必须通过自身的调节进行新陈代谢,适应宿主体内营养环境的变化。化脓性链球菌必须在营养上适应动态宿主环境,还必须通过这些变化协调其毒力因子的表达水平。本文主要对化脓性链球菌碳水化合物摄取途径、代谢调节和对毒力影响等方面进行综述。
1 化脓性链球菌的碳水化合物摄取途径
1.1 GAS的葡萄糖摄取途径
1.1.1 GAS的糖酵解途径(Embden-Meyerhof-Parnas,EMP) 化脓性链球菌在碳源丰富的环境中摄取葡萄糖,EMP是其最主要的代谢途径。EMP发生于胞浆,由12种偶联酶参与,在有氧或缺氧条件下都能发生并产生ATP,并将葡萄糖降解为丙酮酸。EMP包括10个步骤,分为两个阶段:一是由葡萄糖代谢生成三碳糖磷酸;二是由三碳糖磷酸转化为丙酮酸。有氧时丙酮酸进一步氧化分解生成乙酰辅酶A,进入三羧酸循环(Tricarboxylic Acid cycle,TAC cycle),缺氧时丙酮酸被还原为乳酸(图1)[3-5]。
1.1.2 非完全糖酵解途径(Entner-Doudoroff,ED) 化脓性链球菌还存在另外一种糖酵解途径,此途径作为EMP的一种替代途径,其特点是相对于EMP途径,其代谢葡萄糖需要10个步骤,而ED途径只需4步就能完成。实现这一过程的关键在于特征性酶酮-羟基戊二酸醛缩酶(keto-hydroxyglutarate aldolase,KDPGA)等。在ED途径中,KDPGA醛缩酶催化2-酮基-3-脱氧-6-磷酸葡萄糖酸,转化为甘油醛-3-磷酸和丙酮酸,进入TAC循环代谢。图1为EMP和ED的过程[5-6]。

图1 化脓性链球菌葡萄糖摄取EMP和ED途径[5]Fig.1 GAS uptake glucose through EMP and ED pathways[5]
1.1.3 磷酸烯醇式丙酮酸:碳水化合物磷酸转移酶系统(Phosphoenolpyruvate (PEP)-dependent phosphotransferase system (PTS)) 目前PTS系统仅在细菌中发现,化脓性链球菌能够通过PTS利用不同碳源,以适应环境的变化。该系统也是一个信号转导通路,可使多种单糖、二糖和氨基糖等发生转运和磷酸化。其中,葡萄糖作为PTS系统主要利用的碳源,能被主动跨膜转运入胞质,同时磷酸化生成葡萄糖-6-磷酸(图2),进入糖酵解途径。此过程由三种细胞质磷酸转移蛋白组成:通用 PTS 系统蛋白酶I(EI)以及含组氨酸蛋白(HPr)和糖特异性 PTS 系统通透酶(EII)完成。EII由至少有1个是膜结合型的4个蛋白质结构域(EIIA/B/C/D)组成[7]。PTS的葡萄糖摄取途径(即磷酸转移级联)起始于EI和PEP,PEP将其磷酰基转移至EI,EI再通过HPr进入EIIA和EIIB结构域。最后,EIIB通过EIIC穿过质膜时磷酸化葡萄糖,形成葡萄糖-6-磷酸,进入糖酵解途径[7-9]。
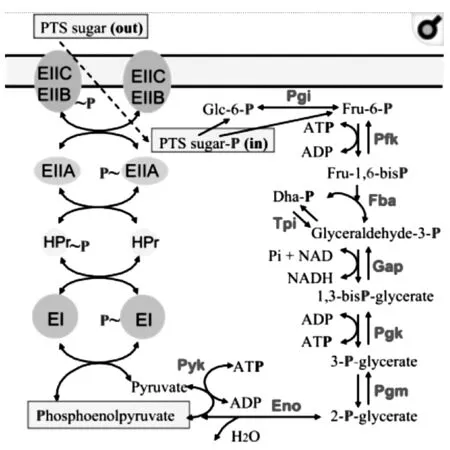
图2 化脓性链球菌葡萄糖摄取的PTS途径[7]Fig.2 GAS uptake glucose through PTS pathways[7]
1.2 非葡萄糖碳水化合物代谢:乳糖摄取
在Loughman等[10]的研究中发现,化脓性链球菌等一些细菌利用葡萄糖作为优选碳源,但当环境中葡萄糖缺乏时,化脓性链球菌还可以使用其PTS系统摄取和代谢非葡萄糖碳水化合物,例如乳糖,图3即为化脓性链球菌的乳糖摄取途径。目前研究发现,几乎全部化脓性链球菌基因组中都存在两个影响乳糖代谢和转运的操纵子,即Lac.1和Lac.2,其下游产物通过塔格糖-6-磷酸途径作用于乳糖和半乳糖代谢。每个操纵子由8个基因组成,包括lacABCDEF、lac.2-特异性lacG或lac.1-特异性spy_1401/ptsIIA,以及调节子/阻遏物lacR。Lac.1基因座专门参与乳糖/半乳糖调节,使Lac.2基因座有效利用乳糖/半乳糖。
Lac.2对环境中的碳源敏感,是一种典型的Lac操纵子。首先,外源乳糖或半乳糖通过PTS转运蛋白以乳糖-6-磷酸的形式转运至细胞内,转化为半乳糖-6-磷酸,再通过Lac异构酶和LacA/B和LacC的作用,转化成塔格糖-1,6-二磷酸,又在LacD作用下转化为3-磷酸甘油醛和磷酸二羟丙酮。后二者均可进入EMP途径进一步代谢[11]。
Lac.1高度保守。因为缺乏LacG基因,其编码的酶不直接参与乳糖代谢。但Lac.1对Lac.2有替代功能, LacD.1醛缩酶作为几种毒力基因的转录调节因子,保留了醛缩酶活性,促进乳糖代谢,但LacD.2不能替代LacD.1的调节活性[10,12]。
1.3 非葡萄糖碳水化合物代谢:苹果酸摄取
当环境中葡萄糖缺乏时,因为化脓性链球菌具有苹果酸酶(Malic enzyme,ME)途径的基因,使其可以用PTS系统磷酸转运蛋白EI酶来摄取苹果酸。苹果酸在环境组织中含量丰富,可作为非葡萄糖补充碳源。
ME由两个相邻操纵子中的四个基因组成,具有调节双组分MaeKR的基因,用于表达编码苹果酸通透酶(MaeP)和苹果酸酶(MaeE)的基因。其表达受葡萄糖、苹果酸和pH值影响,葡萄糖通过独立于CcpA的机制抑制maePE和maeKR。苹果酸和低pH诱导maeP和maeE的表达,并诱导依赖于MaeK传感器激酶。苹果酸被ME以NAD依赖性方式转化为丙酮酸和CO2[13-14]。
2 碳代谢的调节
2.1 碳分解代谢物阻遏(Carbon Catabolite Repression,CCR)
CCR是一种全面调节机制(Global Regulatory Mechanism),使化脓性链球菌选择性地使用混合底物中的不同碳源。当环境中葡萄糖充足时,CCR可以抑制二级碳源的利用,包括转录激活、抑制和通过RNA结合蛋白控制翻译水平。 此外,CCR还可以通过碳水化合物敏感的调节剂如CcpA、LacD.1和Mga影响化脓性链球菌中毒力因子的表达[5,15]。
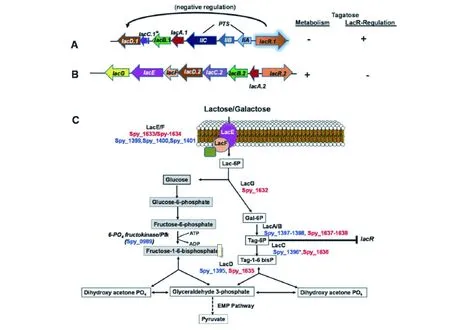
图3 化脓性链球菌乳糖摄取途径[5]Fig.3 Pathway for the intake of lactose by GAS[5]
2.2 分解代谢物控制蛋白A(Catabolite control protein A,CcpA)
CcpA是CCR的关键调控因子,是LacI/GalR转录因子家族的成员[16],CcpA作为化脓性链球菌体内主要调节因子,参与繁殖/凋亡平衡,不仅影响碳分解代谢还影响毒力调节[17-18]。对于碳代谢,CcpA主要是一种抑制因子,通过影响PTS系统中胞膜和胞质处发生的磷酸化过程,来调节碳水化合物摄取。在PTS中,HPr丝氨酸残基的磷酸化产生HPr-Ser-46-P,作为CcpA的蛋白质共同作用因子,CcpA-HPr-Ser-46-P二聚体更有效地与其特定的分解代谢物控制元件(cre)位点结合,使CcpA结合DNA成为碳水化合物依赖性转录抑制因子,改变其基因表达[7,19]。对于毒力调节,CcpA影响毒力相关基因的表达,包括sls、speB、sag、rivR、mac、spd3和mga等[17-19]。
2.3 PTS的调节
化脓性链球菌中PTS催化许多碳水化合物的摄取和磷酸化,除此之外,PTS还能通过影响HPr的磷酸化显著调节碳水化合物的摄取[5,7,20]。
HPr可以发生不同形式的磷酸化,在HPr的His15残基上,由PEP提供磷酸基团,EI酶靶向磷酸化HPr,生成HPr-His15-P,促进PTS系统糖转运。除此之外,HPr也可在Ser46残基处,由ATP或焦磷酸提供磷酸基团,HPr激酶/磷酸化酶(HPrK/P)磷酸化HPr,生成CcpA的辅助因子HPr-Ser46-P,抑制PTS系统糖转运。HPr激酶也在碳水化合物的调节中发挥着核心作用,可以由FBP、葡萄糖-6-磷酸激活[20]。化脓性链球菌根据代谢需求,平衡HPr-His15-P和 HPr-Ser46-P的相对浓度[21]。
PTS与化脓性链球菌致病性之间也有关联,有研究表明CCR也主要受PTS影响[21],某些毒力因子(如emm、mrp、arp和enn)的调节是建立在CCR的基础上,例如经典的CcpA依赖性CCR机制控制化脓性链球菌毒力基因调节因子Mga,使CcpA在Mga启动子的早期激活中起作用[7,22]。
2.4 乳糖代谢的调节
LacR是一种DeoR型调节因子,位于标签物通路基因(lac操纵子I)的下游,在没有乳糖/半乳糖的情况下,抑制lac操纵子I的转录。LacT属于BglG家族的转录抗干扰物,并且具有PTS调节结构域(PRD)和CoAT RNA结合结构域。LacT作为lac操纵子II的转录激活因子,在肺炎链球菌中,LacT调节乳糖转运,LacR/T操纵基因位点也被发现在其他链球菌(包括化脓性链球菌)中也是高度保守的,表明LacR/T在其他链球菌中具有相似的功能[23-24]。
3 碳水化合物摄取对化脓性链球菌毒力的影响
3.1 葡萄糖浓度对毒力的影响
3.1.1 葡萄糖水平变化通过CcpA和Mga影响毒力 在低浓度葡萄糖环境中,化脓性链球菌可以通过CcpA直接结合抑制CCR的表达,有利于二级碳源的利用[15];低葡萄糖条件下,CcpA还通过结合Mga调节子的启动子Pmga上cre位点,直接抑制Mga调节子的表达(Mga是一类存在于所有化脓性链球菌的转录激活因子,调节许多化脓性链球菌毒力因子的表达),影响毒力[22,25-26]。Valdes等[25]的研究发现,与富含葡萄糖的培养基(THY)相比,乏葡萄糖的培养基(C培养基)在早期就消耗完葡萄糖,后期利用替代糖的基因被诱导,参与替代糖的利用和运输。化脓性链球菌在C培养基中生长期间,同种化脓性链球菌共发现496个基因(26.7%的非tRNA基因组)差异表达,几种毒力相关基因受到影响。在THY和C培养基中,对比Mga调节子,发现仅有16个基因共同存在;野生菌株与任一培养基中基因缺失菌株Δmga进行比较,基因表达变化超过1.8倍,显示Δmga突变体中核心Mga调节子的基因(例如emm、sic、scpA)转录水平降低7倍至18倍[23]。这些结果表明在对数晚期阶段C培养基中缺乏葡萄糖,CcpA通过直接结合抑制CCR的表达,诱导非葡萄糖碳水化合物的代谢并改变了Mga调节子,影响了毒力。
3.1.2 葡萄糖水平变化通过PTS介导的Mga磷酸化影响毒力 葡萄糖水平的变化通过体外PTS的磷酸转运蛋白EI和HPr在保守的PRD组氨酸处磷酸化调节Mga活性,影响毒力基因的表达。在化脓性链球菌中,糖操纵子调节剂中PTS调节结构域(PRD)与毒力调节剂Mga具有同源性。在Hondorp等[27]的研究中,构建了ΔptsI(EI缺陷型)化脓性链球菌突变体,EI是PTS中磷酸转移级联的起始酶,通过EI的缺失研究其对Mga的影响,发现ΔptsI表现出减弱Mga的活性,PTS介导的磷酸化在体外抑制emm的Mga依赖性转录。构建PRD组氨酸的丙氨酸(未磷酸化)和天冬氨酸(磷酸化)突变体,发现双磷酸化的PRD1磷酸化模拟物在体内完全失活,抑制Mga调节子的表达。这些研究表明化脓性链球菌受碳源水平的影响,保守的PRD组氨酸的PTS组分EI/HPr磷酸化Mga调节毒力基因的表达。另外,Valdes等[25]在不同葡萄糖水平下观察Mga的表达发现,Mga在乏葡萄糖培养基中磷酸化程度降低。
3.1.3 葡萄糖水平变化通过影响SLS改变细菌毒力 链球菌溶血素-S(SLS)是一种能够广泛溶解不同红细胞的溶血素,在培养基中表现出β-溶血表型[28]。在Richard等[29]的实验中发现,高葡萄糖浓度的培养基中,化脓性链球菌的SLS的表达降低。这是由于高葡萄糖浓度下生长的化脓性链球菌细胞中,CcpA通过与位于SLS启动子中的creC位点结合直接抑制化脓性链球菌中的SLS表达,这种表达模式表示CCR控制SLS表达的机制。实验中测定不同葡萄糖浓度下生长的菌株,在补充12.5 mmol/L葡萄糖的培养基中显示出规则的β-溶血,而在补充25 mmol/L葡萄糖的培养基中是非溶血性的。在不同葡萄糖浓度下测定基因缺失菌株ΔCcpA中SLS启动子的活性,观察到SLS表达的剂量依赖性降低。creC位于SLS启动子的-35和-10区域之间,creC的突变株中完全失去抑制作用,显示出SLS启动子持续高水平活性。
3.2 乳糖水平变化影响细菌毒力
由CcpA和LacD.1构成的碳分解代谢反应调节途径可以调节高达15%的基因组活动,包括CcpA和LacD.1特异性和独立调节、共调节,甚至独立于葡萄糖的调节[26]。受CcpA和LacD.1共调节影响的最重要的毒力基因是speB,其可由CcpA诱导并且在体外和体内都被LacD.1抑制,表明碳分解代谢物感应在化脓性链球菌感染过程中调节毒力发挥着作用[5,23,30]。
Kietzman等构建菌株WT,基因缺失菌株ΔCcpA和ΔLacD.1,复制小鼠皮下感染模型,发现ΔCcpA感染面积均值为18 mm2,而WT组面积为32 mm2,说明ΔCcpA毒力弱于野生菌株,并且其speB表达水平显著降低,而ΔLacD.1和WT组损伤面积无明显差异[31]。但Loughman等在培养条件下,发现ΔLacD.1中分泌蛋白酶活性增加,甚至可达到WT的水平,WT中LacD.1的过表达显著抑制SpeB活性,比WT降低约65%的水平[23]。
LacD.1是Lac.1操纵子的成员,且是半胱氨酸蛋白酶(cysteineproteinase,SpeB)的调节剂,具有参与乳糖和半乳糖代谢的塔格糖1,6-二磷酸醛缩酶的特征。虽然LacD.1具有酶活性,但它不起代谢作用[10]。LacD.1调节功能与其催化活性无关,但必须与底物结合才能发挥其对SpeB的调节作用[12]。SpeB作为一种毒力因子可以帮助化脓性链球菌降解宿主的组织结构,促进化脓性链球菌及其产物在宿主组织中的散播,还可降解蛋白、抗菌肽LL-37来对抗宿主的免疫作用[32]。
3.3 苹果酸对化脓性链球菌毒力的影响
苹果酸可以用作生长的补充碳源,化脓性链球菌通过上文所述的ME途径摄取苹果酸,其ME途径受到葡萄糖、苹果酸和pH值的影响。Paluscio等[14]用5~6周龄雌性SKH-1小鼠,皮下注射约107cfu/mL的化脓性链球菌制造感染的鼠模型,评估ME突变体的毒力水平,构建的ΔMaeK、ΔMaeR和ΔMaeP突变体不能将细胞外苹果酸转运到细胞中,并且突变体毒力减弱(注射细菌3 d后皮肤损伤面积分别约为WT 50 mm2、ΔMaeK 40 mm2、ΔMaeR 30 mm2、ΔMaeP 28 mm2), 而ΔMaeE突变体能够将苹果酸转运到细胞中,但不能最终转化为丙酮酸,且与野生型相比毒力增强(注射细菌3 d后皮肤损伤面积WT、ΔMaeE分别约为50 mm2和75 mm2)。
4 展 望
化脓性链球菌具有葡萄糖、乳糖和苹果酸等碳水化合物摄取途径,碳水化合物的利用与病原菌的生存和致病性息息相关,近年来对化脓性链球菌碳水化合物摄取途径及调节机制研究始终是一个热点问题,许多碳水化合物的摄取途径已经被证实,但是化脓性链球菌非糖类的碳源摄取途径的研究比较有限,其他物质摄取吸收的研究证据不多,有关细菌营养物质摄取系统性、整体性地研究较少,因此对化脓性链球菌碳水化合物摄取进行深入研究与探索,可能对细菌毒力表达和临床防治细菌感染提供科学理论指导和新思路。
近年来,由于抗生素的滥用,化脓性链球菌的耐药性已成为全球性问题,需要安全有效的方法预防A组链球菌感染。目前研究发现,化脓性链球菌的铁摄取途径相关蛋白对宿主有保护作用,并能引起细菌毒力的改变,细菌侵袭能力减弱可能是碳水化合物等营养物质吸收代谢的改变引起的。研究清楚调节碳水化合物等物质的摄取,有益于深入探究细菌的抗生素耐受机制。
化脓性链球菌的碳摄取也受CCR、CcpA和PTS等方式的调节,宿主体内葡萄糖、乳糖和苹果酸浓度的变化也会导致其毒力发生改变,并且这些动态变化机制可使细菌快速地适应变化的营养环境和生长状态,对化脓性链球菌碳水化合物摄取的调控网络和代谢通路进行深入研究,可能会在细菌的多种物质协同吸收方面有新的发现,碳水化合物摄取系统也可作为细菌特异性药物靶标用于新药物的研发,为降低临床耐药性和新药研发提供参考。
