红托竹荪液体菌种发酵条件配方优化研究
2021-09-23葛萃萃刘忠玄杨澍雨
刘 锡, 葛萃萃, 罗 倩, 王 莹, 向 准, 刘忠玄 , 杨澍雨
(1.贵州农业职业学院, 贵阳 550018; 2.浙江公正检验中心有限公司, 浙江 杭州 310009;3.贵州师范学院, 贵阳 550012; 4.贵州省生物研究所, 贵阳 550009)
红托竹荪(DictyophoraRubrovolotaZang)是一种清香型大型食用真菌[1],是我国四大人工栽培竹荪(红托竹荪,长裙竹荪,棘托竹荪和短裙竹荪)中品质最好,价格最高,形态最美的一种,素有“蘑菇皇后,真菌之花,面纱女郎,林中之王”等美誉[2]。红托竹荪经济价值极高,近年来相关产品价格也逐年增长,2016—2019年,贵州省红托竹荪干品产地批发价从500元·kg-1逐年上升到800元·kg-1。由于红托竹荪栽培难度较高,干品产量差异较大,产量从50~150 kg·(667 m2)-1不等,其较高的经济效益吸引了不少企业和个人进行投资,广东,四川,湖南,广西等省均有从贵州省引种进行驯化栽培,但到目前为止,除贵州省外,其他地区没有形成稳定的规模化栽培,原因可能与贵州省独特的高凉地理气候环境有关。
红托竹荪是贵州独具特色的优势食用菌,其产量占全国红托竹荪总产量的90%以上,贵州省织金县为中国红托竹荪之乡,织金红托竹荪于2010年获得国家地理标志产品。红托竹荪在贵州省产业化生产进程中,其显著的生物学特征表现有菌种生长速度慢,抗逆性较差,这导致红托竹荪菌种生产周期长[3],病虫害(特别是红托竹荪的腐烂病)发生严重[4-5],这一技术瓶颈制约了红托竹荪产业的发展,致使其种植规模一直徘徊在330~670 hm2。增强红托竹荪菌种抗逆性和缩短菌种生产周期[6-8],在生产中采用栽培菌棒直接覆土栽培[9-12],改变传统栽培模式,是促进红托竹荪产业发展的关键技术。为此,本研究拟优化红托竹荪液体菌种配方,提高菌种生长速度,缩减菌种生产周期,降低菌种污染率,破除技术瓶颈,促进红托竹荪产业发展。
1 材料与方法
1.1 材 料
1.1.1供试菌株
红托竹荪HT-027,来源于贵州省生物研究所。
1.1.2仪 器
振荡培养全温摇床AHBS-E 200;电子天平BSA 224 S;智能型人工气候箱RQX-400 B;单人净化工作台SW-CJ-1 F;超声波清洗器JN-3200 DTS;电热鼓风干燥箱101-1 BS;循环水多用真空泵SHB-3。
1.1.3玻璃器皿
锥形瓶,培养皿,试管,玻棒,移液枪,烧杯,玻璃漏斗,量筒,布氏漏斗等。
1.1.4药品与其他材料
葡萄糖,白砂糖,蔗糖,蛋白胨, MgSO4·7 H2O,酵母膏,氯化铵,半乳糖,尿素,磷酸二氢钾,硝酸镁,羟甲基纤维素钠,玉米面,小米面,红薯,马铃薯, 琼脂等。
1.2 试验方法
1.2.1培养基制作
1) 母种制备:将红托竹荪试管种接种于不同配方培养基里,进行培养并观察。待出现菌丝时,进行隔天观察,记录菌丝封面时间、菌丝长度及长势等指标。计算菌丝平均满管时间及生长速度。
制作方法:称取200 g削皮马铃薯块加水煮沸,用玻璃棒轻戳马铃薯块,可呈粉状脱落即可,煮液用四层纱布过滤后,在滤液中加入20 g琼脂,加热过程中用玻璃棒进行搅拌,直到琼脂完全溶于水中,在溶液中加入白砂糖,MgSO4·7 H2O,磷酸二氢钾,用玻棒搅拌至药剂完全溶液后,用水定容至1 000 mL烧杯中,pH值不需要调节,趁热将培养基装入锥形瓶中,用棉塞进行密封,在高温条件下进行灭菌。将灭菌后的培养基倒入培养皿内(约10 mL),待培养基凝固后,在培养皿中心位置接入红托竹荪菌种,以上操作均在超净工作台进行。随后,将其放入温度设置为26 ℃的人工气候箱中进行恒温培养,待培养皿布满菌丝后,用作液体培养基菌种。其他培养基制作方法同上。
2) 基础液体培养基:马铃薯200 g,蔗糖20 g,蛋白胨2 g,磷酸二氢钾1 g,MgSO4·7 H2O 0.5 g,用水定容至1 000 mL,pH自然[13]。制作方法同上。
1.2.2红托竹荪菌种液体培养
无菌条件下,用0.5 cm打孔器沿培养皿母种边缘取菌块若干,在每个装有100 mL基础液体培养基的三角瓶中加入4块0.5 cm直径母种菌块,置于26 ℃条件下静置培养,48 h后,菌种块在液体培养基表面开始萌发,出现菌丝时,以120 r·min-1的转速恒温水浴振荡器培养,培养的第3天开始,每72 h取3瓶,观察菌丝体颜色,称量菌丝干重,共观察30 d。
菌丝干重的测量方法:首先将滤纸在烘箱中干燥至恒重,用万分之一电子天平称量滤纸质量,再将滤纸放置在相应大小的布氏漏斗中,将培养液从三角瓶中全部倒出至布氏漏斗过滤,再用蒸馏水过滤清洗滤纸2次,将滤纸和附着在滤纸上的菌丝一起放入恒温干燥箱(50 ℃)干燥至恒重,用万分之一电子天平称量干燥后滤纸质量,用过滤后滤纸质量减去过滤前滤纸质量,即是菌丝干重。
1.2.3碳源的筛选
以葡萄糖、半乳糖、白砂糖等为碳源各20 g,空白对照培养基不加白砂糖,每个处理设5个重复,接种后第18天,各处理经过过滤、无菌水滤洗、干燥、称量,得到不同碳源培养条件下菌丝体干重[14]。
1.2.4氮源的筛选
以酵母膏、氯化铵的氮源分别代替基础培养基中的蛋白胨,空白对照培养基不加氮源,各设5个重复,接种后第18天,各处理按照过滤、无菌水滤洗、干燥、称量进行,得到各种氮源条件下菌丝体干重[15]。
1.2.5红托竹荪菌丝体液体发酵正交试验
以蛋白胨(A),面粉(B),接菌量(C),发酵时间(D)为因子,设计L16(34)正交试验,每个处理各设5个重复,试验评价指标为菌丝体干重,根据结果探讨并优化红托竹荪菌丝体发酵技术条件。
2 结果与分析
2.1 红托竹荪母种菌丝生长状况记录及分析
2.1.1红托竹荪母种在不同培养基中的生长情况
由表3可知,红托竹荪母种在各种淀粉培养基和桦槁木屑培养基中均能生长,其中面粉培养基生长最旺盛,菌丝密度高(特浓密)。虽然在松针培养基中也可生长,但菌丝长势较弱,菌丝密度不高,生长稀疏。

表3 红托竹荪母种在不同培养基中的生长情况Table 3 Growth of D. rubrovolota in different media
2.1.2红托竹荪母种在不同培养基中的生长速率
由图1可知,红托竹荪母种在不同供试培养基中均能生长,其中面粉培养基生长速率最快,第15天菌落直径为4.7 cm;在松针培养基中生长速率最慢,第15天菌落直径为1.0 cm。试验结果表明,红托竹荪母种在玉米,面粉,马铃薯及松针-马铃薯等淀粉类培养基中生长速率相对较快,在松针,桦槁的木屑类培养基中生长速率相对较慢。
2.2 培养时间对红托竹荪菌丝体干物质积累的影响
由图2 可知,菌丝在基础培养基中培养第3天开始进入对数增长期,第21天菌丝干重达到最高,随后菌丝干重开始下降。菌丝体颜色在第3天开始出现淡紫红色,培养至21 d,瓶壁菌丝颜色渐渐变暗。结果表明,以基础液体培养基为基质,红托竹荪HT-027作为母种,在温度为26 ℃进行培养的时间以15~21 d为宜。
2.3 碳源对红托竹荪菌丝体生长的影响
由表5可知,小麦粉和玉米粉是红托竹荪液体发酵过程中最容易吸收的供试碳源,以其作为碳源的菌丝体生长量(干重)分别为0.49 g和0.48 g。小麦粉和玉米粉在0.05和0.1水平上没有显著差异,但与其他供试碳源存在极显著差异;其次容易被红托竹荪吸收的碳源分别是米粉,小米粉,葡萄糖,马铃薯粉,红薯粉和蔗糖,在相同培养条件下,菌丝体生长量(干重)分别为0.42 g,0.41 g,0.39 g,0.38 g,0.32 g和0.24 g;红托竹荪菌丝体对羟甲基纤维素钠,半乳糖,松针吸收很弱;菌丝体生长量(干重)仅为0.17 g,0.16 g和0.11 g;空白对照(ck)最弱,生长极其缓慢,菌丝生长量仅为0.10 g。
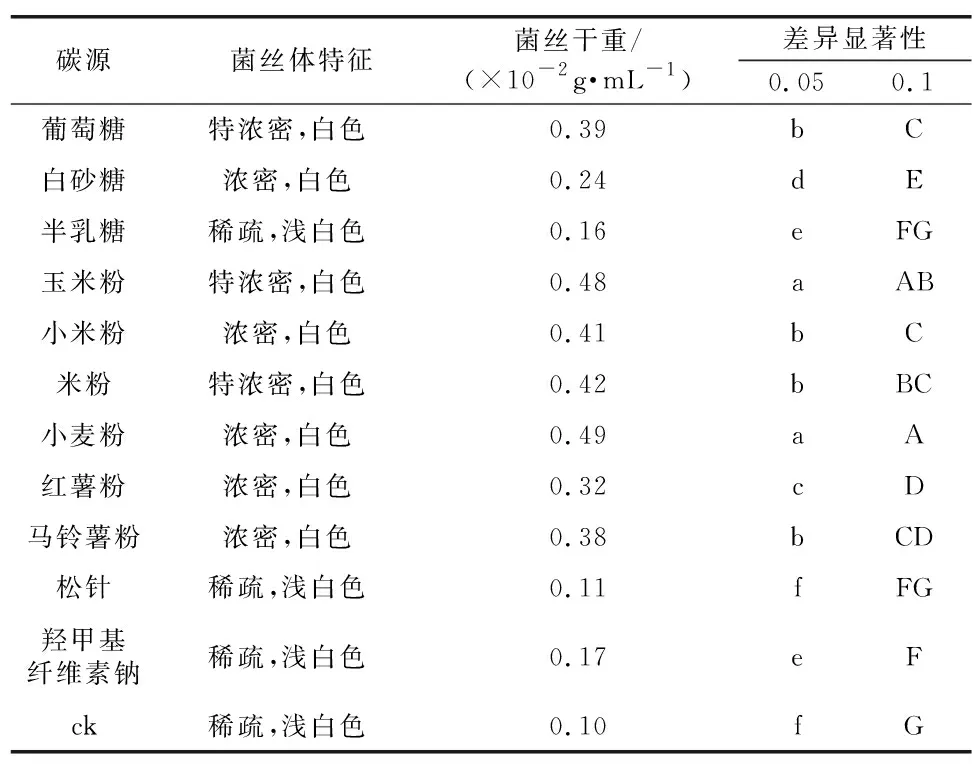
表4 不同碳源对红托竹荪菌丝体生长的影响Table 4 Effects of different carbon sources on mycelium growth of D. rubrovolota
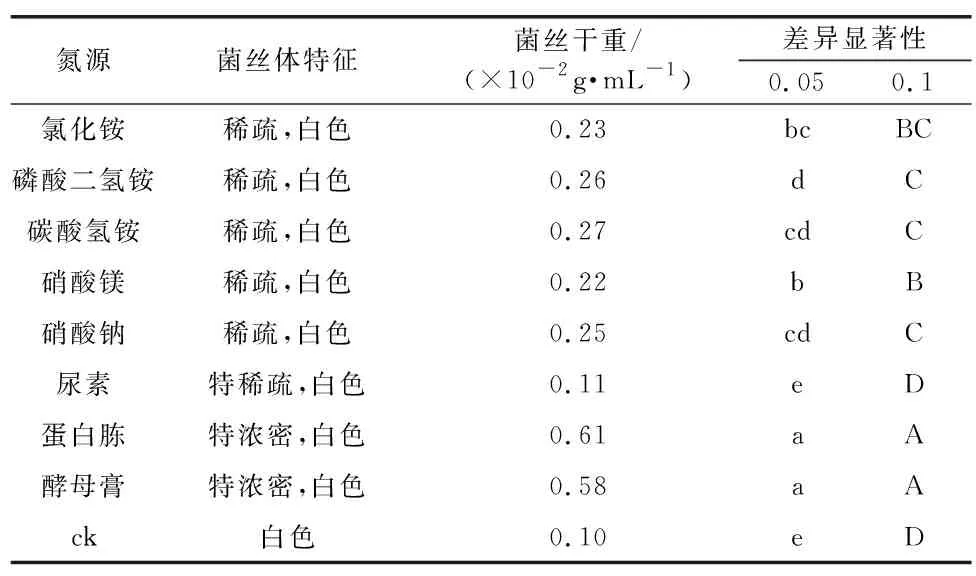
表5 不同氮源对红托竹荪菌丝体生长的影响Table 5 Effects of different nitrogen sources on mycelium growth of D. rubrovolota
2.4 氮源对红托竹荪菌丝体生长的影响
由表6可知,蛋白胨和酵母膏是红托竹荪在基础液体培养基中最易吸收的供试氮源,菌丝体生长量分别为0.61 g和0.58 g。蛋白胨和酵母膏对其他供试的氮源在0.05和0.1水平上存在极显著差异;其次是碳酸氢铵,磷酸二氢铵,硝酸铵,氯化铵和硝酸镁,在相同培养条件下,菌丝体生长量(干重)分别为0.27 g,0.26 g,0.25 g,0.23 g和0.22 g;红托竹荪菌丝体对尿素吸收很弱;菌丝体生长量(干重)仅为0.11 g;空白对照(ck)最弱,菌丝体生长量(干重)为0.10 g,生长极其缓慢。统计分析结果表明,蛋白胨是供试氮源中红托竹荪液体培养基最佳氮源。
2.5 红托竹荪菌丝体液体发酵正交试验
通过红托竹荪HT-027液体发酵正交试验结果可知,菌株HT-027培养基的最优组合是A3B1C3D2,即在蛋白胨0.1%,面粉1%,接菌量为8块(直径0.5 cm,圆形),培养时间为15 d的条件下,HL-027具有最好的菌丝生长量,100 mL液体培养基中菌丝干重为0.76 g(表6)。
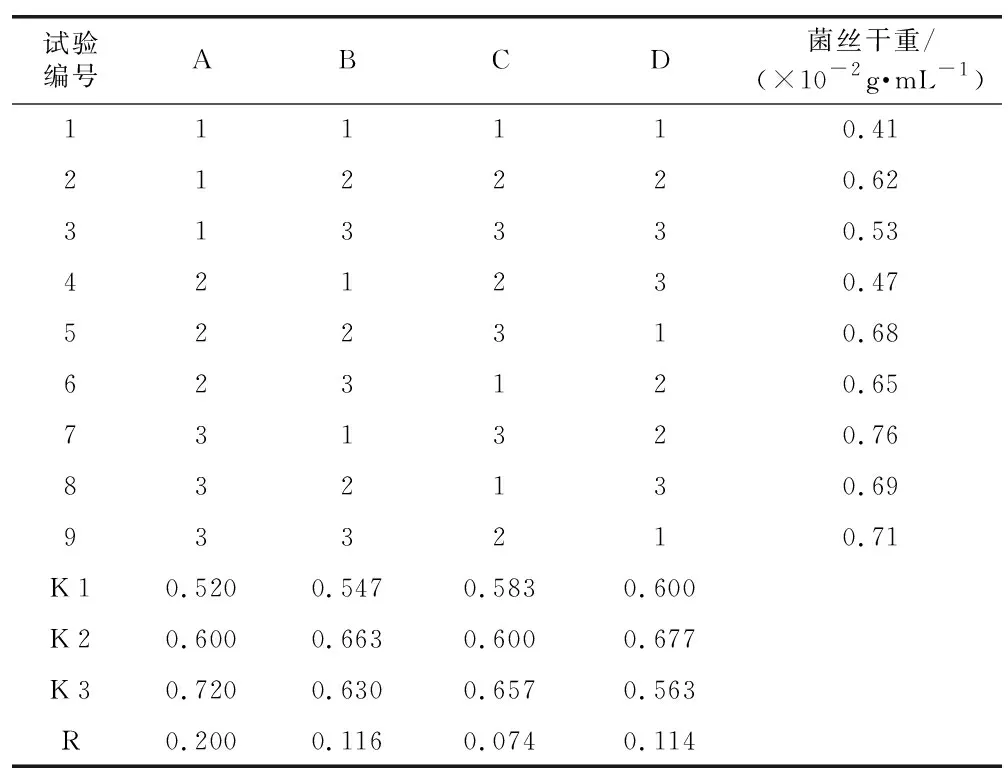
表6 正交试验结果与直观分析Table 6 Orthogonal test results and intuitive analysis
3 结论与讨论
3.1 结 论
1) 红托竹荪在液体基础培养基中,第3天时进入对数生长期,第21天菌丝体干重达到最大,随后小幅度下降。因此可以判断制备红托竹荪液体菌种制备时间控制在12~18 d为宜。
2) 筛选的多种供试碳源中,面粉是红托竹荪最好的碳源,液体培养18 d后,红托竹荪菌丝体干重达到0.49×10-2g·mL-1;红托竹荪最适宜的氮源是蛋白胨和酵母膏,在相同条件下,菌丝体干重达到0.55×10-2g·mL-1和0.51×10-2g·mL-1。
3) 正交试验结果表明,红托竹荪HT-27菌丝体液体发酵培养基的最优组合是A3B1C3D2,即蛋白胨0.1%,玉米粉1%,接菌量为8块(直径0.5 cm,圆形),时间15 d条件下,HT-027具有最好的菌丝生长量,100 mL液体培养基中菌丝干重为0.76 g,在该条件下HT-027菌丝球长势最好,菌球致密,大小均匀,数量众多。
3.2 讨 论
1) 红托竹荪菌丝体在受到光线,摩擦等因素的干扰下,菌丝会由白色变成浅紫红色,这可能是菌种应急代谢的一种反应,通常情况下,这个特征明显的红托竹荪菌种具有较好的抗逆性,出菇特性较好,将之作为衡量菌种质量的一个指标进行深入研究,对产业的发展具有较大意义。
2) 红托竹荪供试碳源筛选过程中,淀粉类碳源能为红托竹荪提供较好的营养供给,而其他碳源不容易被吸收;供试氮源中,生物质氮源(蛋白胨,酵母膏)普遍比较容易被红托竹荪菌种吸收,植物容易吸收的氨态氮和硝态氮红托竹荪不容易吸收,表明红托竹荪对营养物质的吸收具有一定选择性,深入研究易被红托竹荪吸收的营养物质,可以提高红托竹荪的生产效率,获得更好的经济效益。
